土壤动物粒径谱研究进展
2017-06-26徐国瑞马克明
徐国瑞,马克明
1 中国科学院生态环境研究中心,城市与区域国家重点实验室,北京 100085 2 中国科学院大学,北京 100049
土壤动物粒径谱研究进展
徐国瑞1,2,马克明1,*
1 中国科学院生态环境研究中心,城市与区域国家重点实验室,北京 100085 2 中国科学院大学,北京 100049
群落结构如何响应环境变化是生态学研究长期关注的核心问题之一。粒径谱由个体大小和多度构建而来,与营养级转换速率相关、反映生态系统过程动态以及表征生态系统稳定性,可以将其视为一个综合的功能多样性指标用于预测和表征群落的组成以及生态系统功能如何响应环境压力。粒径谱研究最初始于水生生态系统,近年来被引入到土壤动物群落生态学的研究中。简要回顾粒径谱的概念由来及理论基础,分析比较了当前粒径谱研究中的4种易混淆类型,介绍了常用的两类土壤动物粒径谱构建方法及其生态学意义,梳理了土壤动物粒径谱对环境梯度响应与生态化学计量学相结合的研究进展,并指出了应用粒径谱研究土壤动物群落的难点及限制条件。未来,在基础理论研究方面,土壤动物粒径谱应关注个体大小与营养级位置及能量利用关系;在应用方面,土壤动物粒径谱可结合传统的分类方法广泛应用于指示环境污染、生态恢复、保育生物以及土地利用变化等。
粒径谱;土壤动物;生态化学计量;环境梯度
群落结构如何响应环境变化是生态学研究长期关注的经典和前沿领域之一。Sutherland等[1]提出生态学仍需回答的100个根本问题中提到能否用一个综合指标的分布情况反映群落属性对于环境变化的响应,比如个体大小?将群落生态位空间压缩到单一维度,个体大小是直接涵盖多重有意义生物学信息的重要指标[2]。个体大小与新陈代谢密切相关[3],决定了一系列的物种特征,对食物网结构和动态产生深刻影响,是生物体最为根本的一个属性[2,4]。2011年Oikos上以“Body size and ecosystem dynamics”专题论述个体大小对于生态系统动态的影响[5],个体大小在群落研究中的重要性受到越来越多研究者的注意。种群多度变化除表征与其他物种和无机环境之间的相互关系外,更代表着种群在群落中的存在或灭绝[6]。个体大小的多度分布研究最初始于水生生态系统中,将生物(颗粒)按照大小分成不同的粒径级别,计算不同的粒径级别中的生物(颗粒)量,由此得出的生物(颗粒)量在不同径级上的分布曲线称之为粒径(生物量)谱。粒径谱结构揭示了群落的大小分布与营养级结构之间的相互作用[4],是环境变化背景下的群落结构变化和功能响应的综合性指标[7],可以与近年来备受关注功能多样性[8-9]以及基于特征[10-11]的研究框架有益结合。粒径谱有多种类型,包括丰度粒径谱、颗粒粒径谱、生物量谱[12]。粒径谱方法在水生生物中得到了成功应用[13],但陆域生态系统中的相关研究滞后,尤其是土壤动物的粒径谱研究十分薄弱。
土壤动物是生态系统中重要的生物组分,与生态系统关键功能过程紧密相关[14],在生物地球化学循环中起着重要作用[15]。不同大小的土壤动物发挥的生态系统功能与承载的生态系统服务价值不同[16]。作为分解者,中小型土壤动物(蜱螨类,线虫等)显著提高凋落物分解过程[17],促进生态系统元素循环[18]。作为生态系统工程师,大型土壤动物(蚯蚓,蚂蚁等)的自身活动改变土壤理化特征、调控其它生物的活动(如直接取食植物以及捕食微生物等),在营养级联效应中扮演重要角色[19]。越来越多的研究者认同,土壤动物在驱动生态系统对环境变化响应过程中具有重要作用[20]。但由于土壤动物的多样性极高,个体小且存在大量幼虫,分类鉴定到种的难度极高,土壤动物的研究及应用发展缓慢[21]。近年来,研究者将水生生态系统中应用成熟的粒径谱概念引入陆域生态系统中[22-23],使得便捷地应用土壤动物指示环境变化成为可能。
本文试图在简要回顾粒径谱理论发展的基础上,梳理土壤动物粒径谱研究最新进展,并探讨整合粒径谱理论与营养级理论及能量均值法则的可能性,尝试提出未来土壤动物粒径谱研究需要着重回答的问题与应用的方向。
1 粒径谱研究的概念由来、理论基础与类型
1.1 粒径谱的概念由来
粒径谱的概念提出最早可以追溯到Elton所著的Animal Ecology一书[24],其理论模型研究主要经历了最初的Kerr营养级理论模型[25]-Sheldon捕食者/食物大小关系模型[26](K-S),改进的Platt-Denman标准化生物量模型(P-D)[27-28]以及完全符合异速生长形式的Thiebaux-Dickie(T-D)穹顶模型[29-30]3个阶段[12]。粒径谱研究最初始于水生生态系统中,如浮游动植物[31]、底栖动物[32]、鱼类[33]等,通过关注粒径谱(对数化)斜率及截距的变化,监测生态系统状态[7,28]以及预测海洋资源产量[34]。集中在水域生态系统的粒径谱研究经过半个多世纪的发展已经相对成熟,但在陆地生态系统中,尤其是土壤动物群落中,粒径谱研究却处于刚刚起步的阶段。
1.2 粒径谱的理论基础
捕食者与被捕食者之间的大小关系是粒径谱研究的重要理论基础之一[26]。个体大小与营养级之间的正相关关系,即个体越大的生物其营养级位置往往也越高,在多种生态系统(尤其是水生生态系统)中得到广泛证实[35- 37],但由于陆域土壤生境的复杂性,土壤动物群落存在高度杂食性[38],其个体大小与营养级关系仍需进一步研究。
基于个体大小推绎的异速生长关系构成了粒径谱研究的又一重要理论基础[29-30]。个体大小影响细胞质水平上的新陈代谢速率,对于生物个体、种群、群落乃至整个生态系统具有重要意义[3]。Huxley[39]最早提出了基于个体大小的异速生长幂次方程,Y=Y0Mb。式中Y可以是新陈代谢速率,发育时间,种群生长速率或是分子进化速率;M指的是个体大小,通常以个体质量作为表征;Y0是正态化常量,而b则是异速生长的幂次数。同年,Kleiber[40]提出了有机体新陈代谢速率的尺度推绎方程,I=I0M3/4,式中I0是与个体大小无关的正态化常量,可以是基础/野外/最大呼吸速率。个体大小与多种系统特征也存在异速生长推绎关系,如家域范围(b=1)[41],消化速率与次级生产(b=3/4)[3,42],营养循环速率(b=-1/4)[3,43-44]。
生物异速生长推绎(Allometric scaling)幂次数曾存在基于欧式几何推绎的2/3[45- 49]与基于分形理论推绎的3/4[3,50- 53]之间的长期争论,至今仍无定论[54]。也有学者认为在存在资源限制的真实局地群落中,幂次数并不是一个固定值,而是涵盖了众多生物与环境条件的综合值,因此建议将其看做是兼具生物和生态学功能的有用通量[7,55- 57]。
1.3 粒径谱类型
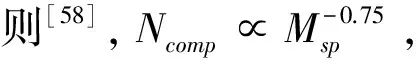
2 土壤动物粒径谱的构建方法与生态学意义
不同大小土壤动物发挥的生态系统功能[74]和承载的生态系统服务[16]不同,如表1中土壤动物各大小类群在营养循环和土壤团聚体形成的作用各异。2005年Mulder[22]首次运用粒径谱方法在土壤动物群落,引起了土壤学者的普遍关注,成为近年来土壤动物群落研究的一个新的研究方法。在介绍构建方法前,需要明确个体大小的定义。尽管个体长度[75]和生物体积[67,69]都可以表征个体大小,但多数研究者认为个体质量是更为本质或更为准确的一个指标,因为个体质量在个体水平和种群水平与功能过程更为相关[3]。因此,建议构建土壤动物粒径谱时,应尽量选择个体质量(干重优于鲜重)作为个体大小的具体表征。粒径谱研究中通常考虑丰度(多度)粒径谱和生物量谱两种类型,二者可以相互转化[76],如下:
log(N)=b×log(M)+a
(1)
而log(B)=log(MN)=log(M)+log(N)
(2)
由(1)和(2)可得:
log(B)=log(M)+log(N)=log(M)+b×log(M)+a=(1+b)×log(M)+a
(3)
式中,B为生物量,M为个体大小,N为丰度(多度)。
下面主要以丰度粒径谱构建为例,介绍当前主要运用的2类土壤动物粒径谱的构建方法。
2.1 土壤动物LSDR粒径谱构建方法
LSDR粒径谱的构建的第一步是获取不同类群土壤动物的质量,大型土壤动物可以通过直接称重法获取个体质量,而对于中小型土壤动物可以通过测量体长,根据体长-质量方程转换为个体质量。常见土壤动物类群的质量-体长转变方程见表2,干重-鲜重转换方程见表3。

表1 不同大小土壤动物在营养循环和土壤结构与团聚体形成中的作用[16,23,77,78]
需要特别指出的是极微型土壤动物,如原生动物等,因其个体过小,未检索到其对应的质量-体长转换方程。另一点是土壤微生物作为土壤动物重要的食物来源,将其与土壤动物一并整合到土壤生物粒径谱研究中,对于整体上理解土壤食物网的结构具有重要意义。然而由于微生物个体变异大,如少数真菌个体可以占据965hm2的面积[94],相关研究极少。Mulder等人[76]通过荧光染色与自动成像技术观测微生物的细胞体积,进而通过细胞体积与碳容量的转换比(3.2×10-13g C/μm3)以及0.5的干鲜重比得到了微生物的个体质量。

表2 质量-体长转换方程
M:个体质量,L:体长,W:体宽

表3 干重-鲜重转换方程
获取了各类群土壤动物质量后,分类群计算土壤动物的平均质量,而后以各类群的平均质量与多度(或多度+1)的对数值作图,即构建出土壤动物的LSDR粒径谱。
2.2 土壤动物ISD粒径谱构建方法
在获取各类群的个体质量后(步骤同LSDR),略去分类学信息,完全按照各类群的个体质量大小排序,分成不同径级。划分径级方法主要包括两种,第一种是按照倍增数列划分[95],如1—2μg,2—4μg,4—8μg…等,第二种是按照具体研究群落的个体大小范围进行等分[76],等分数由研究者自行确定,将各个径级的个体数加和作为Y值,取各个径级的中间值作为X值,进行双对数回归,即为ISD粒径谱。
2.3 土壤动物粒径谱的生态学意义
两种构建方法得到的粒径谱均具有2个重要的参数,粒径谱的斜率(Slope,b)与截距(Y-intercept,a)。土壤动物粒径谱斜率可以反映群落中不同大小的土壤动物的分布情况[96],而截距则代表着在固有资源供应限制情况下的生态系统容量[97]。Mulder[23]将异速生长视角引入土壤无脊椎动物对于生态系统功能响应的研究中,指出粒径谱可以作为衡量人类活动对于景观结构以及食物网结构的综合测度指标,可以作为土地利用对恢复生态学和保护生物学影响模型构建的替代参数,量化土壤群落组成及与其相关的生态系统服务,评估生态系统风险。
3 土壤动物粒径谱对于环境梯度的响应
土壤动物异速生长推绎关系并不是一个固定不变的值,而是局地群落的一个功能属性,可以将其作为一种囊括丰富信息的新的多样性测度指标[55-56]。粒径谱能够响应环境梯度变化(气候因素,生产力以及扰动),反映生态系统功能[7]。
3.1 土壤动物粒径谱对于环境梯度的响应
气候变化(温度升高,降雨增加等)和环境扰动(土地利用变化,森林管理,农田施肥等)可能会通过影响土壤动物生物量的分布,进而影响土壤生物提供的生态系统功能[98-99]。由于在众多生物学过程中的重要作用,温度对于群落中生物量的分布以及食物网的作用受到众多研究者的关注,2012年英国皇家科学院Philosophical Transactions B 组织了“Climate change in size-structured ecosystems”专刊,专题论述具有大小结构的生态系统如何响应气候变化[100]。作为变温动物,土壤无脊椎动物受环境温度变化的影响可能更甚[101]。研究表明,暖温带森林生态系统凋落物层土壤动物的粒径谱关系无论在生长季还是休眠季均可以响应海拔变化,温度是驱动粒径谱斜率在海拔上变化的主要因素[102]。温度也可通过影响资源的可获得性对于土壤动物的生物量分布产生影响;在生长季粒径谱的斜率主要受凋落物层质量影响,而休眠季主要受凋落物数量影响。也有研究[103]发现土壤微节肢动物的粒径谱的斜率在不同温湿度环境下并未产生显著差异,但粒径谱的截距在不同湿度下有差异:更湿润的环境,截距更高,说明湿度可提高生态系统最大容纳的个体多度。该研究中温度的作用不明确可能和其关注的土壤动物类群大小范围变化较窄以及温度跨度较小有关。
由于地上-地下生态系统之间紧密链接[15],植物生产力的变化会对土壤动物群落大小结构产生影响。土壤动物粒径谱可以很好地反映其大小分布情况如何响应植物生产力变化。凋落物作为土壤动物的基础食源,以凋落物质量表征植物生产力,Comor[96]等发现植物生产力对土壤动物的粒径谱斜率有影响,但这种影响并不均等,相对小的土壤动物从更高的生产力中获利更多。
土壤动物对于扰动环境的响应主要集中在土壤线虫的研究。George[104]等人将传统的成熟度指数与粒径谱结合起来应用于土壤线虫群落研究中,发现在添加木灰的处理中相对小的个体受损比其他处理(皆伐与未受扰动)更多。施肥导致群落水平上大个体土壤线虫增加的比小个体土壤线虫的幅度大。但也有研究证实施肥并未改变粒径谱斜率但显著增加其截距[105],施肥使得土壤线虫大个体与小个体获利情况相对均等。群落水平上土壤线虫大小与土壤有机碳,总氮,可利用性P和K正相关[106]。土壤线虫群落粒径谱也可用于指示土地利用变化,牧场和农田生态系统的粒径谱斜率比草地和次生林的更为陡峭[107],这与干扰状态下相对大的土壤动物受损更多的假设相符。Zhao[107]指出基于个体大小构建的粒径谱(ISD)比基于分类信息构建的土壤线虫粒径谱(LSDR)有更高的解释率,可能更为实用。
3.2 土壤动物粒径谱与生态化学计量
生态化学计量学主要研究能量与多种元素(以C、N、P为主)在生物体与环境中的平衡关系,其动态平衡决定了细胞质过程、个体消费者-资源互作、种群密度以及群落和生态系统格局[108- 111]。生态化学计量学的一个重要理论基础是生长速率假说,即生物体必须通过调节自身的C、N、P比值适应不同的生长速率,认为P对于生物生长和繁殖密切相关,异养生物高生长速率需要对应低C:P比与N:P比[110,112]。异速生长与生态化学计量学之间的联系在水生生态系统中得到广泛证实,直到2009年,Mulder[76]将粒径谱(生物量谱)与生态化学计量联系起来,在涵盖了广泛类群(真菌、细菌以及土壤动物)的欧洲草原土壤食物网中证实了生长速率假说,即由于P对于核糖体RNA以及蛋白质产量的重要影响,P的可获得性越高,土壤生物的相对生长速率越快,其粒径谱斜率也越陡峭。这项研究首次揭示了P的可获得性和土壤食物网异速生长的耦合关系。
此后,Ott等[113]在森林生态系统的凋落物层无脊椎动物类群中验证了生态系统Na短缺假说(凋落物中的Na含量低,而其消费者依赖Na保持膜透性,对Na要求高,即分解者系统中存在Na短缺),发现Na元素与土壤无脊椎动物的粒径谱斜率高度相关。结构物质假说认为N元素对于核酸产生与结构物质(蛋白质,微纤丝,几丁质)具有普遍重要性,这一假说在草甸与森林生态系统中都得到了证实[96,113]。最新的研究发现凋落物层的S元素与粒径谱斜率负相关,S元素对于土壤动物的生长可能具有潜在抑制作用[102]。S元素对于土壤无脊椎群落大小分布的影响的机理需进一步研究。未来生态化学计量与粒径谱的整合研究中应纳入更多的化学元素并将动物自身的化学元素计量特征考虑在内,比较生物体与环境之间的元素计量关系,找出限制土壤动物生长的化学计量元素,更直接探索生物生长自身与环境资源供给的动态平衡关系。
3.3 土壤动物粒径谱与其他功能多样性指标的结合研究
土壤动物粒径谱的应用还可以与传统的多样性指标、功能多样性以及基于特征的研究方法广泛结合。如与丰富度、多度以及群落组成指标相结合,从不同侧面揭示全球变化致使土壤微节肢动物群落缩小(Community downsizing)的可能机制[114]或与营养级研究相结合,揭示环境压力下的碎屑食物网营养级紧实(Trophic contraction)以及土壤动物群落拆解(Community disassemble)机制[103]。有研究将土壤动物分为不同功能群进行粒径谱构建,进而更为详尽地回答土地利用变化如何影响土壤动物群落的功能变化[107]。另外,基于取食功能团权重计算的个体大小可以有效补充基于分类信息与在评估土壤食物网状态时的不足[115]。在土壤线虫研究中,可与基于谱系、取食以及个体大小特征集合而成熟度指数相结合,共同反应土壤线虫群落状态,有效指示土壤质量。也有研究指出,土壤线虫个体大小的群落加权均值(Community-weighted mean)是指示土壤生态系统对于干扰响应的有效指标[106]。
4 土壤动物粒径谱研究的应用难点以及限制条件
土壤动物分类精度越高对于专业知识的要求及时间投入也就越多。尽管已有研究表明适度降低分类精度(如在属[76]、形态种[57]或科[102]一级水平上构建土壤动物LSDR粒径谱),土壤动物的粒径谱斜率依然可以指示环境变化,但也有研究指出不同的分类精度会影响土壤食物网中的异速生长推绎关系[116]。因此,土壤动物分类精度对于粒径谱的影响还需进一步探讨,未来有必要针对不同研究关注的具体科学问题和主要土壤动物类群,进行预实验比较不同分类精度下粒径谱响应环境的敏感度与有效性。
土壤动物的个体发育阶段也会对粒径谱的应用产生重要影响,土壤动物某些类群(如线虫、弹尾类、鞘翅目、双翅目、鳞翅目等)的个体大小在发育阶段会有几个数量级的变化,这种变化往往伴随着食性的改变[117-118]。LSDR粒径谱构建过程中,缺失发育阶段信息,会增大粒径谱响应环境变化的噪音,对于重点关注土壤中大量幼虫或是发育阶段有多个龄期在土壤中度过的类群时,需谨慎应用或解释。
对于关注土壤动物群落变化,但缺少系统地土壤动物分类知识专业训练的研究者而言,ISD的相对简单构建方法以及图像扫描软件的发展,使土壤动物粒径谱研究变得简单易行[57]。取样充分与具有代表性是应用ISD粒径谱方法研究土壤动物群落的先决条件,径级划分的宽度与边界直接影响群落的粒径谱结构[119]。由于完全忽略了分类学信息,应用ISD方法构建土壤动物粒径谱时,土壤动物的标准化获取以及统计分析时如何划分径级是两大难点。未来的研究中,将ISD与LSDR两种粒径谱构建方法结合起来,对于综合反应土壤动物群落如何响应环境变化具有重要意义。
5 未来方向
营养级理论是粒径谱推绎关系(斜率,截距等)变化链接生态系统功能重要理论基础。粒径谱与营养级的相关关系主要在水生生态系统中的ISD粒径谱得到证实,而适合描述土壤动物群落的LSDR和ISD粒径谱与营养级的关系仍需进一步研究。水生态系统中,粒径谱斜率越为平缓,则代表该群落的营养级转化速率越高,越陡峭其营养级转化速率越小。土壤生境比水体生境更为复杂,影响土壤生物生长与活动的无机环境因素很多,另外土壤动物高度的杂食性可能会导致土壤动物粒径谱与营养级关系变得复杂。Mulder[99]利用酶活性信息定义土壤动物取食功能群间接证实了土壤食物网与ISD粒径谱之间存在关系,但这并没有直接回答土壤动物个体大小与营养级之间或是土壤动物粒径谱斜率与营养级转化效率之间的关系。近年来,随着稳定性同位素技术在土壤中的应用发展,使得直接测量不同种类的大中型土壤动物的营养级位置成为可能,但对于土壤中小型动物营养级位置的研究仍然较为困难。对于具有明确食物关系的土壤生物,研究捕食者与食物二者之间个体大小比有助于解释粒径谱与营养级的关系。另外,个体大小与营养级的关系在不同尺度上的研究结果可能不一致,如水生生物的个体大小与营养级的关系薄弱,但在群落水平上呈现出了显著正相关[120],因此有必要从不同尺度上(如种类,功能群,群落等)验证个体大小与营养级的关系。
能量均等法则(EER)认为生物的能量利用不受生物个体大小影响,即不同大小的生物类群其能量利用均等。粒径谱理论结合新陈代谢理论可以推绎出群落中各类群生物的能量利用情况[121, 122]。关于土壤动物的能量利用研究十分薄弱,且已有的少数研究结果并不一致。能量均等法则在森林土壤节肢动物的某些类群中得到证实[122, 123],但最近Enthes[124]利用涵盖多营养级的土壤动物类群更为翔实的数据证明森林中的土壤动物群落并不存在能量均等法则。生物群落的能量分布情况对于理解群落结构及其对于环境变化的响应至关重要,未来的基础理论研究应着重关注土壤动物个体大小与营养级位置及能量利用关系。
土壤生物的高度多样性以及分类局限性使得大范围应用传统方法评估土壤质量十分困难,而土壤动物粒径谱具有以下3个优点:(1)构建方法简单,便于应用;(2)与土壤功能与环境响应高度相关;(3)对于分类知识要求不高。因此土壤动物粒径谱可以与传统的分类学知识以及食物网理论互相补益,成为预测土壤质量的标准化评估工具[57]。未来可以将土壤动物的ISD粒径谱与LSDR粒径谱相结合广泛应用于指示环境污染,生态恢复,保育生物以及土地利用变化中。
[1] Sutherland W J, Freckleton R P, Godfray H C J, Beissinger S R, Benton T, Cameron D D, Carmel Y, Coomes D A, Coulson T, Emmerson M C, Hails R S, Hays G C, Hodgson D J, Hutchings M J, Johnson D, Jones J P G, Keeling M J, Kokko H, Kunin W E, Lambin X, Lewis O T, Malhi Y, Mieszkowska N, Milner-Gulland E J, Norris K, Phillimore A B, Purves D W, Reid J M, Reuman D C, Thompson K, Travis J M J, Turnbull L A, Wardle D A, Wiegand T. Identification of 100 fundamental ecological questions. Journal of Ecology, 2013, 101(1): 58- 67.
[2] Woodward G, Ebenman B, Emmerson M, Montoya J M, Olesen J M, Valido A, Warren P H. Body size in ecological networks. Trends in Ecology & Evolution, 2005, 20(7): 402- 409.
[3] Brown J H, Gillooly J F, Allen A P, Savage V M, West G B. Toward a metabolic theory of ecology. Ecology, 2004, 85(7): 1771- 1789.
[4] White E P, Ernest S K, Kerkhoff A J, Enquist B J. Relationships between body size and abundance in ecology. Trends in Ecology & Evolution, 2007, 22(6): 323- 330.
[5] Blanchard J L. Body size and ecosystem dynamics: an introduction. Oikos, 2011, 120(4): 481- 482.
[6] Ott D, Digel C, Rall B C, Maraun M, Scheu S, Brose U. Unifying elemental stoichiometry and metabolic theory in predicting species abundances. Ecology Letters, 2014, 17(10): 1247- 1256.
[7] Petchey O L, Belgrano A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters, 2010, 6(4): 434- 437.
[8] Petchey O L, Gaston K J. Functional diversity: back to basics and looking forward. Ecology Letters, 2006, 9(6): 741- 758.
[9] Cadotte M W, Carscadden K, Mirotchnick N. Beyond species: functional diversity and the maintenance of ecological processes and services. Journal of Applied Ecology, 2011, 48(5): 1079- 1087.
[10] Messier J, McGill B J, Lechowicz M J. How do traits vary across ecological scales? A case for trait-based ecology. Ecology Letters, 2010, 13(7): 838- 848.
[11] Suding K N, Lavorel S, Chapin III F S, Cornelissen J H C, Díaz S, Garnier E, Goldberg D, Hooper D U, Jackson S T, NAVAS M L. Scaling environmental change through the community-level: a trait-based response-and-effect framework for plants. Global Change Biology, 2008, 14(5): 1125- 1140.
[12] 周林滨, 谭烨辉, 黄良民, 连喜平. 水生生物粒径谱/生物量谱研究进展. 生态学报, 2010, 30(12): 3319- 3333.
[13] Sprules W G, Munawar M. Plankton size spectra in relation to ecosystem productivity, size, and perturbation. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(9): 1789- 1794.
[14] Bardgett R D, van der Putten W H. Belowground biodiversity and ecosystem functioning. Nature, 2014, 515(7528): 505- 511.
[15] Wardle D A, Bardgett R D, Klironomos J N, Setälä H, van der Putten W H, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[16] Lavelle P, Deca⊇ns T, Aubert M, Barot S, Blouin M, Bureau F, Margerie P, Mora P, Rossi J P. Soil invertebrates and ecosystem services. European Journal of Soil Biology, 2006, 42(S1): S3-S15.
[17] García-Palacios P, Maestre F T, Kattge J, Wall D H. Climate and litter quality differently modulate the effects of soil fauna on litter decomposition across biomes. Ecology Letters, 2013, 16(8): 1045- 1053.
[18] Hättenschwiler S, Gasser P. Soil animals alter plant litter diversity effects on decomposition. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(5): 1519- 1524.
[19] Eldridge D J, Bowker M A, Maestre F T, Alonso P, Mau R L, Papadopoulos J, Escudero A. Interactive effects of three ecosystem engineers on infiltration in a semi-arid Mediterranean grassland. Ecosystems, 2010, 13(4): 499- 510.
[20] Wardle D A. Communities and Ecosystems: Linking the Aboveground and Belowground Components: Monographs in Population Biology. Princeton, NJ: Princeton University Press, 2002.
[21] Deca⊇ns T. Macroecological patterns in soil communities. Global Ecology and Biogeography, 2010, 19(3): 287- 302.
[22] Mulder C, Cohen J E, Setälä H, Bloem J, Breure A M. Bacterial traits, organism mass, and numerical abundance in the detrital soil food web of Dutch agricultural grasslands. Ecology Letters, 2005, 8(1): 80- 90.
[23] Mulder C. Driving forces from soil invertebrates to ecosystem functioning: the allometric perspective. Naturwissenschaften, 2006, 93(10): 467- 479.
[24] Elton C S. Animal ecology. New York: McMillan, 1927.
[25] Kerr S R. Theory of size distribution in ecological communities. Journal of the Fisheries Research Board of Canada, 1974, 31(12): 1859- 1862.
[26] Sheldon R W, Sutcliffe Jr W H, Paranjape M A. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada, 1977, 34(12): 2344- 2353.
[27] Platt T, Denman K. Organisation in the pelagic ecosystem. Helgoländer Wissenschaftliche Meeresuntersuchungen, 1977, 30(1/4): 575- 581.
[28] Platt T, Denman K. The structure of pelagic marine ecosystems. Journal du Conseil International pour l′Exploration de la Mer, 1978, 173: 60- 65.
[29] Thiebaux M L, Dickie L M. Models of aquatic biomass size spectra and the common structure of their solutions. Journal of Theoretical Biology, 1992, 159(2): 147- 161.
[30] Thiebaux M L, Dickie L M. Structure of the body-size spectrum of the biomass in aquatic ecosystems: a consequence of allometry in predator-prey interactions. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(6): 1308- 1317.
[31] Blanco J M, Echevarría F, García C M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina, 1994, 58(1/2): 17- 29.
[32] Duplisea D E, Drgas A. Sensitivity of a benthic, metazoan, biomass size spectrum to differences in sediment granulometry. Marine Ecology Progress Series, 1999, 177: 73- 81.
[33] Macpherson E, Gordoa A. Biomass spectra in benthic fish assemblages in the Benguela system. Marine Ecology Progress Series, 1996, 138: 27- 32.
[35] Woodward G, Speirs D C, Hildrew A G. Quantification and resolution of a complex, size-structured food web. Advances in Ecological Research, 2005, 36: 85- 135.
[36] Woodward G, Hildrew A G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology, 2002, 71(6): 1063- 1074.
[37] Jennings S, Warr K J, Mackinson S. Use of size-based production and stable isotope analyses to predict trophic transfer efficiencies and predator-prey body mass ratios in food webs. Marine Ecology Progress Series, 2002, 240: 11- 20.
[38] Digel C, Curtsdotter A, Riede J, Klarner B, Brose U. Unravelling the complex structure of forest soil food webs: higher omnivory and more trophic levels. Oikos, 2014, 123(10): 1157- 1172.
[39] Huxley J S. Problems of relative growth. London, UK: Methuen, 1932.
[40] Kleiber M. Body size and metabolism. Hilgardia, 1932, 6(11): 315- 353.
[41] Jetz W, Carbone C, Fulford J, Brown J H. The scaling of animal space use. Science, 2004, 306(5694): 266- 268.
[42] Ernest S K M, Enquist B J, Brown J H, Charnov E L, Gillooly J F, Savage V M, White E P, Smith F A, Hadly E A, Haskell J P, Lyons S K, Maurer B A, Niklas K J, Tiffney B. Thermodynamic and metabolic effects on the scaling of production and population energy use. Ecology Letters, 2003, 6(11): 990- 995.
[43] Cross W F, Benstead J P, Rosemond A D, Bruce Wallace J. Consumer-resource stoichiometry in detritus-based streams. Ecology Letters, 2003, 6(8): 721- 732.
[44] Elser J J, Fagan W F, Denno R F, Dobberfuhl D R, Folarin A, Huberty A, Interlandi S, Kilham S S, McCauley E, Schulz K L, Siemann E H, Sterner R W. Nutritional constraints in terrestrial and freshwater food webs. Nature, 2000, 408(6812): 578- 580.
[45] White C R, Seymour R S. Mammalian basal metabolic rate is proportional to body mass2/3. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(7): 4046- 4049.
[46] Dodds P S, Rothman D H, Weitz J S. Re-examination of the “3/4-law” of metabolism. Journal of Theoretical Biology, 2001, 209(1): 9- 27.
[47] Heusner A A. Size and power in mammals. Journal of Experimental Biology, 1991, 160(1): 25- 54.
[48] Heusner A A. Body size and energy metabolism. Annual Review of Nutrition, 1985, 5(1): 267- 293.
[49] Heusner A A. Energy metabolism and body size I. Is the 0.75 mass exponent of Kleiber′s equation a statistical artifact? Respiration physiology, 1982, 48(1): 1- 12.
[50] Gillooly J F, Brown J H, West G B, Savage V M, Charnov E L. Effects of size and temperature on metabolic rate. Science, 2001, 293(5538): 2248- 2251.
[51] West G B, Brown J H, Enquist B J. A general model for the origin of allometric scaling laws in biology. Science, 1997, 276(5309): 122- 126.
[52] West G B, Brown J H, Enquist B J. A general model for the structure and allometry of plant vascular systems. Nature, 1999, 400(6745): 664- 667.
[53] West G B, Brown J H, Enquist B J. The fourth dimension of life: fractal geometry and allometric scaling of organisms. Science, 1999, 284(5420): 1677- 1679.
[54] Glazier D S. A unifying explanation for diverse metabolic scaling in animals and plants. Biological Reviews, 2010, 85(1): 111- 138.
[55] Mulder C, Ahrestani F S, Bahn M, Bohan D A, Bonkowski M, Griffiths B S, Guicharnaud R A, Kattge J, Krogh P H, Lavorel S, Lewis O T, Mancinelli G, Naeem S, Peuelas J, Poorter H, Reich P B, Rossi L, Rusch G M, Sardans J, Wright I J. Connecting the Green and Brown Worlds: Allometric and Stoichiometric Predictability of Above- and Below-Ground Networks. Advances in Ecological Research, 2013, 49: 69- 175.
[56] Mulder C, Vonk J A, Den Hollander H A, Hendriks A J, Breure A M. How allometric scaling relates to soil abiotics. Oikos, 2011, 120(4): 529- 536.
[57] Turnbull M S, George P B L, Lindo Z. Weighing in: Size spectra as a standard tool in soil community analyses. Soil Biology and Biochemistry, 2014, 68: 366- 372.
[58] Damuth J. Population density and body size in mammals. Nature, 1981, 290(5808): 699- 700.
[59] Russo S E, Robinson S K, Terborgh J. Size-abundance relationships in an Amazonian bird community: implications for the energetic equivalence rule. The American Naturalist, 2003, 161(2): 267- 283.
[60] Marquet P A, Navarrete S A, Castilla J C. Body size, population density, and the energetic equivalence rule. Journal of Animal Ecology, 1995, 64(3): 325- 332.
[61] Lawton J. Species richness and population dynamics of animal assemblages. Patterns in body size: abundance space. Philosophical Transactions of the Royal Society B: Biological Sciences, 1990, 330(1257): 283- 291.
[62] Blackburn T M, Gaston K J. A critical assessment of the form of the interspecific relationship between abundance and body size in animals. Journal of Animal Ecology, 1997, 66(2): 233- 249.
[63] Currie D J. What shape is the relationship between body size and population density? Oikos, 1993, 66(2): 353- 358.
[64] Lawton J H. What is the relationship between population density and body size in animals? Oikos, 1989, 55(3): 429- 434.
[65] Cotgreave P. The relation between body size and abundance in a bird community: the effects of phylogeny and competition. Proceedings of the Royal Society B: Biological Sciences, 1994, 256(1346): 147- 149.
[66] Ernest S K M. Body size, energy use, and community structure of small mammals. Ecology, 2005, 86(6): 1407- 1413.
[67] Chang C W, Miki T, Shiah F K, Kao S J, Wu J T, Sastri A R, Hsieh C H. Linking secondary structure of individual size distribution with nonlinear size-trophic level relationship in food webs. Ecology, 2014, 95(4): 897- 909.
[68] Morse D R, Lawton J H, Dodson M M, Williamson M H. Fractal dimension of vegetation and the distribution of arthropod body lengths. Nature, 1985, 314(6013): 731- 733.
[69] Siemann E, Tilman D, Haarstad J. Insect species diversity, abundance and body size relationships. Nature, 1996, 380(6576): 704- 706.
[70] Griffiths D. Size-abundance relations in communities. The American Naturalist, 1986, 127(2): 140- 166.
[71] Yoda K, Kira T, Ogawa H, Hozumi K. Self-thinning in overcrowded pure stands under cultivated and natural conditions. Journal of Biology Osaka City University, 1963, 14: 107- 129.
[72] Hughes R N, Griffiths C L. Self-thinning in barnacles and mussels: the geometry of packing. The American Naturalist, 1988, 132(4): 484- 491.
[73] Long Z T, Morin P J. Effects of organism size and community composition on ecosystem functioning. Ecology Letters, 2005, 8(12): 1271- 1282.
[74] 邵元虎, 张卫信, 刘胜杰, 王晓丽, 傅声雷. 土壤动物多样性及其生态功能. 生态学报, 2015, 35(20): 6614- 6625.
[75] Brooks J L, Dodson S I. Predation, body size, and composition of plankton. Science, 1965, 150(3692): 28- 35.
[76] Mulder C, Elser J J. Soil acidity, ecological stoichiometry and allometric scaling in grassland food webs. Global Change Biology, 2009, 15(11): 2730- 2738.
[77] Hendrix P F, Crossley Jr D, Blair J, Coleman D C. Soil biota as components of sustainable agroecosystems // Edwards C A, Lal R, Madden P, Miller R H, House G, eds. Sustainable Agricultural Systems. Ankeny, Iowa: Soil and Water Conservation Society, 1990: 637- 654.
[78] Giller K E, Beare M H, Lavelle P, Izac A M N, Swift M J. Agricultural intensification, soil biodiversity and agroecosystem function. Applied Soil Ecology, 1997, 6(1): 3- 16.
[79] Gowing G, Recher H F. Length-weight relationships for invertebrates from forests in south-eastern New South Wales. Australian journal of ecology, 1984, 9(1): 5- 8.
[80] Lang A, Krooss S, Stumpf H. Mass-length relationships of epigeal arthropod predators in arable land (araneae, chilopoda, coleoptera). Pedobiologia, 1997, 41(4): 327- 333.
[81] Ganihar S R. Biomass estimates of terrestrial arthropods based on body length. Journal of biosciences, 1997, 22(2): 219- 224.
[82] Collins P T. Length-biomass relationships for terrestrial Gastropoda and Oligochaeta. American Midland Naturalist, 1992, 128(2): 404- 406.
[83] Mercer R D, Gabriel A G A, Barendse J, Marshall D J, Chown S L. Invertebrate body sizes from Marion Island. Antarctic Science, 2001, 13(2): 135- 143.
[84] Edwards C A. Relationship between weights, volumes and numbers of soil animals// Graff O, Satchell J E eds. Progress in Soil Biology. Braunschweig: Vieweg & Sohn, 1967: 585- 591.
[85] Sample B E, Cooper R J, Greer R D, Whitmore R C. Estimation of insect biomass by length and width. The American Midland Naturalist, 1993, 129(2): 234- 240.
[86] MclaughlinB, Jonsson T, Emmerson M C. Temporal variability in predator-prey relationships of a forest floor food web. Advances in Ecological Research, 2010, 42: 171- 264.
[87] Balushkina Y V. Body weight of Chironomid larvae as a function of length. Gidrobiologicheskii Zhurnal, 1982, 183: 53- 60.
[88] Ferris H. Form and function: metabolic footprints of nematodes in the soil food web. European Journal of Soil Biology, 2010, 46(2): 97- 104.
[89] Höfer H, Ott R. Estimating biomass of Neotropical spiders and other arachnids (Araneae, Opiliones, Pseudoscorpiones, Ricinulei) by mass-length regressions. Journal of Arachnology, 2009, 37(2): 160- 169.
[90] Edwards R L. Estimating live spider weight using preserved specimens. The Journal of Arachnology, 1996, 24(2): 161- 166.
[91] Rosswall T, Persson T, Lohm U. Energetical Significance of the Annelids and Arthropods in a Swedish Grassland Soil. (Ecological Bulletins). Stockholm: Swedish Natural Science Research Council, 1977: 1- 211.
[92] Tita G, Vincx M, Desrosiers G. Size spectra, body width and morphotypes of intertidal nematodes: an ecological interpretation. Journal of the Marine Biological Association of the UK, 1999, 79(6): 1007- 1015.
[93] Breymeyer A. Correlations between dry weight of spiders and their length and fresh weight. Bulletin de l′Academie Polonaise des Sciences, 1967, 15(5): 263- 265.
[94] Ferguson B A, Dreisbach T A, Parks C G, Filip G M, Schmitt C L. Coarse-scale population structure of pathogenicArmillariaspecies in a mixed-conifer forest in the Blue Mountains of northeast Oregon. Canadian Journal of Forest Research, 2003, 33(4): 612- 623.
[95] Kerr S R, Dickie L M. The biomass spectrum: a predator-prey theory of aquatic production. New York: Columbia University Press, 2001.
[96] Comor V, Thakur M P, Berg M P, de Bie S, Prins H H T, van Langevelde F. Productivity affects the density-body mass relationship of soil fauna communities. Soil Biology and Biochemistry, 2014, 72: 203- 211.
[97] Stead T K, Schmid-Araya J M, Schmid P E, Hildrew A G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology, 2005, 74(3): 475- 487.
[98] Vanaverbeke J, Steyaert M, Vanreusel A, Vincx M. Nematode biomass spectra as descriptors of functional changes due to human and natural impact. Marine Ecology Progress Series, 2003, 249: 157- 170.
[99] Mulder C, Den Hollander H A, Vonk J A, Rossberg A G, op Akkerhuis G A J M, Yeates G W. Soil resource supply influences faunal size-specific distributions in natural food webs. Naturwissenschaften, 2009, 96(7): 813- 826.
[100] Brose U, Dunne J A, Montoya J M, Petchey O L, Schneider F D, Jacob U. Climate change in size-structured ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences, 2012, 367(1605): 2903- 2912.
[101] Paaijmans K P, Heinig R L, Seliga R A, Blanford J I, Blanford S, Murdock C C, Thomas M B. Temperature variation makes ectotherms more sensitive to climate change. Global Change Biology, 2013, 19(8): 2373- 2380.
[102] Xu G R, Zhang S, Lin Y H, Ma K M. Context dependency of the density-body mass relationship in litter invertebrates along an elevational gradient. Soil Biology and Biochemistry, 2015, 88: 323- 332.
[103] Lindo Z, Whiteley J, Gonzalez A. Traits explain community disassembly and trophic contraction following experimental environmental change. Global Change Biology, 2012, 18(8): 2448- 2457.
[104] George P B L, Lindo Z. Application of body size spectra to nematode trait-index analyses. Soil Biology and Biochemistry, 2015, 84: 15- 20.
[105] Niu K C, Liu T, Shen Q R, Li H X. Does body size-abundance allometry in soil fauna vary with environment? A field test for nematode communities in response to fertilization. Soil Biology and Biochemistry, 2015, 91: 268- 270.
[106] Liu T, Guo R, Ran W, Whalen J K, Li H X. Body size is a sensitive trait-based indicator of soil nematode community response to fertilization in rice and wheat agroecosystems. Soil Biology and Biochemistry, 2015, 88: 275- 281.
[107] Zhao J, Xun R, He X Y, Zhang W, Fu W, Wang K L. Size spectra of soil nematode assemblages under different land use types. Soil Biology and Biochemistry, 2015, 85: 130- 136.
[108] Reiners W A. Complementary models for ecosystems. The American Naturalist, 1986, 127(1): 59- 73.
[109] Elser J J, Dobberfuhl D R, MacKay N A, Schampel J H. Organism size, life history, and N: P stoichiometry. Bioscience, 1996, 46(9): 674- 684.
[110] Sterner R W, Elser J J. Ecological stoichiometry: the biology of elements from molecules to the biosphere. Princeton, NJ: Princeton University Press, 2002.
[111] Frost P C, Benstead J P, Cross W F, Hillebrand H, Larson J H, Xenopoulos M A, Yoshida T. Threshold elemental ratios of carbon and phosphorus in aquatic consumers. Ecology Letters, 2006, 9(7): 774- 779.
[112] Perez-Moreno J, Read D J. Nutrient transfer from soil nematodes to plants: a direct pathway provided by the mycorrhizal mycelial network. Plant, Cell & Environment, 2001, 24(11): 1219- 1226.
[113] Ott D, Digel C, Klarner B, Maraun M, Pollierer M, Rall B C, Scheu S, Seelig G, Brose U. Litter elemental stoichiometry and biomass densities of forest soil invertebrates. Oikos, 2014, 123(10): 1212- 1223.
[114] Lindo Z. Warming favours small-bodied organisms through enhanced reproduction and compositional shifts in belowground systems. Soil Biology and Biochemistry, 2015, 91: 271- 278.
[115] Zhao J, Li D J, Fu S L, He X Y, Fu Z X, Zhang W, Wang K L. Using the biomasses of soil nematode taxa as weighting factors for assessing soil food web conditions. Ecological Indicators, 2016, 60: 310- 316.
[116] Sechi V, Brussaard L, De Goede R G M, Rutgers M, Mulder C. Choice of resolution by functional trait or taxonomy affects allometric scaling in soil food webs. The American Naturalist, 2015, 185(1): 142- 149.
[117] Bakonyi G. Effects ofFolsomiacandida(Collembola) on the microbial biomass in a grassland soil. Biology and Fertility of Soils, 1989, 7(2): 138- 141.
[118] Eisenbeis G. Biology of soil invertebrates // König H, Varma A, eds. Intestinal Microorganisms of Termites and Other Invertebrates. Berlin Heidelberg: Springer, 2006: 3- 53.
[119] Silverman B W. Density estimation for statistics and data analysis. London, New York: Chapman & Hall/CRC press, 1986.
[120] Jennings S, Pinnegar J K, Polunin N V C, Boon T W. Weak cross-species relationships between body size and trophic level belie powerful size-based trophic structuring in fish communities. Journal of Animal Ecology, 2001, 70(6): 934- 944.
[121] Ehnes R B, Rall B C, Brose U. Phylogenetic grouping, curvature and metabolic scaling in terrestrial invertebrates. Ecology Letters, 2011, 14(10): 993- 1000.
[122] Meehan T D. Energy use and animal abundance in litter and soil communities. Ecology, 2006, 87(7): 1650- 1658.
[123] Kampichler C. Biomass distribution of a microarthropod community in spruce forest soil. Biology and Fertility of Soils, 1995, 19(2/3): 263- 265.
[124] Ehnes R B, Pollierer M M, Erdmann G, Klarner B, Eitzinger B, Digel C, Ott D, Maraun M, Scheu S, Brose U. Lack of energetic equivalence in forest soil invertebrates. Ecology, 2014, 95(2): 527- 537.
Advances in the body size spectra study of soil fauna
XU Guorui1,2, MA Keming1,*
1StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China2UniversityofChineseAcademyofSciences,Beijing100049,China
Community structure and their responses to environmental changes have long been a major concern in ecology. Constructed by body size and abundance, size spectra correlate with trophic transfer efficiency, respond process rate dynamics, and characterize ecological stability. Thus, body size spectra (BSS) can be an indicator of functional diversity to predict and characterize how community composition and ecosystem function respond to environmental pressures. The initial focus of BSS was in aquatic ecosystems until recently, when it was used in the community ecology of soil invertebrates. The present study briefly reviewed the concept, background, and theoretical basis of BSS. Four different but often confused BSS patterns were also distinguished. Then we showed how to construct the two frequently used types of BSS in soil fauna and their ecological significances. We introduced research progress on how the BSS of soil organisms respond to environmental gradients and relate to ecological stoichiometry. Limitations and constraints of the BSS application to soil fauna were also noted. In basic theoretical research, we should focus on the correlation of body size with trophic level and energy use in soil animals. Combined with traditional classification method, BSS of soil fauna can be widely used to indicate environmental pollution, ecological restoration, conservation biology, and land use changes.
body size spectra; soil fauna; ecological stoichiometry; environmental gradients
国家自然科学基金面上项目(31470481)
2016- 01- 2; 网络出版日期:2016- 10- 29
10.5846/stxb201601260185
*通讯作者Corresponding author.E-mail: mkm@rcees.ac.cn
徐国瑞,马克明.土壤动物粒径谱研究进展.生态学报,2017,37(8):2506- 2519.
Xu G R, Ma K M.Advances in the body size spectra study of soil fauna.Acta Ecologica Sinica,2017,37(8):2506- 2519.
