干旱条件下接种AM真菌对小马鞍羊蹄甲幼苗根系的影响
2017-06-26张亚敏马克明曲来叶
张亚敏,马克明,曲来叶,*
1 中国科学院生态环境研究中心, 北京 100085 2 中国科学院大学, 北京 100049
干旱条件下接种AM真菌对小马鞍羊蹄甲幼苗根系的影响
张亚敏1,2,马克明1,曲来叶1,2,*
1 中国科学院生态环境研究中心, 北京 100085 2 中国科学院大学, 北京 100049
为了探讨岷江干旱河谷丛枝菌根真菌(AMF)对寄主植物幼苗根系的影响,通过接种购买的AMF摩西球囊霉菌(Funneliformismosseae)到优势乡土灌木小马鞍羊蹄甲(Bauhiniafaberivar.microphylla)幼苗,在重度、中度和轻度干旱条件下培养3个月,研究不同干旱条件下AMF对幼苗根系形态特征、结构特征、功能性状的影响。方差分析结果表明:(1)3种干旱胁迫条件下,接菌均显著增加了幼苗的根总长、根表面积、根分枝数、根尖数(P<0.001),在中度胁迫和轻度胁迫下,接菌显著促进根鲜重、根体积的增加(P<0.001),轻度胁迫条件下接菌幼苗的根鲜重、根总长、根表面积、根体积、根尖数最高并显著高于其它处理,但接菌与未接菌的根平均直径之间没有显著差异;(2)接菌幼苗根系趋向于叉状分支结构,在重度胁迫时,叉状分支趋势更显著(P<0.001);(3)接菌幼苗的根比例都显著小于未接菌的,但幼苗比根长不存在显著差异。相关分析结果表明:菌根侵染率与根鲜重、根总长、根表面积、根体积、根分枝数、根尖数呈极显著正相关(P<0.001),与拓扑指数、根比例呈极显著负相关(P<0.001)。研究表明,在干旱条件下,AMF虽然没有提高生长初期的根系的吸收效率,但接种AMF显著影响幼苗根系形态特征和结构特征,更利于植物适应干旱环境,并且AMF对幼苗根系的促生作用随着干旱胁迫程度减轻而提高。
摩西球囊霉菌;根系形态;干旱胁迫;拓扑结构;小马鞍羊蹄甲
植物根系不仅为植物提供物理支持,并且是从土壤中吸收水分、养分,是为地上部分提供光合作用物质基础的重要器官[1]。根系的发育直接影响整个植株的生长、发育和生存[2]。有研究表明植物根系吸收水分、养分的能力更多的取决于根长、根表面积,特别是植物细根(直径≤2 mm),是植物吸收的活跃部位[3],比表面积大,在整个根系的总长度和总表面积中占有主导地位[4]。根系的分支和构型对营养物质的吸收也有关键作用[5]。
与植物其他器官相比,根系的发展具有更高的可塑性。根系形态是由内在的基因因素和外在的生物、非生物环境因素共同作用的结果[6],其变化是植物生理生态内在变化的外在表现之一,因而其形态结构会随着土壤性质、水分条件、营养状况、不同真菌共生的改变而改变[1, 7],以达到生长的最优策略,所以在不同的生长环境下根系具有非常强的生理和形态的可塑性[8]。通常情况下,根系主要受到土壤养分和土壤水分的影响。在干旱、半干旱区,土壤含水量是植物生长的主要限制因素。土壤水分通过影响植物生长速率、生物量分配、土壤养分有效性、资源利用效率等等[9],最终影响植物的生理生态功能。一般来说,在干旱胁迫的条件下,根系会通过降低根系生物量、根长、根体积,细化主根,显著增加侧根数目、根冠比等对策来缓解胁迫,在重度干旱胁迫时还会通过抑制细根生长等变来适应环境条件[10- 14]。相关研究表明丛枝菌根真菌(AMF)能够显著促进寄主植物生长和提高宿主植物抗旱性[15-16]。一方面,共生的菌丝网络结构能够促进植物间接的吸收水分、矿质营养,缓解环境胁迫;另一方面,根系也会通过形态改变以及空间构型变化来促进植物直接的吸收水分、矿质营养[17-18]。
从生理和形态学的角度,植物可由自养的、可见的地上部分和异养的、不可见的地下部分组成。虽然目前人们更多地关注地上部分的变化,但地下部分的结构及其变化对于植物与生态系统功能的影响和地上部分一样重要[19]。前期的研究已经发现AMF在岷江干旱河谷乡土植被恢复过程中具有重要的正向作用[20- 22],但在该区域AMF共生对寄主植物根系的影响的研究还比较缺乏。本研究选择岷江干旱河谷区域现存的多年生优势乡土灌木种小马鞍羊蹄甲[9],对其幼苗的根系接种摩西球囊霉菌[23],在不同程度的干旱胁迫条件下,通过一个生长季的培养,探究小马鞍羊蹄甲幼苗根系对水分胁迫和接种内生菌根真菌的响应和可塑性。本研究假设接种摩西球囊霉菌能够显著影响植物幼苗根系形态特征、结构特征、功能性状,提高根系吸收效率。
1 试验地点
控制试验在于2014年5月至9月中国科学院茂县山地生态系统定位研究站塑料大棚中完成。大棚顶部为塑料薄膜,四周为遮阴网,棚内温湿度等条件与当地气象条件一致,年日照时数1373.8h左右,年均温9.3℃左右,年降雨量825.2mm左右,年蒸发量968.7mm左右,十分干燥。
2 材料与方法
2.1 试验材料
植物 小马鞍羊蹄甲(Bauhiniafaberivar.microphylla)无菌幼苗。属于多年生豆科灌木,在四川省岷江干旱河谷区域广泛分布。2013年在岷江干旱河谷核心区采集小马鞍羊蹄甲的种子,选择形态大小基本一致,表皮光滑,健康无虫害的种子晒干备用。2014年5月11 日,挑选饱满种子,用20% 浓硫酸浸泡4h,蒸馏水冲洗干净并浸泡24h,2014年5月12日,把种子均匀的播撒在灭菌土为基质的育苗盘内,再覆盖2—3mm灭菌土,喷洒足够的蒸馏水,置于大棚中萌发。
菌种 摩西球囊霉菌(Funneliformismosseae)。菌种购买于北京市农林科学院植物营养与资源研究所微生物室,为高粱繁殖的土沙混合物,内含供试菌种孢子、侵染根段和菌丝片段。Funneliformismosseae从新疆昭苏新疆韭(Alliumcoeruleum)根围分离,为2857 个孢子/20 L菌剂。置于4℃冰箱保存。
供试基质 灭菌土。2014年5月取自岷江干旱河谷核心区渭门(四川省茂县),过2mm筛充分混匀,进行高压蒸汽灭菌,设置温度121℃、灭菌时间30min,灭菌2次。

表1 培养基质的基本理化性质
2.2 试验方法
本实验采用析因设计,有干旱胁迫和接菌处理两个因素。根据野外调查结果,干旱胁迫设置3个水分梯度,重度胁迫(LW)、中度胁迫(MW)和轻度胁迫(HW),控制含水量分别为40%、60%、80%的田间持水量,即控制含水量分别为7.37%、11.06%、14.74%。接菌处理设置2种微生物处理,不接菌(NM)和接种摩西球囊霉菌(FM)。使用规格为20cm×25cm的塑料花盆,每盆套两层塑料膜,然后装入灭菌基质4kg。待幼苗长出3—6片叶子,2014年5月24日移植,在每个盆的中央挖一个洞,距土壤表面5cm,铺洒10g菌种,然后将幼苗转移至洞中,使植物根系与菌种充分接触,压实周围土壤。最后表层覆盖0.1kg的蛭石,以防止水分蒸发过快。试验共6个处理,每个处理10个重复。移植前期保证充足的水分供应,待幼苗定植长势良好,2014年6月11日开始采用隔天称重法控制水分,每盆一株幼苗,控水持续至2014年9月21日,收割。
2.3 指标测定及样品分析
每一株幼苗按照根、茎、叶分别收获,根系用蒸馏水清洗干净,同时取部分土样,所有样品保存于冰盒带回实验室。鲜重在万分之一分析天平(Mettler-Toledo AL204)上称量得到,根系用扫描仪(EPSON 11000XL)扫描后经WinRhizo软件处理分析得到根长、根表面积、根体积、根尖数等指标。最后植物样品68℃烘箱中烘干至恒重,在万分之一分析天平(Mettler-Toledo AL204)上称量得到干重。其他相关指标计算如下:根比例=根干重/植株总干重,比根长=根长/根干重,拓扑指数(TI)=lgA/lgM(A最长根系通道最大路径数,M根系所有外部连接的总数)

图1 根系拓扑结构示意图Fig.1 The schematic view of topology of root system
Bouma和Fitter 等提出了根系拓扑结构的两种典型结构:鱼尾形分支和叉状分支(图1),Ⅰ:鱼尾形分支 (A=7,M=7);Ⅱ:叉状分支(A=4,M=8)[24]。典型的鱼尾形分支TI = 1,叉状分支 TI =0.5。根系分支由连续的连接组成,连接分为内部连接和外部连接,两个分支点之间为内部连接,分支与分生组织之间为外部连接,两个连续分支之间的长度为连接长度。有研究表明,植物根系的分支介于鱼尾形分枝与叉状分支之间,拓扑指数越接近1,根系越接近鱼尾形分支;相反,拓扑指数越接近0.5,根系越接近叉状分支。
2.4 数据处理
数据分析统计在SPSS 19.0软件上完成,采用单因素方差分析、双因素方差分析、LSD多重比较和相关分析,分析不同干旱胁迫程度时AMF接菌处理对幼苗根系的影响,显著水平设置为α=0.05。方差分析前,所有实测数据进行正态检验,以保证数据服从正态分布和方差齐性。相关图表制作在excel中完成。
3 结果与分析
3.1 根系形态特征
从图2可以看出,随着干旱胁迫程度从重度到轻度,未接菌幼苗根系的根鲜重、根总长、根表面积、根体积、根分枝数、根尖数之间均没有显著性差异;接种摩西球囊霉菌的幼苗根分枝数在轻度胁迫时显著高于重度胁迫,根鲜重、根总长、根表面积、根体积、根尖数在轻度胁迫时都显著高于中度胁迫和重度胁迫。3种干旱胁迫程度下,接菌幼苗的根总长、根表面积、根分枝数、根尖数均显著高于未接菌幼苗,而接菌幼苗的根鲜重、根体积则仅在中度胁迫和轻度胁迫时显著高于未接菌幼苗。“轻度胁迫+接种摩西球囊霉菌”处理幼苗的根鲜重、根总长、根表面积、根体积、根尖数最高并显著高于其它所有处理。统计分析结果表明接菌处理、水分梯度及两者交互作用对幼苗的根鲜重、根总长、根表面积、根体积都有显著影响;根分枝数只受接菌处理的显著影响;根尖数受到接菌处理及接菌与水分交互作用的显著影响。值得注意的是小马鞍羊蹄甲幼苗的根平均直径只受水分影响,相同干旱胁迫条件下,接菌与未接菌幼苗根平均直径没有显著影响(图3)。
3.2 根系拓扑结构特征
从图4可以看出,随着干旱胁迫程度从重度到轻度,接菌的和未接菌的小马鞍羊蹄甲幼苗根系拓扑指数均没有显著性变化,即本研究所设定的水分条件的变化对小马鞍羊蹄甲幼苗根系拓扑结构没有产生显著影响。但相同的干旱胁迫程度下,根系拓扑指数均表现为未接菌幼苗大于接菌幼苗,未接菌幼苗的拓扑指数介于0.75—0.80之间,趋向于鱼尾形分支结构;而接菌后幼苗的拓扑指数趋向于0.5,趋向于叉状分支结构发展。并且在重度胁迫和轻度胁迫时,未接菌的幼苗根系拓扑指数显著大于接菌的,接菌幼苗根系拓扑指数更接近0.5,叉状分支结构的发展趋势更加明显。统计分析结果表明,接菌处理对幼苗根系拓扑指数有显著影响。

图2 不同干旱胁迫和接菌处理的小马鞍羊蹄甲幼苗根系形态特征Fig.2 Root morphology of B. faberi seedlings under different drought tress and inoculationNM: 不接菌no microorganism,FM: 接种摩西球囊霉菌Funneliformis mosseae,LW: 重度胁迫low water,MW: 中度胁迫middle water, HW: 轻度胁迫high water;**表示影响极显著,*表示影响显著,n.s.表示影响不显著
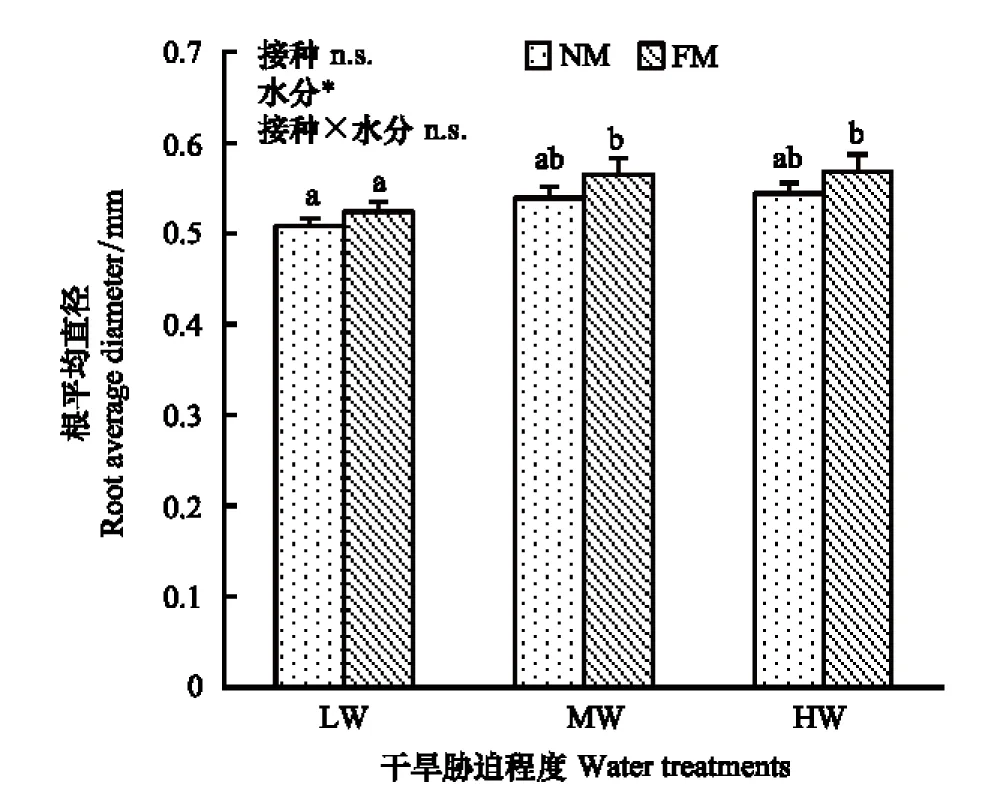
图3 不同干旱胁迫和接菌处理的小马鞍羊蹄甲幼苗根平均直径Fig.3 Root average diameter of B. faberi seedlings under different drought stress and inoculationNM: 不接菌no microorganism,FM: 接种摩西球囊霉菌Funneliformis mosseae,LW: 重度胁迫low water,MW: 中度胁迫middle water, HW: 轻度胁迫high water;**表示影响极显著,*表示影响显著,n.s.表示影响不显著

图4 不同干旱胁迫和接菌处理的小马鞍羊蹄甲幼苗根系的拓扑指数Fig.4 Root topological index of B. faberi seedlings under different drought stress and inoculationNM: 不接菌no microorganism,FM: 接种摩西球囊霉菌Funneliformis mosseae,LW: 重度胁迫low water,MW: 中度胁迫middle water, HW: 轻度胁迫high water;**表示影响极显著,*表示影响显著,n.s.表示影响不显著
3.3 根系功能性状特征
从图5可以看出,随着干旱胁迫程度从重度到轻度,未接菌幼苗的根比例逐渐减小,并且在重度胁迫时显著高于轻度胁迫时;接菌幼苗的根比例则在重度胁迫时显著高于中度和轻度胁迫。相同干旱胁迫程度下,未接菌幼苗的根比例都显著大于接菌幼苗。重度胁迫和中度胁迫时,未接菌幼苗的比根长小于接菌幼苗;轻度胁迫时,未接菌幼苗的比根长大于接菌幼苗。但是所有处理中幼苗比根长不存在显著性差异。统计分析结果表明,接菌处理、水分梯度对根比例有显著影响,但接菌处理、水分梯度以及两者交互作用对比根长都没有显著影响。
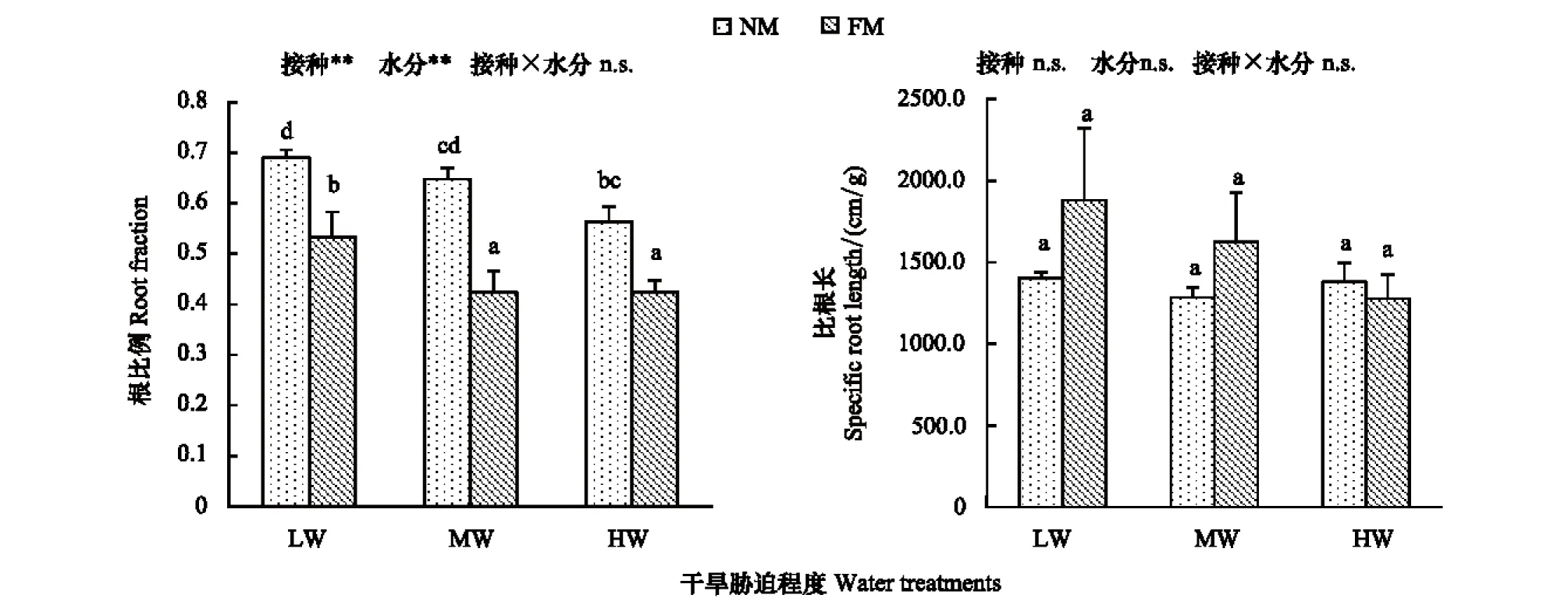
图5 不同干旱胁迫和接菌处理的小马鞍羊蹄甲幼苗根系的功能性指标Fig.5 Root functional index of B. faberi seedlings under different drought stress and inoculationA:root fraction、B:specific root lengthA:根比例、B:比根长; NM: 不接菌no microorganism,FM: 接种摩西球囊霉菌Funneliformis mosseae,LW: 重度胁迫low water,MW: 中度胁迫middle water, HW: 轻度胁迫high water;**表示影响极显著,*表示影响显著,n.s.表示影响不显著
3.4 菌根侵染率与根系各指标的相关性分析
将菌根侵染率和幼苗根系各指标进行pearson相关分析,通过分析结果(表2)可知:菌根侵染率与根鲜重、根总长、根表面积、根体积、根分枝数、根尖数在0.05水平上呈极显著正相关,其中与根尖数的相关系数最大r=0.650;与拓扑指数、根比例在0.05水平上呈极显著负相关;与根平均直径、比根长呈正相关,但未达到显著水平。

表2 菌根侵染率与小马鞍羊蹄甲幼苗根系指标相关系数
4 讨论
4.1 形态特征方面
丛枝菌根真菌能够通过改变寄主植物的根系形态特征,提高植物对水分、养分的吸收,进而促进寄主植物的生长发育,提高寄主植物的抗逆性[14, 25]。摩西球囊霉菌与小马鞍羊蹄甲幼苗根系形成良好的共生关系[20],在相同的干旱胁迫程度下,接菌AMF的幼苗的根鲜重、根总长、根表面积、根体积、根分枝数、根尖数都显著大于未接菌的。本研究在保水性差、养分含量低的培养基质(表1)上进行实验,发现接种AMF确实改变了宿主植物的根系形态,促进了根系碳水化合物积累,扩大了根系吸收范围,增加了根系与土壤的接触面,显著促进了根系的生长,增强了植物的抗旱性,这与前人的研究结论相似[14-15,26-28],也与我们之前的假设一致,其中根尖数与AM真菌侵染情况相关性最大。并且AMF对小马鞍羊蹄甲根系的促生作用随着干旱胁迫程度减轻而提高。但是本研究中接菌与未接菌幼苗的根平均直径之间没有显著差异,这与前人对青冈栎、三叶鬼针草、香樟幼苗的研究发现根平均直径减小,整个根系形态趋向于伸长发展等研究结果并不一致[29- 31],这可能与不同植物物种的遗传特性有关[6, 32]。接菌促进了小马鞍羊蹄甲幼苗根总长,其中细根(直径≤2mm)的增加说明在干旱胁迫的环境,小马鞍羊蹄甲幼苗由于与AMF共生,产生了更多的细根,通过增加吸收活跃的细根长度和根尖数量,更好的促进了根系的水分、养分吸收,进而减小了干旱胁迫危害。在本研究中,由于与AMF共生也同样促进了幼苗小根(2mm<直径≤5mm)的发展,即接种AMF同等程度地促进了幼苗的各个分级的根系的增加,使得各等级根系的分配比例关系在接菌与未接菌之间没有显著差异,进而导致了根平均直径没有显著差异,接菌处理没有改变根系的生长分配策略。

图6 不同干旱胁迫和接菌处理的小马鞍羊蹄甲幼苗各等级根长度占总长度的比例Fig.6 The ratio of root length of different classes of B. faberi seedlings under different drought stress and inoculationA:小细根总长度比例、B:大细根总长度比例、C:小根总长度比例;NM: no microorganism不接菌, FM: Funneliformis mosseae接种摩西球囊霉菌,LW: low water重度胁迫,MW: middle water中度胁迫, HW: high water轻度胁迫。**表示影响极显著,*表示影响显著,n.s.表示影响不显著
4.2 结构特征方面
接种AMF不仅对根系形态特征有显著影响,而且对根系构型也有显著影响[1, 28]。根系拓扑结构的差异表现了植物在对干旱环境适应上生态生理差异性以及营养物质吸收与根系延伸策略的差异[33]。根系的拓扑性质直接影响到植物根系吸收效率和根系构建过程中所需的碳量[34]。鱼尾分支结构次级分支少,重叠小,内部竞争小,叉状分支结构与之相反,从而在相同单位碳的投入下,鱼尾分支的根系分布范围大于叉状分支,所以鱼尾分支的根系在相同单位碳投入水平下,能够获取更多的水分和养分[34-35],达到更高的植物生长效率。本研究中未接菌的小马鞍羊蹄甲根系在3种干旱情况下都趋向于鱼尾形分支结构,与前人对胡杨的研究结果一致:干旱贫瘠的土壤环境中幼苗根系趋向鱼尾分支结构,特别是在水分较低时,幼苗主要发展主根,几乎无侧根,这种策略更有利于植物生长[36]。而在有AMF共生时,小马鞍羊蹄甲幼苗根系拓扑指数减小,水分最低的重度胁迫时显著减小,根系向叉状分支结构发展的趋势显著。以上结论说明从结构特征方面,幼苗与AMF共生显著影响根系拓扑结构,这也与我们之前的假设一致。但值得注意的是叉状分支结构并没有提高小马鞍羊蹄甲幼苗根系的吸收效率。
4.3 功能性指标方面
本研究结果表明,干旱胁迫时接种AMF能显著促进幼苗根系生物量积累,但是也显著减少幼苗根系生物量占总生物量的比例(根比例),AMF改变了幼苗的生物量分配,使幼苗有更高比例的物质用于地上部分的生长,与前人研究结论相似[22]。已有研究表明植物根系吸收水分和养分的能力更多的取决于根长而不是生物量[1]。比根长可以表征根系收益和花费的关系,具有较大比根长的植物在根系生物量投入方面比具有较小比根长的植物更具有效率[37]。在干旱胁迫下,植物会通过提高比根长、根冠比等来适应环境,当有菌根共生时,植物则会通过菌丝网络结构减少自身消耗[38]。从功能性指标方面看,接菌与未接菌幼苗的比根长没有显著差异,所以接种摩西球囊霉菌没有直接提高小马鞍羊蹄甲幼苗根系吸收效率,反而可能更多的得益于菌丝网络对吸收的促进,这一点与我们之前的假设并不一致。
综上所述,干旱胁迫条件下,接种摩西球囊霉菌显著影响了幼苗根系形态特征、结构特征,但对根平均直径和比根长等功能性指标没有显著影响,没有提高根系吸收效率。前期的研究发现AMF能够显著提高叶面积、光合速率等,显著促进地上部分生长和光合作用[20]。由此推测在生长的初期,接种摩西球囊霉菌显著促进小马鞍羊蹄甲根系生长可能是源于地上光合作用显著增加,进而提高了初级生产力,增加了碳水化合物分配到根系的量,提高了根鲜重、根总长、根表面积、根体积、根分枝数、根尖数;而根系生长的增加进一步促进幼苗水分、养分吸收,最终在干旱贫瘠的条件下促进幼苗的生长发育,缓解干旱胁迫。总体来说,AMF的共生确实可以改善根系形态和结构,有利于植物适应干旱环境,加速植被恢复,这对干旱河谷区生态恢复也具有重要的现实意义。
致谢:中国科学院茂县山地生态系统定位研究站提供温室大棚,北京市农林科学院植物营养与资源研究所微生物室提供菌种,特此致谢。
[1] Hodge A, Berta G, Doussan C, Merchan F, Crespi M. Plant root growth, architecture and function. Plant and Soil, 2009, 321(1/2): 153- 187.
[2] 单立山. 西北典型荒漠植物根系形态结构和功能及抗旱生理研究[D]. 兰州: 甘肃农业大学, 2013.
[3] Finér L, Ohashi M, Noguchi K, Hirano Y. Factors causing variation in fine root biomass in forest ecosystems. Forest Ecology and Management, 2011, 261(2): 265- 277.
[4] 席本野, 王烨, 贾黎明, 司婧, 向地奎. 宽窄行栽植模式下三倍体毛白杨根系分布特征及其与根系吸水的关系. 生态学报, 2011, 31(1): 47- 57.
[5] Dannowski M, Block A. Fractal geometry and root system structures of heterogeneous plant communities. Plant and Soil, 2005, 272(1/2): 61- 76.
[6] Malamy J E. Intrinsic and environmental response pathways that regulate root system architecture. Plant, Cell and Environment, 2005, 28(1): 67- 77.
[7] Atkinson D, Black K E, Forbes P J, Hooker J E, Baddeley J A, Watson C A. The influence of arbuscular mycorrhizal colonization and environment on root development in soil. European Journal of Soil Science, 2003, 54(4): 751- 757.
[8] Hodge A. Plastic plants and patchy soils. Journal of Experimental Botany, 2006, 57(2): 401- 411.
[9] 宋成军. 岷江干旱河谷植被恢复机制研究——以小马鞍羊蹄甲为例[D]. 北京: 中国科学院研究生院, 2009.
[10] 丁红, 张智猛, 戴良香, 康涛, 慈敦伟, 宋文武. 干旱胁迫对花生根系生长发育和生理特性的影响. 应用生态学报, 2013, 24(6): 1586- 1592.
[11] 郭数进, 杨凯敏, 霍瑾, 周永航, 王燕平, 李贵全. 干旱胁迫对大豆鼓粒期叶片光合能力和根系生长的影响. 应用生态学报, 2015, 26(5): 1419- 1425.
[12] 李文娆, 张岁岐, 丁圣彦, 山仑. 干旱胁迫下紫花苜蓿根系形态变化及与水分利用的关系. 生态学报, 2010, 30(19): 5140- 5150.
[13] 马富举, 李丹丹, 蔡剑, 姜东, 曹卫星, 戴廷波. 干旱胁迫对小麦幼苗根系生长和叶片光合作用的影响. 应用生态学报, 2012, 23(3): 724- 730.
[14] 王如岩, 于水强, 张金池, 周垂帆, 陈莉莎. 干旱胁迫下接种菌根真菌对滇柏和楸树幼苗根系的影响. 南京林业大学学报: 自然科学版, 2012, 36(6): 23- 27.
[15] Birhane E, Sterck F J, Fetene M, Bongers F, Kuyper T W. Arbuscular mycorrhizal fungi enhance photosynthesis, water use efficiency, and growth of frankincense seedlings under pulsed water availability conditions. Oecologia, 2012, 169(4): 895- 904.
[16] 张中峰, 张金池, 黄玉清, 杨慧, 罗亚进, 罗艾滢. 丛枝菌根真菌对植物耐旱性的影响研究进展. 生态学杂志, 2013, 32(6): 1607- 1612.
[17] Smith S E, Smith F A. Roles of arbuscular mycorrhizas in plant nutrition and growth: new paradigms from cellular to ecosystem scales. Annual Review of Plant Biology, 2011, 62(1): 227- 250.
[18] Smith S E, Facelli E, Pope S, Smith F A. Plant performance in stressful environments: interpreting new and established knowledge of the roles of arbuscular mycorrhizas. Plant and Soil, 2010, 326(1/2): 3- 20.
[19] Kardol P, Wardle D A. How understanding aboveground-belowground linkages can assist restoration ecology. Trends in Ecology & Evolution, 2010, 25(11): 670- 679.
[20] 张亚敏, 马克明, 李芳兰, 曲来叶. 干旱胁迫条件下AMF促进小马鞍羊蹄甲幼苗生长的机理研究. 生态学报, 2016, 36(11), doi: 10.5846/stxb201506291320.
[21] 王冰冰, 曲来叶, 宋成军, 宫渊波. 岷江干旱河谷优势灌丛对土壤微生物群落组成的影响. 生态学报, 2015, 35(8): 2481- 2493.
[22] 宋成军, 曲来叶, 马克明, 傅伯杰, 陈羚. AM真菌和磷对小马安羊蹄甲幼苗生长的影响. 生态学报, 2013, 33(19): 6121- 6128.
[23] 陈云, 曲来叶, 马克明, 杨曦雨. 岷江干旱河谷小马鞍羊蹄甲根围丛枝菌根真菌群落的研究. 菌物学报, 2016, 35(1): 39- 51.
[24] Fitter A H, Stickland T R. Architectural analysis of plant root systems 2. Influence of nutrient supply on architecture in contrasting plant species. New Phytologist, 1991, 118(3): 383- 389.
[25] 黄京华, 刘青, 李晓辉, 曾任森, 骆世明. 丛枝菌根真菌诱导玉米根系形态变化及其机理. 玉米科学, 2013, 21(3): 131- 135, 139- 139.
[26] Wu Q S, Zou Y N, He X H, Luo P. Arbuscular mycorrhizal fungi can alter some root characters and physiological status in trifoliate orange (PoncirustrifoliataL. Raf.) seedlings. Plant Growth Regulation, 2011, 65(2): 273- 278.
[27] Wu Q S, Zou Y N, He X H. Contributions of arbuscular mycorrhizal fungi to growth, photosynthesis, root morphology and ionic balance of citrus seedlings under salt stress. Acta Physiologiae Plantarum, 2010, 32(2): 297- 304.
[28] 曾富兰. 丛枝菌根真菌诱导黄花蒿(ArtemisiaannuaL.)根系形态变化及变化的生理机制[D]. 南宁: 广西大学, 2014.
[29] 张中峰, 张金池, 黄玉清, 郭晓平, 杨慧, 邓艳. 水分胁迫和接种菌根真菌对青冈栎根系形态的影响. 生态学杂志, 2015, 34(5): 1198- 1204.
[30] 王宁, 秦艳. AM真菌对宿主植物三叶鬼针草根系形态的影响. 安徽农业科学, 2012, 40(1): 13- 4, 26- 26.
[31] 何跃军, 钟章成. 水分胁迫和接种丛枝菌根对香樟幼苗根系形态特征的影响. 西南大学学报: 自然科学版, 2012, 34(4): 33- 39.
[32] Yang H S, Zhang Q, Dai Y J, Liu Q, Tang J J, Bian X M, Chen X. Effects of arbuscular mycorrhizal fungi on plant growth depend on root system: a meta-analysis. Plant and Soil, 2015, 389(1/2): 361- 374.
[33] Oppelt A L, Kurth W, Godbold D L. Topology, scaling relations and Leonardo′s rule in root systems from African tree species. Tree Physiology, 2001, 21(2/3): 117- 128.
[34] 单立山, 李毅, 任伟, 苏世平, 董秋莲, 耿东梅. 河西走廊中部两种荒漠植物根系构型特征. 应用生态学报, 2013, 24(1): 25- 31.
[35] 单立山, 李毅, 董秋莲, 耿东梅. 红砂根系构型对干旱的生态适应. 中国沙漠, 2012, 32(5): 1283- 1290.
[36] 吕爽, 张现慧, 张楠, 夏延国, 井家林, 李景文. 胡杨幼苗根系生长与构型对土壤水分的响应. 西北植物学报, 2015, 35(5): 1005- 1012.
[37] 黄冬. 湖北省21个典型树种细根形态结构比较研究[D]. 武汉: 华中农业大学, 2010.
[38] Johnson D, Martin F, Cairney J W G, Anderson I C. The importance of individuals: intraspecific diversity of mycorrhizal plants and fungi in ecosystems. New Phytologist, 2012, 194(3): 614- 628.
Inoculation with arbuscular mycorrhizal fungi enhances the root system ofBauhiniafaberivar.microphyllaseedlings under drought stress conditions
ZHANG Yamin1,2, MA Keming1, QU Laiye1,2,*
1ResearchcenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China2UniversityofChineseAcademyofSciences,Beijing100049,China
Arbuscular mycorrhizal fungi (AMF) can develop a symbiotic relationship with the roots of most terrestrial plants, which can improve the drought tolerance of the host plants. Based on our previous studies, AMF play a critical role in promoting native plant growth in the arid valley of the Minjiang River, China. Furthermore, the effects of AMF on root growth are as important as their effects on aboverground growth. To understand how plant roots respond to AMF under different drought stress conditions, we designed a completely randomized full factorial pot experiment in a greenhouse in the arid valley of the Minjiang River. We added one common AMF (Funneliformismosseae, FM) to the roots of seedlings from a dominant native shrub (Bauhiniafaberivar.microphylla), using three different drought stress conditions. Continuous drought stress was induced by watering the seedlings with distilled water at one-day intervals for three months at low (40%), medium (60%), and high levels (80%) of the field capacity. At the end of the experiment, we harvested the seedlings, and cleaned their roots with distilled water. We subsequently measured the root fresh weight, scanned the roots with a root scanner (EPSON 11000XL), and obtained variables such as root length, root surface area, root volume, root forks, and number of root tips with WinRhizo. We subsequently analyzed the root architecture and the functional characteristics of theB.faberiseedlings to address the relationship between root development and AMF presence under different levels of drought stress. We used one-way ANOVAs, two-way ANOVAs, LSD fitting methods, and Pearson′s correlations for our statistical analyses. Inoculation of FM significantly increased the total root length, root surface area, root forks, and the number of root tips under all three drought stress conditions (P< 0.001). In addition, under medium and high soil water content, it significantly increased root fresh weight and root volume (P< 0.001). More specifically, high soil water conditions resulted in the significantly highest root fresh weight, total root length, root surface area, root volume, and number of root tips after FM addition. Nonetheless, there was no significant difference in average root diameter between inoculated and non-inoculated seedlings. Inoculated seedlings tended to develop a dichotomous branching style, which was more profound at low (40% of field capacity) soil water content (P< 0.001). Furthermore, the root fractions of inoculated seedlings were significantly smaller than the non-inoculated seedlings (P< 0.001). However, there was no significant difference in specific root length among all the treatments. Root fresh weight, root length, root surface area, root volume, root forks, and number of root tips correlated significantly and positively with colonization rate (P<0.001). In contrast, topological index and root fraction were significantly and negatively correlated with colonization rate (P<0.001). Overall, we found that, although AMF did not improve the root absorption efficiency in the initial growth period ofB.faberi, AMF presence significantly affected seedling root morphology and root functional characteristics. These latter effects enhancedB.faberiseedling growth, which allowed the plants to adapt to drought conditions. Finally, the positive effects of AMF on root growth increased with improving water conditions.
Funneliformismosseae;drought stress; root morphology; topology of root system;Bauhiniafaberivar.microphylla
国家自然科学基金(31170581)
2016- 01- 28; 网络出版日期:2016- 10- 29
10.5846/stxb201601280209
*通讯作者Corresponding author.E-mail: lyqu@rcees.ac.cn
张亚敏,马克明,曲来叶.干旱条件下接种AM真菌对小马鞍羊蹄甲幼苗根系的影响.生态学报,2017,37(8):2611- 2619.
Zhang Y M, Ma K M, Qu L Y.Inoculation with arbuscular mycorrhizal fungi enhances the root system ofBauhiniafaberivar.microphyllaseedlings under drought stress conditions.Acta Ecologica Sinica,2017,37(8):2611- 2619.
