兔肝细胞生长因子蛋白质结构及功能分析*
2017-06-26韩金霞梁兆光
韩金霞,梁兆光
(1.大庆油田总院心内科,黑龙江 大庆 163000;2.哈尔滨医科大学附属第一医院心内七科,黑龙江 哈尔滨 150001)
肝细胞生长因子 (Hepatocyte growth factor,HGF),是一种分泌型肝素亲和糖蛋白,是心肌营养因子和特异的促内皮细胞生长因子,能够促进新生血管的形成。HGF明显促进VEGF(血管内皮生长因子)的mRNA表达,两者在促血管生成方面具有协同作用[1]。文献报道,在兔、小鼠缺血模型中,HGF能刺激新生血管生成,在体内和体外试验中,HGF的血管生成活性被证实比血管内皮生长因子及碱性成纤维细胞生长因子更为强大[2-3]。有报道称[4],在大鼠心肌梗死模型中,HGF过度表达能刺激血管新生和侧支血管形成。兔肝细胞生长因子(rabbit hepatocyte growth factor,RABHGF) 是首次扩增出的兔HGF基因序列,已在genbank中发表。本实验获得了两种全长的兔HGF cDNA序列,利用软件和生物信息学站点进行分析,为今后利用兔HGF进行基因研究提供更多的信息。
1 材料与方法
2007年本课题组通过5′-Race和3′-Race法和重组PCR法成功获得了未知的兔肝细胞生长因子的基因序列,获得了两种全长的兔HGF cDNA序列,命名为兔HGF-1和兔HGF-2,已被Genbank收录,编号分别为EU128740和FJ237417。利用计算机软件Gene Runner和DNAStar及生物学信息站点,对兔HGF cDNA序列进行分析和比较,并对编码的蛋白质氨基酸序列进行分析和预测。
2 结果
2.1 兔HGF的cDNA序列及其分析
兔HGF-1由2299个碱基对组成,编码了762个氨基酸;兔HGF-2由2320碱个基对组成,编码了769个氨基酸。人HGF基因cDNA序列为2184bp,编码1条含728个氨基酸,具有4个糖基化位点、4个kringle环,分子量为83KD的多肽链。通过比较不同的HGF的cDNA克隆后发现,存在多种HGF的mRNA的转录本,经过不同的拼接,导致了不同的HGF变种[5]。例如:人HGF是由1条含有728个氨基酸的单链前体蛋白裂解而来的异质二聚体,单链HGF和异质二聚体形式具有相等的生物活性[6]。兔HGF-2的cDNA在第854位碱基处较兔HGF-1的cDNA有1个21碱基片段(GAAGCCGTTATTTTGCAAGAG)的插入,使推导的兔HGF-2氨基酸序列在285位残基处较兔HGF-1多7个氨基酸(GSRYFAR)。通过Gene Runner分析表明,在兔HGF-2氨基酸序列的285~292位置附近并不存在特殊的蛋白质功能基序。将兔HGF-1的cDNA与兔HGF-1的cDNA核酸序列用DNAStar的Clustal V方法进行比较发现二者相似性为99.8%;而用Jotun Hein和Clustal W方法比较二者相似性为100%。兔HGF-1与兔HGF-2的氨基酸序列进行比较发现二者相似性为;用Jotun Hein方法比较为100%,用Clustal V方法比较为99.1%,用Clustal W方法比较为99.9%。因此,推断兔HGF-1和兔HGF-2二者编码蛋白质的活性是相似或者相同的,或者推断出兔HGF-1和兔HGF-2基因序列是两种极为相似的变种。
兔HGF-1蛋白和兔HGF-2蛋白都缺失了FLPSS分子。FLPSS分子是pro-HGF的自然变种,因在其编码区缺失15bp,故在Kringle 1区缺失了5个氨基酸。但这一缺失不影响其分泌后的加工,仍可被酶切为少于5个氨基酸的双链HGF形式。与全长的pro-HGF分子比较,FLPSS分子存在数量少,与肝素的亲和力略有降低,其他性质基本一致[6]。通过DNAStar软件对genbank中公布的鼠HGF mRNA序列(GI:170172521,GI:220766,GI:220437)的比较发现,鼠HGF mRNA(GI:170172521,GI:220766)两个序列里含有FLPSS分子,鼠HGF mRNA (GI:220437)的序列也存在了FLPSS分子的缺失。
2.2 兔HGF蛋白质序列的同源性分析及比较
利用核酸分析软件DNAStar,将兔HGF的测序结果与已知的人HGF(2187bp)[GI:2171032]和鼠HGF(2189bp)[GI:220437]序列进行了同源性分析。将兔HGF-1和人HGF的核酸序列进行比较后发现,二者同源性为89.3%,其推导的氨基酸序列同源性为91.4%。此外,兔HGF-1和鼠HGF核酸序列同源性为86.8%,推导的氨基酸序列同源性为92.0%。将兔HGF-2和人HGF的核酸序列进行比较后发现,二者同源性为89.1%,其推导的氨基酸序列同源性为90.9%。此外,兔HGF-2和鼠HGF核酸序列同源性为86.6%,推导的氨基酸序列同源性为91.6%。
2.3 蛋白质各组成及疏水性分析
兔HGF-2序列片段全长2320个碱基对,含有2202个碱基对组成的最大开放阅读框架及118bp组成的3'非翻译区。为了更加全面地统计各参数,用expasy中的工具ProtParam,结果如下:氨基酸数目:769个; 分子量:87483.1;等电点:8.76;pH值:2.5;负电荷残基总数(Asp+Glu):82;正电荷残基总数(Arg+Lys):103;分子式:C3859H5993N1091O1122S58;原子总数:12123;半衰期:30h;不稳定系数:31.73,该蛋白分类为稳定蛋白;脂肪系数:67.15;Grand average of hydropathicity (GRAVY)亲水性评估:-0.606,该蛋白为亲水蛋白。
2.4 蛋白质功能基序分析
应用Gene Runner对兔HGF-2蛋白进行分析,分析提示:其分子内部含有一特殊结构RGD。RGD是促进细胞粘附的蛋白质中的特有结构,围绕RGD的序列都是可变的,但RGD序列本身却是高度保守的。识别RGD序列的整合素有α3β1、α5β1、IIb/β3等。1个cAMP-/cGMP依赖蛋白激酶磷酸化位点;2个酪氨酸激酶(Tyr)磷酸化位点;3个N-糖基化位点;4个kringle环;9个酪蛋白激酶II(CK2)磷酸化位点;10个N-豆蔻酰化位点;含12个蛋白质激酶C(PKC)磷酸化位点。
2.5 蛋白质亚细胞定位预测
通过工具PSORT进行预测,结果如下:细胞外质,包括细胞壁:13.0%;线粒体:21.7%;液泡结构:4.3%;胞核:47.8%。细胞质:8.7%;细胞骨架:4.3%。
2.6 蛋白质信号肽及酶切位点预测
通过采用基于神经网络(NN)的算法和隐藏的马尔可夫模型(HMM)预测兔HGF-2蛋白质的信号肽及其切割位点,结果表明,兔HGF-2蛋白具有一段由32个氨基酸组成的信号肽。信号肽概率:0.990;信号锚定概率:0.008。最大可能切割位点:0.763 其切割位点可能位于32-33AA(AEG-QK)之间。见图1。
2.7 蛋白酶切位点预测
通过工具Peptide Cutter进行预测,结果发现,共有如下蛋白酶对兔HGF 2蛋白有酶切作用:精氨酸-C蛋白水解酶、Asp-N内切酶、Asp-N内切酶+N端亮氨酸、BNPS-Skatole、细胞凋亡蛋白酶1、2、3、4、5、6、7、8、9、10、高特异性糜蛋白酶、低特异性糜蛋白酶、梭菌蛋白酶、CNBr、肠激酶、颗粒酶B、凝血因子Xa、甲酸、谷氨酰基肽链内切酶、盐酸羟胺、氧代苯甲酸、LysC、LysN、NTCB、胃蛋白酶(pH1.3)、胃蛋白酶(pH>2)、脯氨酸肽链内切酶、蛋白酶K、葡萄球菌肽酶I、烟草蚀纹病毒酶、嗜热菌蛋白酶和凝血酶,及胰蛋白酶等。
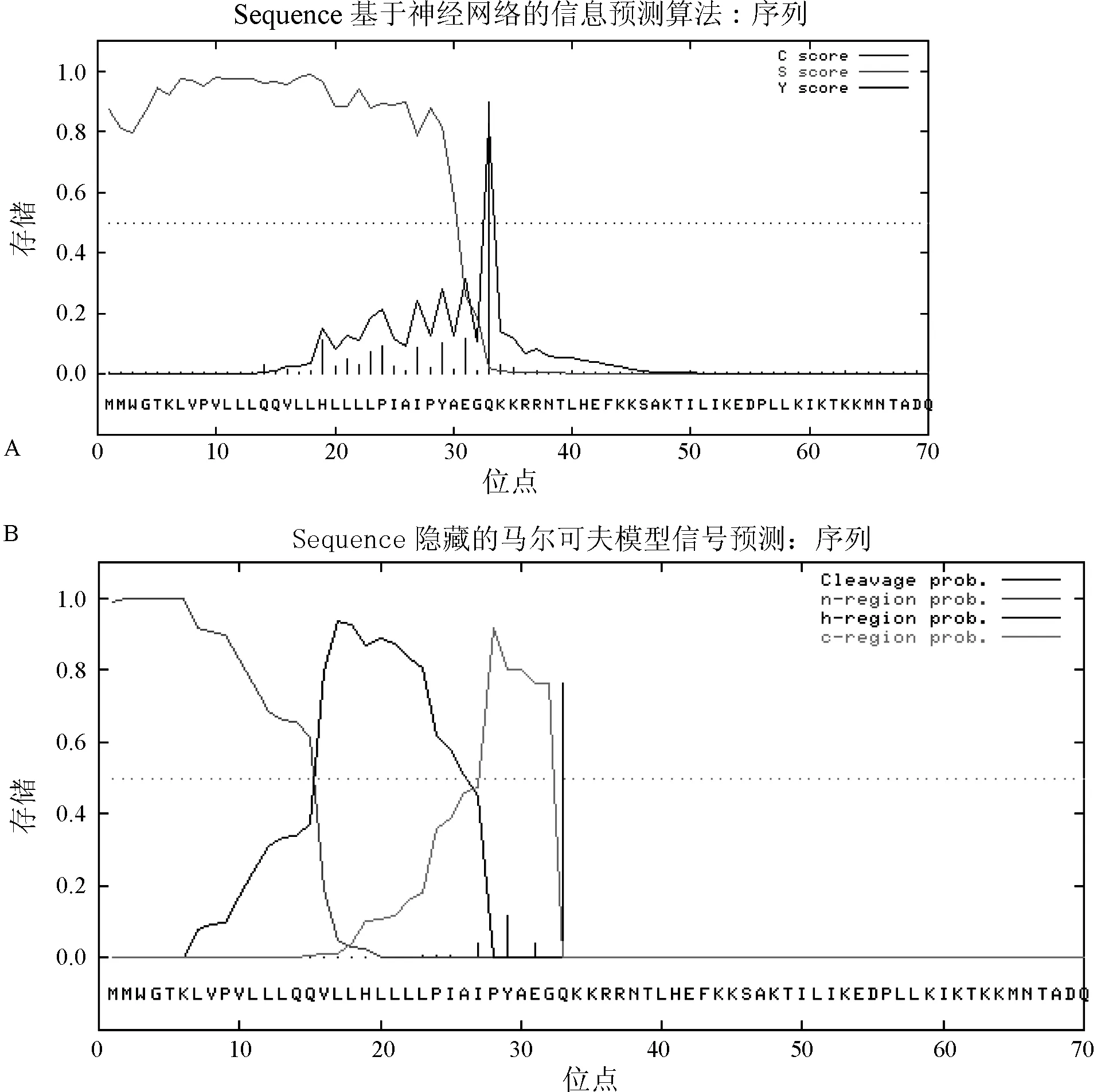
图1 兔HGF1蛋白质信号肽预测 注:A:NN(神经网络)算法;B:HMM(马尔可夫模型)算法
2.8 蛋白质跨膜区预测
为了更直观的显示兔HGF-2蛋白是否具有跨膜区,借助网站预测结果:ExpAA=19.92,该数值大于18;First 60 AAs=19.88,该数值大于10;PredHel=1;Topology=i7-29o,拓扑结构(跨膜螺旋)位于膜内侧,氨基酸位置是7-29。见图2。

图2 兔HGF-2蛋白质跨膜区预测
3 讨论
通过Gene Runner分析和DNAStar的Clustal V方法推断兔HGF-2和兔HGF-1二者编码蛋白质的活性是相似或者相同的。因此,以兔HGF-2蛋白为例进行比较全面的蛋白序列分析。兔HGF-2通过generuner分析表明,其具有3个糖基化位点、4个kringle环,分子量为87KD的多肽链,兔HGF蛋白半衰期为30h,属于稳定的亲水蛋白。预测兔HGF-2蛋白是否具有跨膜区,ExpAA=19.92,该数值大于18,说明这个蛋白结构中更可能存在跨膜蛋白,或者说有一个信号肽;First 60 AAs=19.88,该数值大于10,说明这个蛋白结构中在N-端可能存在信号肽;PredHel=1预测这个蛋白结构中可能存在1个跨膜蛋白。总结比较已报道的不同的哺乳动物的HGF,虽然它们均有促进肝细胞生长和增殖的功能,但在来源、分子量和性质等方面有较大差异[7]。
HGF 是一种具有多种生物学功能的细胞因子,如促细胞分裂剂、促细胞运动剂和促形态形成剂等作用[8]。HGF通过结合到c-Met受体而作用于多种类型靶细胞,包括内皮细胞,并能诱导非内皮细胞释放其他的内皮细胞分裂原,是强有力的血管新生的刺激因子[9]。蒋逸风等[10]实验研究提示,HGF可能主要通过促进血管内皮细胞增殖,加速内皮系愈合而间接抑制血管平滑肌细胞的增殖,从而起到预防再狭窄的作用。
本研究表明,兔HGF基因可转染至COS-7细胞并分泌表达兔HGF蛋白,对细胞具有促进细胞生长的生物学活性,从而利用兔HGF基因和已建立的兔心肌缺血模型进行下一步缺血性心脏病的基因治疗实验研究。
[1] NAKAMURA T,MIZUNO S,MATSUMOTO K,etal.Myocardial protection from ischemia/ reperfusion injury by endogenous and exogenous HGF [J].Clin Invest,2000,106 (12):1511-1519.
[2] MORISHITA R,SA KAKIM,YAMAMOTO K,etal.Impairment of collateral formation in Lp transgenic mice:therapeutic angiogenesis induced by human hepatocyte growth fator gene[J].Circulation,2001,105(10):1491-l496.
[3] TANIYAMA Y,MORISHITA R,AOKI M,etal.Therapeutic angiogenesis induced by human hepatocyte growth factor gene in rat and rabbit hindlimb ischemia models:preclinical study for treatment of peripheral arterial disease[J].Gene Ther,2001,8(1):181-189.
[4] TANIYAMA Y,MOFISHITA R,AOKI M,etal.Angiogensis and antifibrotic action by hepatocyte growth factor in cardiomyopathic hamsters[J].Circulation,2000,2(2):246-252.
[5] 俞水亮,杨复华.肝细胞生长因子的分子生物学研究[J].生物工程学报,2002,18(1):1-4.
[6] 张武.肝细胞生长因子研究进展[J].免疫学杂志,2001,17(3)125-128.
[7] 罗运权,吴孟超.肝细胞生长因子[J].新消化病学杂志,1997,5(3)198-199.
[8] SEIDEL C,BORSET M.Role of hepatocyte growth factor and its recptor C-Met in multiple myeloma[J].Med Oncol,1998,15(3):145-153.
[9] MORISHITA R,AOKI M,HASHIYA N,etal.Therapeutic angiogenesis using hepatocyte growth factor[J].Curr Gene Ther,2004,4:199-206.
[10] 蒋逸风,林晓耘,陈双红,等.肝细胞生长因子和血管内皮细胞生长因子对血管壁细胞增殖的影响[J].解放军医学杂志,2003,28(9):814-815.
