欧美杨111号组织培养再生体系的建立
2017-06-24矫丽曼
矫丽曼
(辽宁省杨树研究所,辽宁 盖州 115200)
欧美杨111号组织培养再生体系的建立
矫丽曼
(辽宁省杨树研究所,辽宁 盖州 115200)
以欧美杨111号叶片为外植体,以MS和1/2MS为基本培养基,附加不同浓度的NAA、6-BA和IBA,观察不定芽诱导和生根情况,确定欧美杨111号植株再生体系。结果显示:欧美杨111号叶片最佳分化培养基为MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+蔗糖25 g·L-1+琼脂6 g·L-1,pH值6.5,不定芽分化率为96.67%;最佳生根培养基为1/2MS+IBA 0.3 mg·L-1+蔗糖20 g·L-1+琼脂6 g·L-1,pH值6.0,全部生根,平均根数13.2条。
欧美杨111号;组织培养;再生体系;外植体
欧美杨111号Populus euramericana‘Bellotto’植物新品种保护登记名称为“贝洛托111”,是意大利杨树研究所利用人工控制授粉,通过有性杂交试验所获得的杂交无性系,雌性植株。母本为美洲黑杨P.deltoides‘217/958’,父本是自由授粉的欧美杨无性系。1984年中国林业科学研究院张绮纹从意大利引入[1]。2002年通过国家林业局植物新品种保护审定,编号:20020005。欧美杨111号树干通直、树冠窄小、侧枝细、树形美观,生长速度快,是有很强的耐旱、耐低温、抗害虫、抗溃疡病的优良品种,无性繁殖容易,抗风能力强,落叶期晚,轮伐期短,材质好,是纸浆材和板材的优良原材料,适合在我国东北的南部、华北、华东、内蒙、华南及西南等广大地区种植[2-4]。
为提高欧美杨111号的抗逆性,通过转基因的手段将带有特异功能的外源基因导入体内,在受体上表达,而组织培养再生体系的建立为转基因的成功提供了基础与前提。本文建立了欧美杨111号组织培养再生体系,为该杨树品种的广泛推广、抗性及分子水平的研究提供一定的理论基础。
1 材料与方法
1.1 材料
2016年3月末从辽宁省杨树研究所锦州市金城苗圃采集欧美杨111号1年生枝条,置于室内水培萌发,幼叶伸展后,以萌发的幼叶作为外植体。
1.2 方法
1.2.1 欧美杨111号外植体的选择及预处理[5-7]
选取萌发伸展长度在1 cm以上的幼叶,用剪刀将叶片剪下,用自来水冲洗干净,放入无菌平皿中。在无菌条件下,用75%的乙醇溶液冲洗3次,再用0.1%的氯化汞溶液浸泡5 min,取出后用无菌水冲洗数次,用无菌剪刀将叶片的两端剪掉,并在叶片中间与叶脉平行处剪开几个裂口,即获得无菌外植体叶片。
1.2.2 不定芽分化培养基的优化[8-10]
不定芽分化培养基以MS为基本培养基,添加不同浓度的NAA和6-BA(表1),将处理好的无菌外植体分别接种于不同培养基中诱导,同时培养基中添加蔗糖25 g·L-1、琼脂6 g·L-1,pH值6.5,每个处理重复3次,共接30个叶片。
1.2.3 生根培养基的优化[11-12]
生根培养基以1/2MS为基本培养基,添加不同浓度的IBA(表2),同时添加蔗糖20 g·L-1,琼脂6 g·L-1,pH值6.0。剪下生长长度超过2 cm的不定芽,每瓶接2个不定芽,4瓶为1个处理,重复3次,共接24个不定芽。
1.2.4 培养条件及计算方法[13-14]
接种后的各处理放在组织培养室内,培养温度25℃,光照强度2 000~2 500 lx,每天照明14 h,接种的分化苗每3周转接1次,20 d后观察叶片的分化情况、分化时间及分化数量。培养40 d后统计分化的叶片数和分化的不定芽数,计算平均分化芽和不定芽分化率。
2 结果与分析
2.1 不定芽分化培养基的确定
随着叶片培养时间的增加,先在叶片的剪切口处开始膨大,形成嫩绿色的瘤状愈伤组织,之后变成暗红色,约27 d后在愈伤组织处分化出不定芽。从表1可以看出,欧美杨111号叶片平均分化芽2.6~22.8个,不定芽分化率20.00%~96.67%,其中7、10、11、12、13号的不定芽分化率高于其他,10号最高为96.67%。芽长势见图1。
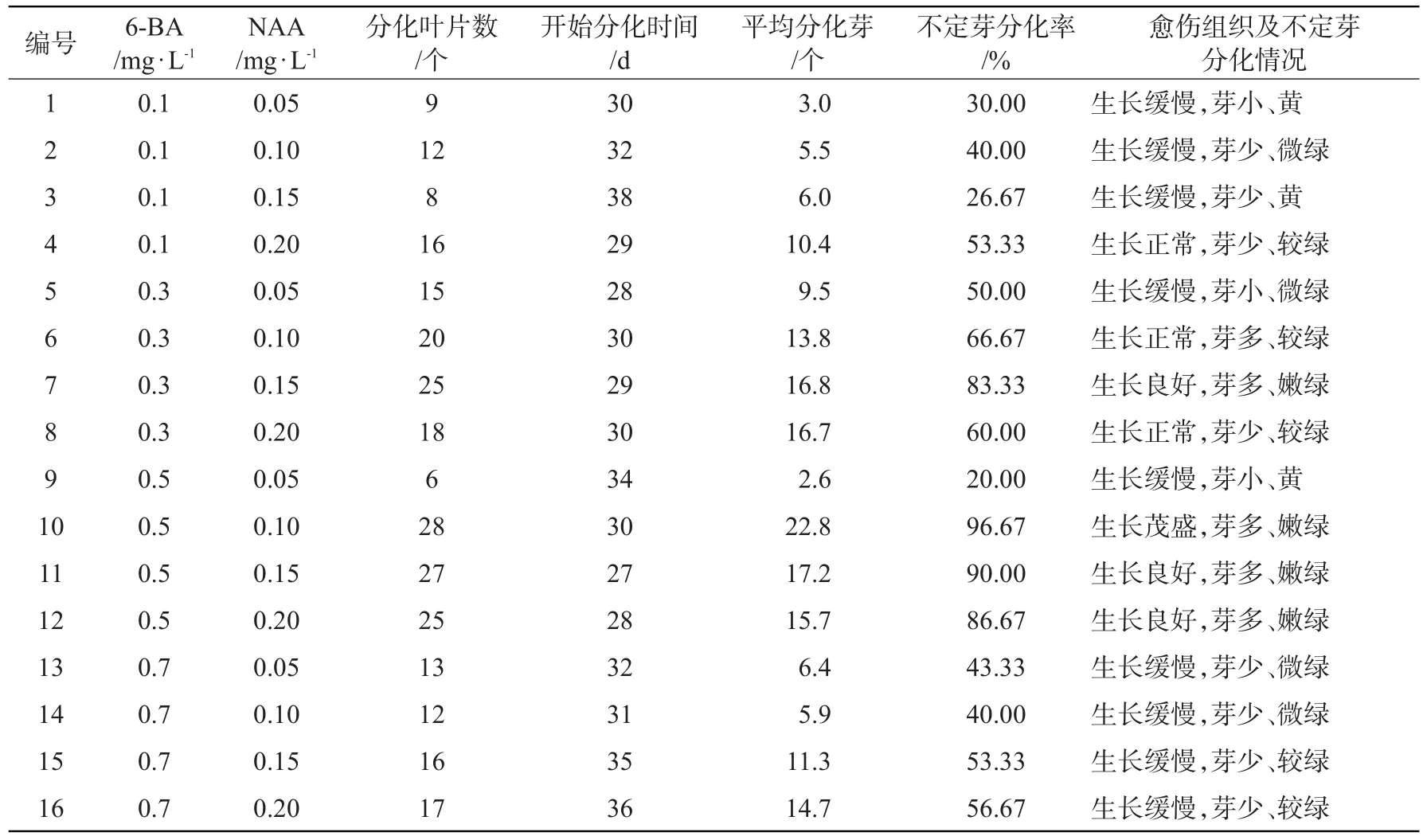
表1 欧美杨111号叶片在不同培养基上的分化情况
同时采用相同的方法对叶柄分化培养基进行了筛选,结果与叶片相同,只是叶柄开始分化时间早于叶片5 d左右。
因此确定欧美杨111号叶片不定芽最佳分化培养基为MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+蔗糖25 g·L-1+琼脂6 g·L-1,pH值6.5。
2.2 不定芽生根培养基的确定
10 d左右在茎的基部开始膨大,之后长出小根,初为红色,随着根的伸长变成浅红、乳白色,培养到20 d左右计算生根率。由表2可知,不定芽培养15 d左右开始生根,生根的不定芽数18~24个,生根率75%~100%。其中3号的生根率最高为100%,平均生根数为13.2条。因此确定欧美杨111号不定芽最佳生根培养基为1/2MS+IBA 0.3 mg·L-1+蔗糖20 g·L-1+琼脂6.0 g·L-1,pH值6.0。

图1 欧美杨111号叶片在分化培养基上分化及不定芽的生长状况
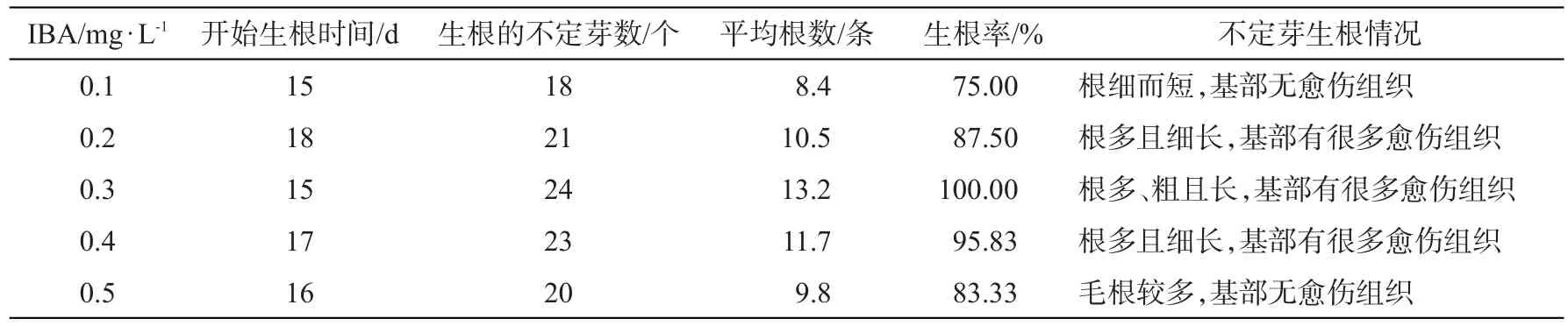
表2 欧美杨111号不定芽在不同培养基上的生根情况
3 结论与讨论
3.1 外植体的选择
同一植株上不同器官的再生能力有所不同,即使同一器官的不同部位,再生能力也有差异[15]。本试验采用叶片为外植体进行组织培养再生体系的建立,同时也剪取了叶柄和叶芽为外植体,叶柄的分化要早于叶片,但在分化后期基本相同。叶芽为外植体几乎未分化。
3.2 外植体的预处理
对大多数植物来说,挑选新生的幼叶、叶柄或茎尖做为外植体,必须根据剪材时间、材料的幼嫩程度等选择消毒剂。本文采用75%的乙醇溶液和0.1%的氯化汞作为消毒剂,并在无菌的条件下进行清洗和消毒,降低了外植体在接种培养过程中的感染率。
3.3 不同激素对杨树不定芽分化及生根的影响
植物愈伤组织不定芽的分化直接取决于培养基的种类、添加激素的种类与浓度。常用的林木组织培养培养基有MS、WPM和GMS,用的最多的是MS培养基。杨树组织培养中常用的有生长素(IAA、NAA、IBA和2,4-D)和细胞分裂素(KT、6-BA、ZT、2ip、BAP)。本试验用6-BA、NAA来诱导欧美杨111不定芽的分化,其最适分化培养基为MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+蔗糖25 g·L-1+琼脂6 g·L-1,pH值6.5。用IBA诱导生根,其最适生根培养基为1/2MS+IBA 0.3m g·L-1+蔗糖20 g·L-1+琼脂6 g·L-1,pH值6.0。不定芽分化率96.67%,平均分化芽22.8个,全部生根,平均根数13.2条。
本研究以欧美杨111号为试验材料,通过对植物生长调节剂的种类、浓度等的研究,建立起组织培养再生体系,为该杨树在全国范围内推广提供了前提基础,也为基因工程育种的研究提供了基本条件和保障。
[1]李文荣,任建中,段自安,等.杨树与柳树新品种及其栽培[M].北京:中国林业出版社,2008.
[2]张绮纹,李金花.杨树工业用材林新品种[M].北京:中国林业出版社,2003.
[3]尹伟伦.中国杨树栽培及利用研究[R].北京:中国林业出版社,2005.
[4]陈章水.杨树栽培实用技术[M].北京:中国林业出版社,2005.
[5]陶延珍,李枫,李毅.箭杆杨组织培养再生体系的建立[J].西北农林科技大学学报(自然科学版),2008,36(3):203-207.
[6]赵鑫闻.甜杨叶片高频植株再生体系的建立[J].中国农学通报,2015,31(34):6-9.
[7]杨传平,郑琼,马旭俊,等.欧美杨“山地1号”组织培养再生系统的建立[J].分子植物育种,2006,4(4):579-582.
[8]张蕾,苏晓华,张冰玉,等.京2杨组培条件的优化与再生体系建立[J].林业科学研究,2007,20(6):787-793.
[9]康冰,王关平,张小红,等.欧美黑杨离体再生途径及影响因子的研究[J].西北植物学报,2004,24(12):2355-2358.
[10]李开隆,靳春莲,李明德.香杨的组织培养和植株再生[J].植物生理学通讯,2009,45(3):281.
[11]樊军锋,李玲,韩一凡,等.84K杨叶片外植体再生系统的建立[J].西北林学院学报,2002,17(2):33-36.
[12]张冰玉,苏晓华,郑书星.山新杨叶片高频植株再生体系建立及其遗传稳定性[J].北京林业大学学报,2008,30(3):68-73.
[13]冯连荣.盖杨叶片高频植株再生体系的建立[J].安徽农业科学,2016,44(1):209-211.
[14]赵鑫闻,彭儒胜,赵继梅.辽宁杨叶片高频植株再生体系的建立[J].中国农学通报,2015,31(10):13-16.
[15]孙宇飞,高秀华,赵彦修,等.欧美107杨组织培养再生系统的建立[J].山东师范大学学报(自然科学版),2004,19(2):85-87.
(责任编辑:张素清)
Establishment of tissue culture regeneration system of Populus euramericana‘Bellotto’
JIAO Liman
(LiaoningProvincialInstituteofPopulus,Gaizhou115200,China)
In order to establish plant regeneration system of Populus euramericana‘Bellotto’by tissue culture,leaves of P.euramericana‘Bellotto’were used as explants,MS and 1/2MS were used as basic culture medium,which added with different concentrations of NAA,6-BAand IBA,and the adventitious bud induction and rooting situations were observed.Results showed that:the optimum medium for adventitious bud differentiation was MS+6-BA0.5 mg·L-1+NAA0.1 mg·L-1+sucrose 25.0 mg·L-1+agar 6.0 mg·L-1,pH 6.5;the optimum medium for rooting was1/2MS+IBA0.3 mg·L-1+sucrose 20.0 mg·L-1+agar 6.0 mg·L-1,pH 6.0.
Populus euramericana‘Bellotto’;tissue culture;regeneration system;explant
S722.37
A
1001-1714(2017)01-0015-04
2016-11-06
矫丽曼(1981-),女,工程师,主要从事杨树转基因育种和森林保护等方面研究。E-mail:jiaoliman1025@163.com。
