响应面法优化苦水玫瑰精油提取后废弃物中总黄酮分离纯化工艺及抗氧化活性研究
2017-06-23陆秀云曹佳敏
陆秀云,王 波,曹佳敏,李 广,龚 祥,周 围,,,*
(1.西北师范大学地理与环境科学学院,甘肃兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃兰州 730010;3.甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
响应面法优化苦水玫瑰精油提取后废弃物中总黄酮分离纯化工艺及抗氧化活性研究
陆秀云1,王 波2,曹佳敏3,李 广1,龚 祥3,周 围1,2,3,*
(1.西北师范大学地理与环境科学学院,甘肃兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃兰州 730010;3.甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
目的:探讨响应面法优化苦水玫瑰精油提取后废弃物中总黄酮的分离纯化工艺及抗氧化活性,为回收利用苦水玫瑰精油提取后废弃物中的总黄酮提供依据。方法:通过静态实验研究D101型树脂对苦水玫瑰精油提取后废弃物中黄酮类化合物的吸附和解析能力,之后在单因素动态实验的基础上,采用响应面法优化苦水玫瑰精油提取后废弃物中总黄酮分离纯化工艺参数。在此基础上,以维生素C(VC)为对照,研究纯化后总黄酮对ABTS+·、DPPH·、·OH的清除能力。结果:静态实验吸附量1.83 mg/g,吸附率86.10%,洗脱率88.07%,说明D101型树脂对苦水玫瑰精油提取后废弃物中黄酮类化合物有较好的吸附和解析能力;响应面法优化的动态吸附工艺参数为上样液pH2.12、上样液质量浓度10.4 mg/L、上样液流速1.72 mL/min,吸附率为95.06%;用60 mL无水乙醇溶液洗脱,解析率达到98.30%;分离纯化后的总黄酮纯度可达5.651%;纯化后的总黄酮对ABTS+·、DPPH·、·OH清除作用的IC50分别为:0.03、0.1、8 μg/mL,最大清除率分别为:98.96%、89.76%、65.45%,可以看出废弃物中总黄酮具有较好的抗氧化活性。
苦水玫瑰精油提取后废弃物,总黄酮,响应面,分离纯化,抗氧化活性
玫瑰(Rose)为蔷薇科蔷薇属的多年生常绿或落叶灌木,又称为刺玫花、徘徊花、穿心玫瑰等,是一种具有食用和药用价值的天然植物。苦水玫瑰是中国玫瑰和钝齿蔷薇的杂交种,盛产于甘肃永登苦水镇。苦水玫瑰花色泽殷红,品质可与久负盛名的大马士革玫瑰媲美,现已成为集观赏、油用、食用、药用及香料等多种用途[1-3]于一身的特色经济品种。有文献[4-6]报道,苦水玫瑰中含有黄酮类、多酚类等主要化学成分。其中,黄酮类化合物泛指以2-苯基色原酮为母体的一类化合物,为植物代谢过程中产生的一类重要天然有机化合物,具有清除自由基、抗氧化、抗衰老、抗癌、抑制酶的活性等重要作用,因而黄酮类化合物成为近几年研究的热点。
近年来,苦水玫瑰的主要用途是提取玫瑰精油,一般采用水蒸汽蒸馏法[7-8],待苦水玫瑰精油提取后,将会产生大量废弃物[9]。其中,此类废水有机物浓度高,色度大,处理难度大,处理费用高。目前,部分工厂因缺乏废弃物处理技术与资金,导致处理后废水水质无法达到《污水综合排放标准》(GB8978-1996),在此情况下,一些工厂将玫瑰废水简单沉降后直接排放或不做任何处理直接排放到外界环境中,使自然水体颜色变红,水体中COD、BOD5等污染指标的浓度增加,水质恶化,造成严重的水环境污染。因此,为解决此类环境污染问题,提取玫瑰废水中的黄酮类化合物,不仅可以回收废水中的有效成分,而且可以使废水颜色变淡,有机物含量大幅降低,有利于废水处理。本文以甘肃省永登县苦水玫瑰精油提取后所产生废水为实验对象,对苦水玫瑰精油提取后废水中总黄酮的分离纯化及回收利用进行了研究。
响应面分析[10-13]是一种利用合理的实验设计,通过分析多元二次回归方程来求得最佳工艺参数的统计方法。它具有实验周期短,回归方程精确度高,能研究多因素间交互作用等优点。根据有关文献[14-20],测定黄酮类化合物抗氧化能力的方法主要有DPPH·、ABTS+·、·OH检测法,这种方法具有稳定性好、简便易行、灵敏可靠等优点。因此,本实验用响应面法优化玫瑰废水中黄酮分离纯化工艺,并采用DPPH·、ABTS+·、·OH检测法对玫瑰废水中黄酮抗氧化能力进行测定,以期为玫瑰废水中有效成分的开发利用提供依据,还需对其成分进行进一步的研究。
1 材料与方法
1.1 材料与仪器
苦水玫瑰精油生产过程中产生的废弃物,过滤离心,备用。
芦丁对照品 上海源叶生物科技有限公司,纯度>98%;D-101型大孔树脂 西安蓝晓科技有限公司;1,1-二苯基苦基苯肼(DPPH) 东京化成工业,纯度>97%;2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS) 上海源叶生物科技有限公司,纯度>98%;30%双氧水、盐酸、无水乙醇、NaNO2、AlCl3、NaOH 等均为国产分析纯;蒸馏水 屈臣氏。
Sartorius BL610电子分析天平 北京赛多利斯仪器系统有限公司;7230G型可见分光光度计 上海精密科学仪器有限公司;ZD-2型自动电位滴定仪 上海雷磁仪器厂;SP Scientific型真空冷冻干燥机 美国VirtTis公司;LABORTA 4001型旋转蒸发仪 德国Heidolph;玻璃层析柱。
1.2 标曲绘制与总黄酮浓度测定
采用亚硝酸钠-氯化铝比色法。分光光度法以黄酮与铝离子在碱性与亚硝酸存在条件下形成黄酮的铝络合物,生成稳定的红色。红色的深浅与黄酮含量呈一定的比例关系,可以芦丁(标准样)作标准,于510 nm波长处比色定量测定。
参考樊琛等人[20]的方法。具体方法如下:准确称取105 ℃干燥恒重的芦20.0 mg用80%乙醇定容至200 mL得浓度0.1 mg/mL的标准储备液。准确吸取标准应用液0.0、1.0、2.0、3.0、4.0、5.0 mL于10 mL比色管中,加30%乙醇至5.0 mL,加5% NaNO2溶液0.3 mL,摇匀放置6 min,加10% AlCl3溶液0.3 mL,摇匀,放置6 min后加1 mol/L NaOH溶液4.0 mL,加水定容,摇匀放置10~15 min。以蒸馏水作空白参比,于波长510 nm处测定吸光度。以芦丁质量浓度为横坐标、吸光度为纵坐标,作总黄酮标准曲线。取适量待测液,用上述方法测定。
1.3 大孔树脂静态分离纯化实验
1.3.1 大孔树脂的预处理 取适量新树脂用95%乙醇浸泡24 h,然后装柱,用5~8倍的乙醇通过树脂层,洗至流出液与适量水(流出液∶水=1∶5)混合无白色浑浊现象,再用纯净水通过树脂层,洗尽乙醇,最后转入酸碱处理,即5% HCl溶液通过树脂层,并浸泡3 h,而后用纯净水以同样流速洗至出水pH为中性,再用5% NaOH溶液通过树脂层,并浸泡3 h,而后用纯净水洗至出水pH呈中性。
1.3.2 静态吸附-解吸性能实验 分别称取预处理好的D-101型大孔吸附树脂5.00 g(干重1.0742 g)于250 mL具塞磨口三角瓶中,精密加入20 mL质量浓度为114.1 mg/L的样液,避光密封,并置恒温振荡器中,在25 ℃条件下,120 r/min振荡12 h,每1 h取适量上层液,按1.2节方法求出样液中总黄酮质量浓度,并绘制树脂静态吸附曲线。将吸附饱和的大孔树脂用20 mL 80%乙醇溶液洗脱,每1 h取适量上层液,按1.2节方法求出样液中总黄酮浓度,绘制出静态洗脱曲线。计算各树脂吸附量、吸附率与解析率。
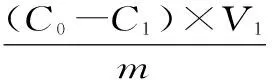
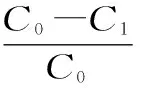
式中:W为吸附量(mg/g);C0为吸附液初始质量浓度(mg/mL);C1为吸附液平衡质量浓度(mg/mL);V1为吸附液体积(mL);C2为洗脱液质量浓度(mg/mL);V2为洗脱液体积(mL);m为树脂干质量(g);R为吸附率(%);S为洗脱率(%)。
1.4 动态吸附-解吸性能优化实验
将预处理好的树脂湿法装入(1.5 cm×20 cm)玻璃层析柱中,然后将苦水玫瑰精油提取废弃物总黄酮提取液上柱,每20 mL收集一次流分,按1.2方法求出相应流分的总黄酮质量浓度,并绘制出动态吸附曲线。待吸附树脂吸附饱和后用去离子水洗至流出液无色,最后用乙醇洗脱,每5 mL收集一次洗脱流分,按1.2方法求出相应洗脱流分的总黄酮质量浓度,并绘制出动态洗脱曲线。
1.4.1 上样液pH对吸附效果的影响 在上样液质量浓度70 mg/L和上样液流速2 mL/min条件下,考察不同上样液pH(1、2、3、4、5)对树脂吸附效果的影响,作pH-吸附率曲线图。
1.4.2 吸附流速对吸附效果的影响 在上述确定的上样液pH和上样液质量浓度70 mg/L的条件下,考察不同上样液流速(1、2、3、4、5 mL/min)对树脂吸附效果的影响,并作出吸附流速-吸附率曲线图。
1.4.3 上样液质量浓度对吸附效果的影响 在上述确定的上样液pH和吸附流速的条件下,考察不同上样液质量浓度对树脂吸附效果的影响,并作出上样液质量浓度-吸附率曲线图。
1.5 响应面实验设计
在单因素实验结果的基础上,选取上样液pH、吸附流速、上样液浓度作为影响因素,根据Box-Behnken实验设计原理,响应面分析实验为三因素三水平共17个点,这些实验点分为两类:一类是自变量取值在各水平所构成的三维析因点,共12个;一类是区域的中心点,零点实验重复5次,用来估计实验误差。响应面实验的因素与水平见表1。
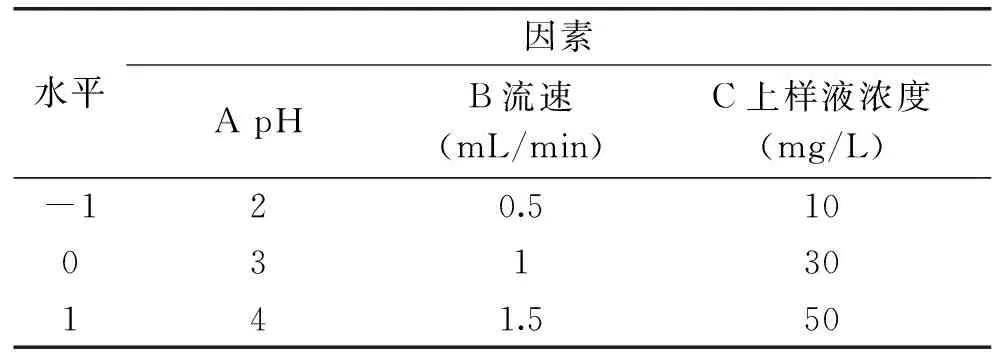
表1 响应面实验因素与水平Table 1 Factors and levels of response surface experiment
1.6 纯度的测定
利用旋转蒸发仪将提取液和洗脱液中乙醇回收后,放入冷冻干燥机中干燥得到粉末,再分别称取0.05 g苦水玫瑰精油提取废弃物中总黄酮粗品和纯化后所得粉末,放入25 mL容量瓶中,加无水乙醇充分溶解后摇匀、定容,按1.2中的方法测定吸光值,然后代入标准曲线回归方程求出总黄酮的浓度,计算总黄酮纯度。
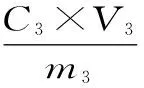
式中:P为纯度(%);C3为从标准曲线计算出的总黄酮的浓度(mg/mL);V3为25 mL;m为总黄酮粗品和纯化后粉末的质量50 mg。
1.7 总黄酮抗氧化性实验
抗氧化实验前将玫瑰废水浓缩液用蒸馏水配成适当浓度的玫瑰废水待测液。
1.7.1 DPPH自由基清除实验 分别精确移取2.0 mL总黄酮浓度为50、100、150、200、250、300 μg/L各待测液于10 mL试管中,分别加入2.0 mL配制好DPPH·乙醇溶液,摇匀,室温下放置30 min,以无水乙醇调零,在517 nm处测得吸光度值A1。同时,精确移取2.0 mL黄酮溶液与2.0 mL无水乙醇混合后在517 nm处测得吸光度值A2,然后精确移取2.0 mL配制好的DPPH·乙醇溶液与2.0 mL无水乙醇混合后在517 nm处测得吸光度值A0,算出待测液对DPPH的清除率,同时测定VC对DPPH的清除能力。清除率计算公式如下:
其中:A0-DPPH·乙醇溶液与无水乙醇混合后的吸光度;A1-待测液与DPPH·乙醇溶液混合后的吸光度;A2-待测液与无水乙醇混合后的吸光度。
1.7.2 ABTS自由基清除实验 精密吸取4.9 mmol/L过硫酸钾5.00 mL,加入38.41 mg固体ABTS,溶解后定容于10 mL容量瓶中(其中过硫酸钾浓度为2.45 mmol/L,ABTS+·浓度为7 mmol/L),存放12~16 h后,用pH=7.4磷酸缓冲液将其稀释至A734=0.7±0.02(约稀释90倍),得到ABTS工作液,工作液需在24 h内使用。
分别精确移取1.0 mL不同浓度的黄酮溶液于10 mL试管中,加入A734=0.7±0.02的ABTS工作液3.00 mL,摇匀静置10 min,于734 nm处测定吸光度,平行3次,采用同样方法测定VC清除能力,计算清除率。
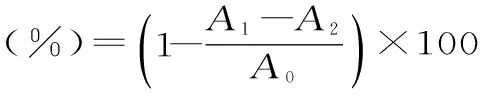
其中:A0-无水乙醇与ABTS+·溶液混合后的吸光度;A1-待测液与ABTS+·溶液混合后的吸光度;A2-待测液与无水乙醇混合后的吸光度。
1.7.3 羟基自由基清除实验 分别在具塞试管中依次加入9 mmo1/L FeSO4溶液2 mL,9 mmol/L水杨酸-乙醇溶液2 mL,浓度为4、6、8、10、12、14 μg/mL的样液2 mL和8.8 mmol/L H2O22 mL,摇匀,于37 ℃水浴中反应30 min,以蒸馏水为参比,在510 nm下测定吸光度值A1,并按相同方法,测定不加样液的溶液的吸光度A0,不加H2O2的溶液的吸光度A2,算出待测液对·OH的清除率,同时测定VC对·OH的清除率。清除率计算公式如下:
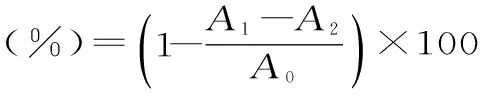
其中:A0-FeSO4、水杨酸、蒸馏水、H2O2溶液混合后的吸光度;A1-FeSO4、水杨酸、待测液、H2O2溶液混合后的吸光度;A2-FeSO4、水杨酸、蒸馏水、待测液混合后的吸光度。
1.8 数据统计分析
每个实验组设三个平行,数据采用Microsoft Office Excel 2007(Microsoft Office 2007,Microsoft Co.,Redmond,USA)进行处理,Design-Expert. V 8.0.6软件对数据进行响应面分析。

表2 静态吸附容量、吸附率与洗脱率Table 2 Static adsorption capacity,adsorption rate and elution rate
2 结果与分析
2.1 黄酮标准曲线
如图1所示,总黄酮标准曲线回归方程(以芦丁计):A=11.436C+0.0008,R2=0.9999,结果表明在0.005~0.05 mg/mL之间线性良好。

图1 总黄酮标准曲线Fig.1 Standard curve of total flavonoids
2.2 大孔树脂静态吸附洗脱实验
2.2.1 吸附容量、吸附率及洗脱率 由表2可看出,D-101型大孔吸附树脂不仅有较大的吸附率,还有较高的洗脱率。
2.2.2 静态吸附曲线 由图2可知,D-101型大孔吸附树脂对苦水玫瑰精油提取废弃物总黄酮的吸附为快速平衡型,起始阶段大孔树脂对废弃物的总黄酮吸附较强,黄酮质量浓度增加较快,在1 h后基本达到平衡,由此可见,D-101型大孔吸附树脂对苦水玫瑰精油提取废弃物总黄酮具有良好的吸附动力学特性。
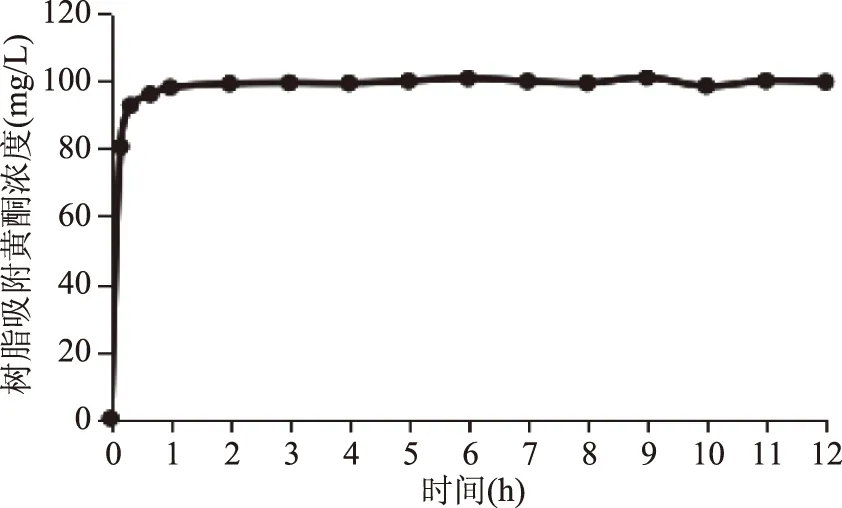
图2 大孔树脂静态吸附曲线Fig.2 Static adsorption curve of macroporous resin
2.2.3 静态洗脱曲线 从图3可以看出,D-101型大孔吸附树脂对苦水玫瑰精油提取废弃物总黄酮的洗脱为快速平衡型,起始阶段总黄酮质量浓度较大,在1 h后基本洗脱完全。1 h后曲线有些许波动,是由于树脂对洗脱液中的黄酮再次吸附,再次洗脱,这样循环往复。
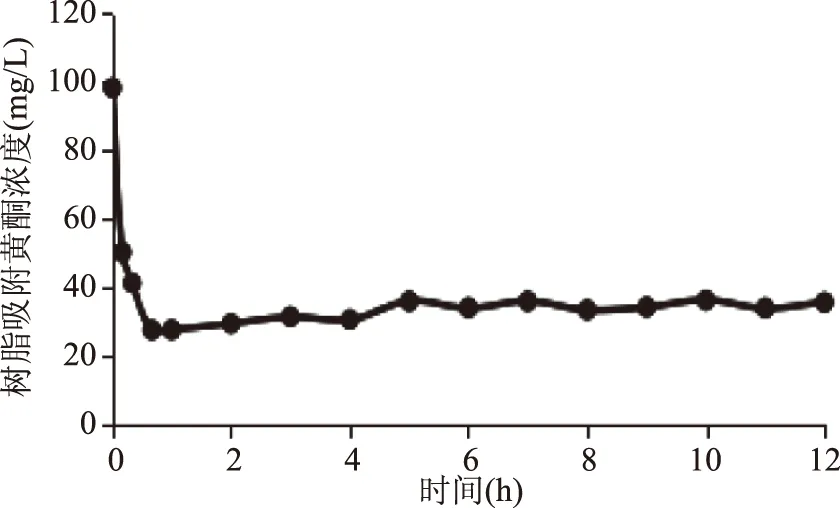
图3 大孔树脂静态洗脱曲线Fig.3 Static elution curve of macroporous resin
综上分析可知,D-101型树脂对苦水玫瑰精油提取废弃物总黄酮具有良好的吸附洗脱特性,适合苦水玫瑰精油提取废弃物总黄酮的分离纯化。
2.3 动态吸附单因素实验
2.3.1 上样液pH对吸附效果的影响 根据化合物的结构特点调整上样液pH,可达到较好的吸附效果。在上样液质量浓度70 mg/L和上样液流速2 mL/min条件下,考察不同上样液pH对树脂吸附效果的影响,结果见图4与图5。
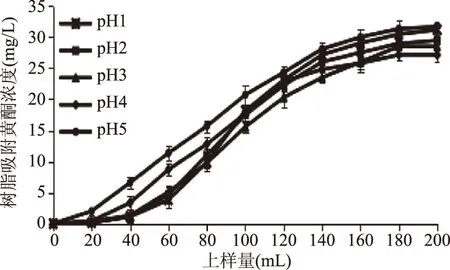
图4 大孔树脂对不同pH上样液的动态吸附曲线Fig.4 The dynamic adsorption curve of the resin on different pH samples
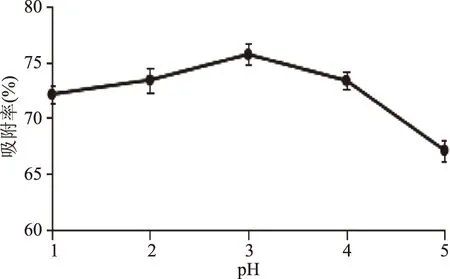
图5 不同上样液pH对树脂吸附效果的影响Fig.5 Effect of different sample solution pH on the adsorption of resin
由图4可以看出,pH4、pH5在上样60 mL时已出现少量渗漏,而pH1、pH2、pH3在上样量达到80 mL时才发现渗漏点,pH2和pH3的动态吸附曲线基本重叠。并且图5显示pH2和pH3吸附率最高。从工业生产角度考虑,选择pH3进行吸附比较合适。这是因为黄酮类化合物含多羟基,呈弱酸性,故要达到较好的吸附效果,吸附需在pH3条件进行。
2.3.2 上样液流速对吸附效果的影响 在上样液pH3和上样液质量浓度70 mg/L的条件下,考察不同上样液流速对树脂吸附效果的影响,结果见图6、图7。
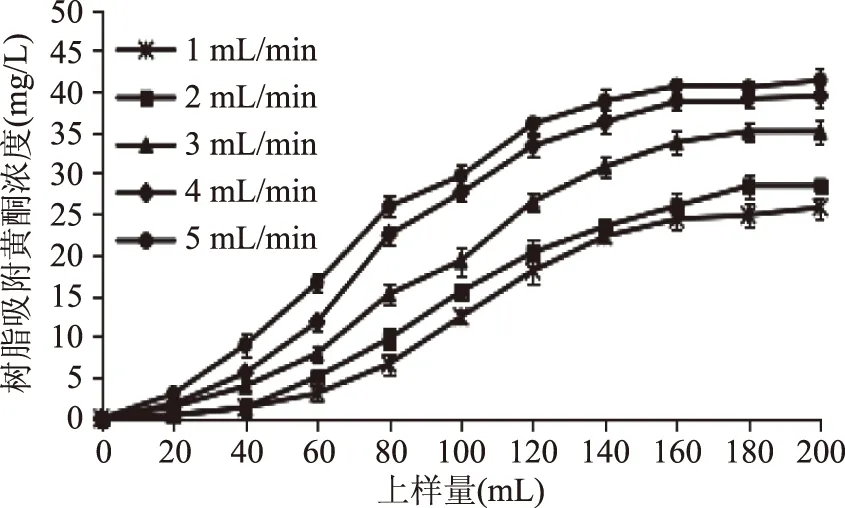
图6 大孔树脂对不同流速的动态吸附曲线Fig.6 Dynamic adsorption curves of different flow rate of macroporous resin
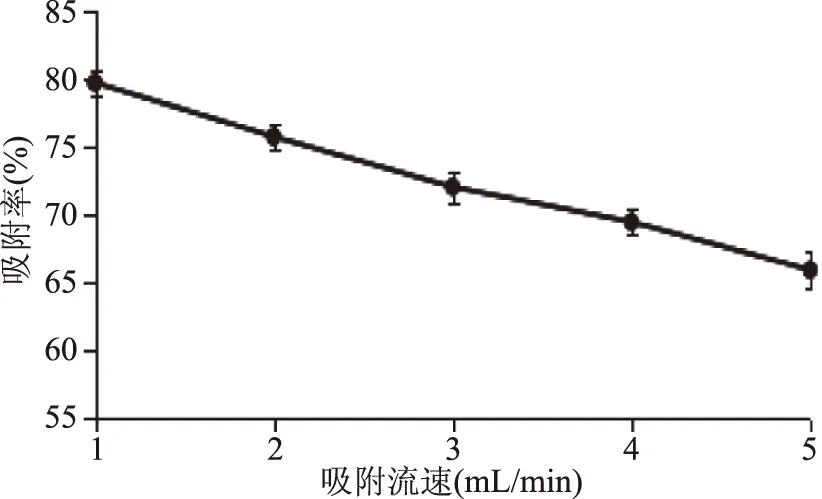
图7 不同流速对树脂吸附效果的影响Fig.7 Effect of different flow rate on the adsorption of resin
由图6可知,流速为1、2、3、4、5 mL/min时,渗漏点分别出现在80、70、62、50、40 mL附近。图6表明流速为1 mL/min时吸附率最高,达到79.63%。虽然流速0.5 mL/min时,渗漏点可能出现的更迟,吸附率可能更高,但因为流速慢,导致循环周期延长,不适用于实际工业生产。因此,选择上样液流速为1 mL/min。
2.3.3 上样液质量浓度对吸附效果的影响 在上样液 pH3和上样液流速1 mL/min条件下,考察不同上样液质量浓度对树脂吸附效果的影响,结果见图8、图9。
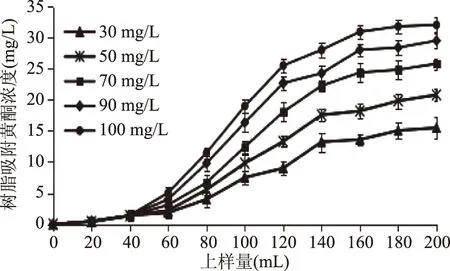
图8 大孔树脂对不同浓度上样液的动态吸附曲线Fig.8 The dynamic adsorption curve of the resin on different concentrations of sample solution of macroporous resins
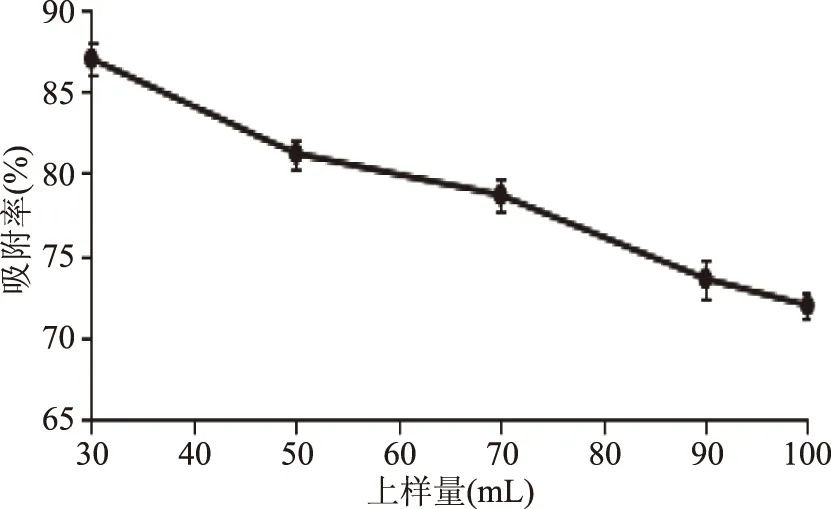
图9 不同上样量浓度对树脂吸附效果的影响Fig.9 Effect of different concentration sample on the adsorption of resin
由图8可知,30、50、70、90、100 mg/L上样液浓度的渗漏点分别在120、100、78、70、65 mL,且质量浓度为30 mg/L的上样液吸附率最高。故选择上样液质量浓度为30 mg/mL。
2.4 响应面法实验优化动态吸附工艺条件
2.4.1 响应面实验结果及方差分析 运用Design Expert 8.0.6软件对表3数据进行统计分析,可得出三因素与吸附率之间的多元二次方程关系式吸附率(%)=86.73-0.81A+0.21B-4.83C-0.99AB-0.61AC-0.38BC+0.79A2-0.20B2+1.88C2。
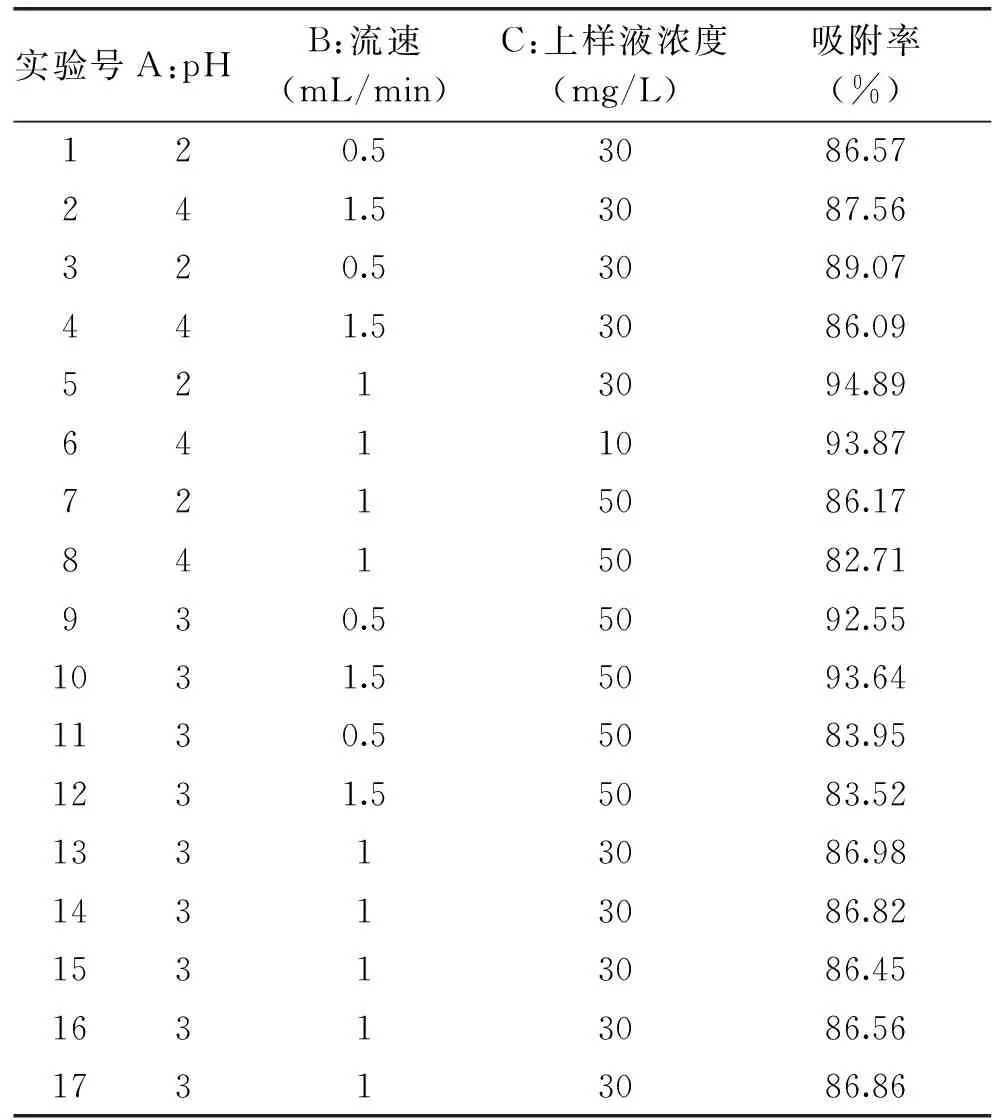
表3 响应面法实验结果与分析Table 3 Experimental results and analysis of response surface method
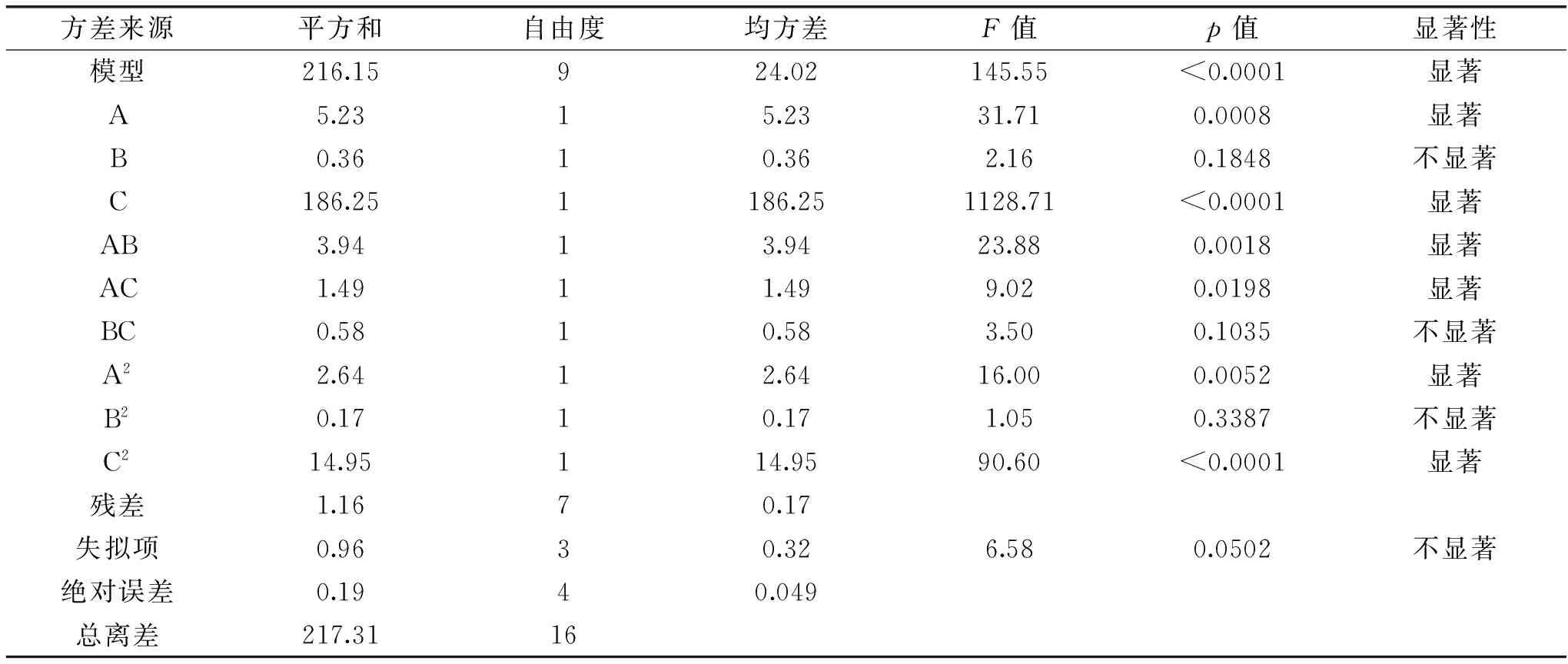
表4 方差分析Table 4 Variance Analysis
由表4可知,该响应回归模型显著,失拟项不显著;方差R2=0.9947,表明99.47%的数据可以用此方程来解释。通过该模型的方差分析可知:上样pH(A)、吸附流速(B)、上样液浓度(C)对总黄酮吸附率影响差异均显著,影响效应的大小依次为上样液浓度(C)>上样pH(A)>吸附流速(B)。
2.4.2 两因素交互影响吸附率的响应曲面分析 吸附率对应于上样pH、吸附流速、上样液浓度所形成的三维空间曲面,可直接反映上样pH、吸附流速、上样液浓度以及它们之间的交互作用对吸附率的影响。
运用Design Expert 8.0.6软件分析得到的响应曲面如图10所示。在上样pH、吸附流速、上样液浓度所形成的三维空间曲面上,任意两者的交互作用对吸附率影响的曲线越斜,说明二者的交互作用对吸附率的影响越大。由图10a和图10b可以看出上样pH与吸附流速的交互作用、上样pH与上样液浓度的交互作用对吸附率的影响呈现的是一个斜面说明两者的交互作用对吸附率影响较大。由图10c得出,吸附流速与上样液浓度的交互作用对吸附率的影响不明显。所以,上样pH与吸附流速的交互作用、上样pH与上样液浓度的交互作用对吸附率的影响较大,与表4结果相同。
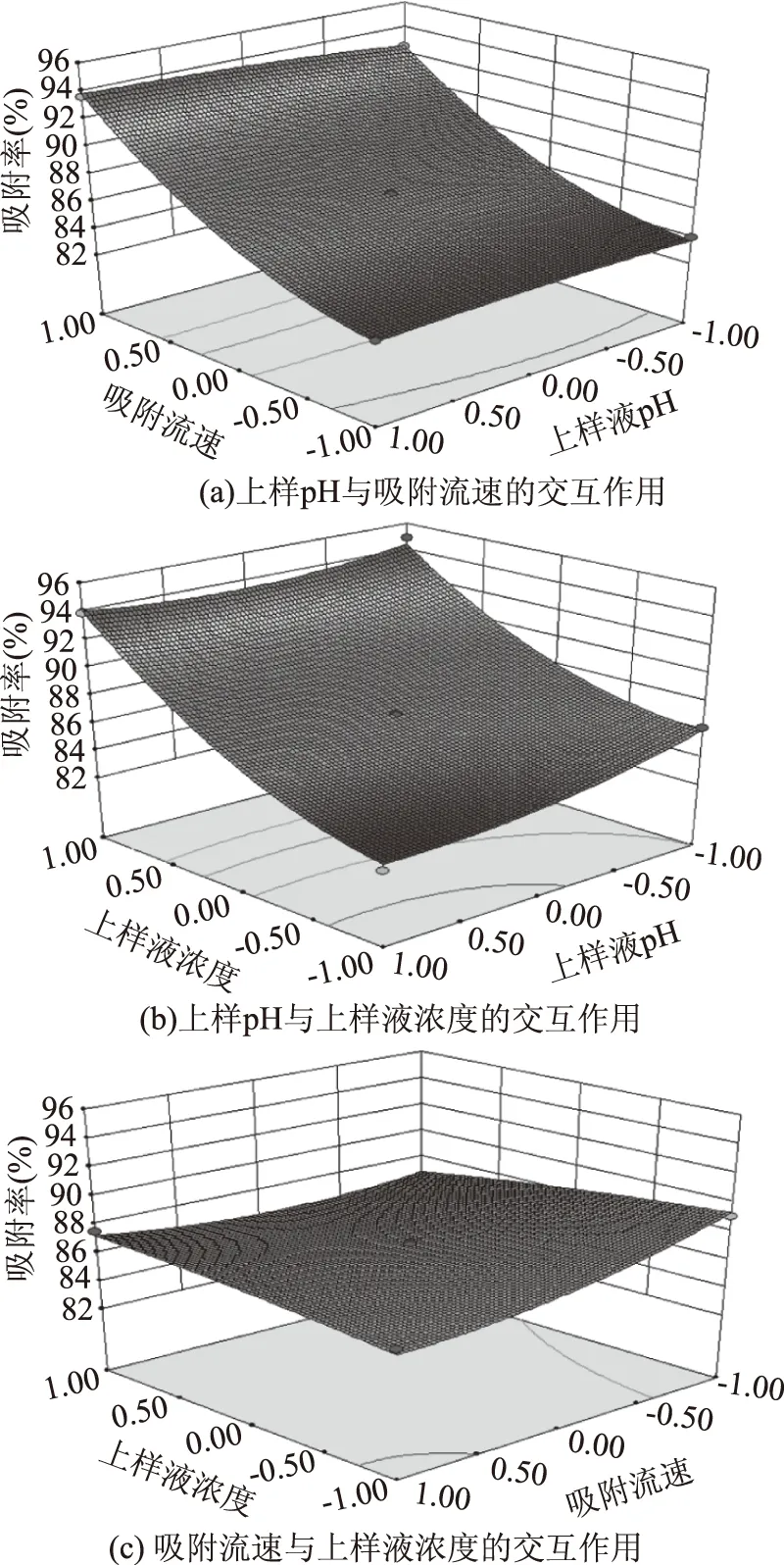
图10 响应曲面图Fig.10 Response surface plot
2.4.3 回归方程及验证实验 借助Design Expert 8.0.6软件中多元二次回归模型对总黄酮吸附率进行估算,对二次函数模型进行极值分析,预测三因素的最佳组合为:pH2.12,吸附流速1.72 mL/min,上样液浓度10.4 mg/L,此时模型预测极大值为95.0635%。在最优吸附条件的基础上进行验证实验,结果见表5。
2.5 动态洗脱实验
由图11可知,无水乙醇溶液通过约15 mL时总黄酮开始被洗脱下来,之后在25 mL附近时迅速达到高峰,通过60 mL后,吸附在树脂上的总黄酮基本被洗脱下来,解析率达98.30%,洗脱曲线出峰快,且无明显的拖尾现象。
2.6 产品纯度测定
由表6可知,经纯化后,纯度由原来的1.220%提高到了5.651%,提高至4.63倍。
2.7 玫瑰废水总黄酮的抗氧化性
自由基清除能力是物质抗氧化活性主要表现之一。由于自由基含有未配对电子,极不稳定,所以化学性质十分活跃,能迅速而强烈的损伤生物机体,导致机体功能障碍和疾病的发生,自由基的清除作用实验,可研究玫瑰废水总黄酮提取物的抗氧化性,寻找黄酮的药效机理。目前,有关玫瑰废水黄酮的抗氧化活性的研究相对较少。本实验以抗坏血酸为参照,研究了黄酮样品对DPPH·、ABTS+·和·OH 清除活性。

表5 响应面验证实验Table 5 Response surface verification experiment
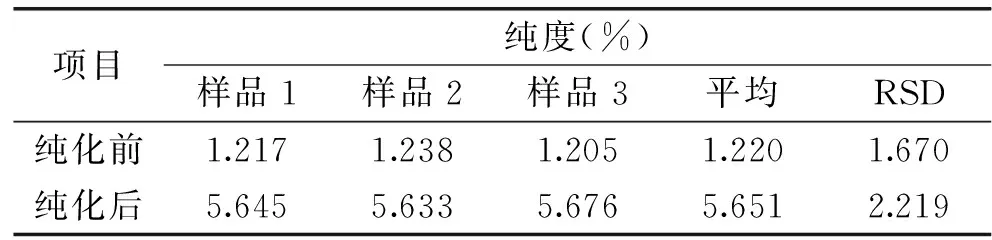
表6 玫瑰精油提取后废水中总黄酮纯度Table 6 The purity of the total flavonoids after the extract of rose essential oil
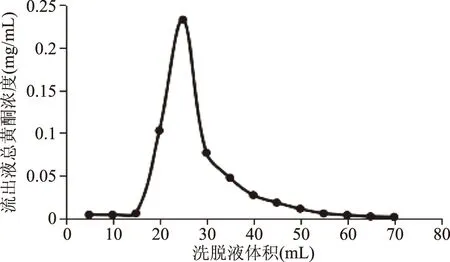
图11 动态洗脱曲线Fig.11 Dynamic elution
2.7.1 对DPPH自由基的清除作用 如图12所示,玫瑰废水中黄酮、VC对DPPH·的清除活性均随浓度的增大而逐渐增大,量效关系显著。在浓度为0~300 μg/L范围内,玫瑰废水中黄酮对DPPH·的最大清除率为89.76%;在浓度为0~50 μg/mL范围内,VC对DPPH·的最大清除率为82.72%;玫瑰废水中黄酮、VC清除DPPH·的IC50值分别为0.1、7 μg/mL,玫瑰水中黄酮的清除DPPH·能力是VC的70倍,说明玫瑰废水中黄酮有很强的抗氧化功效。

图12 DPPH自由基清除率Fig.12 DPPH free radical scavenging rate
2.7.2 对ABTS自由基的清除作用 如图13所示,玫瑰废水中黄酮、VC对ABTS+·的清除活性均随浓度的增大而逐渐增大,量效关系显著。在浓度为0~120 μg/L范围内,玫瑰废水中黄酮对ABTS+·的最大清除率为98.96%,在浓度为0~16 μg/mL范围内,VC对ABTS+·的最大清除率为89.14%;玫瑰废水中黄酮、VC清除ABTS+·的IC50值为0.03、6.5 μg/mL,玫瑰废水中黄酮比VC的抗氧化强,是VC的216倍。
图13 ABTS自由基清除率Fig.13 ABTS free radical scavenging rate
2.7.3 对羟基自由基的清除作用 如图14所示,玫瑰废水中黄酮、VC对·OH的清除活性均随浓度的增大而逐渐增大,量效关系显著。在浓度为0~14 μg/mL范围内,玫瑰废水中黄酮对·OH的最大清除率为65.45%,在浓度0~700 μg/mL范围内,VC对·OH的最大清除率为99.77%;其IC50值分别为8、200 μg/mL,玫瑰废水中黄酮的抗氧化活性强于VC的抗氧化活性,大约是VC的25倍。
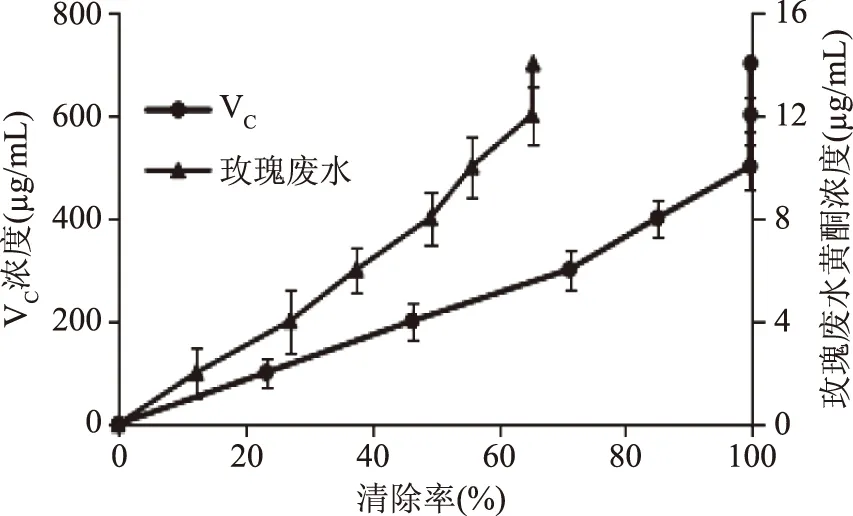
图14 ·OH自由基清除率Fig.14 OH free radical scavenging rate
3 结论
本研究通过静态吸附-解析实验发现D101型树脂对苦水玫瑰精油提取后废弃物中黄酮类化合物有较好的吸附和解析能力,之后在单因素动态实验的基础上,采用响应面法优化苦水玫瑰精油提取后废弃物中总黄酮分离纯化工艺,最终确定最优的纯化条件为上样液pH2.12、上样液质量浓度10.4 mg/L、上样液流速1.72 mL/min,优化后吸附率达到95.06%,解析率达到98.30%。
苦水玫瑰精油提取后废弃物中黄酮对DPPH自由基、ABTS自由基、羟基自由基具有较强的清除能力,表明苦水玫瑰精油提取后废弃物中黄酮有很强的抗氧化性,为玫瑰废水中有效成分的开发利用提供依据。
[1]周围,周小平,赵国宏,等. 中国苦水玫瑰油香气成分的研究[J]. 色谱,2002,20(6):560-564.
[2]王多宁. 玫瑰花的综合利用及开发前景[J]. 黑龙江农业科学,2010,187(1):117-120.
[3]赵晓峰,吴荣珠. 玫瑰花综合利用与其开发前景[J]. 保鲜与加工,2004,4(3):30-31.
[4]俞秀红. 玫瑰花的保健功能及其应用研究进展[J]. 福建农业科技,2016,17(4):46-48.
[5]Yasuyuki H. The phytochemistry of Rosa Rugosa[J]. Phytochemistry,1996,43:535-549.
[6]宋可柯,陈红艳,廖蓉苏,等. 不同品种玫瑰花中黄酮的提取及抗氧化性[J]. 中国农业大学学报,2016,17(5):59-63.
[7]马希汉,王永红,尉芹,等.玫瑰精油提取工艺研究[J]. 林产化学与工业,2004,24(5):80-84.
[8]寇伟. 玫瑰精油的提取及研究[J]. 油气开采,2016,42(5):48.
[9]梁文博,胡亚云,尉芹. 法国玫瑰精油加工废水中色素的提取及稳定性研究[J]. 西北林学院学报,2007,22(5):128-131.
[10]Nordiyanah Anuar,Naziz Saat. Optimization of extraction parameters by using response surface methodology purification and identification of anthocyanin pigments in Melastorma malabathricum fruit[J]. The Scientific World Journal,2013,81(5):1-10.
[11]左丽云,赵淳,乐薇,等. 响应面法优化箬叶总黄酮的大孔树脂纯化工艺[J]. 化学与生物工程,2015,32(12):33-37.
[12]朱俊访,李博. 响应面法优化淡竹叶总黄酮的大孔树脂纯化工艺[J]. 世界中医药,2016,11(4):715-718.
[13]杨云舒,李荣,姜子涛. 响应面法实验优化广枣黄酮的微波提取工艺及黄酮的提纯[J]. 食品科学,2015,36(22):18-24.
[14]吴殿民,邵大伟,冯立国,等.不同玫瑰品种干花蕾抗氧化能力研究[J]. 北方园艺,2013,17:67-70.
[15]Rui Fan,Nan Li.HPLC-DAD-MS/MS Identificantion and HPLC-ABTS+· on-line antioxidant activity evaluation of bioactive compounds in liquorice extract[J]. Eur Food Res Technol,2015,240:1035-1048.
[16]窦勇博. 牡丹花黄酮的抗氧化活性研究[J]. 中国果蔬,2016,36(4):23-26.
[17]Franco D,Pinelom,Sineiro J. Processing of rosarubiginosa:extraction of oil and antioxidant substances[J]. Bioresour Technol,2007,98(18):3506-3512.
[18]杨虎,张生堂,高国强. 玫瑰黄酮的提取及其清除DPPH自由基活性研究[J]. 食品科学,2012,33(24):152-155.
[19]帕尔哈提·柔孜,阿依姑丽·艾合麦提,朱昆,等.玫瑰花瓣总黄酮和总多糖的体外抗氧化活性[J]. 食品科学,2013,34(11):138-141.
[20]樊琛,胥慧贞,刘桂芹,等. 玫瑰花苞抗自由基能力的检测[J]. 食品研究与开发,2015,36(5):78-81.
[21]樊琛,李燕,曾庆华,等. 玫瑰花苞总黄酮的提取[J]. 安徽农业学报,2013,41(30):12162-12163.
Response surface optimization and purification technology and antioxidant activity of total flavonoids from Kushui rose oil distillation waste
LU Xiu-yun1,WANG Bo2,CAO Jia-min3,LI Guang1,GONG Xiang3,ZHOU Wei1,2,3,*
(1.College of Geography and Environmental Science,Northwest Normal University,Lanzhou 730070,China;2.Central Laboratory of Technical Center of Gansu Entry-Exit Inspection and Quarantine Bureau,Lanzhou 730020,China;3.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
Objective:To investigate response surface optimization and purification technology and antioxidant activity of total flavonoids from Kushui rose oil distillation waste,and provide the basis for the recovery of total flavonoids from Kushui rose oil distillation waste. Methods:Studying on D101 resin adsorption and desorption ability for flavonoids compounds by static experiment,then based on dynamic experiment of single factors,the optimum purification process parameters of Kushui rose oil distillation waste by response surface method. On this basis,with vitamin C(VC)as the control,study the scavenging ability of total flavonoids purified on ABTS,DPPH,and OH free radical. Results:The static adsorption capacity was 1.83 mg/g,the adsorption rate was 86.10%,the elution rate of 88.07%,which indicated that D101 resin had better adsorption and desorption ability for flavonoids compounds of Kushui rose oil distillation waste. And the optimum dynamic adsorption process parameter were the sample solution pH2.12,sample concentration 10.4 mg/L,sample flow rate 1.72 mL/min,the adsorption rate was 95.06%,elution with 60 mL absolute alcohol solution,the desorption rate reached 98.30%,the purity of total flavonoids was up to 5.651%. The IC50value of total flavonoids purified on ABTS,DPPH,OH free radical were 0.03,0.1,8 μg/mL,the maximum scavenging rate were 98.96%,89.76%,65.45%,we can see that the total flavonoids from waste has better antioxidant activity.
Kushui rose oil distillation waste;total flavonoids;response surface;separation and purification;antioxidant activity
2016-12-06
陆秀云(1991-),女,硕士,研究方向:液相色谱质谱分析食品、环境中的有机物质以及废弃物循环利用研究,E-mail:lu1058258184@163.com。
*通讯作者:周围(1957-),男,博士,教授,研究方向:从事食品营养及食品安全分析研究,E-mail:zhouwei845@163.com。
甘肃省科技与支撑计划(农业类)(1604NKCA079)。
TS201.2
B
1002-0306(2017)11-0258-08
10.13386/j.issn1002-0306.2017.11.041
