出芽短梗霉产酸性多糖的CTAB法制备工艺优化及其与普鲁兰多糖的性质比较
2017-06-23童群义
郝 婧,童群义
(江南大学食品学院,江苏无锡 214122)
出芽短梗霉产酸性多糖的CTAB法制备工艺优化及其与普鲁兰多糖的性质比较
郝 婧,童群义*
(江南大学食品学院,江苏无锡 214122)
采用十六烷基三甲基溴化铵(CTAB)法,制备出芽短梗霉酸性多糖,并比较了其与普鲁兰多糖的溶解性与抗氧化活性。经过单因素实验与正交实验确定制备出芽短梗霉产酸性多糖的最佳工艺条件为:质量浓度3%的CTAB溶液与初始多糖溶液体积比1∶1,初始多糖溶液质量浓度7%,沉淀12 h。该条件下,出芽短梗霉产生的酸性多糖得率为5.01%。该方法保持了出芽短梗霉酸性多糖与普鲁兰多糖的结构完整性,为该多糖的后续研究提供参考。酸性多糖与普鲁兰多糖性质比较实验结果表明,出芽短梗霉产生的中性普鲁兰多糖易溶于水,酸性多糖微溶于水;二者的抗氧化活性在0~1 mg/mL范围内无显著性差异,其还原能力、对超氧阴离子自由基以及羟基自由基清除作用均随溶液浓度的提高而增加,为出芽短梗霉酸性多糖的进一步开发与应用提供理论参考。
十六烷基三甲基溴化铵(CTAB),出芽短梗霉,酸性多糖,普鲁兰多糖,性质
出芽短梗霉(Aureobasidiumpullulans)是一种多形态真菌,有多核菌丝体、厚垣孢子和小型椭圆类酵母细胞等多种形态[1]。出芽短梗霉能产出多种代谢产物,主要有胞外多糖、单细胞蛋白、酶和抗生素等[2]。其中,中性的普鲁兰多糖是出芽短梗霉发酵产生的主要胞外多糖。该多糖以麦芽三糖作为基本单位,两端以α-1,6- 糖苷键连接,反复聚合形成高分子直链多糖,所含α-1,4- 糖苷键和α-1,6- 糖苷键的比例为2∶1[3]。普鲁兰多糖黏度稳定无凝胶作用,黏结、成膜及阻氧性能极佳,易自然降解且对人体无害,作为食品添加剂用于食品中可改善食品风味和口感,起到增稠、增加光泽、延长存储时间等作用,其制成的膜还可用于食品包装[4]。此外,出芽短梗霉的一些菌株还能产出包含β-葡聚糖结构的酸性多糖[5-7]。目前国内外的研究主要集中于对出芽短梗霉产普鲁兰多糖发酵条件的优化以及普鲁兰多糖的结构研究,少数国外研究对出芽短梗霉产出的酸性多糖的结构进行了初步分析,研究结果显示出芽短梗霉产生的多糖的结构与菌株差异性有关。而国内外关于出芽短梗霉酸性多糖的制备工艺条件及性质研究则未见报道。
本实验室通过紫外、硫酸二乙酯(Diethylsulfate,DES)交替处理获得一株低产色素的出芽短梗霉变异株G16,其能产出普鲁兰多糖和包含β-葡聚糖结构的酸性多糖。本实验在单因素实验的基础上进行正交实验,优化了CTAB沉淀法分离出芽短梗霉G16产酸性多糖的工艺条件,并比较了酸性多糖与普鲁兰多糖的水溶性和抗氧化活性差异,以期为出芽短梗霉产酸性多糖的进一步开发和利用提供参考。
1 材料与方法
1.1 材料与仪器
出芽短梗霉(Aureobasidiumpullulans)G16 本实验室保藏;种子培养基(g/L) 蔗糖50.0,酵母粉1.5,K2HPO44.0,(NH4)2SO40.8,MgSO40.2,NaCl 2.0,初始pH7.0,121 ℃,20 min灭菌;发酵培养基(g/L) 蔗糖80.0,酵母粉0.9,K2HPO46.0,(NH4)2SO40.6,MgSO40.5,NaCl 4.0,初始pH6.5,121 ℃,20 min灭菌。将种子液接至发酵培养液中,接种量为2%,装瓶量50 mL/250 mL,于28 ℃转速200 r/min 摇床中培养96 h,收集发酵液;十六烷基三甲基溴化铵(CTAB)、无水乙醇、丙酮、NaCl、Na2HPO4、NaH2PO4、铁氰化钾、三氯乙酸、Tris、邻苯三酚、HCl、FeSO4·7H2O、水杨酸、30% H2O2常规分析纯,上海国药集团。
尤尼科2000型分光光度计 尤尼科(上海)仪器有限公司;低速大容量多管离心机 无锡市瑞江分析仪器有限公司;立式园形压力蒸汽灭菌器 上海医用核子仪器厂;双层小容量振荡培养箱 上海知楚仪器有限公司。
1.2 实验方法
1.2.1 出芽短梗霉G16产酸性多糖与普鲁兰多糖分离工艺流程 取出芽短梗霉G16的发酵液上清液,加入两倍体积 95%乙醇,4 ℃静置12 h,4000 r/min 离心15 min,收集沉淀,无水乙醇、丙酮洗涤两次,45 ℃真空干燥至恒重,称重,加水复溶,加入一定比例质量浓度为3% 的CTAB溶液,沉淀一定时间,离心取沉淀,溶于质量浓度为10%的NaCl溶液,蒸馏水透析后用乙醇沉淀,离心收集沉淀,45 ℃真空干燥至恒重,称重,得到酸性多糖[8- 9]。经CTAB溶液沉淀、离心所得的上清液,加入两倍体积95% 乙醇沉淀,离心收集沉淀,溶于质量浓度 10% 的NaCl溶液后操作同上,得到普鲁兰多糖[10]。
酸性多糖得率(%)=经CTAB沉淀所得酸性多糖质量/发酵液上清液乙醇沉淀所得总多糖质量×100
1.2.2 CTAB沉淀法单因素实验 以出芽短梗霉产酸性多糖得率为指标,采用单因素实验,研究CTAB溶液与初始多糖溶液体积比、初始多糖溶液质量浓度、沉淀时间对多糖得率的影响[11]。每组实验重复3 次,取平均值。
1.2.2.1 CTAB溶液与初始多糖溶液体积比的优化 选取质量浓度3% 的CTAB溶液与质量浓度4%的多糖溶液的体积比分别为3∶1、2∶1、1∶1、1∶2、1∶3进行沉淀操作,静置12 h,在4000 r/min条件下离心15 min取沉淀,沉淀物分别用无水乙醇、丙酮洗涤后,溶于质量浓度为10% 的NaCl溶液,蒸馏水透析72 h后,用无水乙醇沉淀,经真空干燥后称重,以酸性多糖得率为指标,确定CTAB溶液与初始多糖溶液最佳体积比。
1.2.2.2 初始多糖溶液质量浓度的优化 取初始多糖溶液质量浓度分别为1%、2%、3%、4%、5%、6%、7%,CTAB溶液与多糖溶液体积比为1∶1,其余步骤同1.2.2.1,确定最佳初始多糖溶液质量浓度。
1.2.2.3 沉淀时间的优化 选取沉淀时间分别为3、6、9、12、15 h,初始多糖溶液质量浓度为6%,CTAB溶液与多糖溶液体积比为1∶1,其余步骤同1.2.2.1,确定最佳沉淀时间。
1.2.3 正交实验 为了综合考虑多因素对出芽短梗霉产酸性多糖得率的影响,根据单因素实验结果,选取各因素的合理水平,设计正交因素水平表(表1),通过L9(34)正交实验得出最佳分离条件。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test
1.2.4 水溶性测定 称取研成细粉末的多糖样品10 mg,置于一定容量的去离子水中,每隔5 min强力振摇30 s,常温下观察30 min内的溶解情况,如无目视可见的溶质颗粒即视为完全溶解。
1.2.5 抗氧化性比较
1.2.5.1 还原能力测定 分别取0.2、0.4、0.6、0.8、1.0 mg/mL的多糖样品溶液各2.0 mL,加入pH6.6磷酸缓冲液和铁氰化钾溶液各2.5 mL,混匀,50 ℃水浴保温20 min,冷水冷却,加入2.5 mL三氯乙酸溶液终止反应。取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL质量浓度为0.1%的三氯化铁溶液,混匀,静置10 min,以去离子水做参比,700 nm下测定吸光度值,吸光度值越大表示还原能力越强[12-13]。以同浓度VC代替多糖作对比实验。
1.2.5.2 超氧阴离子自由基清除率 测定取5支试管,每管分别加6 mL pH8.2的Tris-HCl缓冲液,再分别加入0.5 mL浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖样品溶液,37 ℃水浴10 min后加入1 mL 37 ℃水浴预热过的50 mmol/L的邻苯三酚溶液,混匀后精确反应10 min,用0.5 mol/L的浓盐酸终止反应,在420 nm处测吸光值(A1),不加多糖样品溶液,以去离子水补足,同上操作处理,测定其对比吸光度(A0);空白为等体积pH8.2的Tris-HCl缓冲液[14-16]。以同浓度维生素C对比实验。
清除率(%)=(A0-A1)/A0×100
1.2.5.3 羟基自由基清除率测定 取5支试管,管中依次加入9 mmol/L FeSO4溶液1 mL、浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL多糖样品溶液1 mL和9 mmol/L水杨酸1 mL,混匀后,37 ℃水浴静置10 min,加入1 mL H2O2(6 mmol/L),37 ℃水浴静置30 min后,测定510 nm吸光度(A1);不加多糖样品溶液,以去离子水补足,同上操作处理,测定其对比吸光度(A0);用去离子水为参比[17-18]。以同浓度维生素C代替多糖作对比实验。
清除率(%)=(A0-A1)/A0×100
1.3 统计学分析
采用Origin 8.5 软件作图,数据应用SPSS 20.0统计。各项数据以“平均值±标准差”表示,用t检验比较组间差异的显著性,以p<0.05表示有显著性差异。
2 结果与分析
2.1 单因素实验结果
2.1.1 CTAB溶液与初始多糖溶液体积比对酸性多糖得率的影响 如图1所示,随着CTAB溶液加入体积的增大,酸性多糖的得率呈先增加后降低的趋势,且在CTAB溶液加入体积与初始多糖溶液体积比为1∶1时达到最大值,为总多糖产量的4.67%。故选取CTAB溶液与初始多糖溶液体积比为1∶1。
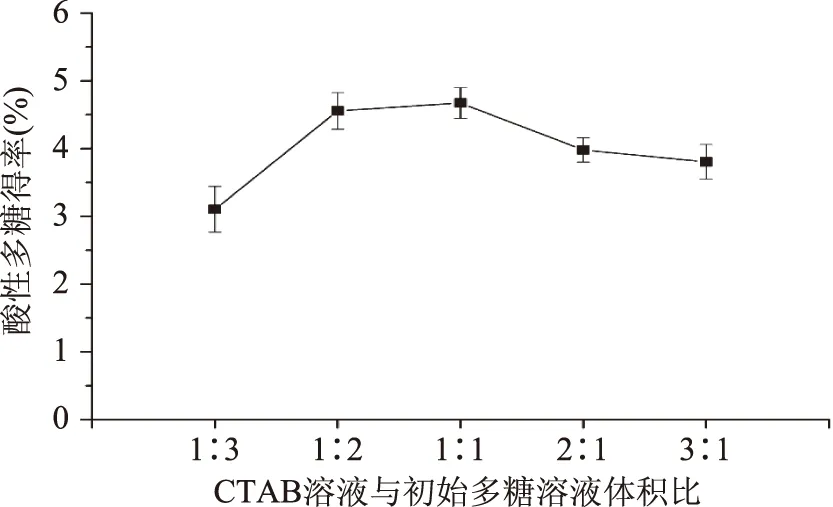
图1 CTAB溶液与初始多糖溶液体积比对酸性多糖得率的影响Fig.1 Effects of volume ratio of CTAB solution to initial polysaccharides solution on yield of acidic polysaccharide from A.pullulans G16
2.1.2 初始多糖溶液质量浓度对酸性多糖得率的影响 如图2所示,随着初始多糖溶液质量浓度的增大,酸性多糖的得率逐渐增大。当初始多糖溶液质量浓度为7%时,出芽短梗霉酸性多糖的得率为4.79%。其原因可能是在一定体积溶液中多糖含量越大,提取剂与多糖的接触越充分,能在相同时间内沉淀出更多酸性多糖,使得率增大。
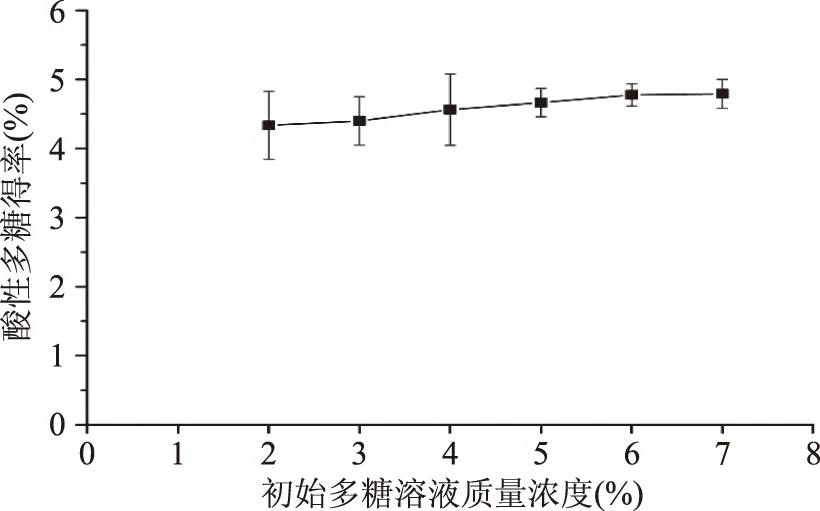
图2 初始多糖溶液质量浓度对酸性多糖得率的影响Fig.2 Effects of concentration of total exopolysaccharides on yield of acidic polysaccharide from A.pullulans G16
2.1.3 沉淀时间对酸性多糖得率的影响 如图3所示,随着沉淀时间增加,酸性多糖得率增加,但9 h之后酸性多糖得率趋于平缓,这可能是因为酸性多糖在CTAB溶液中沉淀是一个较慢的过程,达到一定时间后沉淀的酸性多糖处于饱和状态,酸性多糖沉淀量不再增加,因此选择沉淀时间为9 h,此时出芽短梗霉产酸性多糖的得率达到最大值,占总多糖产量的4.81%。
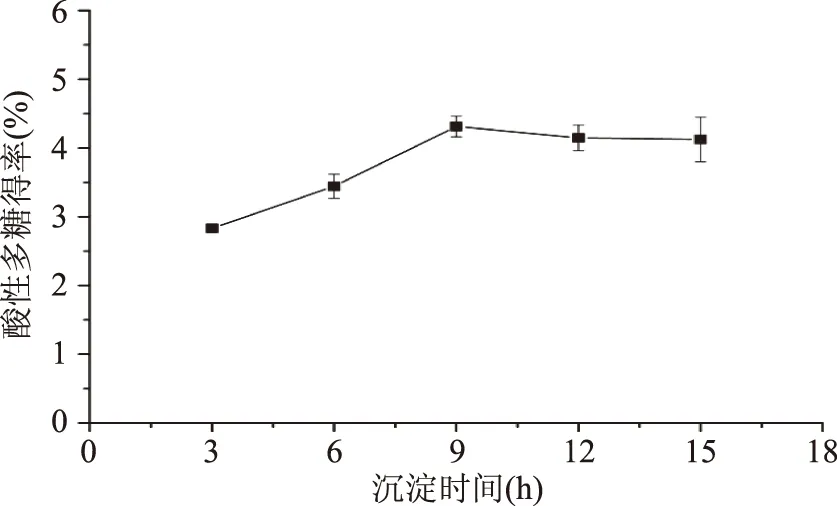
图3 沉淀时间对酸性多糖得率的影响Fig.3 Effects of precipitation time on yield of acidic polysaccharide from A.pullulans G16
2.2 正交实验结果
在单因素实验的基础上,采用L9(34)正交实验设计,对CTAB法分离出芽短梗霉产酸性多糖进行工艺条件优化,正交实验结果见表2。
由表2中R值可见,影响酸性多糖得率的因素主次依次是:CTAB溶液与初始多糖溶液体积比>初始多糖溶液质量浓度>沉淀时间。由k值大小可知,优化工艺组合是A2B3C3,即质量浓度3%的CTAB溶液与初始多糖溶液体积比为1∶1,初始多糖溶液质量浓度7%,沉淀12 h。
2.3 验证结果
按照出芽短梗霉产酸性多糖的最佳分离条件制备酸性多糖,计算酸性多糖得率的平均值为5.01%,说明该最优分离条件适用于出芽短梗霉产酸性多糖的提取。

表3 出芽短梗霉产酸性多糖与普鲁兰多糖的水溶性Table 3 Water solubility of acidic polysaccharide and pullulan from A.pullulans G16
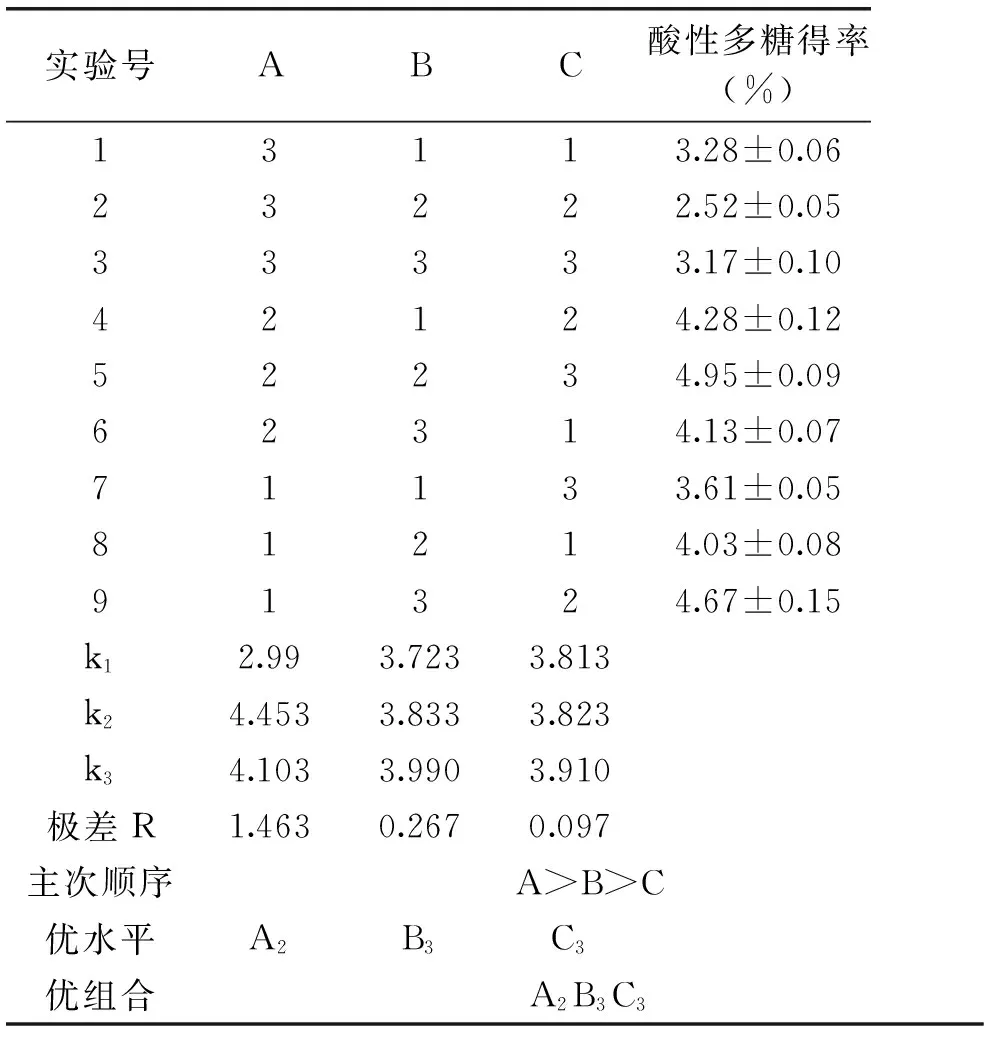
表2 正交实验结果Table 2 The results of orthogonal test
2.4 出芽短梗霉产酸性多糖与普鲁兰多糖水溶性比较
如表3所示,10 mg酸性多糖与普鲁兰多糖能分别完全溶解于1 mL与0.1 mL的去离子水中。结果表明,出芽短梗霉合成的酸性多糖与普鲁兰多糖水溶性存在较大差异,酸性多糖微溶于水,普鲁兰多糖易溶于水。
2.5 出芽短梗霉产酸性多糖与普鲁兰多糖的抗氧化活性比较
2.5.1 还原能力 如图4所示,在测定范围内,两种多糖的还原能力都随浓度的增加而逐渐增加,但均小于同浓度维生素C的还原能力,可能是由于多糖是大分子物质,其中包含的还原性末端相对较少。当浓度为1.0 mg/mL 时,酸性多糖的还原能力为0.425,普鲁兰多糖的还原能力为0.378,二者还原能力无显著性差异(p>0.05)。
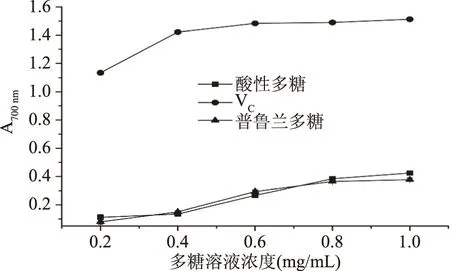
图4 出芽短梗霉产酸性多糖和普鲁兰多糖的还原能力Fig.4 The reduction power of acidic polysaccharide and pullulan from A.pullulans G16
2.5.2 超氧阴离子自由基清除作用 如图5所示,出芽短梗霉产酸性多糖与普鲁兰多糖具有一定的超氧阴离子自由基清除作用,但均小于同浓度维生素C对超氧阴离子自由基的清除作用。在0.2~1.0 mg/mL范围内,出芽短梗霉产酸性多糖与普鲁兰多糖对超氧阴离子自由基清除率随多糖溶液浓度的增大变化均不明显。在溶液浓度为1.0 mg/mL时,酸性多糖清除率为30.63%,普鲁兰多糖清除率为30.96%,二者对超氧阴离子自由基的清除作用无显著性差异(p>0.05)。
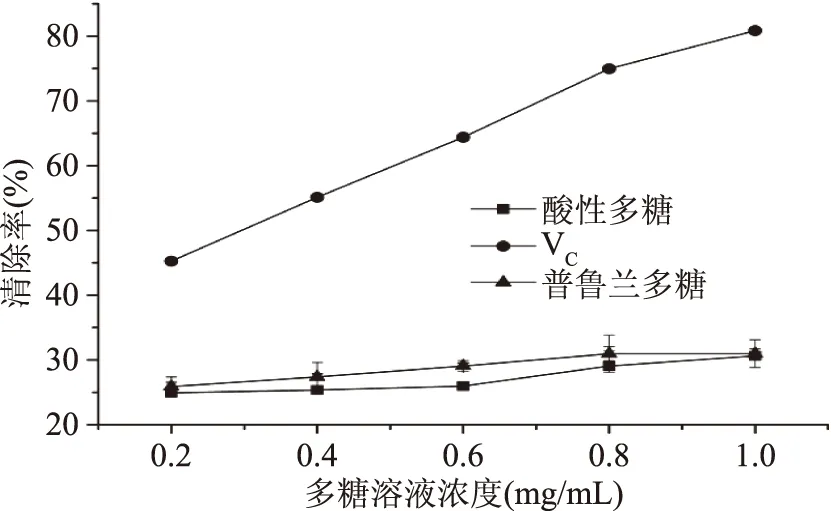
图5 出芽短梗霉产酸性多糖和普鲁兰多糖对超氧阴离子自由基的清除作用Fig.5 Superoxide radical scavenging activities of acidic polysaccharide and pullulan from A.pullulans G16
2.5.3 羟基自由基清除作用 如图6所示,出芽短梗霉产酸性多糖与普鲁兰多糖对羟基自由基有一定的清除作用,在测定范围内,清除作用均随多糖溶液浓度的增大而增大,且酸性多糖对羟基自由基的清除率增速较快,但都低于同浓度VC对羟基自由基的清除作用。当多糖溶液浓度为1 mg/mL时,酸性多糖和普鲁兰多糖对羟基自由基的清除率分别为31.40%和29.76%,二者无显著性差异(p>0.05)。
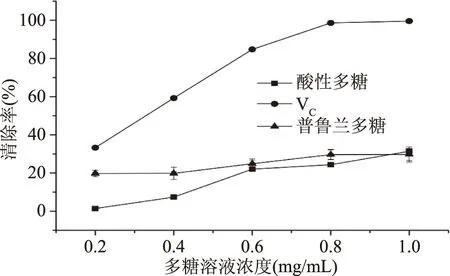
图6 出芽短梗霉产酸性多糖和普鲁兰多糖对羟基自由基的清除作用Fig.6 Hydroxyl radical scavenging activity of acidic polysaccharide and pullulan from A.pullulans G16
3 结论
本实验利用十六烷基三甲基溴化铵(CTAB)可与酸性多糖形成沉淀,从而分离出芽短梗霉发酵产生的酸性多糖与中性普鲁兰多糖。通过单因素实验与正交实验,得出CTAB法制备出芽短梗霉产酸性多糖的最佳工艺条件为:质量浓度 3% 的CTAB溶液与初始多糖溶液体积比1∶1,初始多糖溶液质量浓度7%,沉淀12 h。该最佳工艺条件下,出芽短梗霉G16产酸性多糖得率为总多糖产量的5.01%。与酶解法酶解普鲁兰多糖从而分离酸性多糖[19]相比,普鲁兰酶酶解普鲁兰多糖会破坏普鲁兰多糖的结构,而CTAB法只是与酸性多糖络合形成沉淀从而分离出该酸性多糖,后通过透析法即可除去与酸性多糖络合的CTAB,因此该方法保持了出芽短梗霉产酸性多糖与普鲁兰多糖的结构完整性,为该种多糖的后续研究提供了参考。
溶解性实验结果表明,普鲁兰多糖易溶于水,而酸性多糖微溶于水。以超氧阴离子自由基、羟基自由基清除能力及还原能力为指标对出芽短梗霉产酸性多糖与普鲁兰多糖进行体外抗氧化活性比较,结果表明,在特定的浓度范围内其抗氧化能力随其浓度的提高而增加,且二者的抗氧化活性无显著性差异,为出芽短梗霉产酸性多糖其他相关性质研究及其进一步开发与应用提供理论参考。
[1]Bingxue Li,Ning Zhang,Qing Peng,et al. Production of pigment-free pullulan by swollen cell inAureobasidiumpullulansNG which cell differentiation was affected by pH and nutrition[J]. Applied Microbiology & Biotechnology,2009,84(2):293-300.
[2]Price NP,Manitchotpisit P,Vermillion KE,et al. Structural characterization of novel extracellular liamocins(mannitol oils)produced byAureobasidiumpullulansstrain NRRL 50380[J]. Carbohydrate Research,2013,370(370):24-32.
[3]Mishra B,Vuppu S,Rath K. The role of microbial pullulan,a biopolymer in pharmaceutical approaches:A review[J]. Journal of Applied Pharmaceutical Science,2011,1(6):45-50.
[4]王莉衡.普鲁兰多糖生物合成及应用研究进展[J].化学与生物工程,2015(12):1-2.
[5]Hamada N,Tsujisaka Y. The Structure of the Carbohydrate Moiety of an Acidic Polysaccharide Produced byAureobasidiumsp. K-1[J]. Agricultural & Biological Chemistry,1983,47(6):
1167-1172.
[6]Yurlova N,De Hoog G. A new variety ofAureobasidiumpullulanscharacterized by exopolysaccharide structure,nutritional physiology and molecular features[J]. Antonie van Leeuwenhoek,1997,72(2):141-147.
[7]Tada R,Tanioka A,Iwasawa H,et al. Structural characterisation and biological activities of a unique type beta-d-glucan obtained fromAureobasidiumpullulans[J]. Glycoconjugate Journal,2008,25(9):851-861.
[8]陈海华,许时婴,王璋. 亚麻籽胶中酸性多糖和中性多糖的分离纯化[J]. 食品与发酵工业,2004,30(1):96-100.
[9]Polati R,Zapparoli G,Giudici P,et al. A CTAB based method for the preparation of total protein extract of wine spoilage microrganisms for proteomic analysis[J]. Journal of Chromatography B:Analytical Technologies in the Biomedical and Life Sciences,2009,877(10):887-891.
[10]盛龙. 普鲁兰多糖生物合成的关键影响因素及其机理研究[D].无锡:江南大学,2015.
[11]程斌. 海带硫酸多糖的提取纯化降解及活性研究[D]. 曲阜:曲阜师范大学,2009.
[12]康如龙,刘倩,苏小建,等. 冬瓜皮提取物抗氧化性活性的研究[J]. 食品科技,2013(3):218-222.
[13]程水明,刘莹,梅光明,等. 羧甲基茯苓多糖的抗氧化活性研究[J]. 食品研究与开发,2013,34(3):1-5.
[14]ZhanyongWang,Chenyu Wang,Yue Quan. Extraction of polysaccharides from Phellinus nigricans mycelia and their antioxidant activitiesinvitro[J]. Carbohydrate Polymers,2014,99(99):110-115.
[15]向莹. 滑子菇多糖结构和生物活性的研究[D].广州:华南理工大学,2013.
[16]刘凤. 海洋假单胞菌PF-6胞外多糖的制备与性质的研究[D]. 大连:大连工业大学,2011.
[17]刘晓风,党朵,杨明俊,等. 枸杞粗多糖的提取工艺优化及抗氧化活性研究[J]. 农业机械,2012(8):109-113.
[18]谢燕飞,覃冬,潘廷啟,等. 广西壮药薏苡茎多糖的提取及抗氧化性研究[J]. 中国处方药,2012,10(2):43-45.
[19]CescuttiP,PupulinR,DelbenF,et al. New exopolysaccharides produced byAureobasidiumpullulansgrown on glucosamine[J]. Carbohydrate Research,2002,337(13):1203-1209.
Optimization of process in extracting acidic polysaccharide fromAureobasidiumpullulansusing CTAB as precipitant and comparison of its properties to pullulan
HAO Jing,TONG Qun-yi*
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Acidic polysaccharide secreted byAureobasidiumpullulanswas separated using cetyltrimethylammonium bromide(CTAB)as precipitant and its solubility as well as antioxidant activityinvitrocompared to pullulan were studied. The optimal conditions were obtained through single factor experiments and orthogonal experiments and they were as follows:the ratio of 3%(w/v)CTAB solution to initial polysaccharides solution was 1∶1,concentration of initial polysaccharides solution was 7%(w/v),precipitation time was 12 h. Under this condition,the extraction rate of acidic polysaccharide was 5.01%. This kind of method kept structure integrity of acidic polysaccharide and pullulan and provide references for further research of this polysaccharide. Results of properties comparison between acidic polysaccharide and pullulan indicated that pullulan was easily soluble in water but acidic polysaccharide was only slightly soluble in water. The antioxidation activities of acidic polysaccharide and pullulan were similar when the concentration was in the range of 0 to 1 mg/mL. The reducing power,scavenging rate on superoxide radical and hydroxyl radical of this two kinds of polysaccharides increased with the increase of solution concentration. It could offer theoretical references for further development and application of acidic polysaccharide fromA.pullulans.
cetyltrimethyl ammonium bromide(CTAB);Aureobasidiumpullulans;acidic polysaccharide;pullulan;property
2016-11-18
郝婧(1992-),女,在读研究生,研究方向:碳水化合物科学与工程,E-mail:wjhaojing@163.com。
*通讯作者:童群义(1963-),男,博士,教授,研究方向:碳水化合物科学与工程,E-mail:tqyjn@163.com。
TS201.3
A
1002-0306(2017)11-0162-05
10.13386/j.issn1002-0306.2017.11.022
