胃癌组织低氧诱导因子1α及受控基因与临床病理特点的关系
2017-06-23郭飞波杨勇
郭飞波 杨勇
胃癌组织低氧诱导因子1α及受控基因与临床病理特点的关系
郭飞波 杨勇
目的 探讨胃癌组织低氧诱导因子1α(HIF-1α)及受控基因与临床病理特点的关系。方法 收集87例胃癌患者胃黏膜组织样本(胃癌组织)和癌旁非肿瘤黏膜上皮组织(癌旁组织),采用免疫组化染色检测PFKFB3、PFKFB4、HIF-1α蛋白阳性表达率,免疫印迹试验检测PFKFB3、PFKFB4、HIF-1α蛋白相对表达量,实时定量聚合酶链反应检测PFKFB3、PFKFB4、HIF-1 αmRNA相对表达量;分析PFKFB3、PFKFB4、HIF-1α与胃癌患者临床病理资料及生存预后的关系。结果 胃癌组织PFKFB3、PFKFB4、HIF-1α蛋白表达阳性率高于癌旁组织(P<0.05);胃癌组织PFKFB3、PFKFB4、HIF-1α 蛋白表达量分别为(2.09±0.17)、(2.33±0.21)、(2.16±0.18),高于癌旁组织(1.03±0.11)、(1.47±0.14)、(1.10±0.12)(P<0.05);胃癌组织PFKFB3、PFKFB4、HIF-1α mRNA相对表达量分别为(1.21±0.17)、(1.41±0.18)、(1.32±0.15),高于癌旁组织(0.55±0.50)、(0.63±0.08)、(0.51±0.04)(P<0.05)。肿瘤直径≥4 cm、低分化胃癌、Ⅲ~Ⅳ期胃癌患者PFKFB3、PFKFB4、HIF-1α表达明显升高(P<0.05)。胃癌组织PFKFB3、PFKFB4、HIF-1α阴性组累积3年生存率均高于PFKFB3、PFKFB4、HIF-1α阳性组(P<0.05)。结论胃癌组织PFKFB3、PFKFB4、HIF-1α呈高表达,且表达水平与肿瘤大小、临床分期、分化程度有关,三者可作为胃癌病情、预后的预测指标之一。
胃癌 低氧诱导因子1α 受控基因 病理 预后
胃癌是全世界范围内的高发恶性肿瘤,其发病率和死亡率居消化系统肿瘤的首位[1,2]。中国是胃癌的高发国家,发病率约占全球的30%[3]。近年来随着研究的深入,人们发现低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)在肿瘤发病中起关键作用。国外研究证实[4],低氧反应元件(hypoxic response element,HRE)是HIF-1α调控的主要下游靶基因,生长活跃的肿瘤细胞因能量代谢相对不足而处于低氧状态,此时肿瘤细胞会激活HIF-1α,诱导HRE表达上调,并调控一系列受控基因,使肿瘤细胞重新恢复能量供应。6-磷酸果糖激酶-2/果糖双磷酸酶-2(6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase,PFK-2/FBPase-2)是HIF-
1α的主要受控基因家族[5],哺乳动物中有4种不同的PFK-2/FBPase-2同工酶,分别为PFKFB1、PFKFB2、PFKFB3、PFKFB4。Rovira等[6]报道PFKFB3、PFKFB4有类似癌基因调控元件的作用,能够催化形成2,6-双磷酸果糖,使肿瘤细胞重新获得糖酵解的能量而加速生长。因此,本研究检测胃癌组织HIF-1α及其受控基因PFKFB3、PFKFB4表达水平,分析PFKFB3、PFKFB4与胃
癌临床病理特点的关系,旨在为胃癌的诊断、预防和治疗提供参考信息,现将结果报告如下。
资料与方法
1 一般资料 经医院伦理委员会批准,选择2009年4月~2013年5月在医院行手术治疗的87例胃癌患者作为研究对象,男性59例,女性28例,年龄24~72岁,平均(56.1±5.3)岁。所有患者均经病理学证实,其中腺癌71例,非腺癌16例;组织分型按照胃癌Lauren标准[7]分为弥漫型14例、肠型73例;病理分级:低分化43例,中分化29例,高分化15例;按照美国癌症联合委员会[8](American Joint Committee on Cancer,AJCC)胃癌TNM标准分为Ⅰ~Ⅱ期组33例和Ⅲ~Ⅳ期组54例;浸润深度pT1~2 24例,pT3~4 63例。
2 纳入与排除标准 纳入标准:①所有患者均经病理学证实为胃癌,患者临床资料完整;②患者均行手术治疗,术后规律随访;③术中取组织样本保存;④治疗方案取得患者及家属同意,并签署知情同意书。排除标准:①合并其他恶性肿瘤;②术前接受过放疗、化疗等其他抗癌治疗者;③合并有其他严重并发症影响随访者。
3 主要试剂与仪器 主要试剂:RNeasy MineElute clanup kit、miScript II RT Kit、2×SYBR Green qPCR Mix均购自德国QIAGEN公司;苏木素、伊红染液购自上海信帆生物科技有限公司;免疫组化试剂盒购自上海拜力生物科技有限公司;兔抗人PFKFB3、PFKFB4、HIF-1α单克隆抗体、鼠抗人GAPDH单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG二抗购自美国Sigma公司;Trizol试剂盒、逆转录试剂盒、BCA蛋白浓度测定试剂盒购自美国Thermo公司;PVDF膜、磷酸缓冲盐溶液(PBS)购自美国Santa Cruz公司。主要仪器:YS100普通光学显微镜购自日本尼康公司,凝胶成像系统及图像分析软件购自美国Bio-Rad公司,Real-time PCR仪购自瑞士Roche公司。
4 方法
4.1 样本采集:所有患者均于术中切除胃癌黏膜组织(胃癌组织),同时配对切除距肿瘤组织大体切缘癌旁≥10 cm非肿瘤黏膜上皮组织(癌旁组织),所有组织样本均于低温时采集,并置液氮中保存待检。
4.2 免疫组化染色(immunohistochemical staining,ICH)方法:取组织样本,常规石蜡包埋,制成厚度4 μm的切片,二甲苯、梯度乙醇脱蜡,PBS冲洗,加入3%H2O2甲醇液孵育5 min消除内源性过氧化酶,再加入0.01 mol/L枸橼酸缓冲液,微波抗原修复。滴加3%山羊血清封闭液体,37℃孵育10 min弃去封闭液;分别滴加兔抗人PFKFB3、PFKFB4、HIF-1α单克隆抗体,4℃孵育24 h。加入辣根过氧化物酶标记的羊抗兔二抗,37℃孵育30 min,PBS冲洗3次。二氨基联苯胺(DAB)显色液显色,焦磷酸二乙酯(DEPC)水洗,苏木素复染,中性树胶封片,镜检。结果判定:参考四分法半定量计分标准,活性细胞占比<5%为0分,活性细胞占比5%~25%为1分,活性细胞占比26%~50%为2分,活性细胞占比51%~100%为3分,0~1分为蛋白表达阴性,2~3分为蛋白表达阳性。由2位病理科医生采用盲法阅片,显微镜下随机选择10个视野,计算阳性细胞占比,取平均值。
4.3 免疫印迹试验(Western Blot)方法:将组织样本用手术剪尽可能剪碎,充分研磨,加入RIPA裂解液,置冰水浴上静置50 min,再置于冷冻离心机中,4℃、12 000 r/min离心20 min,提取总蛋白。采用Bradford蛋白检测试剂盒检测总蛋白含量。将50 μg总蛋白以100℃水浴变性3 min,10%十二烷基硫酸钠聚丙烯酰氨凝胶(SDS-PAGE)40 V电泳2 h,30 min转移至PVDF膜,加入5%脱脂奶粉封闭1.5 h。按照1∶200比例用PBS稀释PFKFB3、PFKFB4、HIF-1α单克隆抗体,4℃孵育24 h。PBST稀释液漂洗PVDF膜3次,5 min/次;再加入1∶2 000由PBST稀释的辣根过氧化物酶标记的羊抗兔IgG二抗,7℃振摇孵育1 h,应用荧光分析系统对目的条带进行分析,以GAPDH作为内参照,目的条带与GAPDH条带积分吸光度值之比为目的蛋白相对表达量。
4.4 实时定量聚合酶链反应(RT-PCR)方法:取100 mg组织样本,于液氮中充分研磨,按照Trizol试剂盒提取组织总RNA,紫外分光光度法检测总RNA纯度。将约1 μg总RNA反转录成cDNA,cDNA合成体系:DEPC 3 μl,反转录缓冲液2 μl,RNA逆转录模板1 μl,dNTP 0.2 μl,逆转录酶MMLV 1 μl,上下游引物各0.5 μl,加入双蒸水将总反应体系补充至22 μl,37℃金属浴反应60 min合成cDNA。将cDNA置于Real-time PCR仪进行扩增,扩增引物委托南京金斯瑞生物科技有限公司合成(引物序列见表1)。PCR反应体系:2×SYBR Green qPCR Mix 9 μl,上下游引物各0.5 μl,cDNA 1 μl,加入双蒸水将总反应体系补充至20 μl。反应条件:96℃预变性2 min;95℃变性1 min,60℃退火20 s,72℃延伸30 s,40个循环;后72℃ 57 min;将PCR反应产物采用5%琼脂糖凝胶电泳,凝胶成像系统分析目的条带灰度值,以GAPDH为内参照进行校正,测量目的基因CT值,分析目的基因相对表达量。
5 随访 对87例乳腺癌患者的随访从术后第2天开始,截止日期为随访结束或患者死亡或失访。
6 统计学处理 应用SPSS19.0软件包对数据进行处理,计数资料以百分率(%)表示,采用χ2检验或Fisher确切概率法分析PFKFB3、PFKFB4、HIF-1α与临床病理特点的关系;生存分析采用Kaplan-Meier法,采用Log-Rank test比较组间生存率的差异,P<0.05表示差异有统计学意义。
结果
1 PFKFB3、PFKFB4、HIF-1α蛋白在胃癌组织中的表达 免疫组化染色结果显示:胃癌组织PFKFB3、PFKFB4、HIF-1α蛋白表达阳性率显著高于癌旁组织,组间比较差异有统计学意义(P<0.05),见表2、图1。

表1 引物序列及扩增长度

表2 胃癌组织与癌旁组织PFKFB3、PFKFB4、HIF-1α阳性表达(n,%)

图1 PFKFB3、PFKFB4、HIF-1α蛋白在胃癌组织中的表达(ICH,×200)
2 胃癌组织与癌旁组织PFKFB3、PFKFB4、HIF-1α蛋白表达 Western Blot检查结果显示:胃癌组织PFKFB3、PFKFB4、HIF-1α 蛋白表达量分别为(2.09±0.17)、(2.33±0.21)、(2.16±0.18),明显高于癌旁组织(1.03±0.11)、(1.47±0.14)、(1.10±0.12),组间比较差异具有统计学意义(P<0.05),见图2。

图2 胃癌组织与癌旁组织PFKFB3、PFKFB4、HIF-1α蛋白表达
3 胃癌组织与癌旁组织PFKFB3、PFKFB4、HIF-1α mRNA表达 RT-PCR试验结果显示:胃癌组织PFKFB3、PFKFB4、HIF-1α mRNA相对表达量分别为(1.21±0.17)、(1.41±0.18)、(1.32±0.15),明显高于癌旁组织(0.55±0.5)、(0.63±0.08)、(0.51±0.04),组间比较差异具有统计学意义(P<0.05),见图3。
4 PFKFB3、PFKFB4、HIF-1α表达与临床病理特点的关系 胃癌患者PFKFB3、PFKFB4、HIF-1α蛋白阳性表达与年龄、性别、病理类型、Lauren分型、浸润深度、淋巴结转移等临床病理资料无关(P>0.05);肿瘤直径≥4 cm 胃癌患者PFKFB3、PFKFB4、HIF-1α蛋白阳性表达率明显高于肿瘤直径<4 cm者,低分化胃癌患者PFKFB3、PFKFB4、HIF-1α蛋白阳性表达率明显高于中、高分化者,Ⅲ~Ⅳ期胃癌患者PFKFB3、PFKFB4、HIF-1α蛋白阳性表达率明显高于Ⅰ~Ⅱ期者,各组间比较差异具有统计学意义(P<0.05),见表3。

图3 胃癌组织与癌旁组织PFKFB3、PFKFB4、HIF-1α mRNA表达
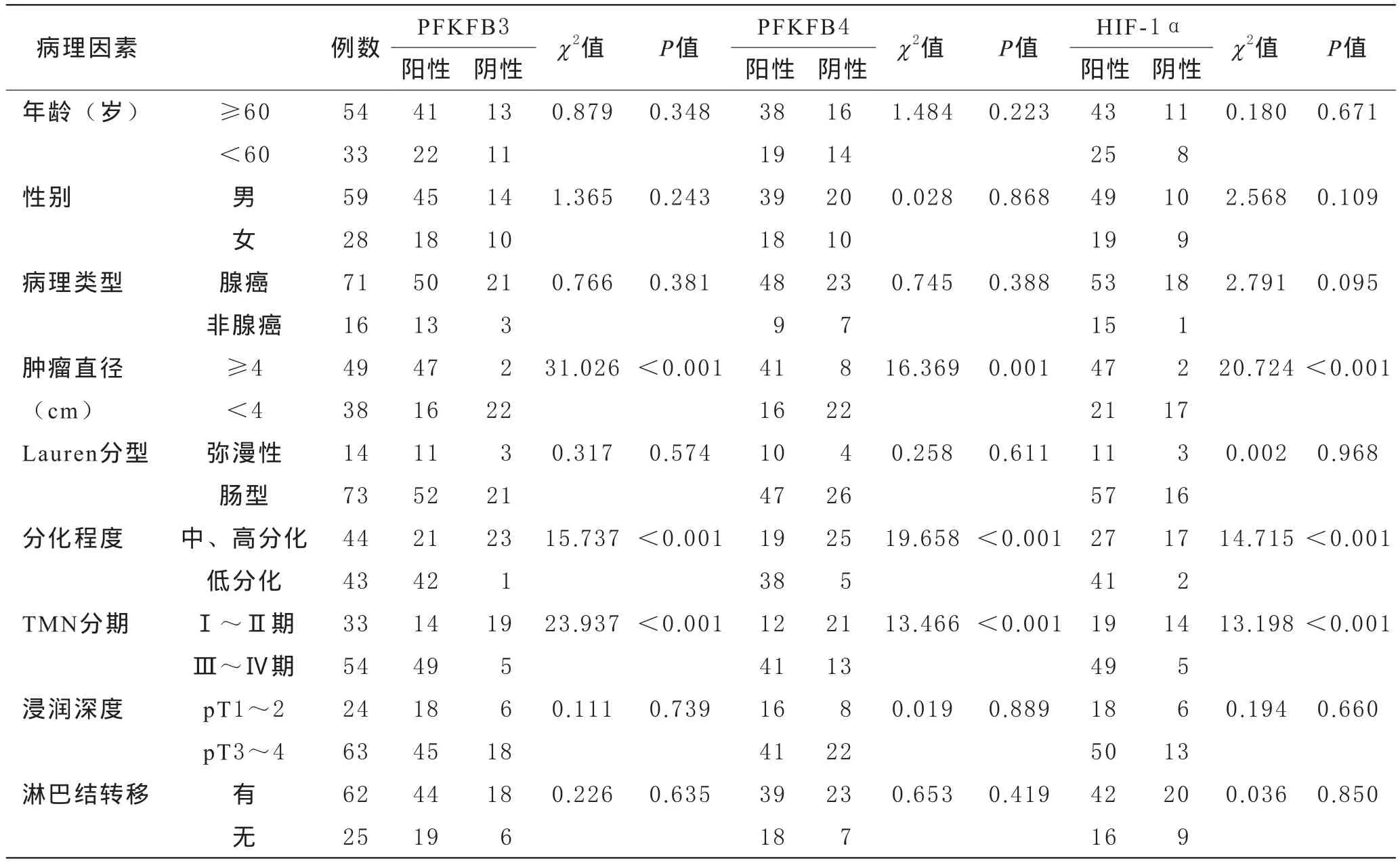
表3 PFKFB3、PFKFB4、HIF-1α表达与临床病理特点的关系
5 PFKFB3、PFKFB4、HIF-1α表达与生存预后的关系 本研究随访截止至2016年5月31日,中位随访时间38.9个月。生存曲线分析显示,PFKFB3阴性累积3年生存率为61.3%(95%CI:15.2%~31.0%),高于PFKFB3阳性累积3年生存率(38.1%,95%CI:20.2%~41.3%)(P<0.05)(图4A);PFKFB4阴性累积3年生存率为58.7%(95%CI:14.4%~26.0%),高于PFKFB3阳性累积3年生存率(36.7%,95%CI:22.0%~45.8%)(P<0.05)(图4B);HIF-1α阴性累积3年生存率为57.3%(95%CI:22.3%~34.3%),高于HIF-1α阳性累积3年生存率(30.5%,95%CI:30.9%~41.3%)(P<0.05)(图4C)。
讨 论

图4 胃癌患者生存曲线
恶性肿瘤细胞在氧气和营养供应不足条件下,细胞糖酵解代谢功能活跃,这种特殊的化学表型被称为Warburg效应。目前研究证实[9],Warburg效应在肿瘤的生长、分化、浸润、转移中发挥关键作用。Giang等[10]报道证实,抑制了恶性肿瘤的Warburg效应,能够显著改善患者的预后。与正常细胞线粒体依赖的糖分解相比,肿瘤细胞糖酵解产能率较低,导致肿瘤细胞因能量供应不足而处于相对低氧状态,肿瘤细胞启动自身的一系列生化反应,从而使细胞适应代谢的需求。HIF-1α是目前研究较多的一种低氧诱导因子,在维持恶性肿瘤细胞的高能量代谢适应过程中发挥重要作用。Ardyanto等[11]报道称细胞低氧状态能够激活HIF-1α信号通路,诱导HRE高表达,并通过调控一系列下游靶基因,使细胞重新获得能量供应。Langer等[12]证实HIF-1α是通过其受控基因调节代谢相关酶、生长因子等表达,其中PFK-2/ FBPase-2是HIF-1α最重要的受控基因之一。
PFK-2/FBPase-2调节糖酵解激酶超家族,包括肌酐激酶、磷酸果糖激酶、腺苷激酶等,能够调控多条糖酵解通路,维持细胞的能量供应[13]。基因组研究证实[14]PFK-2/FBPase-2共有4种同工酶,分别为PFKFB1、PFKFB2、PFKFB3、PFKFB4。Novellasdemunt等[15]发现PFK-2/FBPase-2的4种同工酶均具有缺氧瞬即反应,即当细胞缺氧时能够启动缺氧反应元件,增强细胞的糖酵解,导致细胞乳酸含量增加而诱导细胞增殖,且这种效应可能与肿瘤进展有关。在4种同工酶中,PFKFB3、PFKFB4与胃癌密切相关。代伟伟等[16]采用免疫组化染色法比较了胃癌、肺癌、结肠癌和正常组织PFKFB3、PFKFB4表达情况,结果显示胃癌组织PFKFB3、PFKFB4表达显著高于肺癌、结肠癌和正常组织,但是在肺癌、结肠癌和正常组织中表达差异并无统计学意义,提示PFKFB3、PFKFB4对胃癌组织具有高选择性。本研究显示,胃癌组织PFKFB3、PFKFB4、HIF-1α mRNA和蛋白表达水平均高于癌旁组织,提示胃癌组织PFKFB3、PFKFB4、HIF-1α异常高表达。动物实验模型证实[17],沉默HIF-1α表达能够抑制肿瘤的生长。原位杂交检测结果也证实[18]HIF-1α mRNA在胃癌细胞中异常高水平,并且这种高表达水平与高糖酵解代谢相关。
本研究显示,PFKFB3、PFKFB4、HIF-1α蛋白阳性表达与年龄、性别、病理类型、Lauren分型、浸润深度、淋巴结转移等临床病理资料无关,肿瘤直径³4 cm、低分化胃癌、Ⅲ~Ⅳ期胃癌患者PFKFB3、PFKFB4、HIF-1α表达明显升高,提示PFKFB3、PFKFB4、HIF-1α主要参与胃癌的发生和进展。随着肿瘤细胞的增加,其对代谢的需求更高,此时需要更充足的能量供应。Shioya等[19]报道肿瘤细胞的高糖酵解途径虽然不是获得能量的主要方式,但是可以代偿性的解决肿瘤细胞缺氧和低能量供应状态,从而维持肿瘤细胞的快速生长。这也提示PFKFB3、PFKFB4、HIF-1α可以作为预测肿瘤病情和预后的指标之一。国外有学者提出[20],可以将HIF-1α作为胃癌治疗的一个作用靶点,通过抑制HIF-1α表达,使肿瘤细胞的能量供应受阻,导致细胞坏死凋亡。本研究对不同PFKFB3、PFKFB4、HIF-1α表达水平的胃癌患者生存情况进行分析,结果显示PFKFB3、PFKFB4、HIF-1α阳性表达组3年生存率均明显低于PFKFB3、PFKFB4、HIF-1α表达阴性组,提示PFKFB3、PFKFB4、HIF-1α可以作为胃癌不良预后的预测指标。
综上所述,胃癌组织PFKFB3、PFKFB4、HIF-1α呈高表达,且表达水平与肿瘤大小、临床分期、分化程度有关,三者可以作为胃癌病情、预后的预测指标之一。
1 Marquitz AR,Mathur A,Shair KH,et al.Infection of Epstein-Barr virus in a gastric carcinoma cell line induces anchorage independence and global changes in gene expression[J].Proc Natl Acad Sci U S A,2012,109(24):9593-9598.
2 张俊会,宋国慧,陈志峰,等.北方食管癌高发区磁县1988年至2011年胃癌死亡趋势分析[J].现代肿瘤医学,2016,24(12):1986-1989.
3 邹小农,孙喜斌,陈万青,等.2003-2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
4 Kodama K,Rahman MS,Horiguchi T,et al.Upregulation of hypoxia-inducible factor (HIF)-1α and HIF-2α mRNA levels in dragonet Callionymus valenciennei exposed to environmental hypoxia in Tokyo Bay[J].Mar Pollut Bull,2012,64(7):1339-1347.
5 Park S,Kim YS,Lee HA,et al.Mulberry Leaf Extract Inhibits Invasive Potential and Downregulates Hypoxia-Inducible Factor-la (HIF-la) in SK-NBE(2)C Neuroblastoma Cells[J].Biosci Biotechnol Biochem,2013,77(4):722-728.
6 Rovira J,Irimia JM,Guerrero M,et al.Upregulation of heart PFK-2/FBPase-2 isozyme in skeletal muscle after persistent contraction[J].Pflugers Arch,2012,463(4):603-613.
7 Hass HG,Smith U,Jäger C,et al.Signet ring cell carcinoma of the stomach is significantly associated with poor prognosis and diffuse gastric cancer(Lauren's): single-center experience of 160 cases[J].Onkologie,2011,34(12):682-686.
8 Marchet A,Mocellin S,Ambrosi A,et al.Validation of the new AJCC TNM staging system for gastric cancer in a large cohort of patients (n= 2,155):focus on the T category[J].Eur J Surg Oncol,2011,37(9):779-785.
9 Milane L,Ganesh S,Shah S,et al.Multi-modal strategies for overcoming tumor drug resistance:Hypoxia,the Warburg effect,stem cells,and multifunctional nanotechnology[J].J Control Release, 2011,155(2):237-247.
10 Giang AH,Raymond T,Brookes P,et al.Mitochondrial dysfunction and permeability transition in osteosarcoma cells showing the warburg effect[J].J Biol Chem,2013,288(46):33303-33311.
11 Ardyanto TD,Osaki M,Nagahama Y,et al.Downregulation of cobalt-induced HIF-1alpha expression correlates with cell proliferation and apoptosis in human gastric carcinoma cells[J].Oncol Rep,2008,19(2):339-343.
12 Langer S,Okar DA,Schultz J,et al.Dimer interface rearrangement of the 6-phosphofructo-2-kinase/ fructose 2,6-bisphosphatase rat liver isoenzyme by cAMP-dependent Ser-32 phosphorylation[J].FEBS Lett,2012,586(10):1419-1425.
13 王骏,李师耿,王喻,等.6-磷酸果糖激酶-2/果糖双磷酸酶-2同工酶3基因敲除小鼠模型的构建[J].中华实验外科杂志,2015,32(12):2986-2989.
14 吴二斌,李莉华,郭子健,等.P FKFB3在肝癌中的表达及其临床意义[J].临床肿瘤学杂志,2014,19(6):508-511.
15 Novellasdemunt L,Bultot L,Manzano A,et al.PFKFB3 activation in cancer cells by the p38/MK2 pathway in response to stress stimuli[J].Biochem J,2013,452(3):531-543.
16 代伟伟,梁燕,刘正新,等.6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶在胃癌组织中的表达及其临床意义[J].中华消化杂志,2015,35(4):264-266.
17 许林锋,倪嘉延,陈耀庭,等.HIF-1α基因沉默对大鼠肝癌CBRH-7919细胞p27和Ki67表达的影响[J].中国病理生理杂志,2012,28(10):1825-1829.
18 左海波,陈小伍,朱达坚,等.p-21活化激酶-1和缺氧诱导因子-1α在结直肠癌侵袭与转移中的作用[J].广东医学,2012,33(11):1604-1607.
19 Shioya M,Takahashi T,Ishikawa H,et al.Expression of hypoxia-inducible factor 1α predicts clinical outcome after preoperative hyperthermo-chemoradio therapy for locally advanced rectal cancer[J].J Radiat Res,2011,52(6):821-827.
20 Woo S,Lee BL,Yoon J,et al.Constitutive activation of signal transducers and activators of transcription 3 correlates with better prognosis,cell proliferation and hypoxia-inducible factor-1α in human gastric cancer[J].Pathobiology,2011,78(6):295-301.
Relationship between Hypoxia Inducible Factor 1α,and its Controlled Genes and Clinical Pathological Characteristics in Gastric Carcinoma
GUO Fei-bo,YANG Yong.
Department of Laboratory Medicine,The First People's Hospital of Tianmen,Hubei 431700
Objective To explore the relationship between hypoxia inducible factor 1α,its controlled genes and clinical pathological characteristics in gastric carcinoma. Methods A total of 87 cases of gastric carcinoma patients gastric mucosa tissue samples (gastric cancer tissue) and adjacent non tumor mucosa epithelial tissue (adjacent issue) were collected,PFKFB3,PFKFB4,HIF-1α protein positive rate were detected by immunohistochemical staining,PFKFB3,PFKFB4,HIF-1α protein relative expression was detected by Western blot assay,PFKFB3,PFKFB4,HIF-1α mRNA relative expression was detected by real-time quantitative polymerase chain reaction. The relationship between PFKFB3,PFKFB4,HIF-1α and clinical pathological data and survival prognosis were analysed. Results The positive rate (exactly number?) of PFKFB3,PFKFB4 and HIF-1α protein expression in gastric carcinoma was significantly higher than that in the adjacent tissues (P<0.05).The expression level of PFKFB3,PFKFB4 and HIF-1α protein was (2.09±0.17),(2.33±0.21),(2.16±0.18),was significantly higher than that in adjacent tissues(1.03±0.11),(1.47±0.14),(1.10±0.12)(P<0.05).The expression level of PFKFB3,PFKFB4 and HIF-1α mRNA was (1.21±0.17),(1.41±0.18),(1.32±0.15),was significantly higher than that in adjacent tissues(0.55±0.5),(0.63±0.08),(0.51±0.04)(P<0.05).Tumor diameter³4cm,poorly differentiated gastric cancer,Ⅲ~Ⅳ stage gastric cancer patients PFKFB3,PFKFB4,HIF-1 expression was significantly increased (P<0.05).The cumulative 3 year survival rate of PFKFB3,PFKFB4 and HIF-1α negative group was significantly higher in gastric carcinoma than that in PFKFB3,PFKFB4 and HIF-1α positive group (P<0.05).Conclusion The expression level of PFKFB3,PFKFB4 and HIF-1 are highly expressed in gastric carcinoma,and the expression level was related to tumor size,clinical stage and differentiation degree,three of them can be used as predictors for the prognosis of gastric cancer.
Gastric carcinoma Hypoxia inducible factor 1α Controlled gene Pathology Prognosis
R735.2 R446.8
A
1671-2587(2017)03-0265-07
2016-12-15)
(本文编辑:王虹)
10.3969/j.issn.1671-2587.2017.03.016
431700 湖北省天门市第一人民医院检验科
郭飞波(1980–),男,湖北天门人,主管技师,主要从事病毒免疫与分子病毒学工作,(Tel)13117118657(E-mail)guofeibo1980@163.com。
