从层析荧光到微流控生物芯片
——现场快速检验(POCT)技术基础概述
2017-06-23单万水深圳市第三人民医院深圳518112
单万水 深圳市第三人民医院 (深圳 518112)
从层析荧光到微流控生物芯片
——现场快速检验(POCT)技术基础概述
单万水 深圳市第三人民医院 (深圳 518112)
文章对目前现场快速检验(Point-of-Care Testing,POCT)市场上的各种主流技术进行概述,集中讨论POCT市场占比最大的技术平台—免疫层析技术,根据其工作原理和制造过程,从基本的物理、化学原理出发讨论影响检测结果的主要因素,并从生产、应用层面探讨实现可靠检测的关键手段,进而针对目前精准医疗、个性化医疗的市场需求探讨POCT技术的发展方向和最新出现的技术平台—基于生物芯片的微流控技术,最后就POCT市场上的现有及未来技术平台进行综合分析。
现场快速检验(POCT) 免疫层析技术 微流控技术 生物芯片
现场快速检验(Point-of-Care Test,POCT)是体外诊断行业增长最快的领域。被广泛使用的血糖仪即为最成功的POCT产品,占有整个POCT市场60%以上的份额[1]。目前市场上最有代表性的两种便携式POCT技术是胶体金(或荧光)免疫层析技术和荧光免疫毛细技术。前一种以多家中国公司的产品为代表,后一种以美国Alere公司的Triage产品系列为代表。免疫层析技术起始于上世纪80年代初,而Triage产品的开发始于上世纪90年代,都已有了二三十年的历史[2]。近两年来,随着精准力医疗的大力推进,对精准诊断关键因素之一的医疗检测仪器的性能提出了全新的要求。在此大背景下,,生物芯片技术和微流控技术两大关键技术在医疗检测行业迅速发展。理邦m16磁敏免疫分析系统(生产单位:深圳市理邦精密仪器股份有限公司,简称理邦)是其中一个具有代表性的产品。它把微阵列生物芯片集成进了微流体器件里面。其生物芯片是一个多层纳米膜结构的微阵列、是通过大规模集成电路工艺制造的。相对于传统意义上以玻璃片为基底、以荧光材料为标记物的基因芯片,m16上的生物芯片是在单晶硅片上实现的、通过量子力学现象传感的技术。其微流控技术依赖于机械机构对被测样本和测试试剂实现精确控制。本文对层析荧光技术、毛细荧光技术和微流控生物芯片技术进行详细分析,对3个平台的技术特点进行讨论,并对它们的发展方向和应用进行探索。
1.免疫层析技术
1.1 技术原理
图1所示的是胶体金免疫层析测试卡的结构,由样品垫、胶体金结合垫、硝酸纤维素膜、吸水垫构成。其中,胶体金颗粒上修饰有检测抗体,硝酸纤维素膜上有检测线和控制线。检测时,被测样本在毛细作用下通过胶体金标记的抗体,形成抗原抗体胶体金复合物,复合物继续爬行,通过包被有捕捉抗体的检测线,形成双抗体夹心胶体金复合物,在检测线处呈现色带。过量的胶体金抗体流过检测线,在之后的控制线上形成胶体金免疫复合物,呈现色带。需要注意的是,控制线上色带的形成与被检测物质的存在与否无关,即使样本里没有被检测的物质,控制线也会显现。这种“捕捉抗体-抗原-检测抗体-胶体金纳米颗粒标记物”复合结构被称为双抗体夹心结构,胶体金为指示标记。最典型的产品是“早早孕”试纸条。
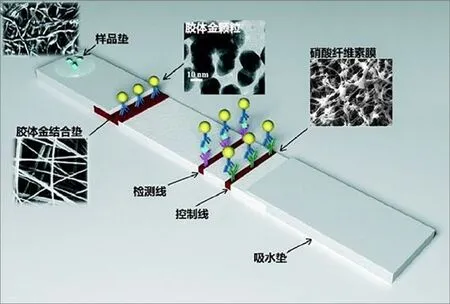
图1. 免疫层析技术原理
检测线上的信号强度也即测试结果可以由公式(1)计算[3]:
公式(1):R∝kt2[Ab][Ag]
其中k是一个和抗体-抗原之间亲和力有关的常数,t是样本在反应区的驻留时间,Ab是检测线上捕捉抗体的浓度,Ag是被测样本中被测物质的浓度。
常数k也和反应条件如pH值、温度等有关系。从化学反应的角度来看,温度从25˚C降低到15˚C,反应速度降低50%。抗体抗原反应的最佳温度是37˚C,一般1~2h就可以达到峰值。如果在4˚C反应,达到峰值时间会长达12~24h。所以检测过程应该尽量保持在同一个温度下进行,否则室内温度的变化会带来很大的影响。
当样本体积一定时,样本在反应区的驻留时间t和流速成反比。流速增加一倍,信号值就降低75%。样本的流动速度可以由公式(2)计算[4]:
公式(2):v(x) = κΔp/(μϕx)
其中κ是所用材料(这里主要指硝酸纤维素膜)的渗透率,Δp是和毛细作用有关的拉普拉斯压力,μ是样本黏度,ϕ是材料的孔隙度,x是位置。样本的黏度μ是影响检测物流速的重要参数。黏度越大,流速越慢,被测物质就有更多的时间和捕捉抗体进行反应,结果就更明显。换言之,即使不同的样本中被测物质浓度相同,但是结果会和样本的黏稠度有关系,测试结果可能有很大不同。
公式(2)中另一个重要参数是x,也就是检测线的位置。x值越小,检测线离样品垫越近,流速也就越大,这样反应上的被测物质就越少。由此可见,检测线的位置是一个非常重要的设计参数,制造过程中需要严格的控制。值得注意的是,检测线的位置是相对于样品垫和胶体金结合垫来讲的,所以除了需要精密控制检测线在硝酸纤维素膜上的位置,对样品垫和胶体金结合垫尺寸和位置的控制同样重要。
如果样本量发生变化,则公式(1)中的驻留时间t也会发生变化。尤其是当样本量太少时,样本很快的流出反应区,被测物质没有足够的时间和捕捉抗体进行反应、结合,导致测试结果低于正常期望值。当样本量过多时,吸水垫可以起到一定的调节作用,饱和以后可以有效阻挡样本的继续流动。但是,驻留在检测线上没有流走的被检测物还会继续和捕捉抗体反应,直到结合过程和分解过程达到一个平衡。但是,这个平衡是和其他条件如温度有关系的。在这种情况下,严格的控制检测时间和环境温度就变得非常重要。
1.2 材料和制造过程对检测性能的影响
图1所示的免疫层析器件看似非常简单,但实际上却是一个非常复杂的结构,影响其检测结果稳定性和重复性的因素众多,这也是多年来此项技术只用在定性判定上的原因。技术储备雄厚的公司已经有了定量检测产品,但是批间差、卡间差仍是一个大的挑战。如果用S表示检测结果信号强度,S可以用表达式(3)描述:
表达式(3):S = f [Y(样品垫),J(胶体金垫),Jj(胶体金颗粒),X(硝酸纤维素膜),Ab(抗体),M(制造过程)]
即最后的信号强度受样品垫、胶体金垫、胶体金颗粒、硝酸纤维素膜、抗体、以及制造过程的影响。而以上列举的每一项变量又受多个因素的影响。举例来讲,影响样品垫特性的因素可以由表达式(4)描述:
表达式(4):Y(样品垫)= fy(材料,蛋白质,缓冲剂,洗涤液,表面活性剂,黏度调节剂,制造过程)
表达式(4)中的材料可以是纤维素膜,也可以是网状织物,但它们有很大差别。举例来讲,网状织物可以较薄、机械强度较好、耐拉、存留体积(可保留液体体积)小,但是确难以在上面加足够量的化学试剂来调节样本中的蛋白成分、pH值、离子强度、黏稠度等,也就是说表达式(4)右侧中的第2、3、4、5、6项的调节就比较困难。纤维素滤膜的特点和网状织物几乎完全相反:较厚、存留体积大、强度小、很难操作。因为存留体积大,所以有足够的空间来在上面修饰各种化学试剂。组装对纤维素滤膜是一个关键的因素,必须确保和胶体金颗粒垫有良好、一致的接触,否则会严重影响被测样本向前流动,这就是表达式(4)右侧第七项(制造过程)所涉及的内容。
表达式(4)中的第二项(蛋白质)的主要作用是封闭样品垫、防止样本中的被测物质因为非特异吸附力而被吸附在样品垫上、不能被检测线检测。另外,如果样品垫上封闭蛋白的量和配比合适的话,硝酸纤维素膜就可以不必再封闭,使成本和操作复杂性大大降低。同一个测试卡产品可能被用来测试多种不同的样本,例如血清、血浆、全血、甚至尿液,缓冲液可以被用来调节样本的pH值,在一定程度上使不同样本中的同种被测物质在检测线上的反应性保持一致。举例来讲,尿液的pH值可以在5~10的大范围内变化,同样浓度的被测物质在不同的pH值环境下的反应性会有很大不同,缓冲试剂可以比较有效的降低这种变化。
表达式(4)中右侧第六项(黏度调节剂)的作用非常重要。由公式(2)可知,样本的黏度对样本流动的速度有直接影响,而由表达式(1)又可以看出样本流动的速度对检测结果的影响又进一步放大。所以,控制样本的黏度非常关键。黏度调节剂的作用是调节不同样本的黏度,使它们在硝酸纤维素膜上流动的速度尽可能相同。
硝酸纤维素膜是使用者可以观察到的另一个部件,也是免疫层析器件上最重要的一个部分。影响它性能的因素可以由表达式(5)描述:
表达式(5):X(硝酸纤维素膜)= fx(最大孔隙尺寸,孔隙尺寸分布,孔隙占比,封闭剂,缓冲液,表面活性剂)
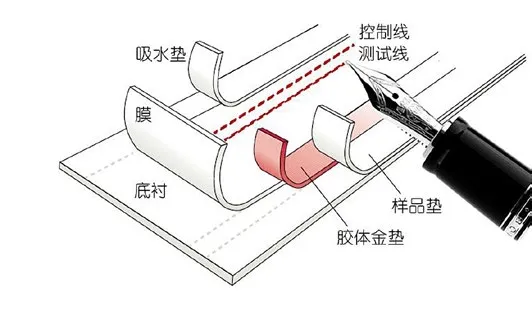
图2. 免疫层析产品的制造过程
硝酸纤维素膜最重要的性能参数是试剂在其中的流速,这主要由表达式(5)中右侧的前3项决定。在最大孔隙尺寸以及孔隙尺寸分布相同的前提下,流速和孔隙占比大约成正比关系。这里面最大的挑战是用宏观的过程控制微观的关键参数。硝酸纤维素膜一般是成卷生产的,卷的宽度是几十厘米,每一卷材的长度是100m。生产过程需要把这样大面积的原材料切割成大约为4mm×40mm的测试条的尺寸,同时保证每个条之间的一致性。此外,测试条边沿需要保持直线形状、测试条表面不能被接触或污染。这样一个生产过程所造成的结果是,同一大张“纸”上切割出来的测试卡的一致性会比较好,但是,控制批间差就要困难很多。
1.3 质量控制
图2所示是免疫层析产品的生产过程。首先在大张层析膜上喷画控制线和检测线,然后把此大张层析膜粘贴在支撑底衬上。这个过程必须要确保底衬和膜的接触紧密、均匀一直,否则将会导致不同测试条(卡)之间的液体流动速度和方式有很大的不同。下一步是粘贴胶体金垫、样品垫和吸水垫。吸水垫和胶体金垫各自和硝酸纤维膜有部分交叠,样品垫覆盖了胶体金垫的一部分。这里面最需要注意的是各层之间的交叠、接触需要密切、均匀,不能在任何膜层表面引入物理变形、污染物、或者化学杂质。很多和液体流动均匀性有关的问题都和以上这几个过程有关。最后一步是在温度和湿度都受控的房间里,把上面制作的大张材料切割成一条条的试纸条,组装入塑料壳。
从上面的制造过程可以看出,同一大张材料上切割出来的测试卡的一致性会比较好,因为是在同一个时间、同一个环境条件、用同一片材料、同一次制作过程完成的。比较难以控制的是不同批次间的差别。所以质量控制也应该主要关注批间差。
建议质量控制流程如下:
(1)保留最少18个质量有保证的测试卡。
(2)准备最少两个浓度的样本,一个是在cut-off值附近,另一个是中值。
(3)如果有检测全血、血清、血浆等不同样本的需求,则需要按照2来准备不同的样本。
(4)每个浓度点测试3个卡,计算平均值。(5)如果平均值相差超过10%,则新批次测试卡不合格。
(6)如果使用温度和室温(25˚C)相差较大,则需要和室温结果比对。
以上第二项考虑的是,如果测试卡存在问题,那问题在cut-off值附近会被放大。第三项的考虑是不同的样本黏稠度不同,对胶体金垫上颗粒的稀释能力会不同,在硝酸纤维膜里的流动速度会有差别。而从前面的讨论我们知道,样本在膜中的流动速度是对测试结果影响最大的因素之一。第四点、第五点考虑的原因是,免疫检测不可能100%完全重复,需要平均并给与一定的误差量。
值得一提的是,胶体金免疫层析、荧光免疫层析、上转发光免疫层析这三种产品都是建立在“层析”这个技术平台上,所以以上的讨论对三种技术均适用。但是,荧光的使用使检测灵敏度得到了一定程度的提升。荧光免疫层析的一个很大的问题是散射的入射光对检测信号的干扰,而使用上转发光可以有效地消除这个问题。
2.微流体技术
从上述讨论可知,层析检测技术里面最少有4种薄膜、两种抗体、抗体修饰的胶体金颗粒、缓冲液、封闭液等。制造过程最难把控的因素来源于:①把各种生化试剂载入相应的材料中并进行干燥;②把各种材料完美、重复的组装在一起。任何存在于各层材料之间的界面缺陷和界面不重复性都会直接导致检测结果的重复性变差甚至失败。解决这些问题的一种办法就是摈弃层析这个平台。美国Alere公司旗下的Triage产品系列就是采取了这样一种方略。
图3所示是美国Alere公司旗下的Triage产品系列的测试卡结构,其中没有任何的薄膜材料。它有上下两层材料组成,两层材料之间的距离是可以产生毛细现象的距离。上层为高度透明材料,目的是可以使在两层材料之间产生的荧光信号不受干扰地传播到透明材料另一侧的荧光检测器件上。底层表面的地貌随需求变化而不同,而最突出的特征就是“搓衣板”地貌。这样一个“搓衣板”地貌可以有效的增加表面积、增加抗体固定量及固定强度。在测试区域的表面上修饰的主要是捕捉抗体和封闭试剂,在样本准备区域的不同部位上修饰有荧光标记物、检测抗体、缓冲试剂、封闭试剂等。样本进入测试卡以后,其中液体溶解各种生化试剂,毛细作用推动试剂向检测区流动。
把一根细细的玻璃管的一端垂直放进一个水盘子里,水在玻璃管里面就会因毛细作用而上升,上升的高度可以由Jurin定律来计算[4]:

其中γ是液体-空气表面张力,θ是液体和玻璃管表面的接触角度,ρ是液体密度,g是万有引力常数,r是玻璃管的直径。由上面的公式可以看出,毛细作用的大小和管子的直径成反比关系,直径越大,毛细现象越小。这一现象被Biosite用来调节试剂在测试卡里的流动速度。图三b的右侧结构中有一凹槽,这一凹槽被用来较长时间地滞留样本,使样本有足够的时间和荧光标记物、检测抗体、缓冲试剂等充分的混合反应。滞留时间可以由凹槽的深度来调节。
其他3个参数γ,θ,ρ均和样本有关,并且和温度有关。在20 ˚C的条件下,水的γ = 0.0728 N/m,ρ = 1000 kg/m3,这些数据可以粗略用来近似偏水性的样本,但是对于油脂含量比较高的黏稠样本,γ,θ,ρ的数值会有所不同,导致试剂流动速度不同,因而测试结果不同。

图3. Biosite微流体测试卡结构
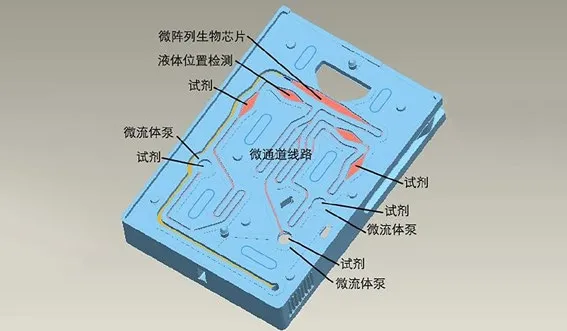
图3. 理邦m16微流控测试卡结构
上述问题的主要原因是,毛细现象是一种自然界发生的被动现象,会随着环境条件及液体特性而发生变化。要想解决这个问题,就必须对微流体进行控制。理邦的m16磁敏免疫检测平台采用的就是这个理念。图3所示是理邦m16产品系列微流控测试卡流体线路图。在这里称之为微流“控”而非微流“体”是因为它对微流体的流动实现了控制的功能。在这个微流控结构里共有三个线性微流体泵,分别对三种试剂进行控制。根据理邦提供的数据,驱动装置是由步进电机构成,每1 mm的驱动距离可以分为25000步,也就是说,每一步的驱动位移是40 nm。微流体泵体的直径大约是3 mm。换算成体积,步进电机每走一步所移动的试剂体积是0.0028μL,实现了精确控制。因为是微流体泵控制的流动,也因此避免了因样本组分或黏稠度不同而导致流速不同、测试结果不同的问题。另外,因为速度是可以调节的,所以可以针对不同的检测项目(心肌标志物、炎症、传染病)进行优化,以达到最佳检测结果。
在前面所描述的层析和毛细微流体平台中,样本中的液体作为溶剂把各种生化材料溶解在一起流到反应区域。在检测区和背景区域结合上的非特异信号物是靠最后残留的多余样本进行清洗,没有专用清洗液体。在这两个方面,m16平台采取了完全不同的方案。为了避免各种试剂之间的相互干扰或交叉反应,m16微流控测试卡采用了3个微流体泵,对不同的试剂依次分别注入反应。在注入不同的试剂之前,微流体泵驱动的清洗液对反应空间进行彻底清洗,有效的消除非特异吸附。m16的另一个独特之处是微流体泵不仅可以控制试剂和样本的流动速度,而且可以控制其流动方向。反应试剂可以前后来回震荡,增加反应结合律也即检测灵敏度,清洗试剂可以通过来回震荡来达到彻底清洗的目的。
3.生物芯片
生物芯片这个用语最早出现在基因检测领域,由美国Affymetrix公司首先使用。图4是该公司在2003年为罗氏生产的检测CYP450基因的生物芯片,用于个性化用药。它是以单晶硅为衬底,通过多层掩膜版的制造过程,在几十万个20 µm2的检测区上合成出不同的基因片段。因为使用了单晶硅硅片,采用了半导体行业常用的掩膜版光刻技术,最后产品外观和半导体芯片非常类似,故被称为生物“芯片”。类似技术已经在基因检测领域大规模使用,但是在免疫检测领域还没有产品出现。

图4. 美国Affymetrix公司的CYP450基因生物芯片
理邦的m16磁敏免疫分析仪采用了通过多层纳米膜淀积、多层掩膜板光刻等大规模集成电路工艺制造的生物芯片技术。图5是其示意图,其中每一个彩色正方形下面是一个由多条亚微米宽的巨磁阻(giant magnetoresistance,GMR)器件构成的检测区,每个检测区上修饰有不同的捕捉分子,用来检测不同的标志物。此示意图中共有12个检测区,可以检测12种不同的生物分子。和Affymetrix芯片最大的不同是,m16生物芯片不仅仅是捕获被测物质的载体,它还探测被测物质生成的信号。信号通过导线传输到仪器上,然后转换成用户可以使用的信息。Affymetrix的芯片只是捕获被测基因的载体,其上产生的荧光信号要通过一个荧光扫描设备来读取。
m16生物芯片的工作原理如图6所示。首先通过大规模集成电路工艺在硅片上生产GMR微阵列芯片。GMR芯片有极高的灵敏度、可以检测到单个纳米磁颗粒[6]。硅片切割成单个芯片以后,首先在上面修饰上捕捉抗体。当样本被加到芯片上以后,其中的被测分子和捕捉分子发生反应、结合。然后加入修饰有检测抗体的纳米磁颗粒,检测抗体和被测分子结合,形成图6所示的复合结构。纳米磁颗粒作为标记物被GMR器件检测。在样本中被测分子含量很低、也即需要高灵敏度的情况下,一个磁颗粒下面只会有一个被测分子。因为GMR器件可以检测到单个纳米磁颗粒,所以这样一个结构就具有了检测单个生物分子的超高灵敏度。
m16磁敏生物芯片是微阵列芯片,其上有多个检测区域,可以同时检测多种物质。比如,肝功4项、心肌标志物五项、呼吸道感染9项、肿瘤12项等,可以用单个微量样本在同一个微流体测试卡上得到结果。更重要的是,部分检测区可以被用来进行实时监测、校准,提高检测结果的可靠性和一致性。在公式2的讨论中我们提到,抗体抗原的最佳反应温度是37˚C,偏离此温度会使反应速度降低、检测结果变弱。在理邦m36的芯片上,有两个温度偏差校准区和一个反应过程校准区,可以实时校准此项因素。这项技术的另一个直接结果是,测试卡从低温储藏室取出后可以马上进行测试、不需要恢复到室温,这对急性心梗等需要快速结果的应用非常有利。试剂批次校准区可以校准运输、储存、试剂批间差等因素。另外根据需要,还可以在芯片上设计假阳性、假阴性校准,使检测结果的准确性和可靠性有巨大改进。

图5. 理邦的m16磁敏生物生物芯片示意图

图6. 理邦m16磁敏生物芯片检测原理

图7. 理邦m36磁敏生物芯片应用方案一例
4.免疫层析技术面临的问题及解决方向
随着精准医疗、个性化医疗的迅速发展,检测技术也在两个方面面临着挑战:第一是重复性,第二是灵敏度。对免疫层析技术来讲,测试条之间的重复性问题是最大的挑战,而重复性差的原因很大一部分是因为需要把多种纤薄、脆弱的材料粘贴在一起、同时保证其中液体流动的一致性。为解决这个问题,一些公司在开发新的材料和结构。Whatman公司的Fusion 5单一薄膜代替了样品垫、胶体金垫、硝酸纤维素膜和吸水垫[7]。Fusion 5是一种大孔隙材料,液体在其中的流动速度很快,但是和蛋白质没有亲和性。同时,常规层析免疫产品使用的多次浸润、干燥过程也不再适用,所以,需要一个完全不同的制造过程。目前市场上使用Fusion 5的产品并不多见。
解决以上所述重复性差的另一个思路是彻底摈弃层析膜以及其他薄膜,采用微流体结构。但是,微流体器件的研发需要机械、流体力学、化学、生物、精加工等尖端技术领域的密切合作,研发时间长,投入大。所以,除了美国Alere公司的Biosite产品系列,还没有其他有影响力的产品出现在市场上。另外,从化学反应的角度出发,化学反应的结果受反应试剂量、反应温度、反应时间等因素影响,免疫反应也不例外。所以,对微流体的精确控制是进一步改进重复性的关键。理邦m16产品实现了对流体的控制。“微”流体的“微”字意味着产品的原材料以及生产过程需要严密控制。理邦通过精密注塑来生产合乎要求的零部件。组装线采用自动化机械手进行组装,可以实现不大于几十微米的组装公差。
美国海军实验室的Baselt博士于1997年提出利用磁阻器件和磁标记物进行生物分子检测的概念[8]。因为发现了更加灵敏的GMR现象,法国科学家Albert Fert和德国科学家Peter Grünberg获得了2007年的诺贝尔物理学奖。目前用于磁敏生物传感器的主要为GMR器件。认识到GMR微阵列芯片在灵敏度上的巨大潜力,除了美国海军实验室外,美国NVE公司,美国斯坦福大学、德国比勒非尔德大学、葡萄牙里斯本大学等29个公司、大学、研究院都在进行磁敏免疫检测技术和产品的研究[9-12]。在国内,进行此研究的有中国科学院电工研究所、清华大学、上海交大、电子科技大学等,但是这些单位到目前为止还没有能够使GMR技术产品化,这里面最主要的挑战是GMR器件和微流体器件的集成[13]。理邦m16磁敏免疫分析仪是近20年来首个出现在体外诊断领域的全新技术平台,在灵敏度、重复性、多项目检测能力等方面有明显的技术优势。
5.小结
在将来的POCT市场上,免疫层析技术仍将会发挥很大的作用,然而不论是从基本的原理上亦或是从制造过程来看,免疫层析技术的内在缺陷也不可忽视,难以满足精准医疗对检测精度的需求。为了应对这些挑战,一个研发方向是把几种薄膜材料进行无缝集成、免去多个不同而且难以控制的组装过程;另一个方向是对制造过程更精密的控制,把批次生产模式改成高度自动的流水线型生产模式。微流控技术可以精确控制生化反应过程(包括温度、时间、速度、剂量),以达到精准检测的目的。微阵列生物芯片技术可以使多项目联检成本显著降低,同时阵列内的各种实时校准单元可以使测试准确性和重复性大大提高。
[1] Kalorama Information, The WorldWide Market for IVD Tests, 9th Edition, 2014.
[2] PLOTZ CM, SINGER JM. The latex fxation test. I. Application to the serologic diagnosis of rheumatoid arthritis[J]. Am J Med, 1956,21(6):888-892.
[3] Millipore C. Rapid Lateral Flow Test Strips-Considerations for Product Development[M]. Millipore Technical Publications, 2008.
[4] Berli CLA, Kler PA . A Quantitative Model for Lateral Flow Assays[J]. Microfuidics and Nanofuidics, 2016,20(7):1-9.
[5] G. K. Batchelor, 'An Introduction To Fluid Dynamics', Cambridge University Press (1967) ISBN 0-521-66396-2.
[6] Li G, Joshi V, White RL, et al. Detection of single micron-sized magnetic bead and magnetic nanoparticles using spin valve sensors for biological applications [J]. Journal of Applied Physics, 2003,93(10):7557-7559.
[7] www.whatman.com (Fusion 5).
[8] 美国专利US 5981297.
[9] www.nve.com.
[10] www.magarray.com.
[11] Osterfeld SJ, Yu H, Gaster RS, et al. Multiplex protein assays based on real-time magnetic nanotag sensing[J]. PNAS, 2009,105(52):20637-20640.
[12] Cardoso FA, Germano J, Ferreira R, et al. Detection of 130 nm magnetic particles by a portable electronic platform using spin valve and magnetic tunnel junction sensors[J]. Journal of Applied Physics, 2008,103(7):455.
[13] Chen L, Bao CC, Yang H, et al. A prototype of giant magnetoimpedance-based biosensing system for targeted detection of gastric cancer cells[J]. Biosens Bioelectron, 2011,26(7):3246-3253.
From Lateral Flow Immunoassay to Microfuidic Biochip——An Overview of Key POCT Technologies
SHAN Wan-shui The Third People’s Hospital of Shenzhen (Shenzhen 518112)
The mainstream point-of-care test (POCT) technologies are reviewed. The lateral fow immunoassay (LFIA) technology which has the largest market share is discussed. The key factors in LFIA’s manufacturing processes and application affecting the test results are investigated based on the physical and chemical principles governing its operation. The means to improve the manufacturing process and precautions in handling the LFIA to ensure reliable test results is explored. Two key technologies, the microfuidic device and microarray biosensor which are being adopted by new POCT assays to meet the needs for precision medicine and personalized medicine, are examined.
POCT, lateral fow immunoassay, microfuidics, biochip
1006-6586(2017)07-0045-08
O657
A
2017-02-18
单万水,教授,主任技师。广东省临床重点专科检验科主任,深圳市第三人民医院院士工作站主任,深圳市医学会检验专委会副主任委员,深圳市医师协会检验分会副会长。
