递增负荷跑台运动大鼠心肌一氧化氮/一氧化氮合酶的增龄变化
2017-06-23丁海丽谢凤香杨澎湃张英杰
丁海丽 谢凤香 杨澎湃 张英杰
(北京体育大学运动人体科学学院,北京 100084)
递增负荷跑台运动大鼠心肌一氧化氮/一氧化氮合酶的增龄变化
丁海丽1谢凤香2杨澎湃1张英杰1
(北京体育大学运动人体科学学院,北京 100084)
目的 探讨递增负荷跑台运动大鼠心肌一氧化氮(NO)及一氧化氮合酶(NOS)的增龄变化特征。方法 54只不同周龄健康大鼠分为3周龄、6周龄和52周龄组,每组又各分为安静对照组、匀速运动组和递增负荷运动组。递增负荷运动模型参考Bedford的跑台递增负荷模型进行。8 w后测定每组大鼠心肌NO含量、结构型NOS(cNOS)和诱导型NOS(iNOS)的活性。结果 匀速运动组与递增负荷运动组NO均较安静对照组明显增加(P<0.01),且递增负荷运动组明显高于匀速运动组(P<0.05);递增负荷运动组cNOS 较匀速运动组与安静对照组明显增加(P<0.01或P<0.05);匀速运动组与递增免负荷运动组NO、cNOS均较安静对照组明显增加(P<0.01),且递增负荷运动组明显高于匀速运动组(P<0.01);匀速运动组与递增负荷运动组NO均较安静对照组明显增加(P<0.01);匀速运动组与递增负荷运动组cNOS均较安静对照组明显增加(P<0.01或P<0.05),且递增负荷运动组明显高于匀速运动组(P<0.01)。结论 递增负荷运动和匀速运动均可以提高大鼠心肌NO含量及cNOS活性,对iNOS作用不明显。年轻大鼠中,递增负荷运动对NO、cNOS的调节作用均优于匀速运动;老年大鼠中,递增负荷运动对cNOS的调节作用优于匀速运动。
递增负荷运动;一氧化氮;一氧化氮合酶
一氧化氮(NO)和一氧化氮合酶(NOS)在调节心功能中发挥重要作用〔1,2〕,研究证实〔3~5〕,运动训练可以平衡心血管系统NO、NOS的含量,表现出很强的运动适应性,这与运动负荷、运动强度、训练水平等均有一定关系。本实验观察递增负荷跑台运动后不同周龄大鼠NO、NOS的变化情况,并与匀速跑台运动进行比较,探讨其可能作用机制。
1 材料与方法
1.1 实验动物与分组 54只不同周龄健康雄性SD大鼠,根据开始跑台训练的周龄不同,分为3周龄、6周龄和52周龄组,每组又各分为安静对照组、匀速运动组和递增负荷运动组,每组6只。实验动物由四川大学华西医学院动物研究中心提供。大鼠自购回后在标准啮齿目动物饲养笼分笼喂养,每笼3~5只,自由饮水进食。进食保证通风条件良好,室温控制在20℃~25℃,相对湿度40%~60%,自然光照。
1.2 运动方案 运动方式采用跑台运动,运动负荷参考Bedford的跑台递增负荷模型进行,在其运动模型基础上有所改动,运动负荷强度有所下降,保持一个递增负荷的运动,对大鼠进行递增负荷运动的刺激,但不达到力竭。在正式运动之前,首先进行3 d适应性跑台训练,跑台坡度为5%,第1天跑速为6 m/min,第2天跑速为10 m/min,第3天跑速为12 m/min,每次20 min。正式训练后,递增负荷运动组大鼠每周训练5 d,每天1次,起始跑台速度为8 m/min,跑台坡度为5%,时间为5 min,5 min后,速度调整为10 m/min,以此类推,每间隔5 min速度递增2 m,直至速度增加为20 m/min。匀速运动组:每周训练5 d,每天一次,速度始终保持在12 m/min。按照此运动方案使大鼠运动过程持续8 w。安静对照组:正常笼内饲养,饲养条件与两个运动组相同,不运动。小动物跑台(杭州立泰)为 DSPT202 型。
1.3 取材 大鼠末次跑台训练结束,称重后用3%戊巴比妥钠麻醉处死,迅速解剖大鼠,取左心室,在冰生理盐水中浸泡,洗去残血,滤纸吸干水分,用生理盐水制成10%匀浆,室温放置30 min,低温离心(4 000 r/min,10 min),取上清液备用。所有标本置于-20℃冰箱保存待测。
1.4 指标测试与方法 NO检测采用硝酸还原酶法,NOS检测采用比色法,所有测定均按试剂盒说明进行。
1.5 统计学方法 采用SPSS17.0软件行双因素方差分析。
2 结 果
2.1 各组大鼠心肌NO含量比较 3周龄大鼠中,递增负荷运动与匀速运动组NO含量均较安静对照组明显增加(P<0.01);且递增负荷运动组明显高于匀速运动组(P<0.05)。6周龄大鼠中,递增负荷运动与匀速运动组均较安静对照组明显增加(P<0.01);且递增负荷运动组明显高于匀速运动组(P<0.05)。52周龄大鼠中,递增负荷运动与匀速运动组心肌NO含量均较安静对照组明显增加(P<0.05)。安静和匀速运动时,各周龄大鼠无明显变化;递增负荷运动时,3周龄大鼠和6周龄大鼠明显高于52周龄大鼠(P<0.05)。见表1。
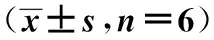
表1 各组大鼠心肌NO含量比较
与同龄安静对照组比较:1)P<0.01,2)P<0.05;与同龄匀速运动比较:3)P<0.05,4)P<0.01;与同运动方式52周龄比较:5)P<0.05,6)P<0.01,表2同
2.2 各组大鼠心肌cNOS活性比较 3周龄大鼠中,递增负荷运动组明显高于安静对照组(P<0.01),递增负荷运动组明显高于匀速运动组(P<0.05)。6周龄大鼠中,递增负荷运动组与匀速运动组均较安静对照组明显增加(P<0.01);且递增负荷运动组明显高于匀速运动。52周龄大鼠中,递增负荷运动组明显高于匀速运动组和安静对照组(P<0.05,P<0.01),匀速运动组明显高于安静对照组(P<0.05,P<0.01)。安静和匀速运动时,各周龄大鼠无明显变化;递增负荷运动时,3周龄和6周龄明显低于52周龄。见表2。
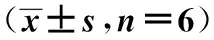
表2 各组大鼠心肌cNOS活性比较
2.3 各组大鼠心肌iNOS活性的水平 相同运动时,52周龄大鼠心肌iNOS活性明显高于6周龄及3周龄(P<0.01);而相同周龄大鼠中,匀速运动和递增负荷运动较安静时无明显变化(P>0.05)。见表3。
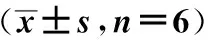
表3 各组大鼠心肌iNOS活性水平比较
与同运动方式52周龄比较:1)P<0.01
3 讨 论
NO是一种强有力的内源性舒血管因子,具有舒张血管,降低血压,抑制血管平滑肌细胞增殖和血小板黏附等生理作用,搏动性血流和血管剪切应力是调节NO释放的两个决定性因素〔2,6〕。研究证实〔7,8〕,运动可以上调大鼠心肌NO含量。本实验提示递增负荷运动对年轻大鼠效果更佳。其原因可能为:大鼠经过6 w的递增负荷跑台运动后,心血管系统发生了适应性的变化,且运动时,血流重新分配,血管剪切应力增加,从而使心血管内皮细胞和其他细胞产生NO〔9〕。有文献报道〔10~14〕,运动引起NO分泌增加的机制可能与运动引起血管内皮细胞NOS的激活或NOS mRNA表达上调有关;短时间运动导致NO浓度增加,认为是运动时产生的血管内切应力增加提高NOS活性;长时间持久性运动则通过NOS mRNA表达上调增加血管内皮和骨骼肌NOS含量使NO浓度增加。
iNOS最早从鼠类巨噬细胞中分离纯化出来,其诱导调节主要发生在转录水平,一般在生理状态下,机体iNOS的表达水平较低或缺乏。研究表明〔15〕,iNOS在力竭运动、大负荷运动后、持续低氧训练后被过度激活,可能是由于此几类运动后,血液中白细胞介素-1、干扰素-γ、肿瘤坏死因子等炎性细胞因子大量合成和释放,这些细胞因子可以促进心肌、血清中iNOS基因的转录和表达。
本研究发现递增负荷运动和匀速运动均可以提高大鼠心肌NO含量及cNOS活性,对iNOS作用不明显。从整体情况看,年轻大鼠中,递增负荷运动对NO、cNOS的调节作用均优于匀速运动;老年大鼠中,递增负荷运动对cNOS的调节作用优于匀速运动,而对NO的调节作用与匀速运动无差异。中青年人可采取递增负荷进行运动,但老年人应考虑多方面因素,根据自身功能状态选择适宜的递增负荷运动。
1 Tao H,Shi KH,Yang JJ.Epigenetic regulation of cardiac fibrosis〔J〕.Cell Signal,2013;25(9):1932-8.
2 钟慈声,孙安阳.一氧化氮的生物医学〔M〕.上海:上海医科大学出版社,1997:3-39.
3 杨 敏,泪 雯,毛 予,等.实验性自身免疫性心肌炎小鼠体内一氧化氮的变化〔J〕.心脏杂志,2014;26(6):641-5.
4 El Assar M,Angulo J,Rodríguez-Mannas L.Oxidative stress and vascular inflammation in aging〔J〕.Free Radic Biol Med,2013;65(7):380-401.
5 Kulandavelu S,Hare JM.Alterations in beta3-adren-ergic cardiac innervation and nitric oxide signaling in heart fail-ure〔J〕.J Am Coll Cardiol,2012;59(22):1988-90.
6 马厚勋,谢正祥.一氧化氮、一氧化氮合酶和心脏功能〔J〕.中国医学生物技术应用,2003;(2):18-27.
7 孙红梅.不同运动负荷对大鼠心肌超微结构及一氧化氮合酶的影响〔J〕.北京体育大学学报,2008;31(7):936-8.
8 陈 婷,呼德尓朝鲁,张 可,等.有氧运动对心梗大鼠左心室β3-AR和一氧化氮合酶表达的影响〔J〕.体育科学,2013;33(9):57-63.
9 夏 志,汪清祥,黄 涛,等.一氧化氮和一氧化氮合酶训练与运动〔J〕.首都体育学院学报,2009;21(1):83-6.
10 Shen W,Zhang X,Zhao G,etal.Nitrc oxide production and NO synthase gene expression contribute to vascular regulation during exercise〔J〕.Med Sci Sports Exerc,1995;27(8):1125-34.
11 Dun NJ,Dun SL,Wong RKS,etal.Colocalization of nitric oxide synthase and somatostatin immunoreactivity in rat dentatehilar neurons〔J〕.Proc Natl Acad Sci U S A,1994;91(8):2955-9.
12 金其贯,冯美云.运动与内皮细胞内皮素和一氧化氮分泌的研究进展〔J〕.中国运动医学杂志,2002;21(3):292-5.
13 杨小英,梁蓓蓓,黄志平,等.不同运动负荷大鼠主要器官各型 NOS 表达水平的研究〔J〕.现代预防医学,2011;381(3):2550-3.
14 Hecker M,Mulsch A,Bassenge E,etal.Subcellular localization and characterization of nitrc oxide synthase (s)in endothelial cell physiological impications〔J〕.Biochem J,1994;299(Pt 1):247-52.
15 张 靓,黄叔怀.不同运动负荷对大鼠 cNOS和 iNOS活性的影响及其机理探讨〔J〕.中国运动医学杂志,2002;21(1):23-6.
〔2016-07-24修回〕
(编辑 苑云杰/曹梦园)
国家体育总局运动医学重点实验室暨运动医学四川省重点实验室资助基金(No.2015CTYY007);四川省科技厅应用基础计划项目(No.2015JY0155);四川省教育厅资助项目(No.14ZB0260)
丁海丽(1983-),女,博士,主要从事运动性疲劳研究。
R493
A
1005-9202(2017)11-2636-03;
10.3969/j.issn.1005-9202.2017.11.015
1 成都体育学院运动医学与健康学院 2 河南护理职业学院
