黄土丘陵区植被恢复对土壤可溶性氮组分的影响
2017-06-22赵路红李昌珍任成杰韩新辉佟小刚冯永忠
赵路红,李昌珍,康 迪,任成杰,韩新辉,佟小刚,冯永忠,*
1 西北农林科技大学,林学院,杨凌 712100 2 陕西省循环农业工程技术研究中心,杨凌 712100 3 西北农林科技大学,农学院,杨凌 712100 4 西北农林科技大学,资源环境学院,杨凌 712100
黄土丘陵区植被恢复对土壤可溶性氮组分的影响
赵路红1,2,李昌珍2,3,康 迪1,2,任成杰2,3,韩新辉2,3,佟小刚4,冯永忠2,3,*
1 西北农林科技大学,林学院,杨凌 712100 2 陕西省循环农业工程技术研究中心,杨凌 712100 3 西北农林科技大学,农学院,杨凌 712100 4 西北农林科技大学,资源环境学院,杨凌 712100
为探究黄土丘陵地区人工植被恢复对土壤氮素养分累积与有效性的影响,研究分析了植被恢复15年刺槐、柠条、刺槐侧柏混交、刺槐山桃混交以及荒草地土壤可溶性氮组分含量及其垂直分布特征。结果表明,与耕地相比,植被恢复显著提高了0—30 cm土壤可溶性氮组分含量,这也使0—30 cm土壤可溶性氮组分密度显著增加,可溶性有机氮密度增幅表现为柠条(262.2%)>刺槐(232.8%)>刺槐山桃混交、刺槐侧柏混交(34.5%)>荒草地(-21.5%),硝态氮密度整体表现为柠条>刺槐>刺槐山桃混交>荒草地>刺槐侧柏混交,增幅为7.9%—182.8%,铵态氮密度以刺槐山桃混交增幅最大(110.3%),荒草地最小为2.6%。可溶性有机氮、硝态氮占全氮的比例以刺槐最高,分别提升了2.4倍和0.6倍,铵态氮占全氮的比例以刺槐山桃混交最高,提升了1.0倍。可溶性氮组分受微生物量碳氮的影响大于有机质和全氮,微生物量氮与可溶性氮组分的相关性优于微生物量碳,硝态氮对土壤有机质、全氮和微生物量碳氮的变化最为敏感。综上,植被恢复能够提高土壤可溶性氮组分含量、密度及其占全氮比例,增加土壤氮的有效性,以刺槐、柠条提升效果最好。
植被恢复;可溶性有机氮;硝态氮;铵态氮
氮是陆地生态系统中核心养分元素之一,与植物生命活动、作物产量及品质密切相关[1],在森林生态系统中也被视为主要的限制生长因子[2],且与森林群落演替、生产力、植物多样性等存在反馈关系[2- 3]。土壤中氮素主要以有机态的形式存在,其中能被盐溶液或者水浸提出来的部分称为可溶性氮,该组分与土壤氮素养分的供应有密切的联系[4]。土壤中的无机氮又称为有效氮,包括铵态氮和硝态氮等,也属于可溶性氮组分。它们数量虽少,但却是植被恢复与生长的主要氮素来源[5]。已有研究表明,土壤各氮组分含量和分布状况受土壤温度、水分、有机质等一系列理化性质的调控[6]。而土地利用方式的变化会影响土壤颗粒组成、水热状况以及微生物的活动[7- 8],进而引起氮素在土壤系统的再分配。
黄土丘陵区植被的破坏导致了严重的土壤侵蚀与其他生态问题,退耕还林是解决该区水土流失问题的重要措施。实施退耕还林后,由于下垫面条件的改变,必然导致土壤理化性质发生变化,彭文英等人研究结果表明,坡耕地退耕后,土壤容重、pH值减小,毛管孔隙度、饱和含水量增大,土壤有机质增加2.75倍,全氮含量增加46.8%[9]。所以土壤氮素含量也会随植被恢复发生改变,如韩新辉等人在黄土丘陵地区的试验结果表明,退耕还林措施能显著提高土壤全氮含量和氮密度[10- 11]。然而植被恢复对土壤可溶性氮组分的影响尚不清楚。土壤可溶性氮组分不仅关乎土壤养分的有效性,同时又因其高度的流动性关系到土壤深层氮素的固存,影响着整个生态系统的生产力与可持续性[12- 13]。因此探明不同植被恢复条件下,土壤各可溶性氮组分的分布规律及其与土壤中其它理化性质的相关性变得尤为重要,同时也能为指导黄土丘陵区植被恢复重建措施实施,认识和评价植被恢复优劣程度提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于陕西省国家退耕还林示范县安塞县境内(108°5′44″—109°26′18″E, 36°30′45″—37°19′31″N),属暖温带大陆性半干旱季风气候,年平均气温8.8℃,年平均降水量505.3 mm,干燥度1.48,年日照时数2395.6 h,无霜期158 d,年总辐射量552.6 kJ/cm2。地貌类型属典型黄土丘陵沟壑区,海拔1010—1400 m。土壤以黄土母质发育的黄绵土为主,约占总面积的95%。植被类型属于暖温带落叶阔叶林向干旱草原过渡的森林草原带,是我国西北典型的生态环境脆弱区。该地区实施退耕还林工程以来,种植有不同的乔木林、灌木林、乔木混交林、乔灌混交林及以苹果为主的经济林,经过多年人工植被恢复建设和水土保持综合治理等措施,起到了显著的生态恢复的效应。
1.2 样地选取与采样
2015年6月,于研究区选择退耕年限均为15a的刺槐(Robiniapseudoacacia;RP)、柠条(CaraganaKorshinskii;CK)、刺槐侧柏混交林(Robiniapseudoacacia,Platycladusorientalis;RP+PO)、刺槐山桃混交林(Robiniapseudoacacia,Prunusdavidiana;RP+PD)及撂荒地(Abandoned Farmland;AF),共5种植被恢复模式,同时以邻近坡耕地(Slop Farmland;SF)作为对照。采样时选择营造和管理方式一致,土壤与成土母质类型相同,坡向、坡度、坡位和海拔均相近的样地,各样地间直线距离不超过2 km,且均为坡耕地退耕而来(种植作物以荞麦、小麦、大豆等陕北黄土高原地区常见的粮食作物为主),其基本特征及林下植被见表1。每种模式选择3个样地,在每个样地内设置20 m×20 m的标准采样区,按照“S”型选取12个采样点,用土钻法取0—10,10—20,20—30 cm共3个层次的土样,同层土各采样点土样充分混合后作为该土层待测土样。土样仔细除去其中植物残体,置于布袋迅速带回实验室待用。同时,每个样地挖取剖面采用环刀法测定各土层容重,用于氮组分密度计算。所采土样一部分自然风干用于pH、有机质、全氮等理化性质的测定,一部分置于-20℃冷冻保存用于土壤微生物量氮、微生物量碳、铵态氮和硝态氮的测定。另外,在每个样地内随机设置12个1 m×1 m的小样方,收集各样方内地表凋落物带回实验室测定各样地的凋落物生物量(表2)。

表1 样地基本特征与土壤物理化学特性(0—30 cm)
CK: 柠条Caraganakorshinskii;RP: 刺槐Robiniapseudoacacia;RP+PO: 刺槐侧柏混交R.pseudoacaciaandPlatycladusorientalismixed forest;RP+PD: 刺槐山桃混交R.pseudoacaciaandPrunusdavidianamixed forest;AF: 荒草地abandoned farmland;SF: 耕地slope farmland;硬质早熟禾Poasphondylodes;白羊草Bothriochloaischaemum;狗尾草Setariaviridis;铁杆蒿Artemisiasacrorum;香青兰Dracocephalummoldavica;野菊花Dendranthemaindicum;蛇葡萄Ampelopsissinica;荞麦Fagopyrumesculentum;±为样本的标准误

表2 不同植被恢复模式凋落物生物量及凋落物C/N
土壤pH用无CO2水浸提后(水土1∶1)pH计法测定;凋落物生物量采用烘干称重法测定;土壤有机质、全氮分别采用重铬酸钾外加热法和凯氏定氮法测定;微生物量碳氮均采用氯仿熏蒸0.5 mol/L K2SO4浸提法;可溶性全氮用K2SO4浸提后用凯氏定氮仪测定;硝态氮、铵态氮用KCl浸提,流动分析仪测定;可溶性有机氮为可溶性全氮与无机氮的差值。
1.3 数据分析
土壤可溶性氮组分密度是指单位面积一定厚度的土层中可溶性氮组分的质量,可以指示土壤氮的储量。对不同土层土壤氮组分密度以公式计算:
Si=Ci×ρi×Di×100
(1)
式中,Si为第i层土壤可溶性氮组分密度(kg/hm2);Ci、ρi、Di分别为第i层土中对应可溶性氮组分氮含量(mg/kg)、土壤容重(g/cm3)、土层厚度(cm)。0—30 cm土层可溶性氮组分密度则为各层土壤氮组分密度之和。
数据处理采用Origin 7.5和SPSS 17.0软件,不同植被恢复样地及土层中有机质、全氮、微生物量氮、微生物量碳、可溶性有机氮、铵态氮、硝态氮含量和密度采用One-way ANOVA进行方差分析,差异显著(P<0.05)采用Duncan法进行检验。另外土壤可溶性氮组分与土壤理化性质及微生物量碳氮的关系采用相关分析和回归分析。
2 结果与分析
2.1 土壤全氮、有机质及微生物量碳氮的变化
表3显示植被恢复对0—30 cm土壤全氮含量有较大影响,不同样地间土壤全氮含量差异显著,其中以柠条最高,达到0.50 g/kg,刺槐山桃混交与耕地最低,平均为0.27 g/kg;刺槐侧柏混交、荒草地、刺槐3种植被恢复模式间无显著差异,平均为0.35 g/kg;与耕地相比土壤全氮含量均有不同程度的提高,增幅为16.0%—103.4%。另外土壤全氮含量随着土层加深而显著降低,其中0—10 cm土层全氮增加量最大,变化幅度为53.7%—135.5%,10—20 cm和20—30 cm土壤全氮增量无显著差异。土壤有机质含量整体表现为柠条(6.51 g/kg)>荒草地、刺槐侧柏混交(平均为5.65 g/kg)>刺槐山桃混交、刺槐(平均为4.31 g/kg)>耕地(3.59 g/kg),相比耕地,5种植被恢复模式均显著增加了土壤有机质含量,增幅为20.0%—81.5%,其中以柠条增幅最高,刺槐山桃混交、刺槐最低。另外,除耕地外,随着土层加深土壤有机质含量显著降低。
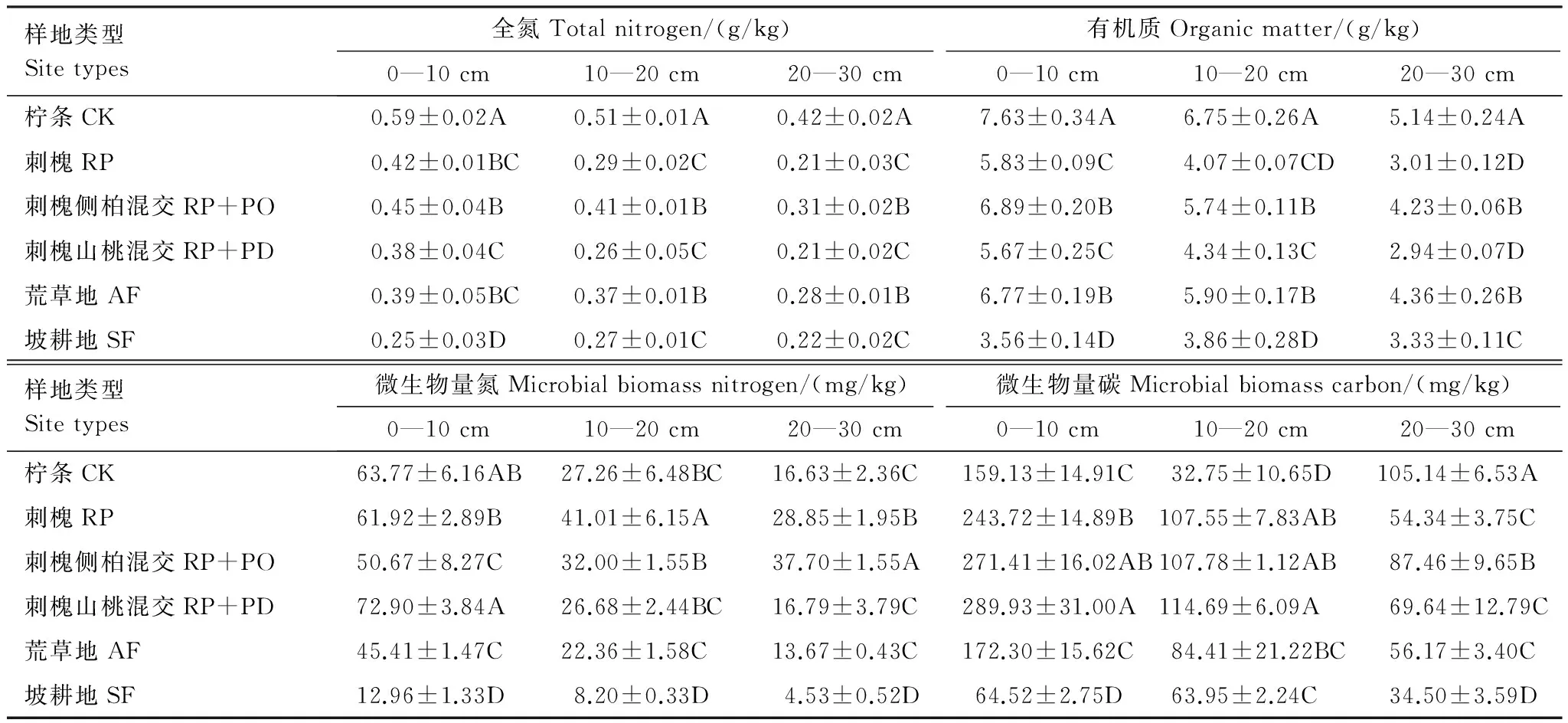
表3 不同植被恢复模式土壤有机质、全氮和微生物量碳氮变化特征
不同的大写字母表示同一土层不同样地在P<0.05水平差异显著;±为样本的标准误
由表3可知,植被恢复显著提高了0—30 cm土壤微生物量碳氮,但因植被类型的不同,提高程度也有所差异。其中微生物量氮含量整体表现为刺槐(43.92 mg/kg)>刺槐侧柏混交、刺槐山桃混交(平均为39.46 mg/kg) >柠条(35.89 mg/kg)>荒地(27.15 mg/kg)>耕地(8.56 mg/kg),相比耕地均显著增加,增幅为217.04%—412.89%;另外,各样地土壤微生物量氮含量均表现为随土层加深而显著降低。土壤微生物量碳含量整体介于54.32 mg/kg—158.08 mg/kg,相比耕地,增加幅度较微生物量氮小,整体约为微生物量氮增幅的0.5倍(82.25%—191.00%),其中以人工混交林(刺槐山桃混交与刺槐侧柏混交)增幅最高,平均为156.82%,而柠条林地土壤微生物量碳增加幅度最低仅为82.25%;除柠条外,均表现为随土层加深而显著降低。
2.2 土壤可溶性氮组分含量变化
不同植被恢复条件下,0—30 cm土壤可溶性有机氮含量有显著差异,但不同土层间可溶性有机氮含量差异不显著。与耕地相比,柠条、刺槐、刺槐山桃混交和刺槐侧柏混交林地土壤可溶性有机氮含量均显著增加,其增幅表现为柠条(256.7%)>刺槐(218.2%)>刺槐侧柏混交、刺槐山桃混交(平均为31.8%),而荒草地却减少了19.5%。可见,植被恢复能增加土壤氮素的可利用性,且固氮树种纯林优于固氮树种与非固氮树种混交林。
如图1所示,不同植被恢复模式间土壤硝态氮含量存在显著差异,与耕地相比均有不同程度的提高,0—10 cm土层硝态氮含量增量表现为柠条>刺槐>刺槐山桃混交>荒草地>刺槐侧柏混交,增幅在7.1%—251.5%;10—20 cm土层变化幅度相对小于0—10 cm土层,相比耕地以柠条最高,达到163.2%,其次为刺槐(52.6%),其余植被恢复模式与耕地硝态氮含量无显著差异。20—30 cm土层增幅最小,以柠条、刺槐平均增幅74.2%为最高,其余植被恢复模式与耕地硝态氮含量无显著差异。
另外,与耕地相比,植被恢复能显著提高土壤铵态氮的含量,0—10 cm增幅表现为刺槐(237.5%)>刺槐山桃混交(108.0%)>柠条(83.1%)>刺槐侧柏混交、荒草地(平均为52.1%);10—20 cm以刺槐山桃混交增加幅度最大,达到74.5%,其次为刺槐、柠条平均增幅为47.4%,其它植被恢复模式与耕地无显著差异。而相比0—10、10—20、20—30 cm铵态氮含量变化幅度最小,以刺槐山桃混交增幅最大,为135.0%,其余各样地均与耕地无显著差异。

图1 不同植被恢复模式土壤可溶性氮组分含量Fig.1 Content of soil soluble nitrogen in forest lands with different vegetation restorations柠条Caragana korshinskii(CK);刺槐Robinia pseudoacacia(RP);刺槐侧柏混交 R. pseudoacacia and Platycladus orientalis mixed forest(RP+PO);刺槐山桃混交R. pseudoacacia and Prunus davidiana mixed forest(RP+PD);荒草地abandoned farmland(AF);耕地slope farmland(SF)。不同的大写字母表示同一土层不同样地在P<0.05水平差异显著;误差线均为样本的标准误
2.3 土壤可溶性氮组分密度变化
如图2所示,黄土丘陵区6种类型的样地0—30 cm土壤可溶性有机氮密度整体介于58.3—269.5 kg/hm2。不同植被恢复模式增加了土壤可溶性有机氮密度,其中以柠条增幅最高,达到262.2%,其次是刺槐(232.8%),刺槐山桃混交、刺槐侧柏混交最低,平均增幅为34.5%,而荒草地可溶性有机氮密度却低于耕地。土壤硝态氮密度整体介于5.8—16.3 kg/hm2,且5种植被恢复模式均显著增加了土壤硝态氮密度,整体表现为柠条>刺槐>刺槐山桃混交>荒草地>刺槐侧柏混交,增幅为7.9%—182.8%。6种类型的样地0—30 cm土壤铵态氮密度小于硝态氮密度,整体介于46.0—97.0 kg/hm2,相比耕地不同植被恢复模式土壤铵态氮密度增加的幅度也较小,其中以刺槐山桃混交增幅110.3%为最大,荒草地最小为2.6%,其次是刺槐、柠条和刺槐侧柏混交,其增幅分别为75.4%、28.2%和16.3%。可见,黄土丘陵区0—30 cm土壤中可溶性氮组分主要以可溶性有机氮含量为主,其次是硝态氮,铵态氮密度最低。

图2 不同植被恢复模式0—30 cm土层土壤可溶性氮组分密度Fig.2 Density of soil soluble nitrogen in forest lands with different vegetation restorations
2.4 可溶性氮组分占总氮比例的变化
由图3可知,0—30 cm土壤可溶性有机氮占全氮的6.98%—23.43%,且不同植被恢复模式间土壤可溶性有机氮占全氮的比例存在差异。与耕地相比,植被恢复提高了土壤可溶性有机氮占全氮的比例,总体表现为刺槐最高,增幅为235.5%,其次是柠条为118.7%,刺槐山桃混交为47.7%,虽然刺槐侧柏混交、荒草地也提高了土壤可溶性有机氮的百分比,但均未达到显著水平。6种类型的样地0—30 cm土壤中硝态氮占全氮的比例处于0.62%—1.10%,相比耕地,仅刺槐、柠条和刺槐山桃混交3种植被恢复模式显著提高了土壤硝态氮占全氮的比例,增幅分别为63.7%、33.8%和10.8%,而刺槐侧柏混交植被恢复模式却减少了33.2%。另外,各样地中0—30 cm土壤铵态氮占全氮的比例介于0.33%—1.04%,但与耕地相比,仅刺槐和刺槐山桃混交土壤铵态氮占全氮的比例有所提高,具体增幅分别为36.4%和98.7%,其它植被恢复模式与耕地无显著差异。
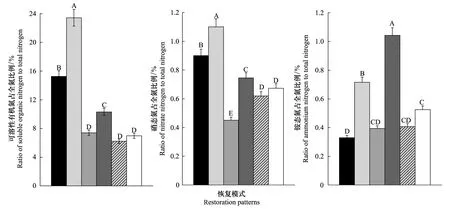
图3 不同植被恢复模式土壤可溶性氮组分占总氮比例Fig.3 Ratio of soil soluble nitrogen to total nitrogen in forest lands with different vegetation restorations
2.5 土壤可溶性氮组分对土壤有机质、全氮和微生物量碳氮变化的敏感性
6种类型的样地,3个土层的土壤有机质、全氮、微生物量碳氮与可溶性氮组分数据相关性分析结果如表4所示,硝态氮与全氮、有机质、微生物量氮、微生物量碳均极显著相关(P<0.01);可溶性有机氮与全氮极显著相关(P<0.01),与土壤微生物量氮显著相关(P<0.05);铵态氮仅与微生物量氮显著相关。
对0—30 cm土层土壤有机质、全氮、微生物量碳氮与可溶性氮组分数据作进一步回归分析(图4),结果表明,硝态氮与全氮、有机质、微生物量氮、微生物量碳拟合效果最明显,均表现出极显著正线性相关关系(P<0.01),拟合线性曲线R2分别为0.436、0.563、0.174和0.467;可溶性有机氮与微生物量氮呈显著正线性相关关系(R2=0.082;P<0.05);铵态氮表现出与微生物量氮、微生物量碳呈显著正线性相关关系(R2=0.094,0.112;P<0.05)。
表4 土壤可溶性氮组分含量与土壤有机质、全氮、微生物量氮、微生物量碳之间的相关性分析
Table 4 Correlation coefficients of Soil organic matter, total nitrogen, microbial biomass carbon and nitrogen in forest lands with different vegetation restorations
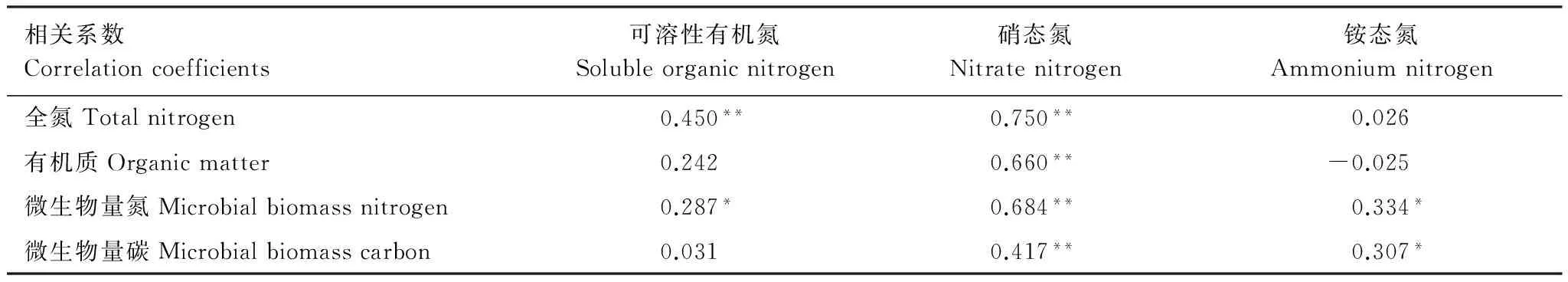
相关系数Correlationcoefficients可溶性有机氮Solubleorganicnitrogen硝态氮Nitratenitrogen铵态氮Ammoniumnitrogen全氮Totalnitrogen0.450**0.750**0.026有机质Organicmatter0.2420.660**-0.025微生物量氮Microbialbiomassnitrogen0.287*0.684**0.334*微生物量碳Microbialbiomasscarbon0.0310.417**0.307*
n=54;*在P<0.05水平相关性显著(双尾);**在P<0.01水平相关性极显著(双尾)
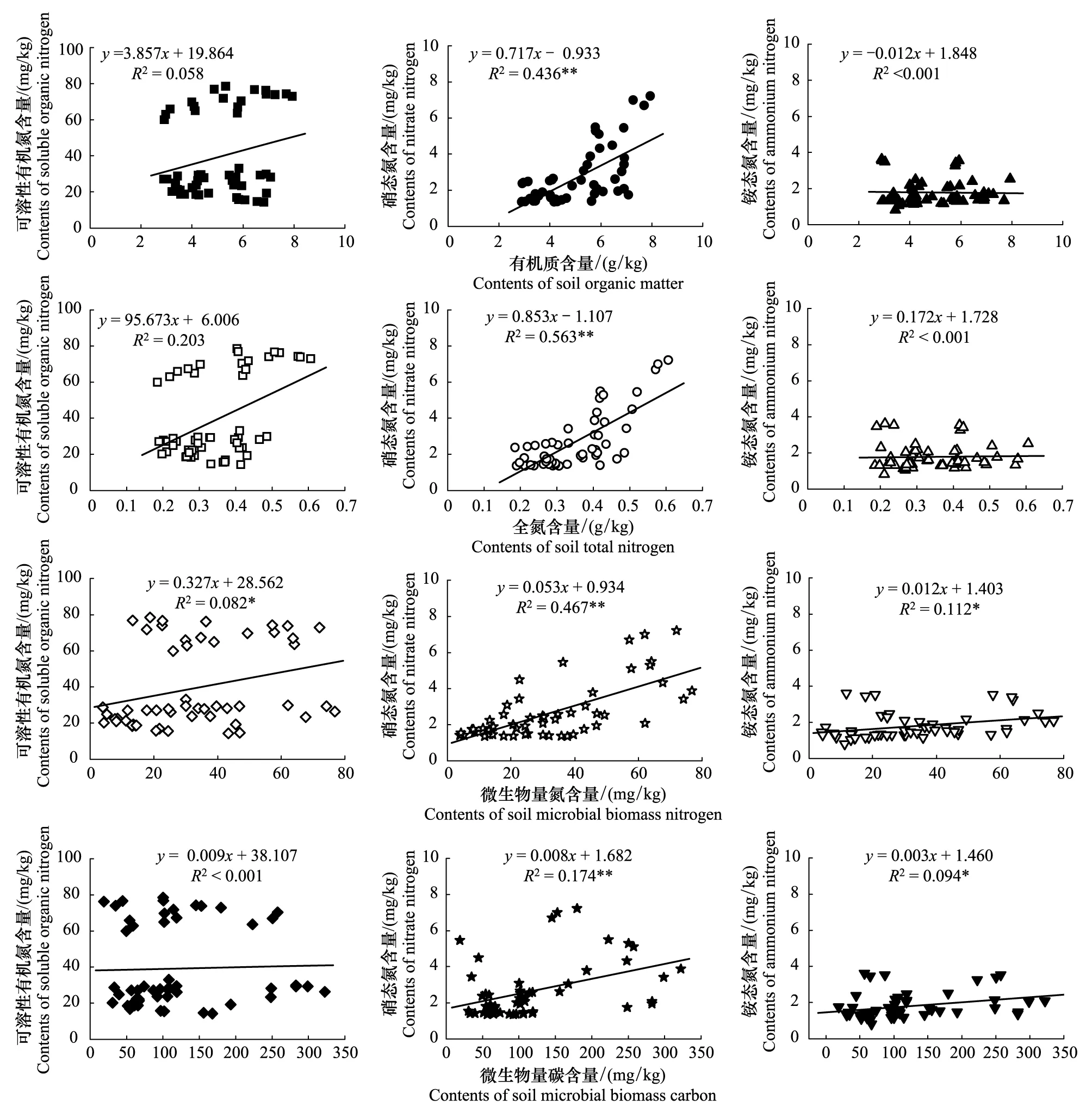
图4 土壤可溶性氮组分与有机质、全氮、微生物量氮、微生物量碳之间的关系Fig.4 Relationships between soil soluble nitrogen, soil organic matter, total nitrogen, microbial biomass carbon and microbial biomass nitrogen in 0—30 cm soil layer with different vegetation restorationsn=54;*在P<0.05水平相关性显著;**在P<0.01水平相关性极显著
3 讨论
3.1 植被恢复对土壤可溶性氮组分的影响
陕北黄土丘陵区实施退耕还林以来,植被覆盖度逐渐增加,改善了土壤微环境[14- 15],凋落物在土壤中积累、矿化[16- 17],增加了土壤氮素的输入[18],同时植物根系分泌物中的有机酸类物质又能加速土壤难溶性物质向可利用性(可溶性)转化,提高土壤氮转化能力[19],进而产生了各林分间土壤可溶性氮组分的分布差异。本次研究的5种植被恢复模式的土壤可溶性氮组分含量相比耕地均有不同程度提升,这可能是因为样地凋落物生物量、土壤有机质、全氮、微生物量氮提高,增加了土壤可溶性氮的来源。王春阳等人[20]的研究表明凋落物添加能增加土壤矿质氮含量,且凋落物C/N越低矿质氮提升效果越好。本次研究凋落物C/N(表2)以柠条最低(15.02),其次是刺槐和刺槐山桃混交(20.64,19.20),刺槐侧柏混交(32.55),荒草地最高(54.83),也表现出凋落物C/N越低,矿质氮提升效果越好的趋势,与不同植被恢复模式土壤可溶性氮组分差异一致。另外,所有样地pH趋近于中性,利于微生物活动,从而提高土壤可溶性氮的含量[21- 22]。
植被恢复在增加土壤可溶性氮组分含量同时,也增加了其在土壤中的密度和所占全氮的比例,增加土壤氮的可利用性[23]。5种植被恢复模式土壤可溶性有机氮、硝态氮等可溶性氮组分密度和所占全氮的比例均有提高,且刺槐、柠条的提升效果最好,而刺槐侧柏混交、刺槐山桃混交林地对土壤可溶性氮组分的提升能力却低于刺槐、柠条纯林地,这可能是因为植被恢复初期混交林分的郁闭度较低,林分凋落物少,土壤容重大、粘粒含量低(表1,表2),导致碳氮源输入少,孔隙度小,粘粒结合的有机质含量低,不利于土壤氮的转化[24]。因此在黄土丘陵地区同一恢复年限不同人工植被恢复模式中,土壤可溶性有机氮、铵态氮和硝态氮等可溶性氮组分含量和供应能力总体表现为固氮树种纯林优于固氮与非固氮树种混交林,人工林优于荒草地。也证明了在黄土丘陵地区人工促进植被恢复能加快土壤可利用氮的修复和贫瘠退化土壤的改良。
3.2 土壤可溶性氮组分与土壤有机质、全氮及微生物量碳氮的关系
土壤有机质作为土壤微生物的碳源和能源物质,其在土壤中的含量和分布情况也会对氮素的转化过程产生重要的影响[25]。本研究结果表明土壤有机质含量与土壤硝态氮呈极显著正相关,这可能是因为土壤有机质的提高,有利于促进土壤氮的矿化,增加土壤矿质氮含量[26]。同时土壤有机质分解过程中,会释放出大量的有机氮组分如氨基酸、氨基酸氮等,也会影响土壤可溶性氮组分的含量[27]。另外,王清奎[28]等人发现,杉木人工林中土壤可溶性有机氮与土壤全氮存在正相关关系,土壤全氮增加的同时,增加土壤氮的源,促进土壤氮转化,提升土壤氮的可溶性。而铵态氮本身受植物吸收和土壤酸碱性等多个方面的限制,因而受土壤全氮或有机质变化的影响较小。
土壤微生物量碳氮能很好的表征土壤微生物[29],土壤氮转化及可利用性与土壤微生物生物量密切相关。本研究中,土壤可溶性氮组分受土壤微生物量碳氮影响大于土壤有机质和全氮,微生物量氮与可溶性氮组分含量的相关性优于微生物量碳。曾全超[30]、邢肖毅[19]等人的研究也得出了类似结果。因为土壤微生物量氮主要是蛋白质、氨基酸、核酸等,非常容易分解,是土壤中的活性氮库[30-31],能直接通过矿化作用转化为硝态氮、铵态氮。微生物量氮越高,说明土壤氮的有效性越高。土壤微生物量碳则主要通过改变土壤有机质含量、土壤微生物数量[24],间接影响土壤氮的转化与可利用性,故与土壤可溶性氮组分含量的相关性低于微生物量氮。
4 结论
黄土丘陵地区植被恢复显著增加了0—30 cm土层土壤有机质、全氮及微生物量碳氮,显著提升了土壤氮的有效性,不同植被恢复模式的提升效果差异显著。与耕地相比,可溶性有机氮、硝态氮含量提升效果以固氮树种刺槐、柠条最好,整体表现为单一固氮树种优于混交林树种,人工林优于荒草地。另外土壤可溶性氮组分密度及其占全氮的比例也有相应的提升,且随着土层的加深,提升效果降低。土壤中可溶性有机氮密度最大,其次是硝态氮,铵态氮密度最低;土壤可溶性有机氮、硝态氮密度及其占全氮的比例以刺槐林地最高,铵态氮密度及其占全氮的比例为刺槐山桃混交模式最高。表明,在黄土丘陵地区种植固氮树种有利于土壤可利用氮的修复和贫瘠退化土壤的改良。相关分析与回归分析表明,土壤全氮、有机质和微生物量碳氮显著影响可溶性氮组分含量和分布,其中土壤可溶性氮组分受土壤微生物量碳氮的影响大于土壤有机质和全氮,且与微生物量氮的相关性优于微生物量碳。可溶性氮组分中硝态氮受有机质、全氮和微生物量碳氮的影响最大,可见硝态氮对植被恢复产生的差异最为敏感。
[1] 苗艳芳, 李生秀, 扶艳艳, 王朝辉, 徐晓峰, 罗来超. 旱地土壤铵态氮和硝态氮累积特征及其与小麦产量的关系. 应用生态学报, 2014, 25(4): 1013 - 1021.
[2] Grant. R F. Nitrogen mineralization drives the response of forest productivity to soil warming: Modelling inecosysvs. measurements from the Harvard soil heating experiment. Ecological Modelling, 2014, 288: 38- 46.
[3] Cusack D F, McCleery T L. Patterns in understory woody diversity and soil nitrogen across native- and non-native-urban tropical forests. Forest Ecology and Management, 2014, 318: 34- 43.
[4] Murphy D V, Macdonald A J, Stockdale E A, Goulding K W T, Fortune S, Gaunt J L, Poulton P R, Wakefield J A, Webster C P, Wilmer W S. Soluble organic nitrogen in agricultural soils. Biology and Fertility of Soils, 2000, 30(5/6): 374- 387.
[5] 周才平, 欧阳华, 宋明华. 中国森林生态系统氮循环特征与生产力间的相互关系. 应用生态学报, 2005, 16(2): 203- 206.
[6] 李贵才, 韩兴国, 黄建辉, 唐建维. 森林生态系统土壤氮矿化影响因素研究进展. 生态学报, 2001, 21(7): 1187- 1195.
[7] Nazaries L, Tottey W, Robinson L, Khachane A, Al-Soud W A, Sørensen S, Singh B K. Shifts in the microbial community structure explain the response of soil respiration to land-use change but not to climate warming. Soil Biology and Biochemistry, 2015, 89: 123- 134.
[8] 王洪杰, 李宪文, 史学正, 于东升. 不同土地利用方式下土壤养分的分布及其与土壤颗粒组成关系. 水土保持学报, 2003, 17(2): 44- 46, 50- 50.
[9] 彭文英, 张科利, 陈瑶, 杨勤科. 黄土坡耕地退耕还林后土壤性质变化研究. 自然资源学报, 2005, 20(2): 272- 278.
[10] 韩新辉, 杨改河, 佟小刚, 冯永忠, 任广鑫, 赵发珠, 杜约翰. 黄土丘陵区几种退耕还林地土壤固存碳氮效应. 农业环境科学学报, 2012, 31(6): l172- 1179.
[11] Zhao F Z, Kang D, Han X H, Yang G H, Yang G H, Feng Y Z, Ren G X. Soil stoichiometry and carbon storage in long-term afforestation soil affected by understory vegetation diversity. Ecological Engineering, 2015, 74: 415- 422.
[12] Filep T, Rékási M. Factors controlling dissolved organic carbon (DOC), dissolved organic nitrogen (DON) and DOC/DON ratio in arable soils based on a dataset from Hungary. Geoderma, 2011, 162(3/4): 312- 318.
[13] Lu S B, Chen C R, Zhou X Q, Xu Z H, Bacon C, Rui Y C, Guo X M. Responses of soil dissolved organic matter to long-term plantations of three coniferous tree species. Geoderma, 2012, 170: 136- 143.
[14] 刘苑秋, 王芳, 柯国庆, 王迎迎, 郭圣茂, 范承芳. 江西瑞昌石灰岩山区退耕还林对土壤有机碳的影响. 生态学报, 2015, 22(4): 885- 890.
[15] Loreau M, Naeem S, Inchausti P, Bengtsson J, Grime J P, Hector A, Hooper D U, Huston M A, Raffaelli D, Schmid B, Tilman D, Wardle D A. Biodiversity and ecosystem functioning: current knowledge and future challenges. Science, 2001, 294(5534): 804- 808.
[16] Wei X R, Shao M A, Fu X L, Ågrend G I, Yin Q X. The effects of land use on soil N mineralization during the growing season on the northern Loess Plateau of China. Geoderma, 2011, 160(3/4): 590- 598.
[17] 董建辉, 薛泉宏, 张建昌, 冯浩. 黄土高原人工混交林土壤肥力及混交效应研究. 西北林学院学报, 2005, 20(3): 31- 35.
[18] 李云, 周建斌, 董燕捷, 夏志敏, 陈竹君. 黄土高原不同植物凋落物的分解特性. 应用生态学报, 2012, 23(12): 3309- 3316.
[19] Maithani K, Arunachalam A, Tripathib R S, Pandey H N. Nitrogen mineralization as influenced by climate, soil and vegetation in a subtropical humid forest in northeast India. Forest Ecology and Management, 1998, 109(1/3): 91- 101.
[20] 王春阳, 周建斌, 董燕婕, 陈兴丽, 李婧. 黄土区六种植物凋落物与不同形态氮素对土壤微生物量碳氮含量的影响. 生态学报, 2010, 30(24): 7092- 7100.
[21] Cheng Y, Wang J, Mary B, Zhang J B, Cai Z C, Chang S X. Soil pH has contrasting effects on gross and net nitrogen mineralizations in adjacent forest and grassland soils in central Alberta, Canada. Soil Biology and Biochemistry, 2013, 57: 848- 857.
[22] 邢肖毅, 黄懿梅, 安韶山, 张宏. 黄土高原沟壑区森林带不同植物群落土壤氮素含量及其转化. 生态学报, 2013, 33(22): 7181- 7189.
[23] Deng L, Wang K B, Shangguan Z P. Long-term natural succession improves nitrogen storage capacity of soil on the Loess Plateau, China. Soil Research, 2014, 52(3): 262- 270.
[24] 金发会, 李世清, 卢红玲, 李生秀. 石灰性土壤微生物量碳、氮与土壤颗粒组成和氮矿化势的关系. 应用生态学报, 2007, 18(12): 2739- 2746.
[25] Sun S H. Liu J J. Chang S X. Temperature sensitivity of soil carbon and nitrogen mineralization: impacts of nitrogen species and land use type. Plant and Soil, 2013, 372(1/2): 597- 608.
[26] 陈书信, 王国兵, 阮宏华, 岳臻, 徐长柏, 徐亚明. 苏北沿海不同土地利用方式冬季土壤氮矿化速率比较. 南京林业大学学报: 自然科学版, 2014, 38(1): 41- 46.
[27] 丁咸庆, 马慧静, 朱晓龙, 陈珊, 侯红波, 彭佩钦. 大围山典型森林土壤有机氮垂直分布特征. 环境科学, 2015, 36(10): 3809- 3815.
[28] 王清奎, 汪思龙, 冯宗炜. 杉木人工林土壤可溶性有机质及其与土壤养分的关系. 生态学报, 2005, 25(6): 1299- 1305.
[29] 赵彤, 闫浩, 蒋跃利, 黄懿梅, 安韶山. 黄土丘陵区植被类型对土壤微生物量碳氮磷的影响. 生态学报, 2013, 33(18): 5615- 5622.
[30] 曾全超, 李鑫, 董扬红, 李娅芸, 安韶山. 黄土高原不同乔木林土壤微生物量碳氮和溶解性碳氮的特征. 生态学报, 2015, 35(11): 3598- 3605.
[31] 赵彤, 蒋跃利, 闫浩, 黄懿梅, 安韶山. 黄土丘陵区不同坡向对土壤微生物生物量和可溶性有机碳的影响. 环境科学, 2013, 34(8): 3223- 3230.
Effects of vegetation restoration on soil soluble nitrogen in the Loess Hilly Region
ZHAO Luhong1,2, LI Changzhen2,3, KANG Di1,2, REN Chengjie2,3, HAN Xinhui2,3, TONG Xiaogang4, FENG Yongzhong2,3,*
1CollegeofForestry,NorthwestAgricultureandForestryUniversity,Yangling712100,China2TheResearchCenterofRecycleAgriculturalEngineeringandTechnologyofShaanxiProvince,Yangling712100,China3CollegeofAgronomy,NorthwestAgricultureandForestryUniversity,Yangling712100,China4CollegeofSourceandEnvironment,NorthwestAgricultureandForestryUniversity,Yangling712100,China
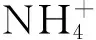
vegetation restoration; soluble organic nitrogen; ammonium nitrogen; nitrate nitrogen
国家自然科学青年基金项目(41301601);陕西省科技统筹创新工程项目(2015KTCL02-07);国家自然科学基金项目(41571501)
2016- 03- 09; 网络出版日期:2017- 02- 17
10.5846/stxb201603090416
*通讯作者Corresponding author.E-mail: Fengyz@nwsuaf.edu.cn
赵路红,李昌珍,康迪,任成杰,韩新辉,佟小刚,冯永忠.黄土丘陵区植被恢复对土壤可溶性氮组分的影响.生态学报,2017,37(10):3533- 3542.
Zhao L H, Li C Z, Kang D, Ren C J, Han X H, Tong X G, Feng Y Z.Effects of vegetation restoration on soil soluble nitrogen in the Loess Hilly Region.Acta Ecologica Sinica,2017,37(10):3533- 3542.
