放牧对鄂尔多斯高原油蒿草场生物量及植被-土壤碳密度的影响
2017-06-22朱清芳闫志坚王育青侯向阳戴雅婷
高 丽,朱清芳,闫志坚,王育青,侯向阳,*,戴雅婷
1 中国农业科学院草原研究所, 呼和浩特 010010 2 中国农业科学院研究生院, 北京 100081
放牧对鄂尔多斯高原油蒿草场生物量及植被-土壤碳密度的影响
高 丽1,2,朱清芳1,闫志坚1,王育青1,侯向阳1,*,戴雅婷1
1 中国农业科学院草原研究所, 呼和浩特 010010 2 中国农业科学院研究生院, 北京 100081
以围封保护和自由放牧油蒿草场为研究对象,通过野外调查与室内分析,研究了围封和放牧条件下沙地草场生物量和植被-土壤碳密度。结果表明:(1)自由放牧使油蒿群落中植物种类增加,但降低了植物群落盖度。自由放牧不仅导致油蒿草场地上、地下总生物量降低,也使得油蒿地上、地下生物量占群落地上、地下总生物量的比例减小。生长季自由放牧样地凋落物生物量显著大于围封保护样地(P<0.05);(2)围封保护样地植被碳密度大于自由放牧样地,土壤碳密度却小于自由放牧样地,但两个样地间差异不显著(P>0.05);(3)油蒿草场90%以上的碳储存于土壤中,围封保护样地和自由放牧样地油蒿草场土壤碳密度占植被-土壤系统碳密度的91%、93%;(4)围封保护油蒿草场碳密度为2.29 kg/m2,自由放牧油蒿草场碳密度为2.68 kg/m2,两个样地间差异不显著,自由放牧对油蒿草场碳密度影响不大。
植物生物量;碳密度;油蒿;围封;放牧
陆地生态系统碳储量是估算陆地生态系统吸收和排放含碳气体数量的关键要素[1],因而是全球气候变化研究中的重要问题[2]。准确评估不同类型植被和土壤的碳存储能力,是制定合理政策措施,提高植被和土壤的碳吸收速度,增加陆地碳存储量的基础[3- 4]。生物量是反映群落或生态系统功能强弱的重要指标[5],其直接反映了生态系统生产者的物质生产量,是生态系统生产力的重要体现[6],生物量是研究生态系统碳储量的基础数据。
半灌木油蒿(Artemisiaordosica)草场是鄂尔多斯高原地区重要的沙地天然放牧场,主要分布在本区的毛乌素沙地和库布齐沙地上,常见于固定、半固定沙地[7]。油蒿草场占整个鄂尔多斯高原总面积的47.3%,占鄂尔多斯高原沙地总面积的73.4%,其对鄂尔多斯高原的系统稳定性起着关键的作用[8]。但是在21世纪之前,由于过度放牧、农田开垦、大面积采薪等不合理利用,导致油蒿草场严重退化沙化[9]。2000年,国家“退耕还林还草”工程以及后期的飞播造林、沙区封育等生物和工程措施加上地方政府的“禁牧、休牧、轮牧”政策的实施,使得沙地草场呈现“整体遏制,局部好转”的局面[10- 11]。目前,关于油蒿草场碳储量的研究,主要集中在不同沙地类型植被和土壤碳储量方面[12- 14],而有关围封和放牧条件下油蒿草场碳储量研究还未见报道。大量实验观测表明,退耕还草、围封草场和人工种草等措施可以促进退化草地土壤有机碳的恢复和积累,具有固定大气CO2的能力[15]。本研究以围封保护和自由放牧油蒿草场为研究对象,开展围封和放牧条件下沙地草场生物量和植被-土壤碳密度的研究,为进一步估算鄂尔多斯高原沙地油蒿草场的碳储量及固碳潜力,更好地评价沙地草场在我国陆地生态系统碳循环中的作用提供参考数据。
1 研究地区与研究方法
1.1 研究地点和样地概况
研究地点设在农业部鄂尔多斯沙地草原生态环境重点野外科学观测试验站,位于鄂尔多斯高原北部库布齐沙漠东段,地处40°19′N,109°59′E,海拔1036 m。该区属于中温带大陆性季风气候,年平均气温6.5℃,最低气温-32.8℃,最高气温39.1℃,年平均降雨量350—380 mm,年蒸发量2093 mm,无霜期145 d。立地类型主要有固定沙地、半固定沙地、流动沙地和丘间低地。土壤类型为风沙土。
20世纪90年代初,试验区内大部分为半流动沙地、流动沙地,植被以油蒿和沙米(Agriophyllumsquarrosum)为主,油蒿数量少,呈不均匀分布,沙米在雨季才能出苗[8]。1990—1994年,研究者们通过补播固沙耐牧草种沙打旺(Astragalusadsurgens)、中间锦鸡儿(Caraganaintermedia)、羊柴(Hedysarumlaeve)和油蒿改良半流动沙地、流动沙地草场,形成了良好的打草场或放牧场。在植被恢复的过程中,沙打旺、羊柴逐渐衰退死亡,中间锦鸡儿仅有少数留存,最终形成了以油蒿为建群种的固定沙地。本研究中,围封保护样地和自由放牧样地是在实施补播后建立的。围封保护样地面积300 m×300 m,采取围栏封育,不放牧;自由放牧样地面积300 m×200 m,一直作为冬春放牧场,放牧牲畜以山羊为主,放牧时间为当年生长季结束到次年植物返青期前。
两个样地均以油蒿为建群种,伴生种以雾冰藜(Bassiadasyphylla)、猪毛菜(Salsolacollina)、刺沙蓬(Salsolapestifer)、苦豆子(Sophoraalopecuroides)、达乌里胡枝子(Lespedezadavurica)等喜沙植物为主。
1.2 植物生物量测定与植物样品采集及制备

图1 样方分布图Fig.1 Location map of six 5m×5m quadrats
2011年5月,在围封保护固定沙地样地和自由放牧固定沙地样地典型地带,根据机械布点法自西向东按 1、2、3…顺序依次标号[16],选择 1、13、25、29、41、53号6个5 m×5 m样方作为测量样方(图1)。从5月到10月,每月对6个样方进行植物群落调查。灌木和半灌木采用标准丛法测定[16],依其丛幅和高度相对地划分为大、中、小3个等级组,每一等级组内,选择生长于固定观测样方外的3个标准丛,分别齐地面刈割。在6个5 m×5 m的样方中分别作1个1 m×1 m的草本样方,分种记录盖度、株树、高度后,齐地面刈割。采集完地上活体部分后,将每个1 m×1 m的样方中凋落物收集装袋。在地上部分刈割后,取50 cm×50 cm×70 cm土方,分5层取地下部分植物样品(0—10、10—20、20—30、30—50、50—70 cm)。
植物样品带回室内后,迅速清除尘土。油蒿植株地上部分分老枝、新枝、叶、果实,称量鲜重;油蒿根系地下部分带回室内用水洗分离法获得根系样品,分细根(<2 mm)和粗根(>2mm)分层装入纸袋;草本层分种称量鲜重;立枯物和凋落物分别称量鲜重。所有植物样品置于鼓风干燥箱中65℃烘干至恒重后,称量干重。称量后的样品,用粉碎粒度较大的植物粉碎机先粗碎,充分混合均匀,然后用细碎的不锈钢植物粉碎机粉碎至100目,全部移入密封塑料袋中封好待测。
1.3 土壤样品采集及制备
8月,在围封保护样地、自由放牧样地各挖取3个土壤剖面,在每个剖面的3个不同位置分0—5、5—10、10—20、20—30、30—50、50—70 cm土层取样,将每个剖面每层土样混合,做为3次重复,用于测定土壤有机碳。同时采用环刀取样,用于测定土壤容重。
剖面土壤样品取回室内后,平铺于干净白纸上,捏碎大块土粒,去除石块和草根等杂物,自然风干,过0.15 mm筛用以测定土壤有机碳。环刀中的土样取出,装入铝盒中,置于鼓风干燥箱中105℃烘干至恒重,称量干重。
1.4 样品分析方法
植物和土壤全碳含量测定采用重铬酸钾、硫酸氧化-外加热法[17]。
1.5指标计算1.5.1 油蒿地上生物量
以下计算公式均参照《陆地生物群落调查观测与分析》[18]。
(1) 绿色部分的生物量BG:

(1)
式中,BG为绿色部分生物量(g/m2);Gl为大丛组油蒿每丛平均重量(g);Nl为大丛油蒿的丛数(丛);Gm为中等油蒿每丛平均重量(g);Nm为中等油蒿的丛数(丛);Gs为小丛组油蒿每丛平均重量(g);Ns为小丛油蒿的丛数(丛);A为样地面积,25 m2。
(2) 木质部分的生物量BV:
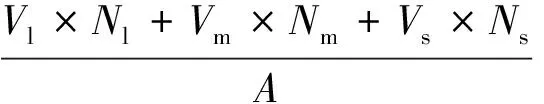
(2)
式中,BV为木质部分生物量(g/m2);Vl为大丛组油蒿每丛平均重量(g);Nl为大丛油蒿的丛数(丛);Vm为 中等油蒿每丛平均重量(g);Nm为中等油蒿的丛数(丛);Vs为小丛组油蒿每丛平均重量(g);Ns为小丛油蒿的丛数(丛);A为样地面积,25 m2。
1.5.2 植被碳密度
植株碳含量乘以单位面积生物量,即得出活体植被碳密度。用测得的凋落物碳含量,乘以凋落物生物量,计算出凋落物碳密度。
1.5.3 土壤有机碳密度
土壤有机碳密度是指单位面积一定深度的土层中土壤有机碳的储量,由于排除了面积因素的影响而以土体体积为基础来计算,土壤碳密度已成为评价和衡量土壤中有机碳储量的一个极其重要的指标[19]。
某一土层i的有机碳密度SOCi(kg/m2)计算公式如下:
SOCi=CiDiEi(1-Gi)/10
(3)
式中,Ci为土壤有机碳含量(%),Di为容重(g/cm3);Ei为土层厚度(cm);Gi为大于2 mm的石砾所占的体积百分比(%)。本研究中土壤为风沙土,Gi=0,所以公式(1)可以简化为:
SOCi=CiDiEi/10
(4)
如果某一土体的剖面由k层组成,那么该剖面的有机碳密度SOCt的计算公式为:
(5)
1.6 数据分析
应用Microsoft Excel 2003对植物生物量、植被碳密度、土壤碳密度等数值计算和曲线图绘制。利用线性混合模型原理和SAS软件Proc mixed程序对两个样地植物生物量、植被碳密度、土壤碳密度进行比较分析。
2 结果与分析
2.1 围封和放牧油蒿草场物种组成
围封保护样地植被盖度60%,共有植物26种。灌木种类有油蒿、白沙蒿和小叶锦鸡儿共3种;草本植物共23种,占围封保护样地总种数的88.46%,其中藜科8种,菊科5种,豆科4种,禾本科2种、萝藦科2种、大戟科1种、唇形科1种、紫葳科1种、旋花科1种、蒺藜科1 种(表1)。
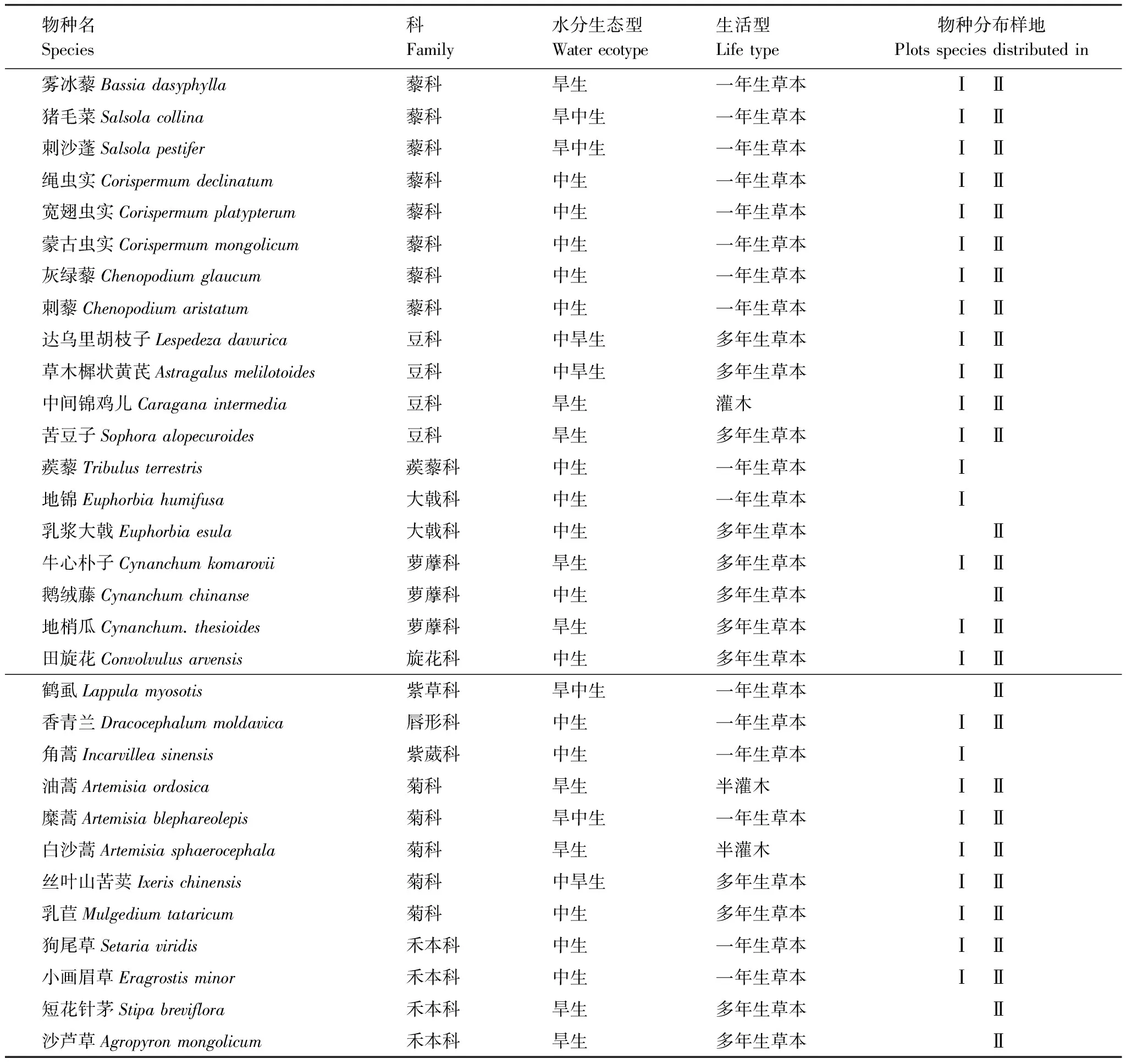
表1 植物群落物种组成特征
Ⅰ:围封保护样地 Enclosed plot;Ⅱ:自由放牧样地 Grazed plot
自由放牧样地植被盖度45%,共有植物28种,占总种数的84.85%,灌木种类有油蒿、白沙蒿和中间锦鸡儿共3种;草本种类共25种,占自由放牧样地总种数的89.29%,其中藜科8种,菊科5种,豆科4种、禾本科4种、萝藦科3种,大戟科1种、唇形科1种、紫草科1种、旋花科1种。放牧使群落中草本植物种类增加,但却降低了植物群落盖度。

图2 生长季大气温度和土壤质量含水量 Fig.2 Air temperature and soil gravimetric water content in the growing season
2.2 围封和放牧油蒿草场地上生物量
围封保护样地和自由放牧样地油蒿群落地上生物量季节动态呈双峰型。5月,水分条件为生长季最好(图2),但温度较低,但两个样地油蒿群落地上生物量处于较低水平;6月,两个样地地上生物量均出现一个微弱的小峰,由于受土壤水分较低的影响,两个样地地上生物量增幅不大;在植物生长旺盛的7月,高温低湿的环境条件,使得两个样地地上生物量较6月大幅下降,尤其是自由放牧样地生物量降到季节最小值;8月,土壤含水量增大,自由放牧样地地上生物量大幅增加,达到季节最大值,而围封保护样地地上生物量降到季节最低值,分析原因是围封保护样地油蒿地上生物量占群落总地上生物量83.10%(表2),所以群落生物量大小由油蒿种群生物量大小决定,而油蒿在7月干旱条件下,光合作用受到抑制,光合产物积累减少,导致8月生物量出现最小值,而自由放牧样地油蒿地上生物量只占群落总地上生物量的61.74%,群落生物量由油蒿和草本层共同决定,草本层生物量通常在8月达到最大,加上8月较好的水分条件,因此自由放牧样地地上生物量最大值出现在8月;9月,自由放牧样地大多数草本层植物枯萎,造成地上生物量骤降,围封保护样地受益于8月相对较高的土壤含水量,油蒿光合产物积累增加,使得地上生物量在9月达到最大值;10月,温度降到生长季最低,油蒿生长减缓,并逐渐枯黄,地上生物量减小(图3)。
5月、7月、9月、10月围封保护样地地上生物量显著大于自由放牧样地,8月自由放牧样地显著大于围封保护样地,6月两个样地差异不显著。两个样地地上生物量生长季均值为:围封保护样地((237.40±50.49) g/m2)极显著大于自由放牧样地((165.96±47.55) g/m2)(P<0.01)。自由放牧不仅导致油蒿草场地上总生物量降低,也使得油蒿地上生物量占地上总生物量的比例减小。

表2 两个样地油蒿地上生物量占群落总地上生物量的比例/%
同列不同字母表示差异显著(P<0.05)
2.3 围封和放牧油蒿草场地下生物量
围封保护样地地下生物量从5月到8月一直在下降(图4),9月出现小幅增加,10月又降低;自由放牧样地地下生物量从5月到7月处于下降状态,8月大幅增加,达到季节最大值,9月地下生物量骤降,10月又有小幅增长。围封保护样地地下生物量最大值出现在5月,最小值出现时间与地上生物量最小值出现时间一致;自由放牧样地地下生物量与地上生物量最大值、最小值出现时间相同。
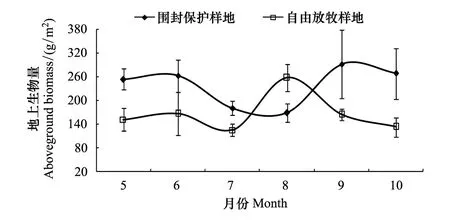
图3 两个样地生长季群落地上生物量 Fig.3 Aboveground biomass of communities in the growing season in two plots

图4 两个样地生长季群落地下生物量 Fig.4 Belowground biomass of communities in the growing season in two plots
7月、9月围封保护样地地下生物量显著大于自由放牧样地,其余月份两个样地差异不显著。地下生物量生长季均值围封保护样地((113.36±34.22) g/m2)显著大于自由放牧样地((73.37±27.35) g/m2)(P<0.05)。围封保护样地油蒿地下生物量占群落总地下生物量98.71%,自由放牧样地油蒿地下生物量占群落总地下生物量89.94%(表3)。自由放牧不仅导致油蒿草场地下总生物量降低,也使得油蒿地下生物量占地下总生物量的比例减小。

表3 两个样地生长季油蒿地下生物量占群落总地下生物量的比例/%
同列不同字母表示差异显著(P<0.05)
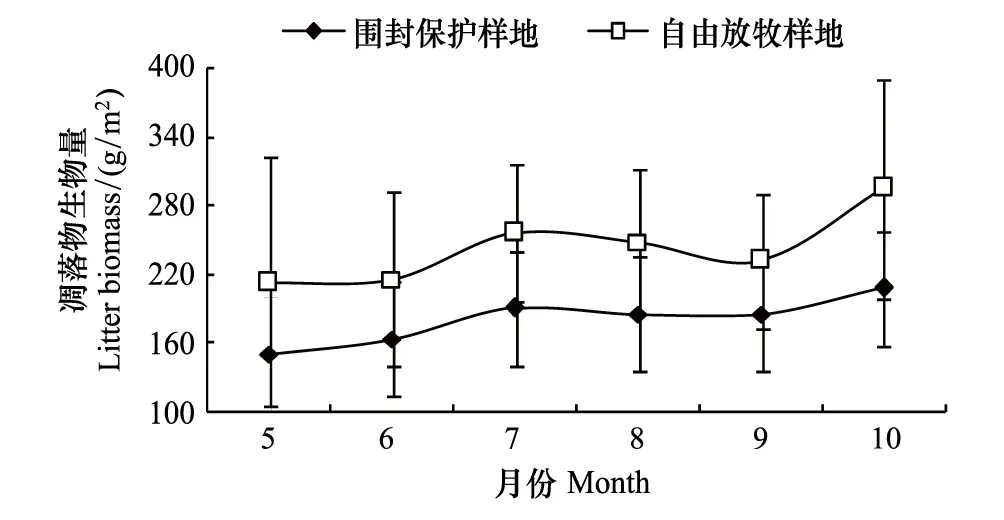
图5 两个样地生长季群落凋落物生物量 Fig.5 Litter biomass of communities in the growing season in two plots
2.4 围封和放牧油蒿草场凋落物生物量
围封保护样地和自由放牧样地凋落物生物量季节动态呈双峰曲线(图5),围封保护样地曲线较平缓,自由放牧样地曲线起伏较大。两个样地峰值均出现在7月和10月。通常凋落物生物量在生长季末期(10月)出现峰值。而本项研究中在植物生长旺期(7月)出现一个小的峰值,分析其原因是7月环境条件呈现出高温低湿的特点,植物在干旱条件下出现萎蔫甚至死亡现象,导致凋落物生物量增加。生长季,自由放牧样地凋落物生物量(243.72±76.68)均值显著大于围封保护样地(181.11±19.43)(P<0.05)。
2.5 围封和放牧油蒿草场植物碳含量
植物碳含量是计算植物碳储量的基本参数,其反映植物在光合作用中固定贮存碳元素的能力。不同植物种类、不同植物构件碳含量不同。本研究于植物生长旺盛期(8月)采样测定了油蒿和主要草本植物的地上和地下部分碳含量(表4)以及凋落物碳含量(37.86%)。
2.6 围封和放牧油蒿草场植被碳密度
由围封保护样地和自由放牧样地地上生物量、地下生物量、凋落物生物量及植物碳含量计算得出围封和放牧条件下油蒿草场植被碳密度。
由图6可以看出,两个样地油蒿草场植被碳密度季节动态与地上生物量季节动态(图3)一致。8月,自由放牧样地油蒿草场植被碳密度显著大于围封保护样地,其它月份差异不显著。两个样地油蒿群落植被碳密度生长季平均值差异不显著(P>0.05),分别为:围封保护样地(0.21±0.03) kg/m2,自由放牧样地(0.19±0.03) kg/m2。

表4 油蒿和草本层主要植物地上和地下部分碳含量/%
同行不同字母表示差异显著(P<0.05)
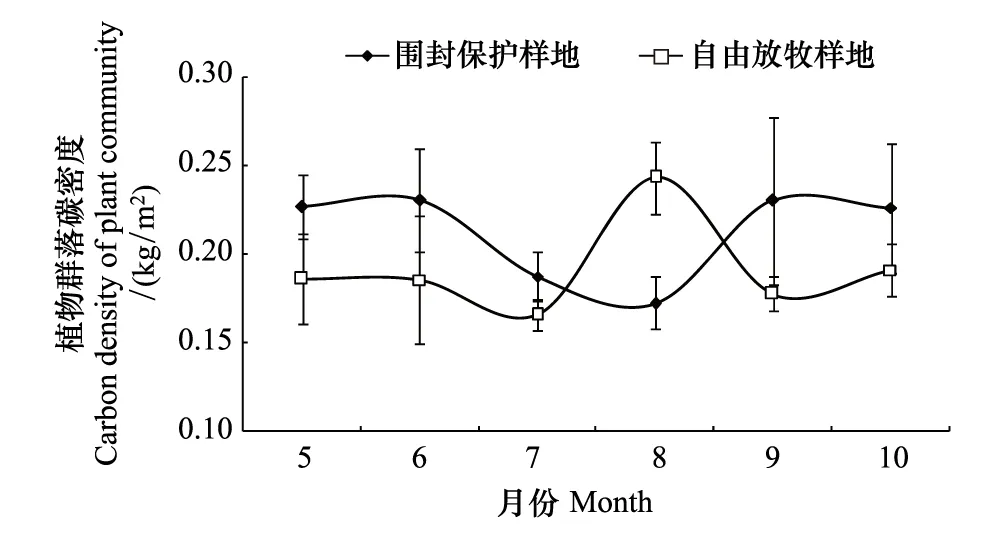
图6 两个样地植物群落碳密度Fig.6 Carbon density of plant communities in two plots
2.7 围封和放牧油蒿草场土壤有机碳密度
由公式(4)、(5)和表5中的数据计算得出围封保护样地和自由放牧样地0—70 cm深度土壤有机碳密度分别为(2.08±0.41) kg/m2,(2.49±0.36) kg/m2,两个样地间差异不显著(P>0.05)。
2.8 围封和放牧油蒿草场植被-土壤系统碳密度
表6可以看出,围封保护样地和自由放牧样地油蒿草场土壤碳密度占植被-土壤系统碳密度的91%、93%,可见,油蒿草场90%以上的碳储存于土壤中。围封保护样地植被碳密度大于自由放牧样地,土壤碳密度却小于自由放牧样地。围封保护油蒿草场碳密度为2.29 kg/m2,自由放牧油蒿草场碳密度为2.68 kg/m2,两个样地间差异不显著。自由放牧对油蒿草场碳密度影响不大。
3 讨论和结论
放牧作为人类对草地生态系统管理和利用的主要手段,是影响草地的最主要的人为干扰方式[20]。放牧通过牲畜的啃食、践踏和物质归还过程干扰草场环境,一方面使群落在结构上出现破口,生境异质性增加;另一方面也使优势种群的竞争势受到抑制,为新物种的侵入创造了条件[21]。在本项研究中自由放牧样地中植物种数多于围封保护样地。自由放牧样地中,牲畜的采食相对降低了优势植物油蒿的竞争势,为其他植物种类的出现创造了条件。一般认为,随着放牧率的增加,植物的再生能力降低,植物的叶量、分蘖数、株高、生长速度、单株干物质和总生物量均下降[22- 23]。通常围封禁牧草地生物量要大于放牧草地。本项研究中围封保护样地地上、地下生物量显著大于自由放牧样地,自由放牧不仅导致油蒿草场地上、地下总生物量降低,也使得油蒿地上、地下生物量占群落地上、地下总生物量的比例减小。油蒿之所以能在鄂尔多斯高原沙地成为主要建群种,除了其本身具有耐干旱、耐贫瘠,根系发达等生理特性外,植物体内所含有的化学成分对其他植物有抑制作用也可能是其中重要原因之一[24]。自由放牧样地中的放牧采食行为,不仅抑制了油蒿的生长,而且降低了油蒿对草本植物的化感作用,所以导致自由放牧样地中油蒿种群生物量低于围封保护样地,而自由放牧样地中草本层植物生物量大于围封保护样地。草地凋落物生物量的主要控制因素分别为地上生物量、土壤碳贮量和降水量[25],所以通常围封样地凋落物生物量大于放牧样地,而在本研究中生长季自由放牧样地凋落物生物量显著大于围封保护样地。不同生境的植被组成差异是导致凋落物量及凋落物组成差异的重要因素[26]。本研究中放牧时间为当年生长季结束到次年植物返青期前,在自由放牧样地中,生长季草本层植物基本未被采食,生长季结束后,草本层一年生植物整株转化为凋落物,而围封保护样地中,草本层植物较少,凋落物主要来自于脱落的油蒿叶、果实及嫩茎。因此,自由放牧样地中较高的立枯量所形成的较强的凋落物截获能力可能是导致自由放牧样地凋落物生物量显著大于围封保护样地的重要原因之一。

表5 两个样地土壤容重、土壤有机质、土壤有机碳含量
同行同一指标不同字母表示差异显著(P<0.05)
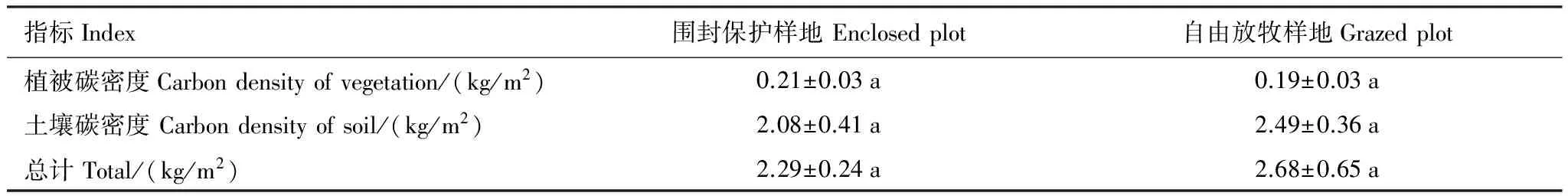
表6 两个样地植被-土壤系统碳密度
同行不同字母表示差异显著(P<0.05)
植物的碳含量相对比较稳定,所以放牧主要通过生物量的改变而影响植被的碳密度,通常放牧导致生物量及植被碳密度降低。本研究中自由放牧导致地上总生物量降低,从而降低了植被碳密度。放牧对土壤有机碳含量的影响仍存在较大争议。目前,放牧与土壤碳密度的关系,尤其是在不同区域(受植被类型、土壤本底和放牧牲畜种类)表现很不一致[27]。通常,轻度放牧对草地土壤的影响相对较小[28-32],而过度放牧将显著降低土壤碳氮贮量[29-30,33-34]前者主要通过促进草地营养循环和植被更新来提高草地干物质生产、营养循环、碳氮贮存[27]。在内蒙古典型草地,我国学者已经发现轻度放牧将提高典型草地和荒漠草地土壤碳和氮贮量、而重度放牧将降低土壤碳氮贮量[30-31,33]。加强草地管理,恢复退化草地可以有效地增加草地土壤有机碳储量[35-38]。在本项研究中,围封保护样地植物碳密度大于自由放牧样地,土壤碳密度却小于自由放牧样地。围封保护油蒿草场碳密度为2.29 kg/m2,自由放牧油蒿草场碳密度为2.68 kg/m2,两个样地间差异不显著,所以自由放牧对油蒿草场碳密度影响不大。已有研究表明,适度的放牧是保持沙地油蒿群落稳定的关键,即一方面要限制过度放牧的情况发生,另一方面也不能完全封闭保护,使固定沙地油蒿群落向下一个演替阶段发展,导致油蒿群落的衰败[39]。所以,无论是从可持续利用角度还是碳固持方面来看,适度放牧是固定沙地油蒿草场最佳利用方式。
[1] Valentini R, Matteucci G, Dolman A J, Schulze E D, Rebmann C, Moors E J, Granier A, Gross P, Jensen N O, Pilegaard K, Lindroth A, Grelle A, Bernhofer C, Grünwald T, Aubinet M, Ceulemans R, Kowalski A S, Vesala T, Rannik Ü, Berbigier P, Loustau D, Guδmundsson J, Thorgeirsson H, Ibrom A, Morgenstern K, Clement R, Moncrieff J, Montagnani L, Minerbi S, Jarvis P G. Respiration as the main determinant of carbon balance in European forests. Nature, 2000, 404(6780): 861- 865.
[2] 李克让, 王绍强, 曹明奎. 中国植被和土壤碳贮量. 中国科学(D辑), 2003, 33(1): 72- 80.
[3] 吕超群, 孙书存. 陆地生态系统碳密度格局研究概述. 植物生态学报, 2004, 28(5): 692- 703.
[4] White R P, Murray S, Rohweder M. Pilot Analysis of Global Ecosystems: Grassland Ecosystems. Washington D C: World Resource Institute, 2000.
[5] Odum E P. Base of Ecology. Beijing: People Education Press, 1971.
[6] 张峰, 上官铁梁, 李素珍. 关于灌木生物量建模方法的改进. 生态学报, 1993, 12(6): 67- 69.
[7] 李博. 内蒙古鄂尔多斯高原自然资源与环境研究. 北京: 科学出版社, 1990.
[8] 李博, 桂荣, 王国贤. 鄂尔多斯高原沙质灌木草地绒山羊试验区研究成果汇编. 呼和浩特: 内蒙古教育出版社, 1995.
[9] 王庆锁, 陈仲薪, 史振英. 油蒿草场的保护与改良. 生态学杂志, 1995, 14(4): 54- 57.
[10] 王玉华, 杨景荣, 丁勇, 宁争平, 张宏林. 近年来毛乌素沙地土地覆被变化特征. 水土保持通报, 2008, 28(6): 53- 57.
[11] 闫峰, 吴波, 王艳姣. 2000—2011年毛乌素沙地植被生长状况时空变化特征. 地理科学, 2013, 33(5): 602- 608.
[12] 李春萍. 内蒙古毛乌素沙地不同生境油蒿(ArtemisiaordosicaKrasch.)灌丛地碳动态研究[D]. 北京: 中国科学院植物研究所, 2006.
[13] 丁越岿, 杨劼, 宋炳煜, 呼格吉勒图, 张琳. 不同植被类型对毛乌素沙地土壤有机碳的影响. 草业学报, 2012, 21(2): 18- 25.
[14] 黄奇. 乌审旗区域植被碳储量估算[D]. 呼和浩特: 内蒙古大学, 2014.
[15] 郭然, 王效科, 逯非, 段晓男, 欧阳志云. 中国草地土壤生态系统固碳现状和潜力. 生态学报, 2008, 28(2): 862- 867.
[16] 中国生态系统研究网络科学委员会. 陆地生态系统生物观测规范. 北京: 中国环境科学出版社, 2007.
[17] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2002.
[18] 董鸣. 陆地生物群落调查观测与分析. 北京: 中国标准出版社, 1996.
[19] 解宪丽, 孙波, 周慧珍, 李忠佩. 不同植被下中国土壤有机碳的储量与影响因子. 土壤学报, 2004, 41(5): 687- 699.
[20] Rowe R J. Environmental and geometric drivers of small mammal diversity along elevational gradients in Utah. Ecography, 2009, 32(3): 411- 422.
[21] 杨利民, 韩梅, 李建东. 中国东北样带草地群落放牧干扰植物多样性的变化. 植物生态学报, 2001, 25(1): 110- 114.
[22] 贾子毅. 毛乌素沙地定居放牧草场植物群落分类与退化梯度分析[D]. 北京: 中国林业科学研究院, 2008.
[23] 赵哈林, 张铜会, 赵学勇, 周瑞莲. 放牧对沙质草地生态系统组分的影响. 应用生态学报, 2004, 15(3): 420- 424.
[24] 于凤兰, 马茂华, 孔令韶. 油蒿挥发油的化感作用研究. 植物生态学报, 1999, 23(4): 345- 350.
[25] 温丁, 何念鹏. 中国森林和草地凋落物现存量的空间分布格局及其控制因素. 生态学报, 2016, 36(10): 1- 9.
[26] 罗永清, 赵学勇, 丁杰萍, 冯静, 苏娜, 周欣, 岳祥飞. 科尔沁沙地不同类型沙地植被恢复过程中地上生物量与凋落物量变化. 中国沙漠, 2016, 36(1): 78- 84.
[27] 何念鹏, 韩兴国, 于贵瑞. 内蒙古放牧草地土壤碳固持速率和潜力. 生态学报, 2012, 32(3): 844- 851.
[28] Frank D A, Evans R D. Effects of native grazers on grassland N cycling in yellowstone national park. Ecology, 1997, 78(7): 2238- 2248.
[29] He N P, Zhang Y H, Yu Q, Chen Q S, Pan Q M, Zhang G M, Han X G. Grazing intensity impacts soil carbon and nitrogen storage of continental steppe. Ecosphere, 2011, 2(1): 1- 10.
[30] Han G D, Hao X Y, Zhao M L, Wang M J, Ellert B H, Willms W, Wang M J. Effect of grazing intensity on carbon and nitrogen in soil and vegetation in a meadow steppe in Inner Mongolia. Agriculture, Ecosystems & Environment, 2008, 125(1/4): 21- 32.
[31] Li C L, Hao X Y, Zhao M L, Han G D, Willms W D. Influence of historic sheep grazing on vegetation and soil properties of a Desert Steppe in Inner Mongolia. Agriculture, Ecosystems & Environment, 2008, 128(1/2): 109- 116.
[32] 陈银萍, 李玉强, 赵学勇, 罗永清, 尚雯. 放牧与围封对沙漠化草地土壤轻组及全土碳氮储量的影响. 水土保持学报, 2010, 24(4): 182- 186.
[33] Cui X Y, Wang Y F, Niu H S, Wu J, Wang S P, Schnug E, Rogasik J, Fleckenstein J, Tang Y H. Effect of long-term grazing on soil organic carbon content in semiarid steppes in Inner Mongolia. Ecological Research, 2005, 20(5): 519- 527.
[34] Elmore A J, Asner G P. Effects of grazing intensity on soil carbon stocks following deforestation of a Hawaiian dry tropical forest. Global Change Biology, 2006, 12(9): 1761- 1772.
[35] 王玮, 邬建国, 韩兴国. 内蒙古典型草原土壤固碳潜力及其不确定性的估算. 应用生态学报, 2012, 23(1): 29- 37.
[36] Maia S M F, Ogle S M, Cerri C E P, Cerri C C. Effect of grassland management on soil carbon sequestration in Rondnia and Mato Grosso states, Brazil. Geoderma, 2009, 149(1/2): 84- 91.
[37] Wu G L, Liu Z H, Zhang L, Chen J M, Hu T M. Long-term fencing improved soil properties and soil organic carbon storage in an alpine swamp meadow of western China. Plant and Soil, 2010, 332(1/2): 331- 337.
[38] Jones M B, Donnelly A. Carbon sequestration in temperate grassland ecosystems and the influence of management, climate and elevated CO2. New Phytologist, 2004, 164(3): 423- 439.
[39] 郭柯. 毛乌素沙地油蒿群落的循环演替. 植物生态学报, 2000, 24(2): 243- 247.
Effects of grazing on plant biomass and the carbon density of vegetation and soil in theArtemisiaordosicashrubland of the Ordos Plateau
GAO Li1, 2, ZHU Qingfang1, YAN Zhijian1, WANG Yuqing1, HOU Xiangyang1,*, DAI Yating1
1GrasslandResearchInstitute,ChineseAcademyofAgriculturalSciences,Hohhot010010,China2GraduateSchool,ChineseAcademyofAgriculturalSciences,Beijing100081,China
Plant biomass and the carbon density of vegetation and soil in enclosed and grazedArtemisiaordosicashrubland of the Ordos Plateau were studied in the field and in the laboratory. The results revealed that the grazed plots supported plant communities with a higher the number of species yet lower vegetation coverage than did the enclosure plots. Grazing, moreover, reduced the overall above-and below-ground biomass of plant communities, as well as the proportion of above-and below-ground biomass consisting ofA.ordosica. Nevertheless, during the growing season the grazed plots produced significantly more litter biomass than did the enclosure plots (P< 0.05). When protected by enclosures, however, the carbon density of the vegetation was higher, whereas that of the soil was lower, than that under grazing; although their seasonal averages did not differ significantly between the two plot treatments (P> 0.05). Ninety percent of carbon storage was in the soil inA.ordosicashrubland. The percentages of carbon density of soil accounting for the vegetation-soil system were 91% in enclosed plot and 93% in grazed plot, respectively. The carbon density ofA.ordosicashrubland was 2.29 kg/m2in enclosed plot and 2.68 kg/m2in grazed plot. Grazing had little impact on carbon density of vegetation-soil inA.ordosicashrubland.
plant biomass; carbon density;Artemisiaordosica; enclosed; grazed
国家重点基础研究发展计划(973计划)项目(2014CB138806);“十二五”国家科技支撑计划项目(2012BAD13B07);国家国际科技合作专项项目(2013DFR30760);中央级公益性科研院所基本科研业务费专项资金(1610332015008);农业部鄂尔多斯沙地草原生态环境重点野外科学观测试验站项目
2016- 01- 14; 网络出版日期:2016- 12- 19
10.5846/stxb201601140091
*通讯作者Corresponding author.E-mail: houxy16@126.com
高丽,朱清芳,闫志坚,王育青,侯向阳,戴雅婷.放牧对鄂尔多斯高原油蒿草场生物量及植被-土壤碳密度的影响.生态学报,2017,37(9):3074- 3083.
Gao L, Zhu Q F, Yan Z J, Wang Y Q, Hou X Y, Dai Y T.Effects of grazing on plant biomass and the carbon density of vegetation and soil in theArtemisiaordosicashrubland of the Ordos Plateau.Acta Ecologica Sinica,2017,37(9):3074- 3083.
