超高压辅助提取对提取溶剂物理特性的影响
2017-06-22张海宁马永昆
张海宁,李 希,马永昆,*
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.洛阳师范学院食品与药品学院,河南 洛阳 471000)
超高压辅助提取对提取溶剂物理特性的影响
张海宁1,2,李 希1,马永昆1,*
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.洛阳师范学院食品与药品学院,河南 洛阳 471000)
以超高压辅助提取蓝莓果渣花色苷为研究对象,从超高压处理对提取溶剂物理性质影响角度对超高压辅助提取机理进行研究。结果表明超高压辅助提取过程会影响提取溶剂的最大吸收波长、pH值、电导率等物理性质;通过氢谱核磁共振谱和红外光谱测定发现超高压处理会影响醇水之间氢键,随着提取压力增加,醇水之间氢键更加稳定,其中花色苷提取率和醇水氢键羟基红外吸收、醇水氢键化学位移具有显著相关性。从提取溶剂角度考虑,超高压处理能够增加花色苷提取率是由于压力引起提取溶剂分子间氢键的变化,进而导致提取溶剂物理性质发生变化,从而提高花色苷提取率。
超高压辅助提取;蓝莓;花色苷;分子间氢键;醇水体系
超高压辅助提取技术是基于食品超高压技术发展起来的一种提取技术。超高压加工技术应用于中
草药提取具有提取时间短、提取杂质少、节能安全等特点[1],随后将超高压技术应用于中草药[2-3]、茶[4]、龙眼[5]、桑橙[6]、番茄[7]等不同原料活性成分的研究越来越多。
在研究超高压提取机理方面,大多研究者都从压力破坏细胞结构和超高压加快传质2 个方面分析。有研究者分析认为超高压能够引起带电基团的去质子化过程,破坏离子键和疏水键,从而导致构象变化和蛋白质变性,进而使细胞膜失去选择性,使得细胞内化合物更容易被提取出来[8],而细胞膜的磷脂质在高压条件下也会发生相变从而增加了细胞膜的通透性,当压力超过300 MPa会导致蛋白质构象的不可逆改变,超高压会引起水分子渗透到蛋白质内部,促进蛋白质分子展开,进而改变磷脂双分子层的膜流动性,破坏细胞硬度[9]。此外根据传质学理论,加压处理能够增加细胞的渗透性,而根据相变理论,随着压力增加生物活性成分的溶解度随之增加[10],因此超高压处理加快了传质过程,压力越高,越多的提取溶剂能够进入细胞内部,随着提取溶剂进入细胞,更多的细胞内活性物质渗透出细胞外,从而增加提取率[11]。
但是提取溶剂是提取过程中一个重要方面,提取溶剂的物理性质(黏度、溶解性、极性等)也会影响提取效果。而超高压辅助提取过程中对提取溶剂物理性质的影响也可能进一步影响超高压辅助提取效果,有研究表明超高压能够通过压缩体积增加了溶剂浓度,增加溶解性,加快化学反应速率[12],超高压还能够降低水的介电常数,从而导致溶剂介质极性的减弱[13],并且高压条件下能够发生很多反应,比如立体异构化、阴离子聚合反应、合成反应、氢化作用等一些无机和有机反应[1],提取溶剂在超高压处理过程中的变化都可能是提取率增加的原因。
然而以往研究者多从超高压加强传质和超高压影响细胞通透性2 个方面分析超高压辅助提取机理,而对超高压处理过程中对提取溶剂性质的影响探讨不足。蓝莓中花色苷含量丰富,蓝莓加工后果渣中仍然含有大量花色苷成分,具有多种生理功能,传统的热提取会造成花色苷的降解,作为一种非热提取方法,超高压技术在花色苷提取应用中具有广阔的应用前景。基于此本实验首先从不同超高压提取条件对花色苷提取率的影响着手,进而研究超高压处理条件对提取溶剂物理参数的影响,尤其是超高压对醇水氢键的影响,最后从超高压提取过程中花色苷提取率和提取溶剂物理参数之间相关性探讨超高压辅助提取机理。
1 材料与方法
1.1 材料与试剂
蓝莓果渣取自兔眼蓝莓(南京市溧水区白马镇)发酵蓝莓酒后压榨所得。压榨所得果渣置于40 ℃干燥箱中干燥48 h后粉碎过100 目筛,避光-20 ℃冰箱内贮藏。其中花色苷总量为(208.53±20.38) mg/100 g干燥后样品。
乙醇、盐酸、氯化钾、乙酸钠(均为分析纯)国药集团化学试剂有限公司;氘代丙酮(氘代纯度)百灵威科技有限公司。
1.2 仪器与设备
UHPF/3 L/700 MPa超高压处理装置 包头科发高压科技有限责任公司;UV-1600紫外-可见分光光度计北京瑞利分析仪器公司;Nicolet iS50傅里叶红外光谱仪美国Thermo Fisher公司;AVANCEⅡ 400 MHz核磁共振波谱仪 瑞士Brüker公司。
1.3 方法
1.3.1 超高压提取条件对花色苷提取率的影响
超高压设备有效体积3 L,最高压力700 MPa,传压介质为癸二酸二辛酯,油温22 ℃,升压速率100 MPa/15 s,解压时间10 s,保压过程中压差不超过10 MPa。
准确称取蓝莓果渣5.00 g置于聚乙烯袋中,按照固液比1∶30(g/mL)加入150 mL提取溶剂(37%盐酸-66%乙醇(1∶99,V/V)),排尽空气后使用封口机热封口,处理条件分别为100、200、300、400、500、600 MPa压力处理5 min;400 MPa分别提取5、10、15、20、25、30 min。常压40 ℃提取30 min作为空白对照。花色苷提取率按下式计算:

1.3.2 提取压力对提取溶剂物理特性的影响
取50 mL提取溶剂(37%盐酸-66%乙醇(1∶99,V/V))于耐高压聚乙烯袋中,尽量排尽空气后使用封口机热封口,分别于100、200、300、400、500、600 MPa压力处理5 min。测定处理后提取溶剂的最大吸收波长、pH值、电导率、红外光谱、氢谱核磁共振谱。未处理提取溶剂作为空白对照,30 min内完成指标测定。
1.3.3 提取时间对提取溶剂物理特性的影响
取50 mL提取溶剂(37%盐酸-66%乙醇(1∶99,V/V))于耐高压聚乙烯袋中,尽量排尽空气后使用封口机热封口,400 MPa分别提取5、10、15、20、25、30 min。测定处理后提取溶剂的最大吸收波长、pH值、电导率、红外光谱、氢谱核磁共振谱。未处理提取溶剂作为空白对照,30 min内完成指标测定。
1.3.4 最大吸收波长、pH值、电导率的测定
最大吸收波长采用分光光度计测定,pH值使用酸度计测定,电导率采用电导率仪测定。
1.3.5 红外光谱测定
采用Nicolet iS50傅里叶红外光谱仪测定超高压处理前后提取溶剂红外光谱,仪器扫描范围为4 000~650 cm-1,使用金刚石ATR直接测定样品,测定条件为25 ℃,扫描64 次,分辨率4 cm-1,以空气作为背景。
1.3.6 氢谱核磁共振谱的测定
采用AVANCEⅡ 400 MHz核磁共振波谱仪测定,参考郑飞云等[14]方法有修改,将样品加入核磁管中,氘代丙酮试剂封在毛细管中锁场,TMS定标,氢核共振频率400 MHz,BBO探头,检测温度18 ℃。
1.4 数据处理
2 结果与分析
2.1 超高压提取条件对花色苷提取率的影响

图1 提取压力(A)和提取时间(B)对花色苷提取率的影响Fig.1 Effects of pressure and extraction time on anthocyanins yield
如图1A所示,提取压力对花色苷提取影响较大,随着压力的增加花色苷提取率也随之提高。与常压提取相比,100 MPa超高压提取能够快速增加花色苷提取率,但是300 MPa以上(500 MPa和600 MPa)压力花色苷提取率没有显著提高。
由图1B可以看出,400 MPa超高压提取不同时间对花色苷提取率影响不显著,但是与对照相比,5 min超高压提取能够显著增加花色苷提取率。随着提取时间的延长,花色苷提取率有所增加,但是当提取时间大于15 min后花色苷提取率反而有所下降,这可能与花 色苷在保压过程中降解有关。M’Hiri等[15]研究发现超高压虽然能够增加提取率,但是超高压引起的细胞破损在提高提取率的同时也会加快酶促反应,酶的氧化作用会导致酚类物质降解,研究发现超高压辅助提取时间如果超过20 min会引起黄酮类物质的分解。
2.2 提取压力对提取溶剂物理特性的影响
本实验所用提取溶剂是酸性乙醇溶液,乙醇分子和水分子在溶液中不是单独存在的,它们会以分子间氢键形式形成分子团簇。刘莹[16]研究发现根据乙醇体积分数不同,醇水分子之间形成的分子团簇也不相同,乙醇体积分数为40%时,1 个醇分子和5 个水分子形成一个团簇分子;而在乙醇体积分数为60%时,1 个醇分子和2 个水分子形成一个团簇分子;当乙醇体积分数达到80%时,5 个醇分子和6 个水分子形成一个新的团簇分子。不同的醇水分子团簇的物理性质不同,包括黏度、最大吸收波长、红外吸收光谱等。
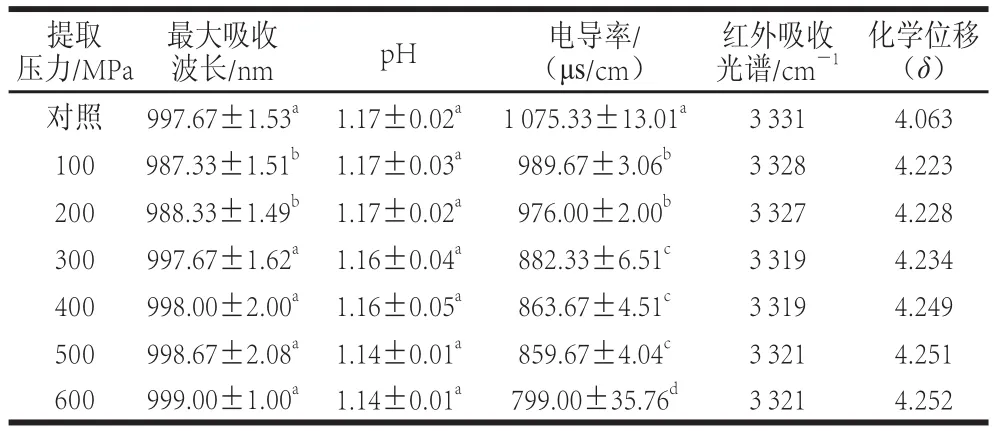
表1 提取压力对提取溶剂物理参数的影响Table1 Effects of pressure on physical properties of the extraction solvent
由表1可以看出,不同压力处理对提取溶剂的物理性质影响不同,超高压100 MPa和200 MPa处理5 min使提取溶剂的最大吸收波长蓝移,可能是提取溶剂极性有所增大或者分子间产生氢键引起的,这可能因为高压能使溶剂分子的电子发生了n→π*跃迁造成的结果。而300 MPa及以上压力处理后提取溶剂的最大吸收波长无显著变化,这可能是因为更高压力的超高压处理使溶剂分子进一步发生了重排。
随着压力增加提取溶剂pH值有降低趋势,但是不同超高压处理提取溶剂的pH值无显著变化,这说明不同压力处理提取溶剂对其pH值没有影响。尽管有研究表明超高压能够去质子化,改变溶剂的电离平衡,促进溶液电离平衡向生成H+方向进行,从而降低pH值[17-19],但是本实验研究发现超高压处理过程中并不能降低提取溶剂的(酸性乙醇)的pH值,这可能因为提取溶剂本身pH值较低(pH 1.17),因此超高压处理没有引起pH值的降低。
电导率是溶液的导电性,在排除温度、杂质等影响后,溶液中离子越多电导率越大。由表1可以看出,提取压力对提取溶剂的电导率有显著影响,随着压力增大,电导率降低,这表明随着超高压提取压力增大,提取溶剂的离子化降低,提取溶剂呈现趋于稳定的状态。Nose等[20]研究威士忌酒中醇水缔合体系时发现酸、酯类化合物会加强醇水溶液的氢键缔合作用,乙醇分子和水分子之间通过氢键缔合作用形成分子缔合群,会造成电导率下降和羟基质子化学位移向低场方向移动;从提取压力对pH值的影响也可以推断出类似结论,因为随着提取压力增加pH值并没有发生显著的降低。
红外光谱主要根据各个基团的振动频率来检测化合物的结构,分子中不同官能团或者化学键的吸收频率不同,在红外光谱中表现出不同位置的特征吸收峰。红外吸收光谱可以用来判断在含氢原子的分子体系(醇、酸、酚等)是否生成了分子间氢键,如果生成了分子间氢键,其红外吸收光谱会向低频区移动,谱峰变宽[21],如图2所示。
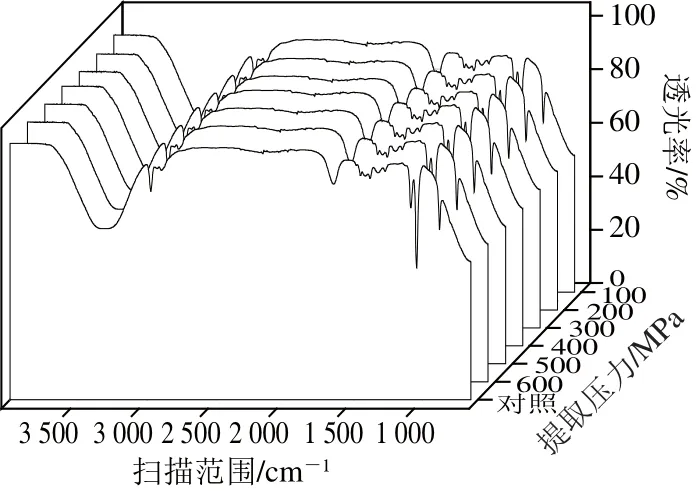
图2 不同提取压力条件下提取溶剂红外吸收光谱图Fig.2 Infrared absorption spectra of the extraction solvent at different pressures
水分子的O—H伸缩振动峰ν(OH)红外光谱位置在3 832.2 cm-1,但是在醇水溶液(提取溶剂)中由于水分子之间、醇分子之间以及水分子和醇分子之间形成了分子间氢键,从而引起ν(OH)向低频区移动,ν(OH)出现位置可以用来说明醇水体系中氢键缔合程度[22]。由表1可以看出,未超高压处理样品ν(OH)位置在3 331 cm-1,随着提取压力的增加,提取溶剂的ν(OH)向低频区移动,400 MPa处理5 min后ν(OH)处于3 319 cm-1,这表明超高压处理促进了提取溶剂中分子间氢键的形成,使提取溶剂更加稳定。但是当压力在500 MPa和600 MPa时,ν(OH)反而向高频区移动,这可能因为压力过高情况下,提取溶剂中分子间氢键被破坏。
氢谱核磁共振测定醇水体系中羟基质子化学位移可以反映醇水体系中3 种分子间(水分子和水分子、醇分子和醇分子、水分子和醇分子)的氢键缔合情况,化学位移的变化可以反映氢键缔合的强弱,如果化学位移向低场移动,则说明醇水分子间通过氢键作用增强了缔合度[23]。由表1可以看出,经过100~600 MPa超高压处理后,提取溶剂羟基质子化学位移(δ)分别为4.223、4.228、4.234、4.249、4.251、4.252,与对照δ相比(4.063),δ分别增加了0.160、0.165、0.171、0.186、0.188和0.189,羟基质子化学位移都向低场移动,并且随着提取压力增大,羟基质子化学位移向低场移动越多。这表明超高压处理通过氢键作用增加了提取溶剂分子间的缔合度,使醇分子和水分子之间结合更加紧密。酸能够促进羟基质子化学位移向低场移动,加强醇水分子缔合[24],也可以从这一方面解释在乙醇溶液中加入酸能够提高花色苷的提取率。
为了进一步分析不同压力处理花色苷提取率和提取溶剂物理参数的相关性,采用Pearson相关系数对不同压力处理花色苷和提取溶剂物理参数进行相关性分析,如表2所示。
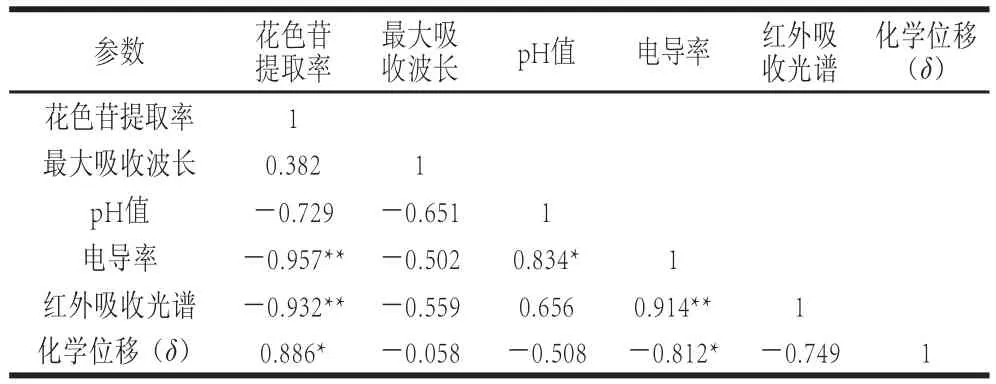
表2 不同压力处理花色苷提取率和提取溶剂物理参数之间相关性分析Table2 Pearson s correlation coefficients between anthocyanins yield and physical properties of the extraction solvent at different pressures
由表2可以看出,花色苷提取率和提取溶剂电导率、红外吸收光谱醇水羟基伸缩振动峰呈极显著负相关(r为-0.957和-0.932),和醇水羟基质子化学位移呈显著正相关(r为0.886)。这说明超高压辅助提取蓝莓果渣中花色苷是与在超高压辅助提取过程中压力改变提取溶剂物理性质有关,尤其是增加了醇水缔合度,增强了醇水氢键的稳定性。这可能因为醇水缔合度的增加引起了提取溶剂黏度的增加[25],从而增加了花色苷的提取率。Cano-Gómez等[26]在多个水-醇(甲醇、乙醇、丙醇等)体系中发现,随着压力增加水-醇体系的黏度增大,Tanaka[27]和Harris[28]等也在不同水-醇体系中发现了相似的结果。
2.3 提取时间对提取溶剂物理特性的影响
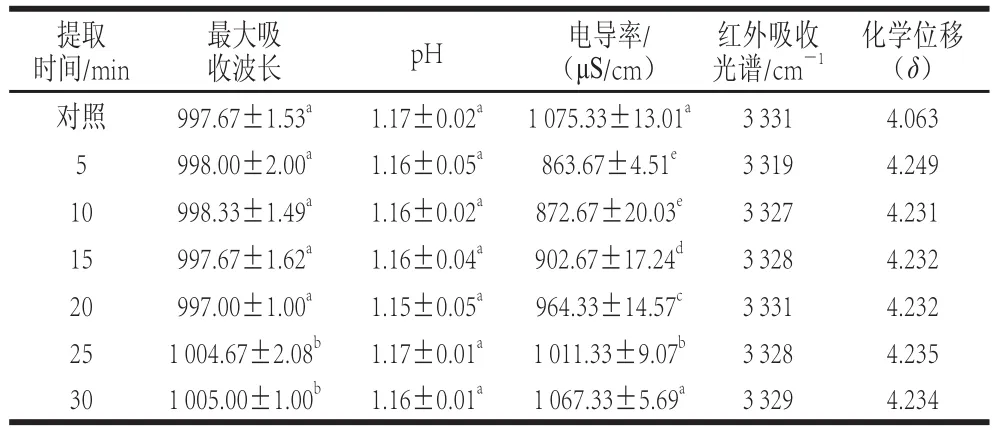
表3 提取时间对提取溶剂物理特性的影响Table3 Effects extraction time on physical properties of the extraction solvent
由表3可以看出,随着提取时间的延长(25 min和30 min),提取溶剂的最大吸收波长呈现红移现象,并且最大吸收波长变化较大;提取溶剂的pH值随着时间延长并没有显著变化。但是同时由表4可知,在相同压力不同提取时间条件下,最大吸收波长、pH值和花色苷提取率相关性不显著。
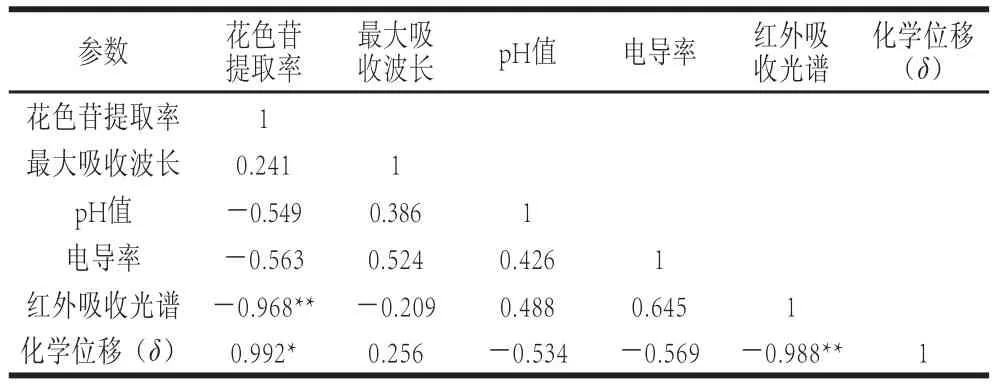
表4 不同提取时间条件下花色苷提取率和提取溶剂物理参数之间相关性分析Table4 Pearson s correlation coefficients between anthocyanins yield and physical properties of the extraction solvent at different extraction times
随着处理时间的延长,提取溶剂的电导率呈现增加趋势,400 MPa处理5 min和10 min提取溶剂的电导率没有显著差异,但是当处理时间超过15 min后电导率快速增加,并且差异显著,这表明随着处理时间的延长提取溶剂离子化增加。
提取溶剂的O—H伸缩振动峰ν(OH)位置随着超高压处理时间的延长表现出向高频区移动现象,这表明随着超高压处理时间延长提取溶剂中分子间氢键发生破坏,随着超高压处理时间进一步延长(25 min和30 min)O—H伸缩振动峰ν(OH)位置则又向低频区移动,这可能是因为随着时间延长提取溶剂达到一种新的平衡状态。同时氢谱核磁共振测定提取溶剂的羟基质子化学位移中也看到相似结果,随着处理时间延长,羟基质子位移向高场移动,说明提取溶剂分子间的氢键被破坏。超高压能够破坏食品中氢键,改变食品的物理性质[29],Martín等[30]发现超高压会破坏水分子间的氢键,而随着时间和压力的增加水分子之间会形成新的稳定结构群。同时从表4看出提取溶剂的O—H伸缩振动峰ν(OH)位置变化和花色苷提取率呈现极显著负相关,提取溶剂的羟基质子化学位移和花色苷提取率呈现显著正相关。
3 结 论
超高压辅助提取过程中会影响提 取溶剂的物理性质,包括提取溶剂的最大吸收波长、pH值、电导率、醇水氢键特征羟基的红外吸收和醇水氢键化学位移等。尤其是超高压处理过程中会影响醇水之间氢键,随着压力增加,醇水之间氢键更加稳定。
在不同提取压力保压5 min条件下,花色苷提取率、电导率和醇水氢键特征羟基的红外吸收呈极显著负相关,和醇水氢键化学位移呈显著正相关。
在不同提取时间处理400 MPa条件下,花色苷提取率和醇水氢键特征羟基的红外吸收光谱呈极显著负相关,和醇水氢键化学位移呈显著正相关。
在提取溶剂方面,超高压辅助提取之所以能够增加提取率是因为压力引起了提取溶剂分子间氢键的变化,氢键变化进一步引起了溶剂的物理性质发生改变,从而提高花色苷提取率。
[1] ZHANG S Q, ZHU J J, WANG C Z. Novel high pressure extraction technology[J]. International Journal of Pharmaceutics, 2004, 278(2): 471-474. DOI:10.1016/j.ijpharm.2004.02.029.
[2] HE X, YOON W B, PARK S J, et al. Effects of pressure level and processing time on the extraction of total phenols, flavonoids, and phenolic acids from Deodeok (Codonopsis lanceolata)[J]. Food Science and Biotechnology, 2011, 20(2): 499-505. DOI:10.1007/s10068-011-0069-7.
[3] LIU F, WANG D, LIU W, et al. Ionic liquid-based ultrahigh pressure extraction of five tanshinones from Salvia miltiorrhiza Bunge[J]. Separation and Purification Technology, 2013, 110: 86-92. DOI:10.1016/ j.seppur.2013.03.012.
[4] XI J, HE L, YAN L. Kinetic modeling of pressure-assisted solvent extraction of polyphenols from green tea in comparison with the conventional extraction[J]. Food Chemistry, 2015,16 6: 287-291. DOI:10.1016/j.foodchem.2014.06.026.
[5] PRASAD K, YANG B, ZHAO M, et al. Effects of high pressure or ultrasonic treatment on extraction yield and antioxidant activity of pericarp tissues of longan fruit[J]. Journal of Food Biochemistry, 2010, 34(4): 838-855. DOI:10.1111/j.1745-4514.2010.00335.x.
[6] ALTUNER E M, IŞLEK C, ÇETER T, et al. High hydrostatic pressure extraction of phenolic compounds from Maclura pomifera fruits[J]. African Jou rnal of Biotechnology, 2014, 11(4): 930-937. DOI:10.5897/ AJB11.2506.
[7] STRATI I F, GOGOU E, OREOPOULOU V. Enzyme and high pressure assisted extraction of carotenoids from tomato waste[J]. Food and Bioproducts Processing, 2015, 94: 668-674. DOI:10.1016/ j.fbp.2014.09.012.
[8] CORRALES M, GARC☒A A F, BUTZ P, et al. Extraction of anthocyanins from grape skins assisted by high hydrostatic pressure[J]. Journal of Food Engineering, 2009, 90(4): 415-421. DOI:10.10 16/ j.jfoodeng.2008.07.003.
[9] SUNWOO H H, GUJRAL N, HUEBL A C, et al. Application of high hydrostatic pressure and enzymatic hydrolysis for the extraction of ginsenosides from fresh ginseng root (Panax ginseng C.A. Myer)[J]. Food and Bioprocess Technology, 201 4, 7(5): 1246-1254. DOI:10.1007/ s11947-013-1234-1.
[10] AZMIR J, ZAIDUL I S M, RAHMAN M M, et al. Techniques for extraction of bioactive compounds from plant materials: a review[J]. Journal of Food Engineering, 2013, 117(4): 426-436. DOI:10.1016/ j.jfoodeng.2013.01.014.
[11] LEE H S, LEE H J, YU H J, et al. A comparison between high hydrostatic pressure extraction and heat extraction of ginsenosides from ginseng (Pana x ginseng C.A. Meyer)[J]. Journal of the Science of Food and Agriculture, 2011, 91(8): 1466-1473. DOI:10.1002/jsfa.4334
[12] RIVALAIN N, ROQUAIN J, DEMAZEAU G. Development of high hydrostatic pressure in biosciences: pressure effect on biological structures and potential applications in biotechnologies[J]. Biotechnology Advances, 2010, 28(6): 659-672. DOI:10.1016/j.biotechadv.2010.04.001.
[13] BARBA F J, TEREFE N S, BUCKOW R, et al. New opportunities and perspectives of high pressure treatment to improve health and safety attributes of foods. A review[J]. Food Research International, 2015, 77:725-742. DOI:10.1016/j.foodres.2015.05.015.
[14] 郑飞云, 姜甜, 董建军, 等. 酒类主要风味物质对乙醇-水体系中氢键的影响[J]. 食品科学, 2010, 31(9): 106-112.
[15] M’HIRI N, IOANNOU I, BOUDHRIOUA N M, et al. Effect of different operating conditions on the extraction of phenolic compounds in orange peel[J]. Food and Bioproducts Processing, 2015, 96: 161-170. DOI:10.1016/j.fbp.2015.07.010.
[16] 刘莹. 乙醇-水团簇分子的光谱学特征及分子结构研究[D]. 南京: 南京理工大学, 2006.
[17] KIM D, HAN G D. High hydrostatic pressure treatment combined with enzymes increases the extractability and bioactivity of fermented rice bran[J]. Innovative Food Science and Emerging Technologies, 2012, 16:191-197. DOI:10.1016/j.ifset.2012.05.014.
[18] HUANG H W, LUNG H M, YANG B B, et al. Responses of microorganisms to high hydrostatic pressure processing[J]. Food Control, 2014, 40: 250-259. DOI:10.1016/j.foodcont.2013.12.007.
[19] STIPPL V M, DELGADO A, BECKER T M. Ionization equilibria at high pr essure[J]. European Food Research and Technology, 2005, 221(1/2):151-156. DOI:10.1007/s00217-004-1130-z.
[20] NOSE A, HOJO M, SUZUKI M, et al. Solute effects on the interaction between water and ethanol in aged whiskey[J]. Journal of Agricultural and Food Chemistry, 2004, 52(17): 5359-5365. DOI:10.1021/jf0400516.
[21] 肖利民, 曾新安, 陈勇, 等. 电磁场催 陈新鲜干红葡萄酒红外光谱分析[J]. 食品科学, 2004, 25(1): 152-155. DOI:10.3321/ j.issn:1002-6630.2004.01.039.
[22] 曾新安, 高大维, 张本山. 电磁场催陈米酒氢键缔合红外光谱分析[J].食品与发酵工业, 2001, 27(6): 50-53. DOI:10.3321/j.issn:0253-990X.2001.06.011.
[23] NOSE A, HOJO M. Hydrogen bonding of water-ethanol in alcoholic beverages[J]. Journal of Bioscience and Bioengineering, 2006, 102(4):269-280. DOI:10.1263/jbb.102.269.
[24] MONAKHOVA Y B, MUSHTAKOVA S P, KUBALLA T, et al. Investigation into the structural composition of hydroalcoholic solutions as basis for the dev elopment of multiple suppression pulse sequences for NMR measurement of alcoholic beverages[J]. Magnetic Resonance in Chemistry, 2014, 52(12): 755-759. DOI:10.1002/mrc.4129.
[25] ROY M N, SINHA B. Viscous synergy and isentropic compressibility of some monoalkanols and cyclic ethers in water at 298.15 K[J]. Journal of Molecular Liquids, 2007, 133(1): 89-99. DOI:10.1016/ j.molliq.2006.07. 009.
[26] CANO-GÓMEZ J J, IGLESIAS-SILVA G A, RAMOS-ESTRADA M. Correlations for the prediction of the density and viscosity of 1-alcohols at high pressures[J]. Fluid Phase Equilibria, 2015, 404: 109-117. DOI:10.1016/j.fluid.2015.06.042.
[27] TANAKA Y, MATSUDA Y, FUJIWARA H, et al. Viscosity of (water + alcohol) mixtures under high pressure[J]. International Journal of Thermophysics, 1987, 8(2): 147-163. DOI:10.1007/BF00515199.
[28] HARRIS K R, WOOLF L A. Visc osity of water + tert-butyl alcohol (2-methyl-2-propanol) mixtures at low temperatures and high pressure[J]. Journal of Chemical and Engineering Data, 2009, 54: 581-588. DOI:10.1021/je800504n.
[29] PÁLINKÁS G, BOPP P, JANCSÓ G, et al. The effect of pressure on the hydrogen bond structure of liquid water[J]. Zeitschrift F ür Naturforschung A, 2014, 39(2): 179-185. DOI:10.1515/zna-1984-0211.
[30] MARTÍN M F S, BARBOSA-CANOVAS G V, SWANSON B G. Food processing by high hydrostatic pressure[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(6): 627. DOI:10.1080/20024091054274.
High Hydrostatic Pressure Enhances the Extraction of Anthocyanins from Blueberry Pomace by Changing Physical Properties of the Extraction Solvent
ZHANG Haining1,2, LI Xi1, MA Yongkun1,*
(1. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China; 2. School of Food and Drug, Luoyang Normal University, Luoyang 471000, China)
The high hydrostatic pressure extraction of anthocyanins from blueberry pomace was investigated with a focus on the mechanism by which high hydrostatic pressure (HHP) enhances the extraction of anthocyanins by affecting physical properties of the extraction solvent (a mixture of 37% HCl and 66% ethanol (1:99, V/V)). The results showed that HHP processing could affect physical properties of the extraction solvent including maximum absorption wavelength, pH value, conductivity, infrared absorption and chemical shift caused by the intermolecular hydrogen bonding between ethanol and water. With increasing pressure, the hydrogen bonding between ethanol and water became more stable. A significant correlation was found between the extraction yield of anthocyanins and infrared absorption and chemical shift from the intermolecular hydrogen bonding. In conclusion, HHP treatment could the intermolecular hydrogen bonding and therefore physical properties of the extraction solvent, leading to increased extraction yield of anthocyanins from blueberry pomace.
high hydrostatic pressure extraction; blueberry; anthocyanins; intermolecular hydrogen bonding; aqueous ethanol solution
10.7506/spkx1002-6630-201712029
TS255.3
A
1002-6630(2017)12-0190-06
张海宁, 李希, 马永昆. 超高压辅助提取对提取溶剂物理特性的影响[J]. 食品科学, 2017, 38(12): 190-195.
10.7506/ spkx1002-6630-201712029. http://www.spkx.net.cn
ZHANG Haining, LI Xi, MA Yongkun. High hydrostatic pressure enhances the extraction of anthocyanins from blueberry pomace by changing physical properties of the extraction solvent[J]. Food Science, 2017, 38(12): 190-195. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712029. http://www.spkx.net.cn
2016-07-17
江苏省普通高校研究生科研创新计划项目(CXZZ13_0696);江苏省高校优势学科建设工程项目(PAPD)
张海宁(1986—),男,博士,研究方向为食品非热加工技术、果蔬深加工。E-mail:zhn19862006@163.com
*通信作者:马永昆(1963—),男,教授,博士,研究方向为食品非热加工、食品发酵工程及食品风味化学。E-mail:mayongkun@ujs.edu.cn
