紫玉米苞叶花色苷与牛血清白蛋白相互作用研究
2017-06-22朱莉马越赵晓燕王丹
朱莉,马越,赵晓燕,王丹
(北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,农业部都市农业(北方)重点实验室,北京100097)
紫玉米苞叶花色苷与牛血清白蛋白相互作用研究
朱莉,马越,赵晓燕,王丹*
(北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,农业部都市农业(北方)重点实验室,北京100097)
采用荧光光谱法、紫外可见吸收光谱法、高效液相色谱法研究紫玉米苞叶花色苷与牛血清白蛋白(BSA)之间的相互作用。结果表明,紫玉米苞叶花色苷与BSA之间存在一定的相互作用,结合程度随着紫玉米苞叶花色苷浓度的增加而增加,二者结合后,会引起BSA结构的变化。紫玉米苞叶中6种主要的花色苷成分与BSA结合程度不同,其结合能力大小依次为:天竺葵-3-(6'-丙二酰葡萄糖苷)>芍药-3-(6'-丙二酰葡萄糖苷)>天竺葵-3-葡萄糖苷>矢车菊-3-葡萄糖苷>矢车菊-3-(6'-丙二酰葡萄糖苷)>芍药-3-葡萄糖苷。
紫玉米;花色苷;荧光光谱;紫外光谱;高效液相色谱
花色苷属类黄酮化合物,是植物的主要呈色物质之一[1-5],紫玉米花色苷的含量较高,且具有很好的生物活性。紫玉米花色苷具有抑制结肠癌细胞HT-29增殖的功能[6-7],能够提高小鼠的淋巴细胞转化能力、抗体生成细胞数和半数溶血值,提高小鼠的免疫功能;具有引起人类白血病和淋巴瘤(MOLT-4 and Daudi)凋亡的能力,且该能力与时间和剂量成依数性关系[8]。然而此类生物活性物质对光热等非常敏感,稳定性差,利用率极低,极大的限制了其应用及功效的发挥。由于花色苷不稳定、中国每年至少浪费数万吨以上的花色苷。目前,关于其稳定性的研究较多,包括辅助成色、添加食品添加剂、微胶囊化等等。但是,花色苷的不稳定性仍没有得到根本解决。花色苷稳定性决定其功能性,因此,花色苷的稳定性是其应用过程中的瓶颈问题。
牛血清白蛋白(BSA)是血浆中含量最丰富的蛋白质,并具有很多生理功能,比如:维持血液渗透压和酸碱度,除此之外,它还作为一些外源和内源化合物(脂肪酸、氨基酸、药物)的载体,参与其体内外运输过程[9]。由于BSA是外源药物的主要结合蛋白,并且与人血清蛋白有高度的同源性,因此,BSA常被作为模型蛋白,用于研究一些化合物与其相互作用,从而反映这些物质在体内的活动情况[10-12]。近来研究表明笃斯越桔花色苷与乳清蛋白相互作用可以提高花色苷的稳定性[13],不同来源花色苷结构及功效不同。紫玉米花色苷能否与BSA相互作用鲜有报道。
本文采用紫外光谱、荧光光谱、高效液相色谱法研究紫玉米苞叶花色苷与BSA之间的相互作用,分析紫玉米苞叶中不同花色苷与BSA的结合效果,为花色苷的进一步应用提供理论基础及技术支持。
1 材料与方法
1.1 材料与设备
紫玉米苞叶(涿紫一号):由北京市农林科学院蔬菜研究中心农产品加工实验室提供。
乙腈(色谱纯)、甲醇(色谱纯):Dima技术公司;甲酸、乙醇、盐酸(分析纯):北京化工厂;Tris:北京银丰科技发展有限公司;牛血清白蛋白(BSA):上海罗氏制药有限公司。
液质联用仪(HPLC 1200 series,IonTrap 6310):安捷伦公司;旋转蒸发仪(BüCHI R-215):瑞士布奇公司;CHRIST真空冷冻干燥机(ALPHR Z-4 LD PLUS):北京博励行仪器有限公司;层析仪(AKTA explorer):美国通用电气;酶标仪(Spectra Max i3):美国丹纳公司。
1.2 试验方法
1.2.1 紫玉米苞叶花色苷的提取
取紫玉米苞叶10 g,置于搅拌机中粉碎1 min,成粉末状。使用的提取溶剂为体积分数60%的乙醇水溶液,并用1 mol/L的盐酸将提取溶剂的pH值调为3;料液比为1∶50(g/mL);提取温度50℃;提取时间1 h;提取次数1次。提取结束后,将提取物进行过滤,其中上清液再放入旋转蒸发仪中旋蒸以得到花色苷的粗提取物,温度设为60℃。
1.2.2 大孔树脂纯化
AmberliteXAD-7大孔树脂预处理后,填装在1.6 cm/ 60 cm的填装柱中,将上述粗提物上样,流速为7 mL/ min,0.5%甲酸水冲洗后,采用0.5%甲酸的甲醇洗脱,收集红色液体,45℃条件下旋转蒸发得到浓缩液,冷冻干燥成干粉备用。
1.2.3 紫玉米苞叶花色苷提取物与BSA相互作用荧光光谱分析
取一定量 BSA固体溶于 0.05 mol/L,pH7.4的Tris-HCl缓冲液,并用缓冲液稀释至1.1×10-7g/mL,备用,取BSA储备液100 μL于非透明96孔板中,向其中加入不同浓度(0 g/mL、9.5×10-7g/mL、3.8×10-6g/mL、7.6× 10-6g/mL、1.1×10-5g/mL、1.5×10-5g/mL、1.9×10-5g/mL)的花色苷溶液100 μL,其中向不加花色苷溶液的处理组中加入100 μL无水乙醇,将其视为空白对照,置于25℃条件下10 min,使其充分反应,利用酶标仪分析加入花色苷前后荧光光谱的变化,测定参数为激发波长260 nm,发射波长范围290 nm~450 nm。
1.2.4 紫玉米苞叶花色苷提取物与BSA相互作用紫外光谱分析
取上述提取的紫玉米苞叶花色苷干粉,用无水乙醇配置花色苷溶液并稀释,使其花色苷浓度为1.92× 10-4g/mL,作为备用溶液。取备用花色苷溶液10 μL于透明96孔板中,并向其中加入不同浓度(0、1×10-3、2× 10-3、3×10-3、4×10-3、5×10-3)的BSA溶液100 μL,向不加BSA溶液的处理组中加入100 μL Tris/HCl缓冲溶液,将其视为空白对照。在25℃条件下静置10 min,使其充分反应,利用酶标仪进行光谱扫描,扫描波长范围为400 nm~750 nm。分析加入BSA溶液前后吸收光谱的变化。
1.2.5 高效液相色谱分析紫玉米苞叶花色苷提取物与BSA相互作用
配置好的花色苷溶液,经45 mm滤膜过滤备用,取滤液100 μL与0.01 g/mL、100 μL的BSA溶液(100 μL的Tris/HCl酸缓冲液,作为空白对照)混合充分混合,室温下反应15 min后,加入200 μL,5%的甲酸醇溶液,放置30 min,经45 mm滤膜,去除沉淀(蛋白及与蛋白结合的花色苷)后,进入液相分析。根据赵晓燕等[14]用HPLC-MS法研究黑树莓花色苷分子结构的检测方法,做适当调整,设置HPLC检测条件:流动相A为5%甲酸水,B相为乙腈;进样量:20 μL;流速:0.6 mL/min;线性洗脱梯度为:0~15 min 10%B,15 min~17 min 40%B,17 min~20 min 100%B,20 min~25 min 100%B,25 min~26 min 10%B。观察反应前后峰面积变化。
1.2.6 数据统计
采用DPS数据分析软件Duncan新复极差法(P< 0.05),Origin7.5软件作图;试验重复3次。
2 结果与讨论
2.1 BSA与紫玉米苞叶花色苷相互作用的荧光光谱
图1反应了BSA与不同浓度紫玉米苞叶花色苷在25℃条件下相互作用后荧光光谱的变化。
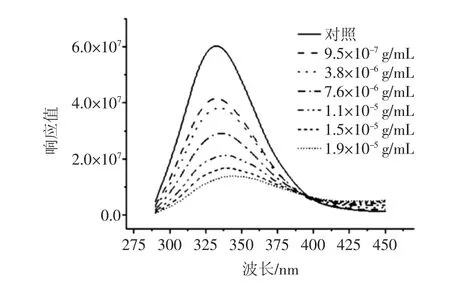
图1 牛血清白蛋白与不同浓度紫玉米苞叶花色苷提取液反应的荧光光谱Fig.1 The fluorescence quenching spectra of bovine serum albumin(BSA)combined with different concentration ofanthocyanins extracted purple corn bract
由图1可知,随着紫玉米苞叶花色苷浓度的增加,BSA的荧光强度逐渐下降,说明紫玉米苞叶花色苷与BSA之间存在一定的相互作用,这与Li Shu等[15]对天竺葵-3-O-葡萄糖苷和BSA之间的相互作用的研究结果一致。色氨酸、酪氨酸、苯丙氨酸是组成BSA主要的氨基酸残基,同时也为BSA提供其所固有的荧光效应。BSA荧光光谱的最大发射峰通常在340 nm处[16]。由图1可见,光谱有轻微的红移,推测紫玉米苞叶花色苷与BSA反应会对BSA结构产生影响。
2.2 BSA与紫玉米苞叶花色苷相互作用的紫外可见光谱
图2表示了紫玉米苞叶花色苷与不同浓度BSA相互作用后紫外吸收光谱的变化情况。
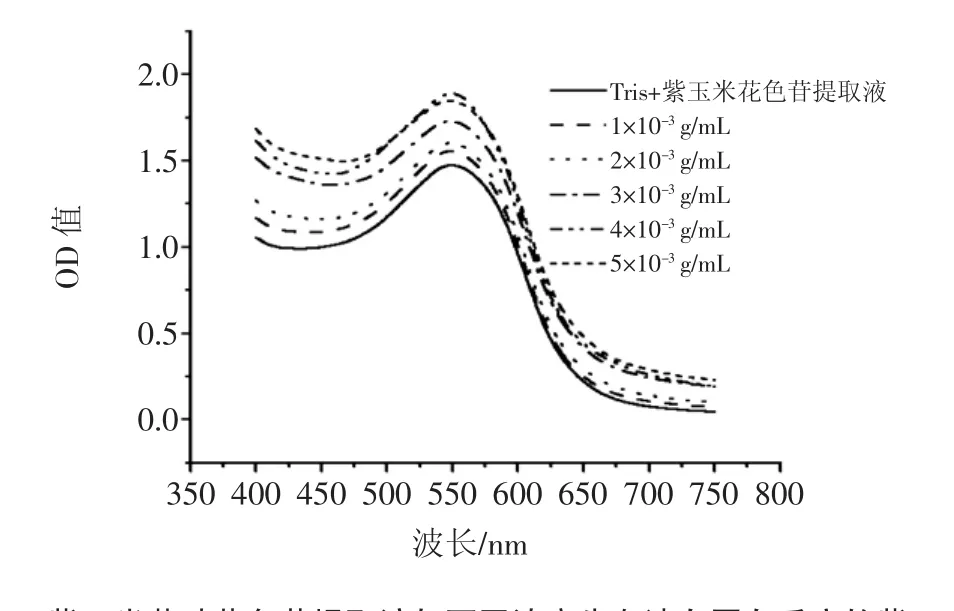
图2 紫玉米苞叶花色苷提取液与不同浓度牛血清白蛋白反应的紫外光谱Fig.2 The UV/VISabsorption spectrum of anthocyanins extracted from purple corn bract combined with different concentration of bovine serum albumin(BSA)
由图2可知,吸收峰峰值随着BSA浓度的增加而增加,并且光谱有轻微红移现象发生,说明紫玉米苞叶花色苷提取物与BSA之间存在相互作用,与荧光猝灭实验结果一致。除此之外,参考荧光猝灭机理[17-18],紫外光谱实验可以进一步说明BSA与紫玉米苞叶花色苷之间的荧光猝灭反应属于静态猝灭过程而非动态猝灭。
2.3 高效液相色谱分析紫玉米苞叶花色苷与BSA相互作用
紫玉米苞叶花色苷主要成分见表1,主要是以矢车菊、天竺葵、芍药色素为苷元的多糖和酰基化结合的糖苷。紫玉米苞叶花色苷与BSA相互作用的HPLC分析结果见图3,图中横坐标与表1物质对应,图3主要反应了紫玉米苞叶中主要的花色苷成分与BSA结合能力的大小,结合能力由峰面积减少量表示。
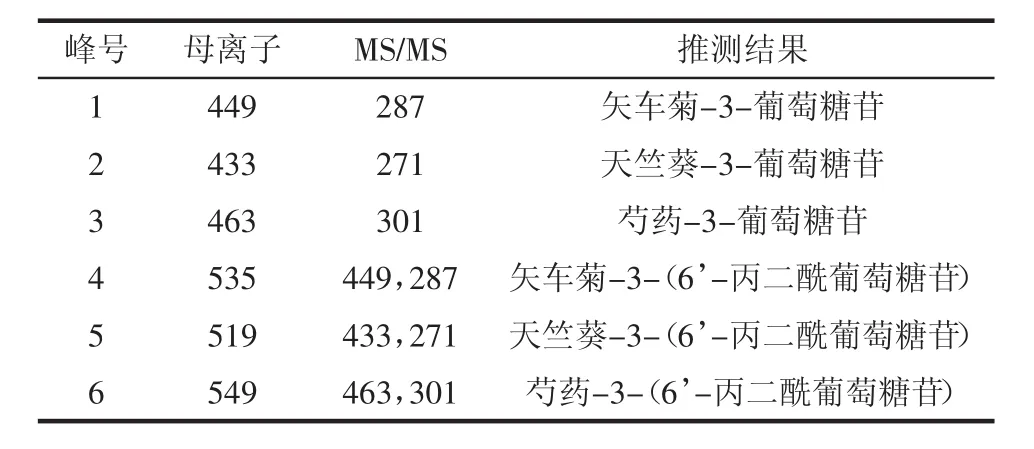
表1 紫玉米苞叶花色苷的质谱分析Table 1 MS data of anthocyanidin from purple corn brack
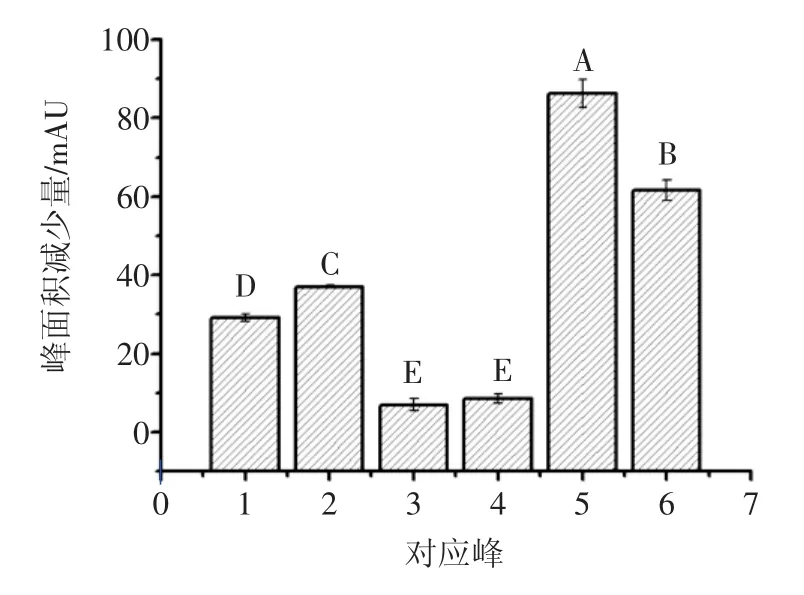
图3 紫玉米苞叶花色苷提取液与牛血清白蛋白反应的HPLC分析Fig.3 HPLC analysis of purple corn husks of anthocyanins combined with bovine serum albumin
从图3中可以得出,由于花色苷结构不同,造成与BSA结合程度存在显著性差异(P<0.05),其中5号峰,天竺葵-3-(6’-丙二酰葡萄糖苷)与BSA结合程度最强,而芍药-3-葡萄糖苷和矢车菊-3-(6’-丙二酰葡萄糖苷)与BSA结合能力较差。紫玉米苞叶中主要的花色苷与BSA结合程度大小依次为:天竺葵-3-(6’-丙二酰葡萄糖苷)>芍药-3-(6’-丙二酰葡萄糖苷)>天竺葵-3-葡萄糖苷>矢车菊-3-葡萄糖苷>矢车菊-3-(6’-丙二酰葡萄糖苷)>芍药-3-葡萄糖苷。
3 结论
紫玉米苞叶花色苷与BSA之间存在一定的相互作用,荧光猝灭遵循静态猝灭机理。紫玉米苞叶中6种主要的花色苷成分与BSA结合程度存在显著性差异,结合程度大小依次为:天竺葵-3-(6’-丙二酰葡萄糖苷)>芍药-3-(6’-丙二酰葡萄糖苷)>天竺葵-3-葡萄糖苷>矢车菊-3-葡萄糖苷>矢车菊-3-(6’-丙二酰葡萄糖苷)>芍药-3-葡萄糖苷。此结果为进一步对紫玉米苞叶花色苷与BSA作用机理的研究提供理论基础。
[1]唐传核,彭志英.天然花色苷类色素的生理功能及应用前景[J].冷饮与速冻食品工业,2000,6(1):26-28
[2]Castañeda-Ovando A,Pacheco-Hernández M,Páez-Hernández M, et al.Chemical Studies of Anthocyanins:A Review[J].Food Chemistry,2009,113:859-871
[3]孙建霞,张燕,孙志健,等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学,2009,30(5):263-268
[4]徐渊金,杜琪珍.花色苷生物活性的研究进展[J].食品与机械, 2006,22(6):154-157
[5]Williams C,Grayer R.Anthocyanins and other flavonoids[J].Natural Product Reports.2004,21(4):539-573
[6]Jing P,Bomser J A,Schwartz S J,et al.Structure-function relationships of anthocyanins from various anthocyanin-rich extracts on the inhibition of colon cancer cell growth[J].Journal of Agricultural and Food Chemistry,2008,56(20):9391-9398
[7]Xiaoyan Zhao,Chao Zhang,Claudia Guigas,et al.Composition,antimicrobial activity,and antiproliferative capacity of anthocyanin extracts of purple corn(Zea mays L.)from China[J].European Food Research and Technology,2009,228(5):759-765
[8]Feng R,Wang S Y,Ni H,et al.Apoptosis of myelocytic leukemia HL-60 cells by polyphenol compound cyaniding-3-rutinoside is mediated by redox stress[J].Fifth AACR International Conference on Frontiers in Cancer Prevention Research,2006(3):A90
[9]Ascenzi P,Fasano M.Pseudo-enzymatic hydrolysis of 4-nitrophenyl acetate by human serum albumin:pH-dependence of rates of individual steps[J].Biochem Biophys Res Commun,2012,424(3):451-455
[10]Kratz F.Albumin as a drug carrier:design of prodrugs,drug conjugates and nanoparticles[J].J Control Release,2008,132(3):171-83
[11]Bolli A,Marino M,Rimbach G,et al.Flavonoid binding to human serum albumin[J].Biochem Biophys Res Commun,2010,398:444-449
[12]Shu Y,Xue W,Xu X,et al.Interaction of erucic acid with bovine serum albumin using a multi-spectroscopic method and molecular docking technique[J].Food Chem,2015,173:31-37
[13]李文秀.几种中药小分子与牛血清白蛋白的相互作用研究[D].长沙:中南大学,2009
[14]赵晓燕,马越,张超.HPLC-DAD-ESI-MS法研究黑树莓花色苷分子结构[J].农产品加工(创新版),2011(12):41-44
[15]Li S,Tang L,Bi H.Study on the interaction between pelargonidin-3-O-glucoside and bovine serum albumin using spectroscopic, transmission electron microscopy and molecular modeling techniques[M]//Problems and materials on debtor and creditor law/. Wolters Kluwer Law&Business,2015:594-618
[16]Lin T,Zhang D,Xu S,et al.Different spectroscopic and molecular modeling studies on the interaction between cyanidin-3-O-glucoside and bovine serum albumin[J].Luminescence,2014,29(2):168-175
[17]Patel R,Mir MUH,Maurya JK,et al.Spectroscopic and molecular modelling analysis of the interaction between ethane-1,2-diyl bis (N,N-dimethyl-Nhexadecylammoniumacetoxy)dichloride and bovine serum albumin[J].Luminescence,2015,30:1233-1241
[18]Xu H,Liu Q,Wen Y.Spectroscopic studies on the interaction between nicotinamide and bovine serum albumin[J].Spectrochim Acta A,2008,71(3):984-988
Study on the Interaction between Purple Corn Bract Anthocyanins and Bovine Serum Albumin
ZHU Li,MA Yue,ZHAO Xiao-yan,WANG Dan*
(Beijing Academy of Agriculture and Forestry Vegetable Research Center,Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(North China),Ministry of Agriculture,P.R.China,Key Laboratory of Urban Agriculture(North),Ministry of Agriculture,P.R.China,Beijing 100097,China)
Fluorescence spectrometry,UV-VIS absorption spectroscopy,and high-performance liquid chromatography(HPLC)were used to research the interaction between purple corn bract anthocyanins and bovine serum albumin(BSA).The results showed that there was a relationship on the purple corn anthocyanins bract and BSA.The bonding degree increased with the increase of the concentration of anthocyanins.Furthermore,the structure of BSA was changed after the combination.The binding abilities of six anthocyanins in purple corn bract was different.The order of combining ability was as follows:pelargonidin-3-(6'-malonylglucoside)>peonidin-3-(6'-malonylglucoside)>pelargonidin-3-glucoside>cyanidin-3-glucoside>cyanidin-3-(6'-malonylglucoside)>peonidin-3-glucoside.
purple corn;anthocyanin;fluorescence spectrum;ultraviolet spectrum;HPLC
10.3969/j.issn.1005-6521.2017.12.004
2016-09-28
北京市农林科学院青年科研基金(QNJJ201603);北京市科技新星计划(Z131105000413023)
朱莉(1991—),女(汉),硕士,研究方向:农产品加工及贮藏工程。
*通信作者:王丹,女,教授,博士,研究方向:农产品加工及贮藏工程。
