外源脯氨酸对镍胁迫下小麦幼苗生长的影响
2017-06-22巴青松张根生张典典李桂萍宋运贤陶兴魁胡玉玲傅兆麟
巴青松,张根生,张典典,李桂萍,宋运贤,陶兴魁,胡玉玲,傅兆麟
(1.淮北师范大学生命科学学院/资源植物生物学安徽省重点实验室,安徽淮北 235000;2.宿州学院生物与食品工程学院,安徽宿州 234000)
外源脯氨酸对镍胁迫下小麦幼苗生长的影响
巴青松1,张根生1,张典典1,李桂萍1,宋运贤1,陶兴魁2,胡玉玲1,傅兆麟1
(1.淮北师范大学生命科学学院/资源植物生物学安徽省重点实验室,安徽淮北 235000;2.宿州学院生物与食品工程学院,安徽宿州 234000)
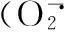
脯氨酸;镍胁迫;活性氧代谢;小麦
镍是植物必需的一种微量元素,同时也是重金属污染物[1]。过量的镍进入土壤后,会在土壤中富集,抑制植物生长;进入植物体的镍还可通过食物链直接或间接危害人体健康[2]。研究发现,植物的许多金属毒害均与活性氧代谢平衡被破坏而引起的活性氧大量积累密切相关,从活性氧代谢角度研究镍胁迫下植物的生理变化,可能有利于揭示植物镍中毒的生理机制。脯氨酸(Pro)是有效的有机渗透调节物质,可与重金属形成络合物,降低金属离子的活性[3];还可以清除细胞内活性氧(Reactive oxygen species,ROS)以维持膜结构的稳定,缓解氯化钠和镉胁迫对植物的影响[4-5]。关于外源脯氨酸对镍胁迫下小麦幼苗根系生长和活性氧代谢的影响还少见报道。因此,本试验抑研究镍胁迫下,外源Pro对小麦幼苗根系生长和活性氧代谢的影响,为揭示植物镍中毒生理机制、提高作物产量及品质提供理论依据。
1 材料与方法
1.1 材料与设计
供试材料为小麦品种轮选988。
取均匀、饱满种子,0.1%HgCl2消毒后,清水浸泡24 h,平铺在放有滤纸的培养皿上。于25 ℃、200 μmol·m-2·s-1光照强度、光暗比12/12的培养箱中培养,每天加入适量去离子水。水培一周后,用体积相同含有100 μmol·L-1NiSO4和不同浓度脯氨酸(0、1、2.5、5、7.5、10、15、12.5、15和20 mmol·L-1)的溶液分别培养,分别记作T0、T1、T2.5、T5、T7.5、T10、T12.5、T15和T20,以蒸馏水培养的为对照(CK)。每天更换一次处理液,每个处理30株幼苗,每个处理3次重复,处理7 d后进行各项指标的测定。
1.2 测定项目与方法
1.2.1 小麦幼苗生长指标的测定
处理7 d后,随机取30株小麦幼苗,测定其株高、根长、根鲜重和根干重。
1.2.2 小麦幼苗根系生理指标的测定
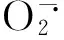
1.3 数据分析
采用SPASS 19.0和 Sigma Plot 10.0软件分别进行统计分析和作图。
2 结果与分析
2.1 外源Pro对镍胁迫下小麦植株生长指标的影响
由表1可以看出,外源Pro对Ni2+胁迫小麦幼苗的生长有显著影响,随外源Pro浓度的升高,小麦幼苗的形态指标呈先上升后下降的趋势,以T5处理效果最好。T5和T0处理相比较,根长、株高、鲜重和干重分别提高了24.8%、12.5%、16.0%、20.0%,均有显著差异。说明5 mmol·L-1外源Pro对100 μmol·L-1NiSO4胁迫小麦幼苗的生长有明显促进作用,可有效缓解镍对小麦幼苗生长的毒害程度。
2.2 外源Pro对镍胁迫下小麦根系抗氧化酶活性的影响
由表2可知,T5处理下,小麦根系四种被测抗氧化酶的活性较单独Ni2+处理均显著提高。SOD、POD、APX和CAT酶活分别升高了54.30%、43.00%、13.08%和67.67%。由此可见,5 mmol·L-1外源Pro可以提高小麦幼苗中上述四种酶的活性,缓解镍胁迫对小麦幼苗的毒害程度。
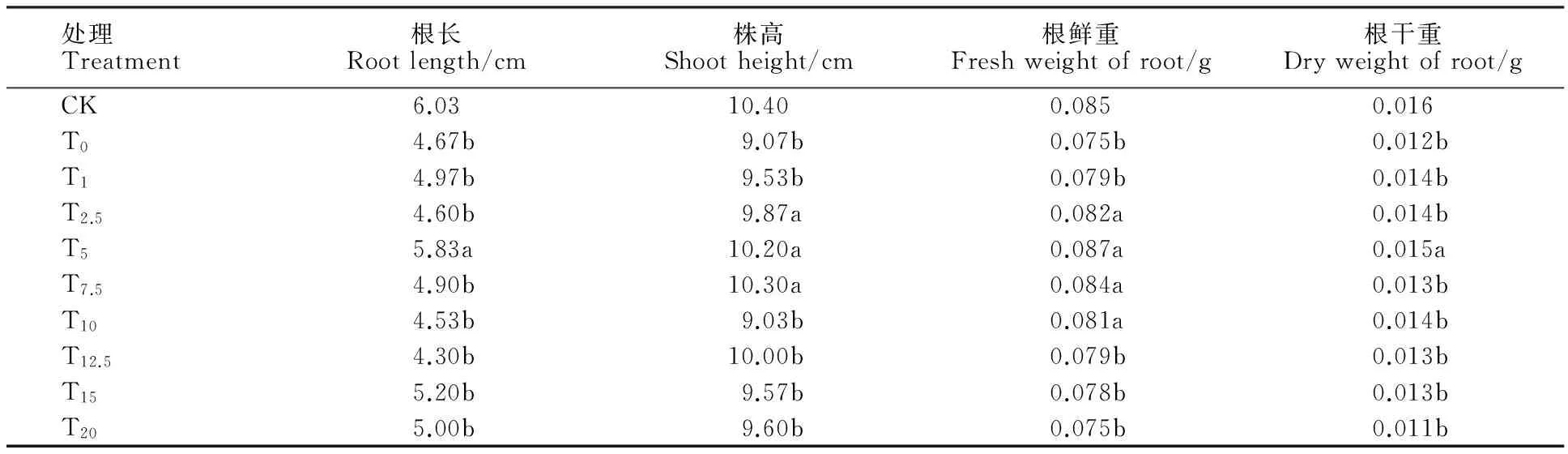
表1 外源Pro对镍胁迫下小麦植株生长指标的影响
同列数据后不同字母表示处理间差异显著(P<0.05)。下同。
Different letters following data mean significant difference among different treatments at 0.05 level.The same below.

表2 外源Pro对镍胁迫下小麦根系SOD、 POD 、CAT、APX活性的影响
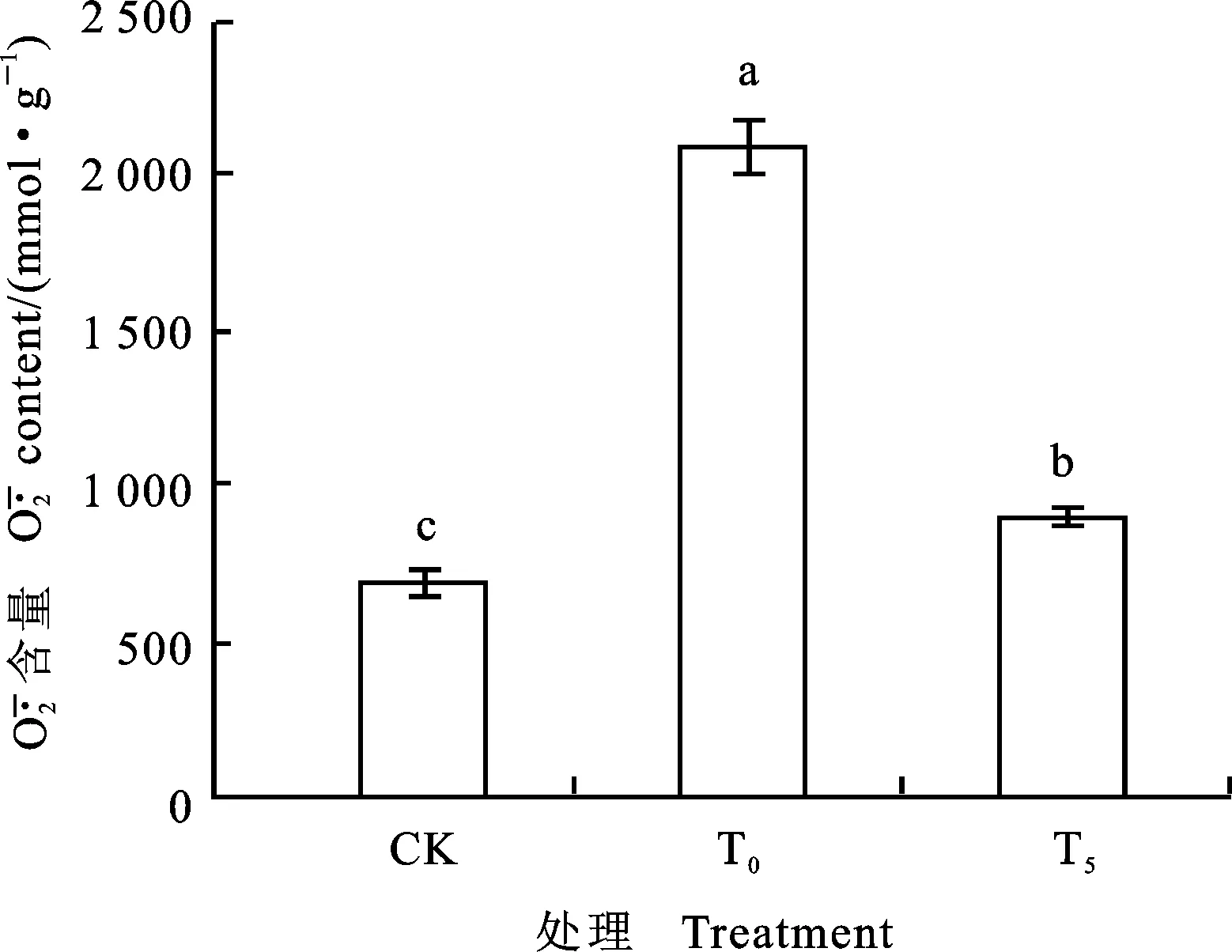
图柱上不同字母表示处理间差异显著。下同。
Different letters above columns mean significant difference among different treatments at 0.05 level.The same below.

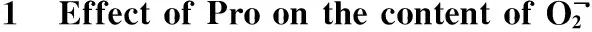
2.4 外源Pro对镍胁迫下小麦根系可溶性糖、游离Pro含量的影响
由图3、4可以看出,单独Ni2+胁迫下,小麦幼苗根系可溶性糖和游离脯氨酸含量与对照相比,分别增加了34.18%和200.60%,差异显著。T5处理后,与单独Ni2+胁迫比较,小麦幼苗可溶性糖和游离脯氨酸的含量下降了36.86% 和42.38%,差异显著。可溶性糖的含量基本恢复至对照水平。说明镍胁迫下5 mmol·L-1外源Pro可有效调控根系渗透调节能力。
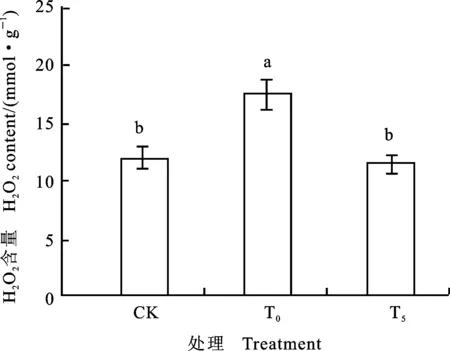
图2 外源Pro对镍胁迫下小麦幼苗H2O2含量的影响
2.5 外源Pro对镍胁迫下小麦根系MDA含量的影响
由图5知, Ni2+胁迫下,小麦幼苗MDA含量与CK相比上升了47.83%,差异显著。说明过量的Ni2+可导致小麦根系过氧化损伤加重。5 mmol·L-1Pro处理后,与单独Ni2+胁迫比较,小麦幼苗MDA的含量下降了32.35%,差异显著,基本恢复至正常水平。由此可见,5 mmoL·L-1外源Pro处理,具有降低小麦根系细胞膜脂过氧化作用,可有效缓解根系Ni2+胁迫。
2.6 外源Pro对镍胁迫下小麦幼苗根系活力的影响
图6表明,与CK比较,Ni2+处理小麦根系活力下降了91.57%,差异显著;外施5 mmol·L-1Pro后,小麦幼苗的根系活力升高了233.83%,差异显著。
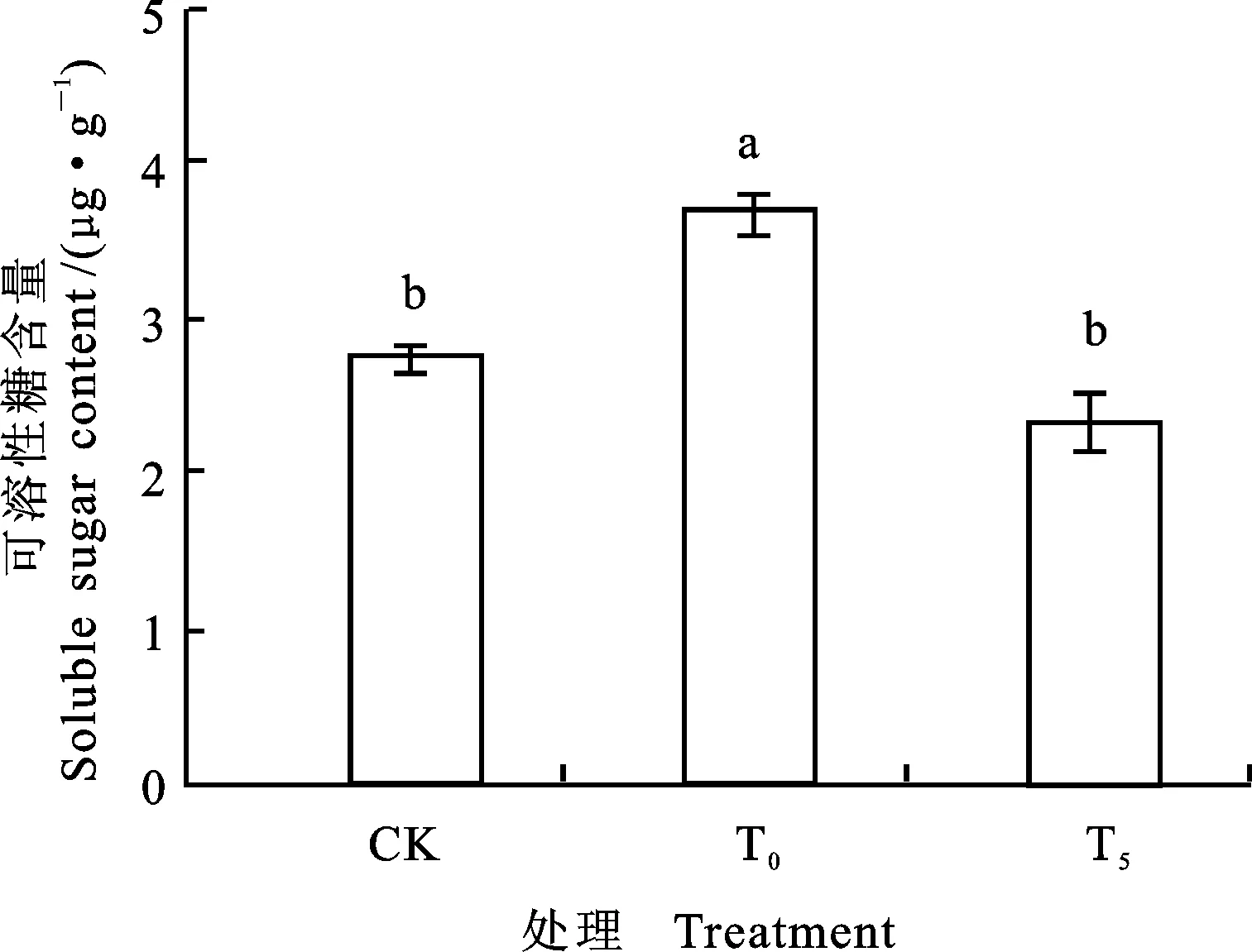
图3 外源Pro对镍胁迫下小麦幼苗可溶性糖含量的影响
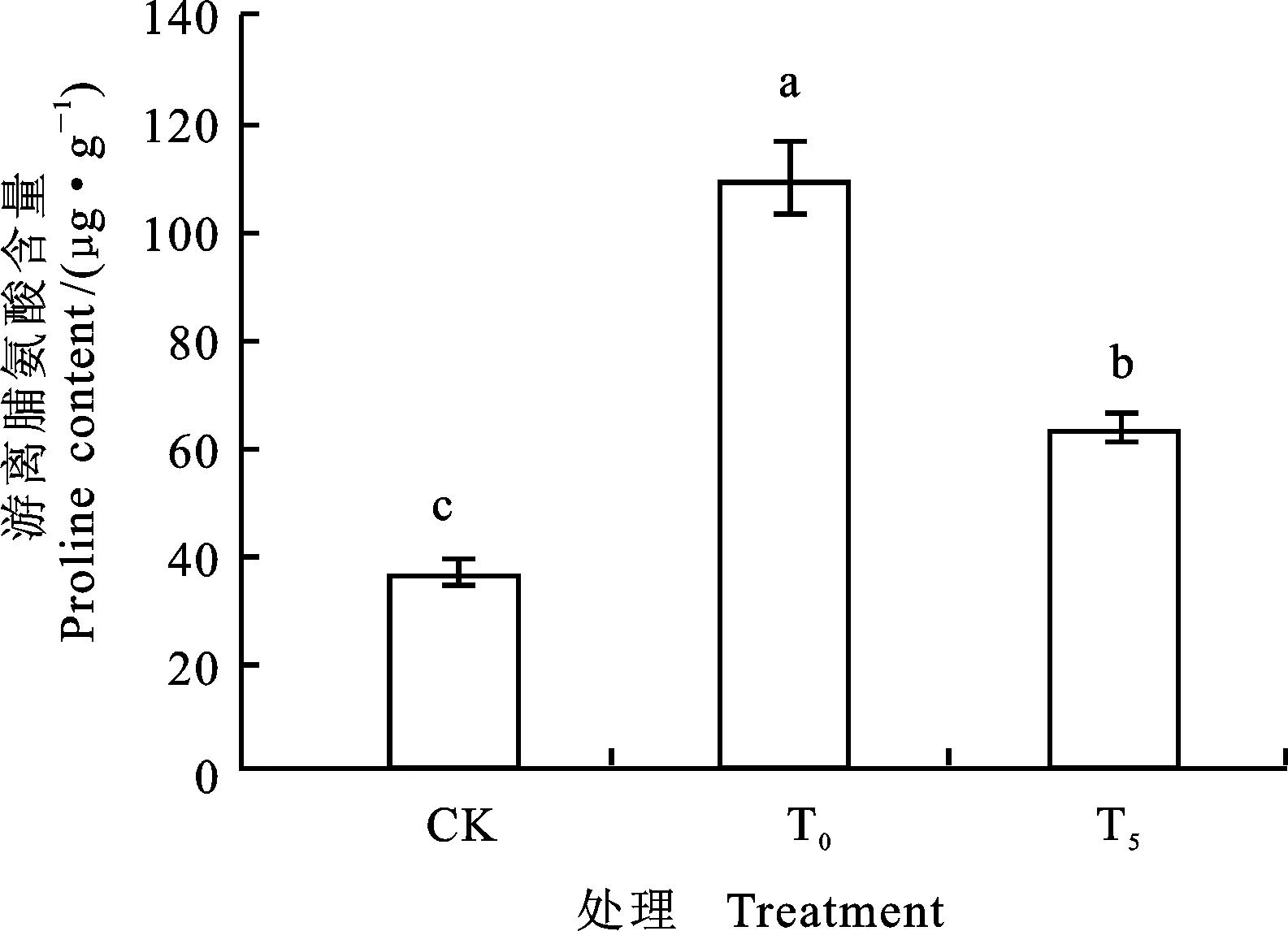
图4 外源Pro对镍胁迫下小麦幼苗游离Pro含量的影响
3 讨 论
高浓度Ni2+处理能够降低小麦根系鲜重和根长度,抑制幼苗生长[16]。小麦中Pro以游离状态存在,非生物胁迫下,植物体内源Pro含量有明显的变化[17-18]。研究发现,外施Pro能够提高盐胁迫下植物的生长能力[19]。本试验结果表明,5 mmol·L-1外源Pro可显著提高小麦Ni2+胁迫下的根长、株高和根重,说明外源Pro可以缓解小麦Ni2+胁迫。
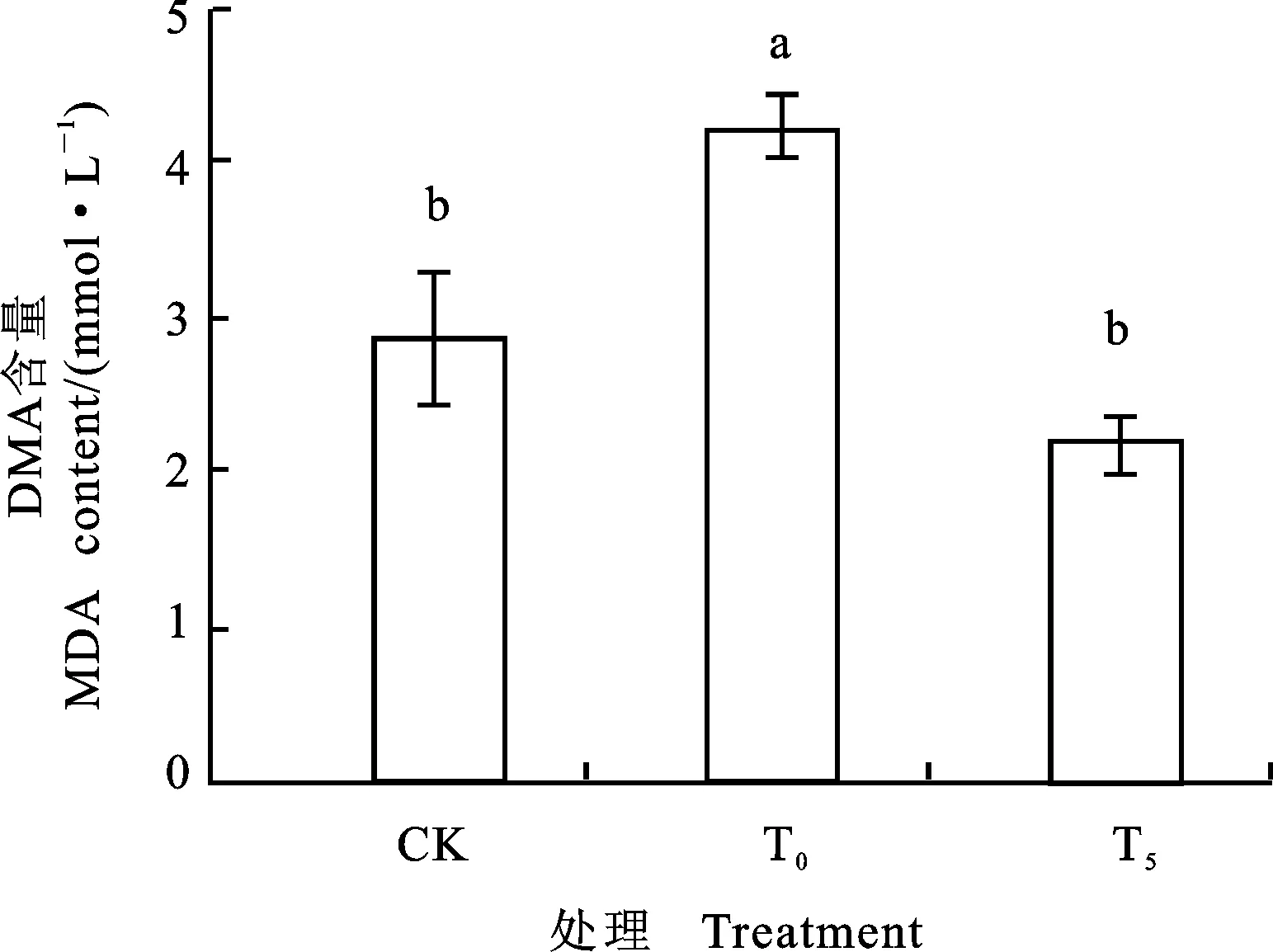
图5 外源Pro对镍胁迫下小麦幼苗MDA含量的影响
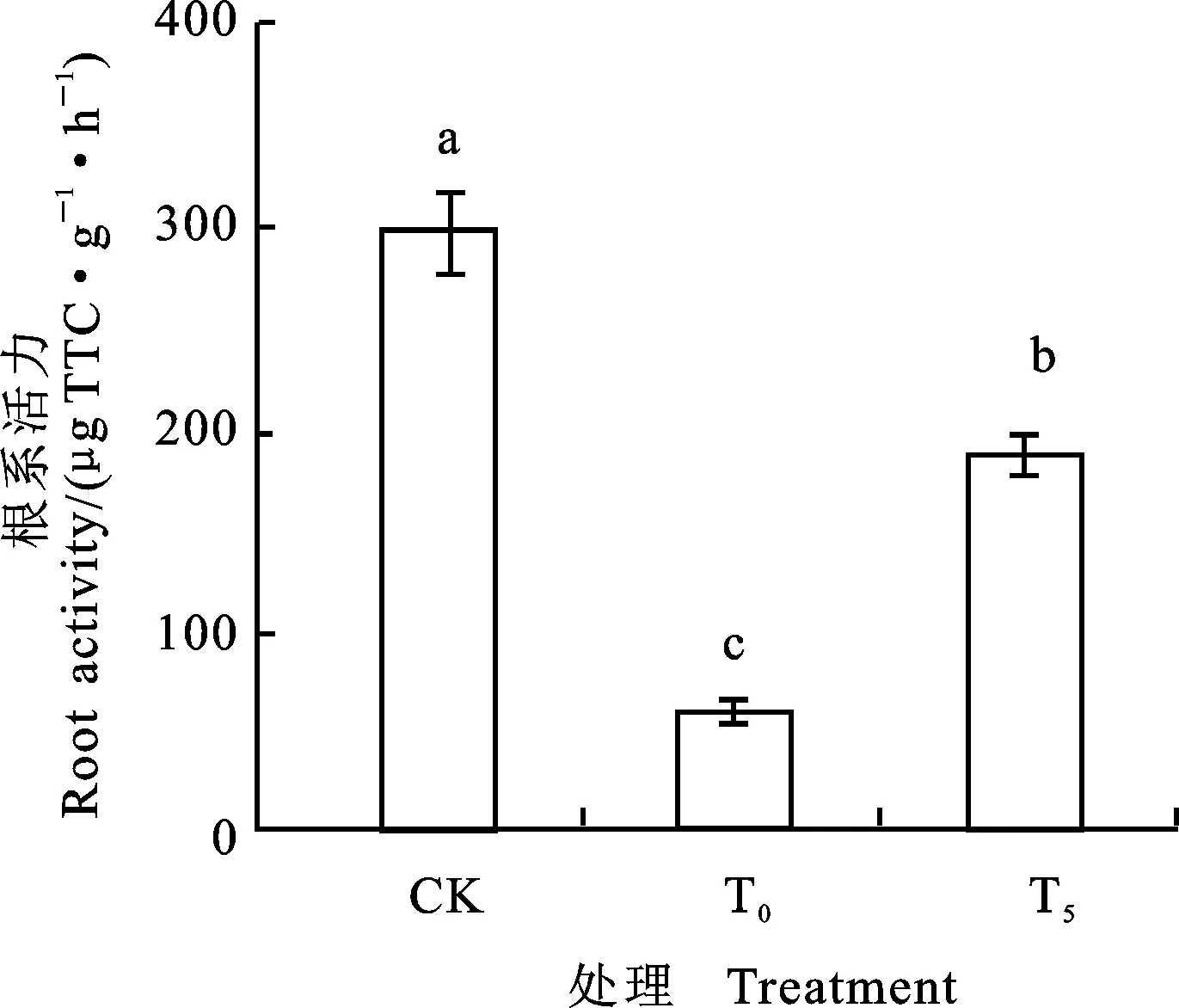
图6 外源Pro对镍胁迫下小麦根系活力的影响
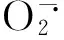
可溶性糖是植物体内的渗透调节物质,可以增强植物细胞内环境的稳定性,在逆境条件下可显著积累,以调节细胞渗透压,增强植物适应环境的能力[22]。外源Pro可提高Ni2+胁迫下小麦根系的可溶性糖含量,提高小麦的抗性。杨居荣等[23]研究发现,抗性高的黑小麦和玉米在镉胁迫下,可溶性糖含量变化较小。抗性相对较弱的黄瓜、大豆中的可溶性糖含量在镉胁迫下显著降低[24]。这些结果的差异可能与重金属的种类、供试材料及测定的时期有关。
外源Pro对小麦Ni2+胁迫下抗逆能力增强、缓解Ni2+对小麦根系毒害作用的更多机理,还有待更进一步的研究。
[1] 张玉秀,张 凯,李金梅,等.镍在植物体中的吸收转运机制[J].中国生态农业学报,2008,16(3):778.
ZHANG Y X,ZHANG K,LI J M,etal.Absorption and transportation mechanism of nickel in plants [J].ChineseJournalofEco-Agriculture,2008,16(3):778.
[2] 王明华,王桂忠,李少菁.氮、磷对镍在食物链上传递的影响[J].生态学报,2007,27(7):2895.
WAND M H,WANG G Z,LI S Q.Influence of N,P additions on the transfer of nickel along the food-chain [J].ActaEcologicaSinica,2007,27(7):2895.
[3] ZOUARI M,BEN A C,ZORRIG W,etal.Exogenous proline mediates alleviation of cadmium stress by promoting photosynthetic activity,water status and antioxidative enzymes activities of young date palm(PhoenixdactyliferaL.) [J].CurrentScience,2016,108(6):1119.
[4] WANI A S,AHMAD A,HAYAT S,etal.Is foliar spray of proline sufficient for mitigation of salt stress inBrassicajunceacultivars [J].EnvironmentalScience&PollutionResearchInternational,2016,23(13):13413.
[5] ZOUARI M,BEN A C,ELLOUMI N,etal.Impact of proline application on cadmium accumulation,mineral nutrition and enzymatic antioxidant defense system ofOleaeuropaeaL.cv Chemlali exposed to cadmium stress [J].Ecotoxicology&EnvironmentalSafety,2016,128:195.
[6] DU B,HAI N,ZHANG Z,etal.Effects of aluminum on superoxide dismutase and peroxidase activities,and lipid peroxidation in the roots and calluses of soybeans differing in aluminum tolerance [J].ActaPhysiologiaePlantarum,2010,32(5):883.
[7] HUI F,QIANG Z,YONG H E.Detection of activity of POD in tomato leaves based on hyperspectral imaging technology [J].Spectroscopy&SpectralAnalysis,2012,32(8):2228.
[8] LUNA C M,PASTORI G M,DRISCOLL S,etal.Drought controls on H2O2accumulation,catalase(CAT) activity and CAT gene expression in wheat [J].JournalofExperimentalBotany,2005,56(411):417.
[9] MIYAKE C,SHINZAKI Y,NISHIOKA M,etal.Photoinactivation of ascorbate peroxidase in isolated tobacco chloroplasts:Galdieria partita APX maintains the electron flux through the water-water cycle in transplastomic tobacco plants [J].PlantandCellPhysiology,2006,47(2):200.
[10] LUKATKIN A S.Contribution of oxidative stress to the development of cold-induced damage to leaves of chilling-sensitive plants:1.Reactive oxygen species formation during plant chilling [J].RussianJournalofPlantPhysiology,2002,49(5):622.
[11] LIU X,WILLIAMS C E,NEMACHECK J A,etal.Reactive oxygen species are involved in plant defense against a gall midge [J].PlantPhysiology,2010,152(2):985.
[13] JI L,LI T X,ZHANG X Z,etal.Root morphological and activity characteristics of rice genotype with high nitrogen utilization efficiency [J].ScientiaAgriculturaSinica,2012,45(23):4770.
[14] 王 琼,苏智先,张素兰,等.慈竹构件和分株水平的可溶性糖含量研究[J].应用生态学报,2004,15(11):1994.
WANG Q,SU Z X,ZHANG S L,etal.Soluble sugar content of clonal plantNeosinocalamusaffinisat module and ramet levels [J].ChineseJournalofAppliedEcology,2004,15(11):1994.
[15] KHAN M R,NAZIR F,ASGHER M,etal.Selenium and sulfur influence ethylene formation and alleviate cadmium-induced oxidative stress by improving proline and glutathione production in wheat [J].JournalofPlantPhysiology,2015,173:9.
[16] 钱立生,王松华,何庆元.小麦幼苗根系抗氧化酶对镍胁迫的响应[J].核农学报,2014,28(9):1708.
QIAN L S,WANG S H,HE Q Y.Nickel-induced oxidative stress and responses of the antioxidant enzymes in roots ofTriticumaestivumL.seedlings [J].JournalofNuclearAgriculturalSciences,2014,28(9):1708.
[17] AKCIN A,YALCIN E.Effect of salinity stress on chlorophyll,carotenoid content,and proline inSalicorniaprostrataPall. andSuaedaprostrataPall.subsp.prostrata(Amaranthaceae) [J].BrazilianJournalofBotany,2016,39(1):101.
[18] ABDULA S E,LEE H J,RYU H,etal.Overexpression of BrCIPK1 gene enhances abiotic stress tolerance by increasing proline biosynthesis in rice [J].PlantMolecularBiologyReporter,2016,34(2):501.
[19] RADY M M,TAHA R S,MAHDI A A.Proline enhances growth,productivity and anatomy of two varieties ofLupinustermisL.grown under salt stress [J].SouthAfricanJournalofBotany,2016,102:221.
[20] SHARMA S S,SCHAT H,VOOIJS R.In vitro alleviation of heavy metal-induced enzyme inhibition by proline [J].Phytochemistry,1998,49(6):1531.
[22] 刘家尧,衣艳君,张其德.盐胁迫对不同抗盐性小麦叶片荧光诱导动力学的影响[J].植物学报,1998,15(2):46.
LIU J Y,YI Y J,ZHANG Q D.Effects of salt stress on chlorophyll a fluorescence induction kinetics in wheat leaves with different salt tolerance [J].ChineseBulletinofBotany,1998,15(2):46.
[23] 杨居荣,贺建群,黄 翌,等.农作物Cd耐性的种内和种间差异Ⅱ.种内差异[J].应用生态学报,1995(S1):132.
YANG J R,HE J Q,HUANG Y,etal.Inter-and intraspecific differences of crops in cadmium tolerance Ⅱ.Intraspecific difference [J].ChineseJournalofAppliedEcology,1995(S1):132.
[24] 朱 芳,方 炜,杨中艺.番茄吸收和积累Cd能力的品种间差异[J].生态学报,2006,26(12):4071.
ZHU F,FANG W,YANG Z Y.Variations of Cd absorption and accumulation of 36Lycopersiconesculentumcultivars [J].ActaEcologicaSinica,2006,26(12):4071.
Effect of Exogenous Proline on the Growth of Wheat Seedling under Nickel Stress
BA Qingsong1,ZHANG Gensheng1,ZHANG Diandian1,LI Guiping1,SONG Yunxian1,TAO Xingkui2,HU Yulin1,FU Zhaolin1
(1.College of Life Science,Huaibei Normal University,Anhui Key Laboratory of Plant Resources and Biology,Huaibei,Anhui 235000,China; 2.College of Biological and Food Engineering,Suzhou University,Suzhou,Anhui 234000,China)
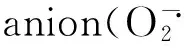
Proline; Nickel stress; Reactive oxygen metabolism; Wheat
时间:2017-05-12
2016-07-14
2016-09-01
安徽省高等学校省级自然科学研究项目(KJ2014B19;KJ2016A624;KJ2013A232);淮北师范大学博士科研启动基金项目(15600971);宿州学院特色种植业苗种生产工程技术研究中心开放课题(2014XKF19);安徽省自然科学基金项目(1708085QC62);安徽省大学生创新创业计划项目(201610373081)
E-mail:baqs1234@163.com
S512.1;S311
A
1009-1041(2017)05-0700-05
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170512.2001.036.html
