碘化N-正丁基氟哌啶醇通过抑制线粒体凋亡通路抗H9c2心肌细胞缺氧/复氧损伤
2017-06-22黄丹梅王远航周巧玲张艳美石刚刚郑付春
汪 彬,黄丹梅,王远航,周巧玲,林 泓,张艳美,石刚刚,郑付春
(汕头大学医学院 1. 药理学教研室,2.第一附属医院药剂科,广东 汕头 515041)
碘化N-正丁基氟哌啶醇通过抑制线粒体凋亡通路抗H9c2心肌细胞缺氧/复氧损伤
汪 彬1,黄丹梅1,王远航1,周巧玲1,林 泓1,张艳美1,石刚刚1,郑付春2
(汕头大学医学院 1. 药理学教研室,2.第一附属医院药剂科,广东 汕头 515041)
目的 研究碘化N-正丁基氟哌啶醇(F2)对H9c2心肌细胞缺氧/复氧(H/R)损伤中线粒体凋亡通路的影响,并探讨其分子作用机制。方法 建立H9c2心肌细胞H/R损伤模型,将H9c2心肌细胞随机分为5组:正常对照组(C组)、缺氧/复氧组(H/R组)、F2低、中、高剂量组。流式细胞术分析测定细胞凋亡率;采用蛋白免疫印迹(Western blot)检测细胞色素C(Cyto C)、Bcl-2、和Bax蛋白表达变化;比色法测定caspase-3的活性。结果 与H/R组相比,F2低、中、高剂量组可明显降低H9c2细胞缺氧/复氧损伤后细胞凋亡率;提高Bcl-2/Bax比值;抑制线粒体中Cyto C的释放;减少caspase-3的活性。结论 F2能够降低H/R后H9c2心肌细胞凋亡率,其机制可能与抑制线粒体通路的细胞凋亡有关。
碘化N-正丁基氟哌啶醇;缺氧/复氧;H9c2心肌细胞;凋亡;线粒体;细胞色素C在缺血的基础上恢复血流后,组织器官的损伤反而加重的现象称为缺血/再灌注(ischemia/reperfusion,I/R)损伤[1]。心肌I/R损伤是心脏缺血性疾病和心脏外科手术后常见的一种病理生理现象,减轻或消除这种损伤一直是该领域的一个研究热点。研究发现,细胞凋亡是心肌I/R损伤后心肌细胞死亡的主要形式,其中线粒体扮演着关键的角色[2]。在心肌I/R损伤过程中,缺血或缺氧等刺激可激活线粒体的凋亡信号转导通路,导致线粒体释放细胞色素C(cytochrome C, Cyto C)、endonuclease G以及凋亡诱导因子(apoptosis-inducing factor, AIF)等分子,进而激活其下游的半胱氨酸天冬氨酸特异性蛋白水解酶(cysteinyl aspartate specific protease, 简称caspase),最终导致心肌细胞凋亡[3]。鉴于线粒体在I/R所致的细胞凋亡中发挥着重要的作用,因此,抑制线粒体凋亡通路已成为研究保护心肌I/R损伤的热点。
碘化N-正丁基氟哌啶醇(N-n-butyl haloperidol iodide, F2)是我们课题组在氟哌啶醇的基础上改造合成的一种新型钙拮抗剂。前期研究证实,F2无论是对整体的心肌I/R损伤还是对离体心肌细胞或心脏微血管内皮细胞缺氧/复氧(hypoxia/reoxygenation, H/R)损伤均有一定的保护作用。它的保护机制可能与阻断心肌细胞细胞膜上的钙通道拮抗钙超载和抑制早期生长反应基因-1(early growth response gene-1, Egr-1)mRNA和蛋白过表达有关[4-6]。但是,F2是否可通过影响线粒体凋亡通路而产生保护作用尚不清楚。因此,本实验通过建立H9c2心肌细胞H/R模型,观察F2对线粒体凋亡通路的影响,并探讨其保护机制。
1 材料与方法
1.1 实验细胞株 H9c2心肌细胞株购自中国科学院典型培养物保藏委员会细胞库。
1.2 主要试剂及仪器 F2有汕头大学医学院药物研究室合成,化学结构有中国科学院上海有机所鉴定。胎牛血清(Gibco);Annexin V-FITC 凋亡检测试剂盒(Dojindo);线粒体蛋白抽提试剂盒(碧云天);Bax一抗、Cyto C一抗(CST);Bcl-2一抗(Santa Cruz);β-actin一抗(北京中杉金桥);VDAC一抗、辣根过氧化物酶标记的二抗(武汉博士德);BCA蛋白定量试剂盒(Thermo SCIENTIFIC),caspase-3活性检测试剂盒(Sigma)。CO2恒温培养箱(SANYO);倒置相差显微镜(Nikon);流式细胞仪(BECKMAN COULTER);酶标仪(Molecular Devices);电泳及转膜装置(Bio-Rad)。
1.3 H9c2心肌细胞培养 H9c2心肌细胞使用含10%胎牛血清,青-链霉素(各100 kU·L-1)的DMEM培养基中培养(培养条件为37 ℃、饱和湿度、5% CO2),2~3 d传代1次。
1.4 H/R模型的建立及实验分组 融合至90%~95%的H9c2心肌细胞随机分为5组:正常对照组(Ctrl组)、缺氧/复氧组(H/R组)、F2低、中、高剂量组。H/R组换用被高纯氮饱和30 min的缺氧液(pH 6.2:137 mmol·L-1NaCl, 12 mmol·L-1KCl, 0.49 mmol·L-1MgCl2,6H2O, 0.9 mmol·L-1CaCl2,4 mmol·L-1HEPES, and 20 mmol·L-1乳酸钠),置于缺氧盒中37℃密闭培养1h,然后换用复氧液(DMEM+10% FBS培养基)正常培养条件下培养3 h,建立H/R损伤模型;F2低、中、高剂量组分别在缺氧液和复氧液中分别加入F2(终浓度为0.1、1、10 μmol·L-1)。
1.5 流式细胞术检测细胞凋亡 H9c2心肌细胞按不同的实验要求处理后,消化、收集细胞,PBS洗涤3次,随后加入100 μL结合缓冲液重悬细胞。加入10 μL Annexin V-TITC和5 μL室温避光孵育15 min。立即加入400 μL结合缓冲液混合均匀,上机检测细胞凋亡。其中每次检测10 000个细胞。
1.6 线粒体及胞质蛋白分离 按照试剂盒说明书,分离线粒体蛋白与胞质蛋白。
1.7 Western blot检测 H9c2心肌细胞根据实验要求处理后,使用冰冷的PBS洗涤3次,加入含PMSF的RIPA裂解液冰上裂解30 min。离心后收集上清液,BCA法测定蛋白浓度,蛋白变性后-30℃冰箱保存。随后使用SDS-PAGE方法分离蛋白。将蛋白转移至硝酸纤维膜上,5%脱脂牛奶室温封闭60 min,4℃孵育一抗过夜,TBST洗膜3次,每次10 min,室温孵育二抗60 min,TBST洗膜3次,每次10 min。加入发光液后暗室压片,显影、定影。结果使用Gel-pro软件分析。
1.8 Caspase-3活性检测 Caspase-3活性检测试剂盒购自Sigma公司,按照说明书上的要求操作。首先,使用胰酶消化细胞,离心。随后再次使用冰冷的PBS洗涤两次,加入含蛋白酶抑制剂的裂解液冰上裂解细胞30 min,16 000×g离心15 min。BCA法测定蛋白浓度,取200 μg总蛋白加入反应缓冲液及底物Ac-DEVD-pNA混合均匀后,37 ℃避光孵育1 h,随后405 nm处测定光吸收值。

2 结果
2.1 F2对H/R所致细胞凋亡率的影响 如Fig 1所示,与正常对照组相比,H/R组凋亡细胞数量明显增加(P<0.05)。与H/R组相比,F2低、中、高剂量组可明显减少凋亡细胞数量(P<0.05)。
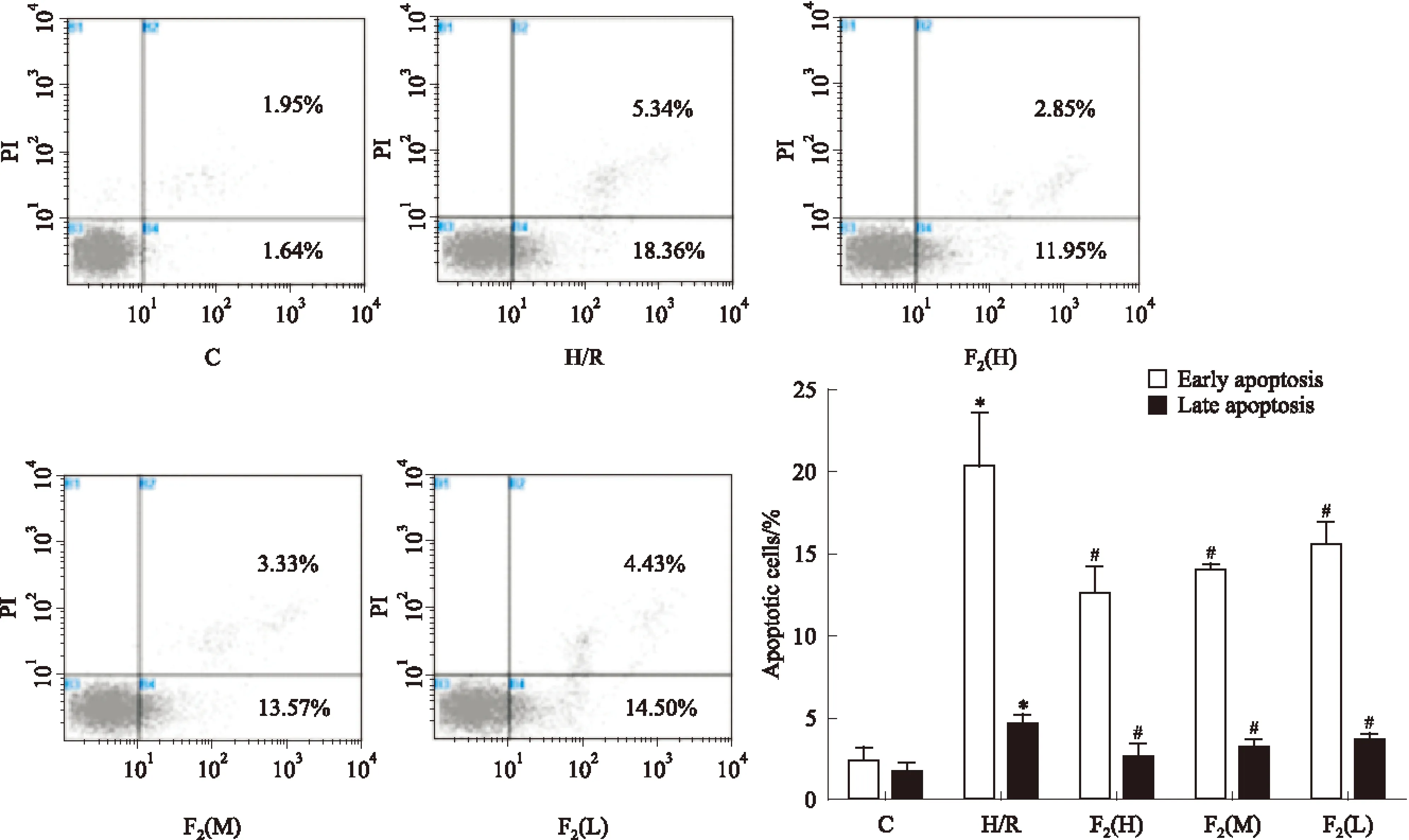
Fig 1 Effect of F2 on H/R-induced apoptosis in H9c2 cells with the annexin V-FITC/PI staining by flow ±s,n=3)
C: control,H/R: hypoxia/reoxygenation,F2(H):F2high concentration group, F2(M):F2medium concentration group,F2(L):F2low concentration group.*P<0.05vsControl group;#P<0.05vsH/R group.
2.2 F2对H/R后Bcl-2、Bax蛋白表达的影响 如Fig2所示,与正常对照组相比,H/R组心肌细胞的Bcl-2蛋白表达降低,Bax蛋白表达升高,Bcl-2/Bax比值降低(P<0.05);而与H/R组相比,F2低、中、高剂量组Bcl-2蛋白表达增多,Bax蛋白表达降低,Bcl-2/Bax比值增加,且呈一定的剂量依赖性(P<0.05)。
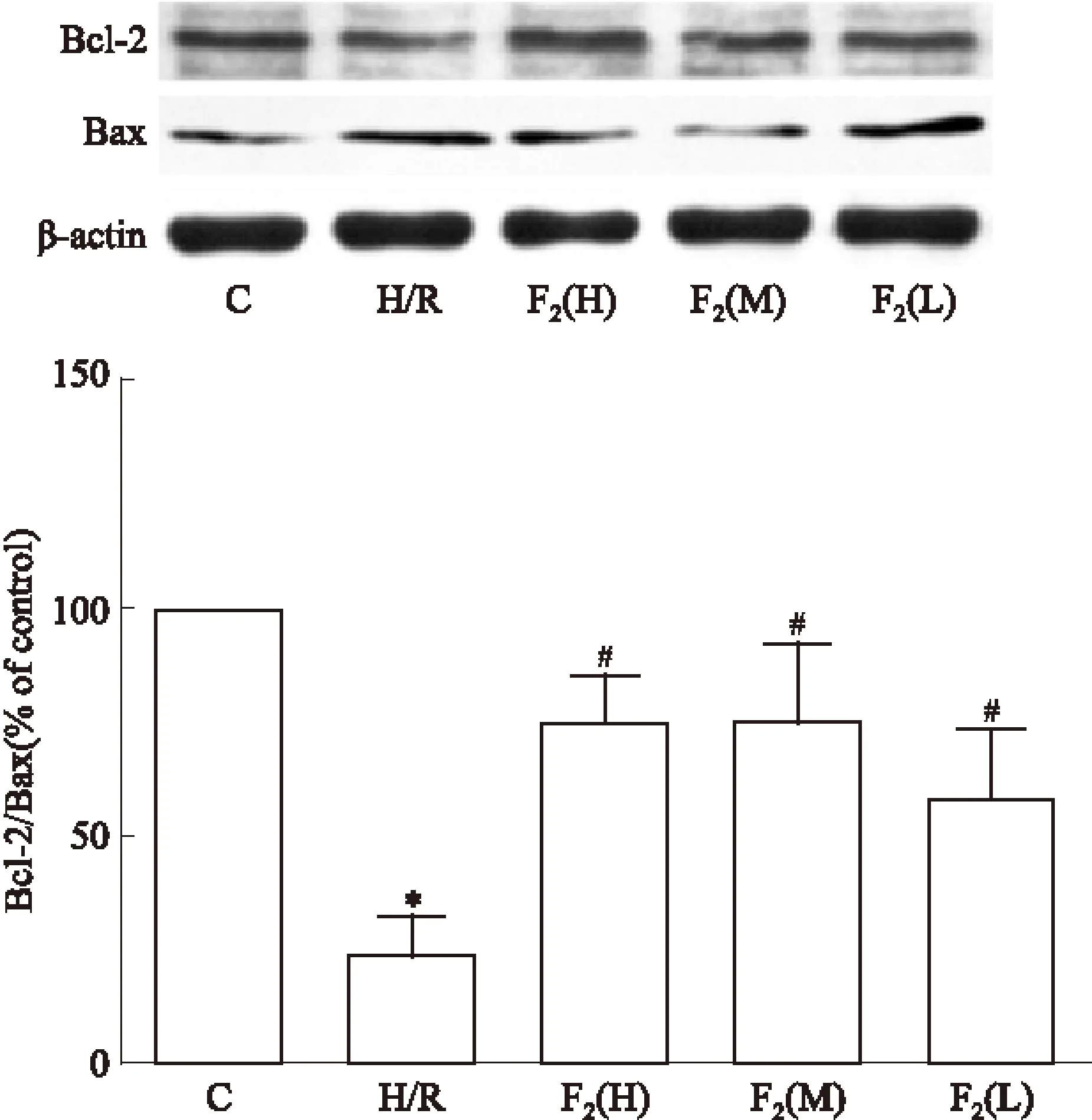
Fig 2 Effects of F2 on expression of Bcl-2 and Bax by Western blot at different treatment ±s,n=3)
β-actin was probed as the loading control. C:control,H/R:hypoxia/reoxygenation, F2(H):F2high concentration group, F2(M):F2medium concentration group,F2(L):F2low concentration group.*P<0.05vsControl group;#P<0.05vsH/R group.
2.3 F2对H/R所致线粒体细胞色素C释放的影响 Western blot检测结果显示,与正常对照组相比,H/R组线粒体中Cyto C蛋白表达降低、胞质中Cyto C蛋白表达升高(P<0.05)。与H/R组相比,F2低、中、高剂量组线粒体中Cyto C蛋白表达升高、胞质中Cyto C蛋白表达降低,并呈一定的剂量依赖性(P<0.05),见Fig 3。
2.4 F2对H/R后caspase-3活性的影响 与正常对照组相比,H/R组caspase-3活性升高(P<0.05);与H/R组相比,F2低、中、高剂量组caspase-3活性明显降低且具有剂量依赖性(P<0.05),见Fig 4。3 讨论
I/R或H/R引起的细胞应激能够诱导细胞产生大量的自由基,进而导致心肌细胞凋亡[7]。目前认为心肌细胞凋亡是心肌I/R损伤的主要形式,因此抑制心肌细胞凋亡是保护I/R诱导的心肌损伤的基本策略。前期的研究发现F2能够通过抑制H/R诱导的原代心肌细胞凋亡减少H/R损伤[8],但原代心肌细胞培养时需要饲养大量的大鼠进行繁殖生产乳鼠,而且分离纯化方法复杂,耗时、耗力,且不能进行传代培养,而H9c2心肌细胞比原代心肌细胞培养方法简单、方便,且能够进行传代培养。因此,我们以H9c2心肌细胞作为研究对象研究F2对心肌细胞H/R过程中线粒体凋亡通路的影响。本实验首先采用Annexin V-FITC/PI双染的方法检测细胞凋亡,流式结果显示,H/R处理后H9c2心肌细胞早期和晚期凋亡率明显升高,而使用F2后可明显地抑制H/R诱导的H9c2心肌细胞凋亡。

Fig 3 Western blot analysis of cytochrome C in cytosolic and membrane fractions of H9c2 cells
VDAC is a mitochondrial marker. β-actin was probed as the loading control. C:control,H/R: hypoxia/reoxygenation, F2(H):F2high concentration group, F2(M):F2medium concentration group, F2(L):F2low concentration group.*P<0.05vsControl group;#P<0.05vsH/R group.
线粒体凋亡通路是H/R刺激诱导心肌细胞凋亡的主要信号通路。在线粒体凋亡通路中,线粒体是调控心肌细胞凋亡的枢纽,其中,Cyto C是线粒体凋亡通路中的关键分子,因为它可激活凋亡的执行者caspase-3进而导致心肌细胞凋亡[9]。Bcl-2基因蛋白家族是一类与线粒体凋亡途径密切相关的蛋白家族,包括抗凋亡蛋白(如Bcl-2、Bcl-xl、mcl-1等)和促凋亡蛋白(如Bax、Bad、Bcl-xl、Bid、Bik等)。Bcl-2基因蛋白家族可通过直接或间接调节凋亡过程中的执行者caspase调控细胞凋亡的发生[10]。在线粒体凋亡通路中,位于胞质中的促凋亡蛋白Bax通过感受内质网释放的钙离子,在线粒体表面形成通道,进而改变线粒体的通透性,从而使Cyto C从线粒体中释放到胞质中,激活凋亡执行者caspase-3,最终引起细胞凋亡[11]。而抗凋亡蛋白Bcl-2则位于线粒体外膜上,通过抑制Cyto C的释放最终抑制凋亡执行者caspase-3激活,抑制细胞凋亡的发生。因此,H/R诱导心肌细胞凋亡与Bcl-2/Bax两蛋白之间的比例密切相关,Bcl-2蛋白表达降低,Bax蛋白表达升高并向线粒体外膜转移,可引起线粒体途径介导的细胞凋亡[12]。本实验结果显示,H/R处理后,抗凋亡蛋白Bcl-2表达降低,促凋亡蛋白Bax表达升高,Bcl-2/Bax比值升高,线粒体中Cyto C表达降低,胞质中Cyto C表达升高,Cyto C从线粒体中释放到胞质中。提示我们线粒体凋亡通路参与心肌细胞H/R损伤,结果与文献一致。而给予F2处理后,抗凋亡蛋白Bcl-2表达升高,促凋亡蛋白Bax表达降低,Bcl-2/Bax比值降低,线粒体中Cyto C表达升高,胞质中Cyto C表达降低,抑制Cyto C从线粒体中向胞质中释放。Cyto C从线粒体中释放出来后,进一步激活下游的caspase-3。因为在心肌细胞凋亡过程中,caspase-3是关键的凋亡执行者,其表达高低直接反映细胞的凋亡程度[13]。因此,可直接通过检测caspase-3来反映心肌细胞的凋亡程度。在我们的实验中发现,H/R后凋亡执行者caspase-3活性升高,说明H/R刺激可以活化caspase-3,最终引起心肌细胞凋亡。给予F2处理后,发现凋亡执行者caspase-3活性降低,说明F2可抑制caspase-3的活化,抑制H/R诱导的心肌细胞凋亡。

Fig 4 Caspase-3 activity in lysates of H9c2 cells
C:control,H/R: hypoxia/reoxygenation, F2(H):F2high concentration group,F2(M):F2medium concentration group,F2(L):F2low concentration group.*P<0.05vsControl group;#P<0.05vsH/R group.
综上所述,F2能够减少心肌细胞H/R中细胞凋亡,其机制与抑制线粒体释放Cyto C,从而抑制线粒体凋亡通路有关。
(致谢:本文实验是在汕头大学医学院药理学教研室完成,感谢各位老师和同学在整个实验设计及文章撰写过程中的辛勤劳动。)
[1] Jennings R B, Sommers H M, Smyth G A, et al. Myocardial necrosis induced by temporary occlusion of a coronary artery in the dog[J].ArchPathol,1960,70:68-78.
[2] Szczepanek K, Xu A, Hu Y, et al. Cardioprotective function of mitochondrial-targeted and transcriptionally inactive STAT3 against ischemia and reperfusion injury[J].BasicResCardiol,2015,110(6):53.[3] 王雨晴, 吴艳娜, 李 欣, 等. RISK信号通路在1-磷酸鞘氨醇后适应减轻心肌细胞缺氧/复氧损伤中的作用[J].中国药理学通报,2015,31(2):181-5.
[3] Wang Y Q, Wu Y N, Li X, et al. Role of RISK signal pathway in reducing cardiomyocytes hypoxia/reoxygenation injury induced by S1P postconditioning[J].ChinpharmacolBull, 2015, 31(2): 181-5.
[4] Huang Y,Gao F,Zhang Y,et al.N-n-Butyl haloperidol iodide inhibits the augmented Na+/Ca2+exchanger currents and L-type Ca2+current induced by hypoxia/reoxygenation or H2O2in cardiomyocytes[J].BiochemBiophysResCommun,2012,421(1):86-90.[5] Zhang Y, Shi G, Zheng J, et al. The protective effects of N-n-butyl haloperidol iodide on myocardial ischemia-reperfusion injury in rats by inhibiting Egr-1 overexpression[J].CellPhysiolBiochem,2007,20(5):639-48.
[6] Zhou Y, Zhang Y, Gao F, et al. N-n-butyl haloperidol iodide protects cardiac microvascular endothelial cells from hypoxia/reoxygenation injury by down-regulating Egr-1 expression[J].CellPhysiolBiochem,2010,26(6):839-48.
[7] Haramaki N, Stewart D B, Aggarwal S, et al. Networking antioxidants in the isolated rat heart are selectively depleted by ischemia-reperfusion[J].FreeRadicBiolMed,1998,25(3):329-39.
[8] Wang J Z, Cai C Y, Zhang Y M, et al. N-n-Butyl haloperidol iodide protects against hypoxia/reoxygenation-induced cardiomyocyte injury by modulating protein kinase C activity[J].BiochemPharmacol,2010,79(10):1428-36.
[9] Li H, Sun J J, Chen G Y, et al. Carnosic acid nanoparticles suppress liver ischemia/reperfusion injury by inhibition of ROS, Caspases and NF-kappaB signaling pathway in mice[J].BiomedPharmacother,2016,82:237-46.
[10]Harsha Raj M, Yashaswini B, Rossler J, et al. Combinatorial treatment with anacardic acid followed by TRAIL augments induction of apoptosis in TRAIL resistant cancer cells by the regulation of p53, MAPK and NFkappabeta pathways[J].Apoptosis,2016,21(5):578-93.
[11]Wang X, Zhang C, Yan X, et al. A novel bioavailable BH3 mimetic efficiently inhibits colon cancer via cascade effects of mitochondria[J].ClinCancerRes,2016,22(6):1445-58.
[12]Chen Q, Xu T, Li D, et al. JNK/PI3K/Akt signaling pathway is involved in myocardial ischemia/reperfusion injury in diabetic rats: effects of salvianolic acid A intervention[J].AmJTranslRes,2016,8(6):2534-48.
[13]Smith M A, Schnellmann R G. Calpains, mitochondria, and apoptosis[J].CardiovascRes,2012,96(1):32-7.
N-n-butyl haloperidol iodide protects H9c2 cardiac myocytes against hypoxia/reoxygenation injury through mitochondria-dependent apoptotic pathway
WANG Bin1, HUANG Dan-mei1, WANG Yuan-hang1,ZHOU Qiao-ling1, LIN Hong1,ZHANG Yan-mei1, SHI Gang-gang1, ZHENG Fu-chun2
(1.DepartmentofPharmacology,ShantouUniversityMedicalCollege,ShantouGuangdong515041,China;2.DepartmentofPharmacy,TheFirstAffiliatedHospital,ShantouUniversityMedicalCollege,ShantouGuangdong515041,China)
Aim To investigate the effect ofN-n-butyl haloperidol iodide(F2) on mitochondria-dependent apoptotic pathway of H9c2 cardiac myocytes during hypoxia/reoxygenation(H/R) injury.Methods The H/R models of H9c2 cardiac myocytes were established. The H9c2 cardiac myocytes were randomly divided into five groups: control group(C group), hypoxia/reoxygenation group(H/R group), F2low concentration group(L), F2medium concentration group(M), F2high concentration group(H).Apoptotic rate was evaluated by flow cytometry(FCM). The levels of Cyto C, Bcl-2, Bax were observed by Western blot. Caspase-3 activity was measured with colorimetry.Results Compared with H/R group, F2low, medium and high concentrations group could significantly decrease apoptosis rate and increase the ratio of Bcl-2 to Bax proteins and inhibit the release of Cyto C into the cytosolic fraction, and decrease caspase-3 activity.Conclusion F2can protect H9c2 cardiac myocytes against H/R-induced injury through interfering in mitochondria-dependent pathway.
N-n-butyl haloperidol iodide; hypoxia/reoxygenation; H9c2 cardiac myocytes; apoptosis; mitochondria; cytochrome C
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.030.html
2017-02-15,
2017-03-12
国家自然科学基金-广东省自然科学基金联合资助基金项目(No U0932005);广东省科技厅公益研究与能力建设专项资金项目(No 2014A020212290); 国家自然科学基金资助项目(No 81473215)
汪 彬(1986-),男,博士,助教,研究方向:心血管药理学,E-mail: wangbin178.17@163.com; 郑付春(1967-),女,硕士,主任药师,硕士生导师,研究方向:心血管药物研发,药物临床研究,通讯作者,E-mail:zhengfc@stu.edu.cn
10.3969/j.issn.1001-1978.2017.06.015
A
1001-1978(2017)06-0819-05
R322.11;R329.25;R845.22;R977.3;R977.6
