褪黑素通过减轻内质网应激抵抗多柔比星心脏毒性
2017-06-22李步潆翟蒙恩刘振华于立明王晓武金振晓段维勋俞世强
李步潆,翟蒙恩,张 彬,刘振华,于立明,王晓武,金振晓,段维勋,俞世强
·基础研究·
褪黑素通过减轻内质网应激抵抗多柔比星心脏毒性
李步潆,翟蒙恩,张 彬,刘振华,于立明,王晓武,金振晓,段维勋,俞世强
目的 探讨褪黑素(Mel)对多柔比星(DOX)心脏毒性的治疗作用及其对内质网应激的影响。方法 60只雄性C57BL/6小鼠20~25 g,随机分为3组(每组n=20):正常对照(Control)组、DOX组和DOX与Mel共处理(DOX+Mel)组。给予小鼠单次腹腔注射DOX,剂量为15 mg/kg。DOX处理后5天,检测心功能、心率、心脏凋亡比例以及内质网应激水平。 结果 DOX显著下调左室射血分数(LVEF)与左室短轴缩短率(LVFS),引起心肌损伤,下调心率,增加心肌细胞凋亡比例。Mel可显著改善DOX引起的心脏收缩功能障碍,减轻心肌损伤,上调心率,并降低心肌细胞凋亡比例。此外,Mel治疗可显著抑制DOX诱发的心肌内质网应激,从而缓解心肌损伤(P均< 0.05)。结论 Mel共处理可显著抑制DOX诱发的内质网应激过度激活,减轻心肌细胞凋亡,从而抵抗DOX心脏毒性。
褪黑素;多柔比星;心脏毒性;内质网应激
蒽环类药物多柔比星(doxorubicin,DOX)是目前治疗多种肿瘤中疗效最确切、应用最广泛的化疗药物之一,但在临床应用因其心脏毒性受到限制[1-3]。临床上应用该药物的患者存在有以下几种形式的心脏毒性,即急性、亚急性、慢性进展性心脏毒性,这些类型的心脏损伤均可导致心力衰竭,严重影响癌症患者预后及生存[4-5]。因此,阐明其致病机制并探寻有效的防治措施意义重大。内质网应激(endoplasmic reticulum stress, ER stress)是在细胞内钙稳态失衡、分泌蛋白过度表达、营养物质缺乏、缺氧以及细胞毒性药物刺激时,错误折叠或者未折叠的蛋白质在内质网中大量蓄积的现象[6]。近年来研究发现ER stress过度激活在DOX心脏毒性的发生发展中发挥了重要作用[7-9]。褪黑素(Melatonin,Mel)是一种主要由松果体分泌的一种神经内分泌激素,是迄今为止发现的最为高效的内源性自由基清除剂[10]。大量研究证实Mel对于多种心血管疾病发挥了明显的保护作用,如抵抗心肌缺血再灌注损伤、缓解糖尿病心肌病、抑制血管平滑肌凋亡等[11-13]。此外,Mel也可显著缓解DOX心脏毒性和细胞毒性[3-14]。但Mel能否减轻DOX引起的ER stress尚无人报道。本实验采用小鼠腹腔注射DOX,探讨Mel对DOX心脏毒性的保护作用及其对心肌ER stress信号通路的调控作用。
1 材料与方法
1.1 材料 成年雄性C57BL/6小鼠,体重(20~25)g,均由第四军医大学实验动物中心提供。Mel(Sigma公司),DOX(Cayman Chemical公司),原位缺口末端标记法(TUNEL)检测试剂盒(Roche公司),兔抗PERK抗体、兔抗p-PERK抗体、兔抗eIF2α抗体、兔抗p-eIF2α抗体、鼠抗CHOP抗体(CST公司),鼠抗β-actin抗体(CMCTAG公司),辣根过氧化物酶(HRP)标记的羊抗兔、羊抗鼠抗体(中杉金桥公司)。Vevo770小动物超声仪(购自VisualSonics公司)。
1.2 方法
1.2.1 动物分组和DOX处理 将60只成年雄性C57BL/6小鼠随机分为3组,每组20只:①正常对照组(Control组):腹腔注射生理盐水,每日摄入自来水;②DOX损伤组(DOX组):一次性腹腔注射DOX(15 mg/kg),每日摄入自来水;③DOX与Mel共处理组(DOX+Mel组):一次性腹腔注射DOX(15 mg/kg),每日通过饮水摄入Mel 20 mg/kg,连续5 d。小鼠DOX处理方法参阅以往文献[15]。
1.2.2 心功能检测 DOX腹腔注射5 d后,利用Vevo770小动物超声仪检测并计算小鼠左室射血分数(LVEF)、左室短轴缩短率(LVFS)等心功能指标。利用PowerLab数据采集分析系统监测小鼠心率。
1.2.3 心肌HE染色与凋亡检测 DOX腹腔注射5 d后,迅速取出心脏,以预冷的PBS冲洗干净,然后置于4%多聚甲醛固定24 h。经脱水、包埋后,垂直于心脏长轴将其切成5 μm厚的切片,并按照文献所述进行苏木精-伊红染色[16]。普通光镜下拍照并观察心肌细胞损伤情况。常规脱蜡至水后,严格按照TUNEL试剂盒说明书要求操作。每张切片在高倍镜下随机选取5个以上不重复的含凋亡细胞的视野,计数视野内凋亡细胞核数,总细胞核数,计算心肌细胞凋亡率(apoptotic ratio)。
1.2.4 蛋白分子表达的检测 DOX腹腔注射5 d后,迅速取出心脏,用预冷的生理盐水冲洗后,液氮中保存待测。去各组小鼠心脏提取蛋白,采用BCA法测定蛋白浓度并根据蛋白定量结果调整蛋白上样体积,经十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶电泳分离蛋白,用湿转法将蛋白转移到氧乙烯(PVDF)膜,经50 g/L脱脂牛奶封闭2 h后,依次滴加抗p-PERK、PERK、p-eIF2α、eIF2α、CHOP及β-actin抗体(浓度为1∶1 000,均以TBST缓冲液配制), 4℃过夜,TBST洗脱3次,分别加1∶5 000辣根过氧化物酶标记的二抗(山羊抗鼠及山羊抗兔),室温孵育1 h,TBST洗脱3次,使用免疫印迹化学发光法检测并观察结果,以β-actin作为内参照,检测各蛋白的表达情况。
2 结 果
2.1 Mel处理改善心功能,减轻心肌损害与凋亡 小鼠腹腔注射DOX后5 d检测超声心动图显示,与Control组相比,DOX处理后小鼠LVEF和LVFS明显降低,心率明显下降(P<0.05);与DOX组相比,DOX+Mel组LVEF、LVFS及心率显著提高(P<0.05);DOX处理1 d后心肌HE染色显示,与Control组相比,DOX损伤组小鼠发生心肌损伤,心肌空泡化现象明显增多(P<0.05);与DOX组相比,DOX+Mel组小鼠心肌空泡化现象显著改善;DOX处理1 d后TUNEL法检测心肌组织凋亡显示,与Control组相比,DOX处理显著增加心肌细胞凋亡率(P<0.05);与DOX组相比,DOX+Mel组小鼠心肌细胞凋亡率显著下降(P<0.05),见图1。
2.2 Mel抑制ER stress信号通路 Western blot检测结果显示,与Control组相比,DOX组心肌p-PERK/PERK、p-eIF2α/eIF2α、CHOP明显增高,提示DOX可诱发心肌组织ER stress反应。与DOX组相比,DOX+Mel组能够显著下调p-PERK/PERK、p-eIF2α/eIF2α比值及CHOP表达(P<0.05),见图2。
3 讨 论
DOX引起的心脏毒性是限制其临床应用的一大障碍。阐明其具体机制并探寻新的有效的防治策略对于该药物的临床应用具有重大意义。DOX心脏毒性的具体机制主要包括氧化应激损伤、拓扑异构酶II-β、凋亡、自噬等。近年来研究发现,ER stress在DOX心脏毒性的病理生理过程中发挥了重要作用。减轻心肌细胞过度产生的ER stress可以明显改善DOX心脏毒性[7-9]。因此,寻找有效方案缓解DOX给药后心肌ER stress是基础与临床医学研究的热点。
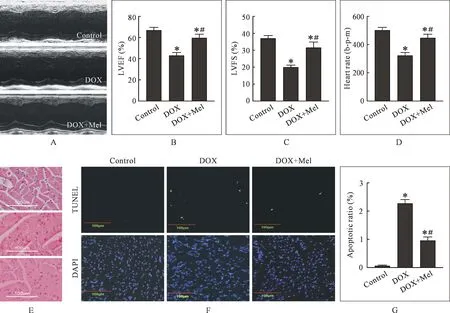
注:A:各组超声心动图;B:LVEF;C:LVFS;D:心率;E:心肌切片HE染色(×200);F:心肌切片TUNEL图像(×200); G:心肌细胞凋亡率(%)。与Control组比较,*P<0.05;与DOX组比较,#P<0.05。图1 Mel显著改善DOX引起的心功能障碍与心肌细胞凋亡(n=20)
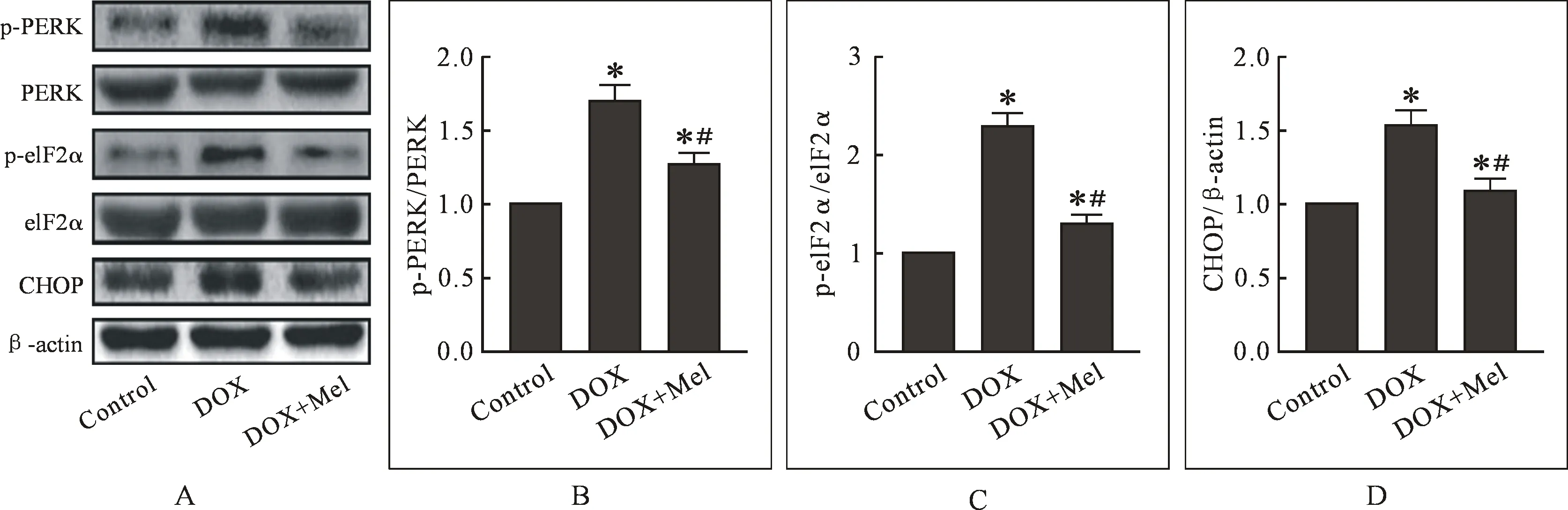
注:A~D:DOX处理后各组心肌p-PERK、PERK、p-eIF2α、eIF2α及CHOP表达水平的检测。与Control组比较, *P<0.05;与DOX组比较,#P<0.05。图2 Mel调控ER stress和凋亡信号通路(n=20)
Mel是一种主要由松果体分泌的吲哚类神经内分泌激素,因其具有直接的自由基清除能力和间接的抗氧化能力而发挥了多种心脑血管保护作用[17]。本课题组前期研究发现,Mel能够显著减低心肌缺血再灌注损伤[18-19]。此外,Mel也可改善DOX引起的心脏毒性[3-14]。前期研究证实,DOX对心脏功能的影响主要表现为心肌收缩功能下降、心率降低等[20]。心肌细胞空泡化现象是心肌损伤的重要病理改变,笔者研究发现,大剂量DOX可诱导发生心肌细胞空泡化反应,提示发生心肌损伤。通过TUNEL染色检测心肌组织凋亡水平, 还发现大剂量DOX也能导致明显心肌细胞凋亡反应。Mel共处理可有效缓解DOX心脏毒性,改善心肌收缩功能,增加心率,改善小鼠心脏功能并减少心肌损伤,降低凋亡率。为了进一步探究Mel抵抗DOX心脏毒性是否与ER stress相关仍需进一步研究。
在真核细胞中,分泌性蛋白质在内质网内折叠成原始构象,并经过修饰最终成为具有生物学活性的蛋白质。只有正确折叠的蛋白质才能分泌入高尔基体,但当细胞内钙稳态失衡、分泌蛋白过度表达、营养物质缺乏、缺氧以及细胞毒性药物刺激会造成错误折叠或者未折叠的蛋白质在内质网中大量蓄积,称为ER stress[6]。ER stress发生时会激活双链RNA依赖的蛋白激酶样内质网激酶(PKR-like ER kinase, PERK),活化的PERK促使真核生物起始因子2α(eukaryotic initiation factor 2α, eIF2α)磷酸化,导致蛋白质翻译水平整体降低,从而减少蛋白质的合成[21]。然而应激过强或持续较长时间时,ER stress则会激活CHOP(C/EBP-homologous protein)表达。CHOP进而激活凋亡途径引起细胞凋亡[22]。研究发现,针对过度激活的心肌ER stress已成为治疗DOX心脏毒性的新的干预策略[7-9]。然而,Mel是否通过调节ER stress来减轻DOX心脏毒性尚无人报道。本研究发现,DOX给药后能显著激活心肌ER stress途径,引起PERK与eIF2α的磷酸化水平以及CHOP的表达增高,造成心肌损伤。Mel共处理可以显著降低PERK与eIF2α的磷酸化水平,抑制CHOP的表达,进而减轻心肌细胞凋亡比例,发挥心肌保护效果。
综上所述,本实验发现,Mel可显著减轻DOX引起的ER stress过度激活,从而抑制凋亡,保护心肌。抑制ER stress很可能是Mel心肌保护的新机制之一。本研究揭示了Mel抵抗DOX心脏毒性新机制,并为Mel相关药物的开发和临床应用提供了实验依据。
[1]Weiss RB. The anthracyclines: will we ever find a better doxorubicin[J]? Semin Oncol, 1992,19(6):670-686.
[2]Octavia Y, Tocchetti CG, Gabrielson KL,etal. Doxorubicin-induced cardiomyopathy: from molecular mechanisms to therapeutic strategies[J]. J Mol Cell Cardiol, 2012, 52(6): 1213-1225.
[3]Govender J, Loos B, Marais E,etal. Mitochondrial catastrophe during doxorubicin-induced cardiotoxicity: a review of the protective role of melatonin[J]. J Pineal Res, 2014, 57(4):367-380.
[4]Von Hoff DD, Layard MW, Basa P,etal. Risk factors for doxorubicin-induced congestive heart failure[J]. Ann Intern Med,1979,91(5):710-717.
[5]Steinherz LJ, Steinherz PG, Tan CT,etal. Cardiac toxicity 4 to 20 years after completing anthracycline therapy[J]. JAMA,1991,266(12):1672-1677.
[6]Hetz C. The unfolded protein response: controlling cell fate decisions under ER stress and beyond[J]. Nat Rev Mol Cell Biol, 2012,13(2):89-102.
[7]Lou Y, Wang Z, Xu Y,etal. Resveratrol prevents doxorubicin-induced cardiotoxicity in H9c2 cells through the inhibition of endoplasmic reticulum stress and the activation of the Sirt1 pathway[J]. Int J Mol Med, 2015, 36(3):873-880.
[8]Wang XY, Yang CT, Zheng DD,etal. Hydrogen sulfide protects H9c2 cells against doxorubicin-induced cardiotoxicity through inhibition of endoplasmic reticulum stress[J]. Mol Cell Biochem, 2012, 363(1-2):419-426.
[9]Fisher PW, Salloum F, Das A,etal. Phosphodiesterase-5 inhibition with sildenafil attenuates cardiomyocyte apoptosis and left ventricular dysfunction in a chronic model of doxorubicin cardiotoxicity[J]. Circulation, 2005,111(13):1601-1610.
[10]Yang Y, Sun Y, Yi W,etal. A review of melatonin as a suitable antioxidant against myocardial ischemia-reperfusion injury and clinical heart diseases[J]. J Pineal Res, 2014, 57(4):357-366.
[11]赵国龙,张秋芳,翟蒙恩,等. 褪黑素受体对大鼠心肌缺血再灌注损伤的调控及其机制研究[J]. 中国体外循环杂志, 2015,13(2):113-118.
[12]毛予,李鹏,杨丽芳. 糖尿病性心肌病中的内质网应激及蛋白质量调控概况[J]. 中国体外循环杂志,2015,13(2):123-125.
[13]刘振华,李步潆,段维勋,等. 褪黑素抑制磷酸钙诱导的大鼠主动脉血管平滑肌细胞凋亡[J]. 中国体外循环杂志, 2016,14(2):112-115.
[14] Ozturk M, Ozler M, Kurt YG,etal. Efficacy of melatonin, mercaptoethylguanidine and 1400W in doxorubicin- and trastuzumab-induced cardiotoxicity[J]. J Pineal Res, 2011, 50(1):89-96.
[15] Zhu SG, Kukreja RC, Das A,etal. Dietary nitrate supplementation protects against Doxorubicin-induced cardiomyopathy by improving mitochondrial function[J]. J Am Coll Cardiol, 2011, 57(21):2181-2189.
[16] Fan GC, Zhou X, Wang X,etal. Heat shock protein 20 interacting with phosphorylated Akt reduces doxorubicin-triggered oxidative stress and cardiotoxicity[J]. Circ Res, 2008,103(11):1270-1279.
[17] Reiter RJ, Tan DX, Paredes SD,etal. Beneficial effects of melatonin in cardiovascular disease[J]. Ann Med, 2010, 42(4):276-285.
[18] Yu L, Sun Y, Cheng L,etal. Melatonin receptor-mediated protection against myocardial ischemia/reperfusion injury: role of SIRT1[J]. J Pineal Res, 2014, 57(2):228-238.
[19] Yu L, Liang H, Lu Z,etal. Membrane receptor-dependent Notch1/Hes1 activation by melatonin protects against myocardial ischemia-reperfusion injury: in vivo and in vitro studies[J]. J Pineal Res, 2015, 59(4):420-433.
[20] Chen CT, Wang ZH, Hsu CC,etal. In Vivo Protective Effects of Diosgenin against Doxorubicin-Induced Cardiotoxicity[J]. Nutrients, 2015, 7(6):4938-4954.
[21] Boyce M, Bryant KF, Jousse C,etal. A selective inhibitor of eIF2alpha dephosphorylation protects cells from ER stress[J]. Science, 2005, 307(5711):935-939.
[22] Puthalakath H, O'Reilly LA, Gunn P,etal. ER stress triggers apoptosis by activating BH3-only protein Bim[J]. Cell, 2007,129(7):1337-1349.
Melatonin protects heart against Doxorubicin-induced cardiotoxicity partly through inhibiting cardiac endoplasmic reticulum stress
Li Bu-ying, Zhai Meng-en, Zhang Bin, Liu Zhen-hua, Yu Li-ming, Wang Xiao-wu, Jin Zhen-xiao,Duan Wei-xun, Yu Shi-qiang
DepartmentofCardiovascularSurgery,XijingHospital,FourthMilitaryMedicalUniversity,ShanxiXi'an710032,China
YuShi-qiang,Email:shiqiangyu210@126.com
Objective To study the effect of melatonin (Mel) on doxorubicin (DOX)-induced cardiotoxicity and endoplasmic reticulum (ER) stress. Methods Male C57BL/6 mice (20-25g) were subject to a single intraperitoneal injection of doxorubicin (DOX, 15 mg/kg). Animals were randomly divided into three groups: Control group (n=20), DOX group (n=20) and DOX+Mel group (n=20). Five days after DOX injection, cardiac function, heart rate, myocardial apoptotic ratio, and the expression of p-PERK, PERK, p-eIF2α,eIF2α and CHOP were measured. Results Mel treatment significantly improved the cardiac functional recovery, increased heart rate and reduced myocardial injury and apoptosis. Additionally, Mel treatment significantly decreased the p-PERK/PERK ratio, p-eIF2α/eIF2α ratio and CHOP expression following DOX treatment (allP<0.05). Conclusion Our results show that melatonin protects the heart against DOX-induced cardiotoxicity by reducing ER stress.
Melatonin; Doxorubicin; Cardiotoxicity; ER stress
10.13498/j.cnki.chin.j.ecc.2017.02.11
国家自然科学基金项目资助(81570231,81570230,81470415)
710032 西安,第四军医大学西京医院心血管外科
俞世强,Email:shiqiangyu210@126.com
2017-02-14)
2017-04-12)
