心脏术后体外膜肺氧合支持临床应用探讨
2017-06-22卢安东苗莉霞李子林董书强董逸飞
卢安东,郭 剑,苗莉霞,闵 凯,李子林,董书强,董逸飞
·临床经验·
心脏术后体外膜肺氧合支持临床应用探讨
卢安东,郭 剑,苗莉霞,闵 凯,李子林,董书强,董逸飞
目的 总结体外膜肺氧合(ECMO)在心脏术后重症患者的临床应用经验,评价其疗效。方法 2014年3月至2016年5月,回顾性分析因心脏术后心肺功能性衰竭行ECMO辅助时间>8 h以上者6例患者的临床资料。结果 6例患者中5例表现为低心排血量综合征,1例表现为严重低氧血症,药物及常规治疗效果不佳。均行ECMO辅助支持治疗(V-A模式),平均年龄(51.8±10.4)岁,ECMO平均支持时间(109.8±27.1)h,3例成功脱离ECMO(50%),1例存活出院(16.7%)。并发症:4例合并肾功能不全并行连续肾脏替代疗法(CRRT)治疗,2例插管部位出血,2例胸腔内出血,1例ECMO后感染。结论 ECMO是治疗心脏术后可逆性心肺衰竭的重要支持手段,ECMO时机的把握、保护性肺通气的应用、有效控制和预防出血是ECMO救治成功的关键因素。
体外膜肺氧合;心脏术后;低心排血量综合征;连续肾替代疗法
低心排血量综合征(low cardiac output syndrom,LCOS)是心脏术后较为严重的并发症,大剂量血管活性药物的使用往往无法逆转,且长期使用无益于心、肾等脏器保护,最终因泵衰竭灌注不足导致脏器功能衰竭而死亡[1-2]。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技术可以有效的保证心、肺、脑等重要脏器的血供和氧供,可全部或部分替代心肺功能,有效减少血管活性药物的使用,避免其副作用,为患者的心肺恢复创造良好的条件[3-4]。据体外生命支持组织(Extracorporeal Life Support Organization,ELSO)统计,2015年,共有将近2 200例心脏或呼吸衰竭危重病患者应用ECMO得到救治,ECMO是心脏术后可逆性心肺衰竭的一种有效机械循环支持方式[5]。
本中心自2014年3月至2016年5月经ECMO支持治疗8例心脏术后重症患者,排除2例ECMO运行时间小于8 h,回顾性分析6例ECMO支持患者的临床资料,评价早期临床结果,分析影响预后的危险因素,为提高ECMO支持疗法的成功率提供经验。
1 资料与方法
1.1 病例资料 选取2014年3月至2016年5月,因心脏术后心肺功能性衰竭行ECMO支持且ECMO辅助时间>8 h的6例患者的临床资料,其中男性3例,女性3例;年龄37~62(51.8±10.4)岁,体质量52~75(59.8±9.2)kg。除病例5在手术室CPR后建立ECMO外,余均在ICU建立ECMO,6例患者具体临床情况见表1。
1.2 ECMO应用指征 ①外科手术矫治彻底,无明显活动性出血。②难治性低心排血量综合征(low cardiac output syndrome,LCOS):血容量补足后,在大剂量血管活性药物多巴胺>10 μg/(kg·min),肾上腺素>0.5 μg/(kg·min)或/和主动脉内球囊反搏(intra-aortic balloon pump,IABP)的支持下,心脏指数小于2.2 L/(min·m2)、收缩压<80 mm Hg;中心静脉压>12 mm Hg且进行性增高;合并内脏器官灌注不足表现:尿量<0.5 ml/(h·kg)或四肢冰凉;顽固性代谢性酸中毒(pH<7.3,血清乳酸浓度>5.0 mmol/L)。③无法脱离体外循环。④心脏术后严重低氧血症(氧和指数<100 mm Hg,PEEP>10 cmH2O)。
1.3 ECMO设备与建立 由离心泵(Maquet,Jostra,德国)、膜式氧合器及肝素化管道(Medos,Lt7000,德国)、股动静脉插管(Medtronic,Bio-Medicus,美国)、空氧混合器、变温水箱、氧饱和度监测仪(Medtronic)以及ACT仪(Medtronic)组成。所有患者均采用直视下切开股动脉(15~19 Fr插管,Medtronic,Bio-Medicus)、股静脉(19~23 Fr插管)方式建立ECMO(VA模式),转流途径为股静脉-离心泵-人工膜肺-股动脉。为避免同侧下肢缺血坏死,在同侧股动脉远端置入一根灌注管(8 Fr,Medtronic,Bio-Medicus)接ECMO动脉分支提供远端肢体血供。
1.4 ECMO管理[6]
1.4.1 流量管理 开始转流时以高流量灌注,泵血流量为理想心输出量的80%,维持平均动脉压50~60 mm Hg,稳定生命体征,减轻心脏负荷,偿还氧债,纠正内环境紊乱。维持SvO2≥65%。在保证生命体征平稳的前提下,尽快将血管活性药物调至小剂量(多巴胺3~5 μg/(kg·min)、肾上腺素<0.1 μg/(kg·min)。ECMO辅助中期(3~7 d)根据心肺恢复情况及血流动力学情况,可逐渐下调泵血流量至理想心输出量的50%左右。后期(结束前1~2 d),逐渐减少流量至患者理想心输出量的20%~30%左右,如果效果不佳,可适当增加血管活性药物和正性肌力药物。如仍不能改善,恢复至原有流量。
1.4.2 呼吸机设置 采取保护性肺通气策略,潮气量4~6 ml/kg,呼吸频率6~8次/min,PEEP 8~10 cmH2O,氧浓度35%~40%。
1.4.3 抗凝管理 6例患者均为心脏术后当日患者,24 h内无需给予普通肝素抗凝,24 h后根据全血活化凝血时间(activated coagulation time,ACT)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT)结果使用肝素,并维持目标值ACT 150~180 s,APTT 50~80 s。全程监测ACT和APTT(1次/4 h),早期可适当放低目标值(ACT 140~170 s,APTT 50~60 s左右),后期逐渐调高(ACT 180~200 s,APTT 70~80 s)。严密监测全身有无出血点及出血倾向(重点是胸腔引流及插管部位),若有明显活动性出血,调低目标值,必要时床旁开胸或切口探查止血。血小板低于50×109时根据情况输注血小板。
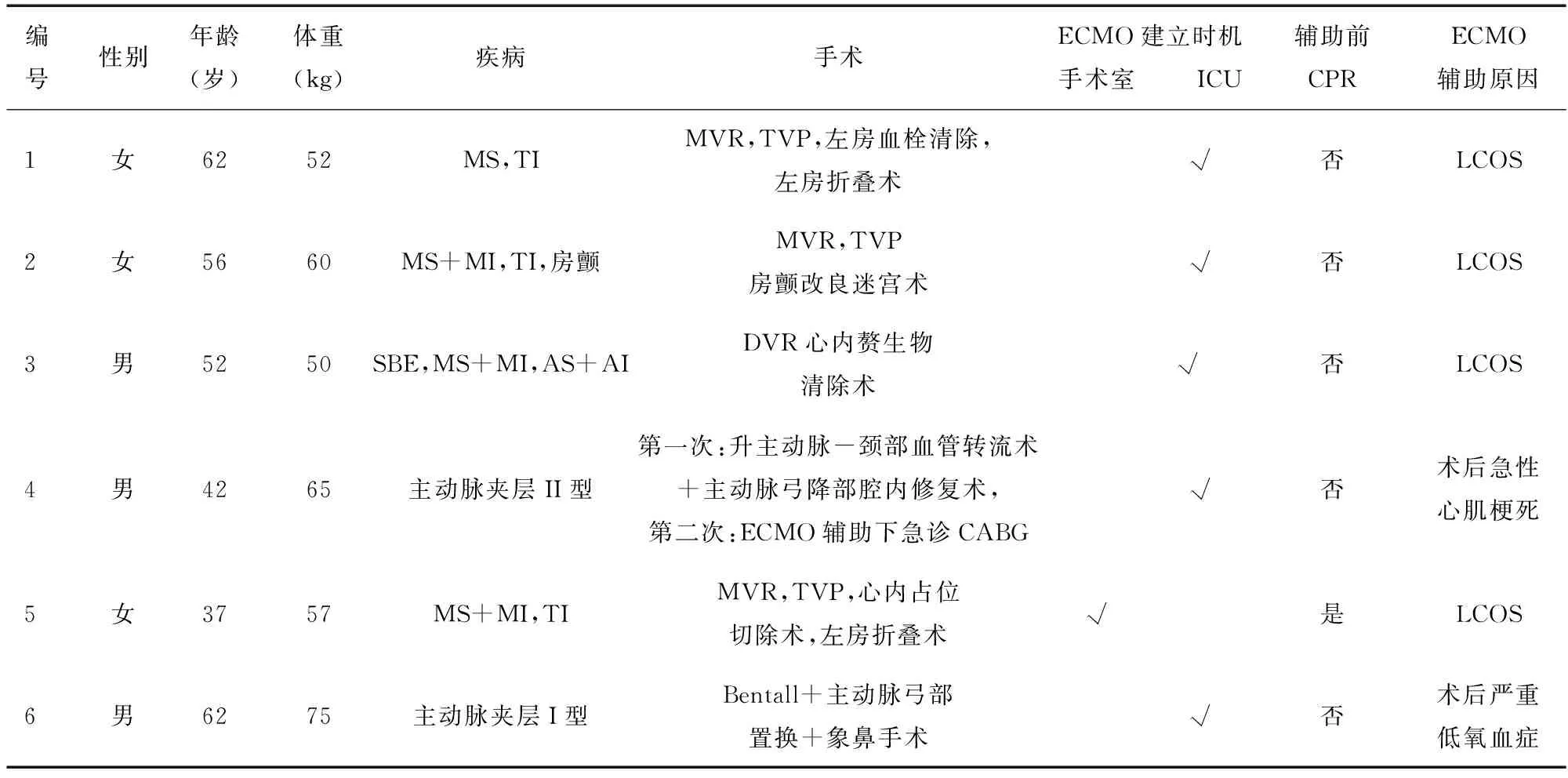
表1 患者的一般临床资料
注:MS:二尖瓣狭窄;TI:三尖瓣关闭不全;MI:二尖瓣关闭不全;AS:主动脉瓣狭窄伴;AI:主动脉瓣关闭不全;SBE:感染性心内膜炎。
1.4.4 监测与评估 除常规生命体征监测外,早期每4 h 1次血气,根据血气结果调整空氧混合器通气量及氧浓度,积极纠正内环境紊乱,并监测血乳酸指标,根据乳酸趋势判断预后(乳酸24 h内持续>10 mmol/L,且无下降趋势,则提示预后不佳)。每日复查血常规、生化及心肌酶谱、脑钠肽(Brain Natriuretic Peptide,BNP);每日复查床旁胸片,了解双肺渗出及胸腔情况;每日行床旁心脏及胸腔彩超,评价容量负荷,心脏结构、射血分数(EF)的变化,评价其心脏恢复可能性,指导撤机。
1.4.5 连续肾替代治疗(continuous renal replacement therapy,CRRT)时机[7]根据尿量及肌酐上升水平积极应用CRRT(尿量<0.5 ml/(kg·h),持续3 h,Cr持续增高>200 μmol/L),CRRT(Fresenius Medical Care multiFiltrate)采用前后置换模式(Continuous veno-venous hemofiltration,CVVH),置换液量2~4 L/h,血流量3~4 ml/(kg·min),超滤速度根据患者液体出入量每1~3 h调整1次。CRRT管路与ECMO并联,动脉端靠近离心泵(泵后膜肺前接口),静脉端靠近氧合器(膜肺后接口)。
1.4.6 营养支持 待患者生命体征平稳后(1~2 d),尽早给予胃肠内营养,维持胃肠道正常功能,预防菌群失调。静脉营养避免使用脂肪乳剂,以免影响膜肺效果。
1.4.7 镇静 ECMO运转期间给予充分镇静镇痛,避免使用异丙酚,减少患者应激及心脏额外做功。每日晨间停镇静药物给予唤醒,以判断患者意识和适当锻炼患者呼吸功能。
1.4.8 严密监测膜肺工作情况 若发生血浆渗漏或明显血栓影响膜肺氧合效果等并发症应及时更换膜肺。
1.5 ECMO撤离 如流量降至患者理想心输出量的20%,使用小剂量正性肌力药物即可维持血流动力学稳定,氧合满意,心脏超声提示心脏运动较好,左室EF≥40%,即可考虑停机。床旁撤除股动静脉及下肢远端插管并修补血管,结束ECMO辅助。
2 结 果
2.1 临床资料与ECMO辅助情况 6例ECMO辅助患者中3例成功脱离ECMO(脱机率50%),其中1例存活出院(生存率16.7%),2例成功撤除ECMO后因非心源性并发症死亡(感染1例,呼吸道并发症1例)。3例因无法撤除ECMO而死亡(心脏无法恢复2例,术后脑功能障碍1例)。ECMO辅助时间82~139(109.8±27.1)h。4例因急性肾功能衰竭行CRRT治疗,1例转血液透析,3例未恢复。1例联合应用IABP治疗。全组机械通气时间86~206(138.5±55.6)h,其辅助期间详细情况见表2。

表2 ECMO辅助期间参数(n=6)
注:RBC:红细胞;Plt:血小板;FFP:新鲜冰冻血浆。
2.2 并发症 6例患者均无氧合器故障及血浆渗漏,无下肢缺血坏死,无明显上半身缺血综合征;2例因胸腔出血床旁紧急开胸止血(其中1例发生心包填塞),2例插管部位出血给予床旁探查止血,均未对患者转归造成严重影响;4例合并急性肾功能衰竭并积极应用CRRT;4例高胆红素血症,其中2例行血浆置换治疗后胆红素明显下降。
3 讨 论
3.1 ECMO辅助 低心排血量综合征是心脏术后患者早期死亡的主要原因之一。虽然大部分LCOS患者通过药物及IABP等治疗手段均能恢复,但部分LCOS患者需要ECMO支持,为心肺功能恢复争取时间和可能性[3,8]。对于心脏术后发生难治性LCOS而评估手术矫正满意且心功能有恢复可能的患者,应用静脉-动脉(V-A)模式ECMO进行辅助循环已是国内大部分心外科的常用手段之一[9]。ECMO亦可作为其他可逆性心肺衰竭,包括急性心梗、心跳骤停、急性呼衰和脓毒症的重要支持治疗手段[10]。本组患者均为心脏术后患者,5例为LCOS,1例为术后严重低氧血症致循环不稳定,6例均采用V-A模式,以达到循环呼吸联合支持目的。本组患者在ECMO辅助后血流动力学均能很快稳定,血管活性药物在12 h内均能降至较低水平,氧合效果满意,血乳酸水平下降,全身组织灌注得到改善。
3.2 呼吸机支持 心脏术后ECMO患者的呼吸机支持时间较长,呼吸机相关性肺不张、肺炎的发生率增大,从而增加患者ICU时间,影响预后;长期呼吸机支持(>7 d)亦会导致肺组织纤维化,从而导致肺不可逆性改变;心脏术后患者循环不稳定,全身机体情况偏差,若采用清醒ECMO(拔除气管插管),氧饥症会导致患者做功增加,不利于心脏恢复;因此,保护性肺通气在ECMO的应用中尤为重要[11]。笔者采用小潮气量(4 ml/kg)、低频率(6~8次/min)、低氧浓度(30%~40%)和高PEEP(8~10 cmH2O)的呼吸机支持手段:小潮气量避免气道压力过高引起的肺损伤;低频率和高PEEP来维持肺泡的正常功能,避免塌陷;低氧浓度避免高氧损害。全组6例患者未发生呼吸道并发症,术后胸片未见肺部渗出增多、肺不张等不良情况产生。其中因低氧血症呼吸衰竭患者,其呼吸道功能在ECMO第五日已基本恢复,于第六日顺利脱离ECMO,于术后第八日顺利拔除气管插管,24 h后复查血气指标良好。
3.3 ECMO失败原因 分析本组患者ECMO脱机率50%,与国内外报道相符,但生存率16.7%低于国内其他中心报道[9,11-12]。分析原因有以下几点:
3.3.1 时机 保证全身脏器氧合,减少脏器缺血缺氧时间在ECMO实施中是极其重要的一点。心脏手术患者术前其他脏器功能往往正常,术后因LCOS,心脏泵衰竭,灌注不足而导致的肾、脑、消化等脏器功能衰竭。大剂量的血管活性药物牺牲了很多脏器的供血来保证心脑供血,长时间使用将会对很多脏器产生不可逆的影响[12]。血乳酸指标是反应组织灌注的重要指标,乳酸>10 mmol/L或乳酸持续增高往往提示预后不佳[13-14]。本组6例患者ECMO辅助前血乳酸(16.6±2.2)mmol/L,大于同行报道的9~12 mmol/L,提示本组的病例时机偏晚,灌注不足已对脏器功能产生了不可逆影响,以致于ECMO脱机率虽接近国内外水平,但生存率远低于同类数据。ECMO时机的把握是致胜的关键,若术后无法脱离体外循环,在评估可逆性和确认手术矫治可靠的前提下,应即刻给予ECMO辅助;若心脏术后患者发生LCOS,血管活性药物呈进行性增加趋势,便应尽快建立ECMO,不要等到血管活性药物剂量已大的惊人,血压仍维持不住,甚至发生心跳骤停的情况在才考虑建立ECMO。ECMO辅助越早,越利于此类患者的恢复。适当放宽ECMO适应证,积极应用ECMO辅助是抢救心脏术后LCOS患者成功的关键。
3.3.2 出血与渗血 体外循环术后凝血功能受到一定影响,而ECMO本身需要抗凝,又对血小板的损害较大,故患者ECMO期间出血风险较大。6例患者中2例胸腔出血(其中1例发生心包填塞),2例插管部位出血。虽在第一时间内出血得到了控制,但由此导致的血液制品使用量增加,大量输血引起的危害却无法避免。血栓弹力图可以准确的评估患者凝血功能情况,便于根据需要补充必要凝血因子。ECMO中因使用肝素,血栓弹力图应使用肝素酶杯检测,从而更加客观的反应机体凝血情况。有效改善凝血功能和预防出血是减少ECMO并发症的重要环节之一[15]。
3.3.3 急性肾功能损伤与衰竭 由于ECMO支持前心肺功能的衰竭、大剂量血管活性药物的应用、ECMO支持后缺血再灌注损伤和全身炎症反应,心脏术后ECMO辅助患者急性肾损伤(acute kidney injury,AKI)的发生率高达81%,合并AKI患者的生存率也大大降低[16]。CRRT仍是治疗此类患者的主要方法[17]。本组6例患者中4例联合应用CRRT,笔者认为,较早的CRRT干预便于容量管理,减低肾脏后负荷、纠正内环境紊乱以加快肾功能恢复;亦有证据显示ECMO中早期的容量负平衡可以提高患者生存率[18]。LCOS患者往往伴有强烈的全身炎症反应综合征,再加上血液与ECMO环路的大量接触亦会产生大量炎性因子。CRRT可滤出部分炎性因子,从而改善患者预后[19]。
3.3.4 感染的预防与治疗 心脏术后ECMO患者长期卧床,全身管路众多,感染的预防尤为重要。首先,ECMO患者应进入独立层流病房,注意无菌操作,ECMO期间尽量避免有创操作;再者,心脏术后大多为预防性使用抗生素,本身并不伴有感染。抗生素的级别因根据病情需要选用适宜抗生素,而不是级别越高越好。本组1例ECMO后感染患者,就是因为早期使用的抗生素级别过高,而导致感染真正出现后抗生素用药困难,无法控制耐药性细菌。最后,注意胃肠道的保护和肠内营养的早期应用。长期气管插管患者无法进食会导致肠道菌群失调易位甚至伪膜性肠炎。ECMO期间在循环稳定后早期给予适量肠内营养,在一定程度上保护了胃肠道功能,避免肠道菌群失调的发生。另外,肠内营养可为机体提供代谢所需要的必要营养物质,有助于机体的恢复。
总之,ECMO可以使得心脏术后重症患者获益,是提高心脏术后心肺衰竭生存率的一种有效支持手段。尽早评估,把握时机是ECMO成功的关键。ECMO精细管理,有效避免各类并发症发生是ECMO成功的重要因素。
[1] Saxena P, Neal J, Joyce LD,etal. Extracorporeal membrane oxygenation support in postcardiotomy elderly patients: the mayo clinic experience[J]. Ann Thorac Surg, 2015, 99(6): 2053-2060.
[2] Kumar TK, Zurakowski D, Dalton H,etal. Extracorporeal membrane oxygenation in postcardiotomy patients: factors influencing outcome [J]. J Thorac Cardiovasc Surg, 2010, 140(2): 330-336.
[3] Beiras-Fernandez A, Deutsch MA, Kainzinger S,etal. Extracorporeal membrane oxygenation in 108 patients with low cardiac output -a single-center experience[J]. Int J Artif Organs, 2011, 34(4): 365-373.
[4]Gattinoni L, Carlesso E, Langer T. Clinical review: Extracorporeal membrane oxygenation[J]. Crit Care, 2011, 15(6):243.
[5] Extracorporeal Life Support Organization. Extracorporeal Life Support Registry Report. International Summary(2015-07).http://www.elso.org.
[6]龙村.体外膜肺氧合循环支持专家共识[J].中国体外循环杂志,2014,12(2):65-67.
[7] Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-184.
[8] Odonkor PN, Stansbury L, Garcia JP,etal. Perioperative management of adult surgical patients on extracorporeal membrane oxygenation support[J]. J Cardiothorac Vasc Anesth, 2013, 27(2): 329-344.
[9] Rastan AJ, Dege A, Mohr M,etal. Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock[J]. J Thorac Cardiovasc Surg, 2010, 139(2): 302-311.
[10] Del Sorbo L, Cypel M, Fan E,etal. Extracorporeal life support for adults with severe acute respiratory failure [J]. Lancet Respir Med, 2014, 2(2):154-164.
[11] Slottosch I, Liakopoulos O, Kuhn E,etal. Outcomes after peripheral extracorporeal membrane oxygenation therapy for postcardiotomy cardiogenic shock:a single-center experience[J]. J Surg Res, 2013, 181(2): e47-55.
[12]杜中涛,杨峰,邢家林,等. 体外膜肺氧合在成人心外科术后心源性休克应用早期死亡率及临床结果危险因素分析[J]. 中国体外循环杂志,2014, 12(4):210-214.
[13] Chen YS, Yu HY, Huang SC,etal. Extracorporeal membrane oxygenation support can extend the duration of cardiopulmonary resuscitation[J]. Crit Care Med, 2008, 36(9): 2529-2535.
[14] Park SJ, Kim SP, Kim JB,etal. Blood lactate level during extracorporeal life support as a surrogate marker for survival[J]. J Thorac Cardiovasc Surg, 2014, 148(2):714-720.
[15] Northrop MS, Sidonio RF, Phillips SE,etal. The use of an extracorporeal membrane oxygenation anticoagulation laboratory protocol is associated with decreased blood product use, decreased hemorrhagic complications, and increased circuit life[J]. Pediatr Crit Care Med, 2015, 16(1):66-74.
[16] Yan X, Jia S, Meng X,etal. Acute kidney injury in adult postcardiotomy patients with extracorporeal membrane oxygenation: evaluation of the RIFLE classification and the Acute Kidney Injury Network criteria[J]. Eur J Cardiothorac Surg, 2010,37(2):334-338.
[17] Chen H, Yu RG, Yin NN,etal. Combination of extracorporeal membrane oxygenation and continuous renal replacement therapy in critically ill patients:a systematic review[J]. Crit Care, 2014, 18(6): 675.
[18] Schmidt M, Bailey M, Kelly J,etal. Impact of fluid balance on outcome of adult patients treated with extracorporeal membrane oxygenation[J]. Intensive Care Med, 2014, 40(9): 1256-1266.
[19]S J, S J, C Q,etal. In-line hemofiltrationminimized extracorporeal membrane oxygenation-related inflammation in a porcine model[J]. Perfusion, 2014, 29(6):526-33.
Clinical application of extracorporeal membrane oxygenation support for critically ill patients after heart surgery
Lu An-dong, Guo Jian, Miao Li-xia, Ming Kai, Li Zi-lin, Dong Shu-qiang, Dong Yi-fei
DepartmentofCardiovascularSurgery,GeneralHospitalofLanzhouMilitaryRegion,Lanzhou730050,China
DongShu-qiang,Email:dongli6983@qq.com
Objective To summarize and evaluate the clinical effect of extracorporeal membrane oxygenation support for critically ill patients after heart surgery. Methods 8 patients with cardiopulmonary functional failure after heart surgery
ECMO support from March 2014 to May 2016 ,and 6 patients (support time>8 hours)were retrospectively analyzed. Results Low cardiac output syndrome occurred in 5 patients, and acute respiratory failure happened in 1 patient, who failed to respond to routine medical therapy. All patients received V-A ECMO. The mean age was (51.8±10.4)years.The aver age support time was(109.8±27.1) hours. Three (50%) patients successfully weaned from ECMO and 1 (16,7%) was discharged from hospital. Complications:renal failure with continuous renal replacement therapy was seen in 4 cases,4 cases had hemorrhage(2 cases of catheter hemorrhage and 2 cases of hemothorax) and 1 case of infection after ECMO. Conclusion ECMO is an life supporting approach for patients with reversible cardiopulmonary failure after heart surgery. The keys to optimal results include earlier use of ECMO, the application of lung protective ventilation strategy,prevention and control of bleeding.
Extracorporeal membrane oxygenation;Post-heart surgery; Low cardiac output syndrom;Continuous renal replacement therapy
10.13498/j.cnki.chin.j.ecc.2017.02.09
730050 兰州,兰州军区兰州总医院心血管外科
董书强,E-mail:dongli6983@qq.com
2016-07-21)
2016-10-24)
