右美托咪定对非体外循环下冠状动脉旁路移植术中心肌氧供需平衡的影响
2017-06-22张涛元侯丽宏支伟伟
张 慧,张涛元,王 淼,雷 翀,侯丽宏,支伟伟,陈 伟
·临床研究·
右美托咪定对非体外循环下冠状动脉旁路移植术中心肌氧供需平衡的影响
张 慧,张涛元,王 淼,雷 翀,侯丽宏,支伟伟,陈 伟
目的 观察右美托咪定对非体外循环下冠状动脉旁路移植术(OP-CABG)中心肌氧供需平衡的影响。方法 将40例ASAⅡ-Ⅲ 级冠心病拟在全麻下行OP-CABG的患者随机分为右美托咪定组(D 组)和对照组(C 组),每组20例。D 组患者从麻醉诱导前10 min至手术结束泵注右美托咪定0.5 μg/(kg·h),C 组患者泵注同等剂量的生理盐水。所有患者记录术前基本信息、麻醉时间、手术时间、诱导期去甲肾上腺素用量、麻醉期丙泊酚和舒芬太尼的用量、术中正性肌力药物评分、再通血管数量、机械通气时间、CCU停留时间和术后住院时间;记录患者诱导前(T0)、气管插管前(T1)、气管插管后3 min(T2)、手术开始时(T3)、劈开胸骨时(T4)、取完乳内动脉后(T5),吻合回旋支或对角支时(T6)、吻合完血管远端时(T7)、吻合完血管近端后5 min(T8)、及手术结束时(T9)的心率(HR)、平均动脉压(MAP)及脑电双频指数(BIS);记录T3~T9的心排量(CO)、心指数(CI)、体循环阻力(SVR) 及 肺循环阻力(PVR);在 T3~T4及 T6~T9分别抽取桡动脉血和肺动脉血1 ml,计算心肌氧供(DO2)和氧耗量(VO2);记录患者术后并发症发生率。结果 D组患者麻醉期丙泊酚用量(P=0.01)、舒芬太尼用量(P=0.04)明显低于 C 组,麻醉维持期去甲肾上腺素用量(P=0.032)明显高于 C 组;D 组 T0~T9 HR、MAP 明显低于 C 组(P<0.05);D 组 T3~T9 SVR、PVR 明显低于 C 组(P<0.05);D 组 T3~T4、T6~T9 VO2明显低于 C 组(P<0.05);一般情况比较、麻醉时间、手术时间、诱导期去甲肾上腺素用量、术中正性肌力药物评分、再通血管数量、机械通气时间、CCU停留时间和术后住院时间、麻醉期各时点BIS值、手术期各时点CO、CI及DO2差异无统计学意义。结论 在OP-CABG 患者中从麻醉诱导前10 min 至手术结束使用0.5 μg/(kg·h)的右美托咪定,可以显著减少麻醉药物的用量,并可维持手术期间血流动力学的稳定,显著降低患者的心肌氧耗,可能会减少术后不良事件的发生,有利于患者的恢复。
右美托咪定;非体外循环下冠状动脉旁路移植术;氧供需平衡
非体外循环下冠状动脉旁路移植术(off-pump coronary artery bypasss grafting, OP-CABG)更加适用于合并其他器官功能障碍的老年冠心病患者[1]。然而,OP-CABG术由于没有体外循环的支持,麻醉显得尤为困难。维持术中血流动力学平稳及心肌氧供需平衡是麻醉的重中之重。右美托咪定为高效、高选择性的新型α2肾上腺素能受体激动药,有镇静、镇痛、抗焦虑等特点[2]。研究右美托咪定对 OP-CABG 手术患者心肌氧供需平衡具有重要的临床应用价值。
1 资料与方法
1.1 病例选择 经本院伦理委员会同意(20140227-5),患者签署知情同意书,选择2015年10月至2016年1月拟行OP-CABG 术40例,男32例,女8例,年龄68~72岁,ASA II或III级,心功能II或III级。随机分为右美托咪定组(D组)和对照组组(C组),每组20例。排除标准:急诊手术;预期存活时间<1年;心动过缓;严重的肝、肾功能障碍;术前置入主动脉内球囊反搏(intra-aortic ballon pump,IABP)者;对试验药物过敏或其他禁忌证患者;精神状态不稳定或有精神疾病者;过去30 d内参加了其他药物临床研究者。剔除标准:中转转机;因严重不良反应终止试验者;无任何监测记录或病例报告表(case report form, CRF)记录不完整,以致无法做出药效和安全性评价者。40例患者均签署知情同意书。按照随机数字表将40例患者分为右美托咪定组(D 组)和对照组(C 组)。
1.2 麻醉与监测 所有手术均在气管插管全身麻醉下进行。患者均不予麻醉前用药即入手术室,监测心电图(ECG)、脉搏血氧饱和度(SpO2)及脑电双频指数(BIS)。同时局部麻醉下行桡动脉穿刺置管, 监测有创动脉收缩压(SBP)、舒张压(DBP)和平均压(MAP)。局部麻醉下右颈内静脉穿刺放置三腔中心静脉管,监测中心静脉压(CVP)。D 组全麻诱导前10 min 给予右美托咪定0.5 μg/(kg·h)至手术结束。C 组全麻诱导前10 min 给与等剂量盐水至手术结束。全麻诱导采用咪达唑仑(0.03 mg/kg)、丙泊酚(血浆靶浓度1.0 μg/ml)及舒芬太尼(效应室靶浓度初始浓度为0.2 μg/L,每分钟增加0.1 μg/L)靶控输注,患者意识消失后给予罗库溴铵(0.6 mg/kg),BIS值达到40~60时进行气管插管。气管插管后经右颈内静脉穿刺放置6腔肺动脉漂浮导管, 连接连续心输出量(CCO)监测仪( Edwards Lifesciences) 监测血流动力学[心排出量(CO)、心指数(CI)、体循环阻力(SVR)、肺循环阻力(PVR)]。麻醉维持采用丙泊酚靶控输注(1.0 μg/ml)和舒芬太尼靶控输注(0.4~1.5 μg/L),每40 min追加罗库溴铵0.15 mg/kg,维持BIS值40~60。采用容量控制通气模式,潮气量设定为6~8 ml/kg(体重为校准体重),维持气道压在30 cmH2O以内,PaCO2维持在35~40 mm Hg。根据失血情况若血红蛋白<80 g/L酌情给予血液制品。手术结束时停止丙泊酚和舒芬太尼靶控输注,术毕送至ICU。所有手术均由同一位经验丰富的外科医生完成。
血流动力学维持:术中泵注硝酸甘油0.2 μg/(kg·min)以扩张冠状动脉血管, 当以侧壁钳部分阻断升主动脉或血压> 140 mm Hg时, 增加硝酸甘油至1~3 μg/(kg·min)以降低血压。麻醉诱导期间, 吻合回旋支、右冠状动脉等心脏背面血管需翻动心脏或心脏需固定在非正常位置时出现血压下降, 间断静脉注射去甲肾上腺素5~10 μg升压并进行记录。若心率血压出现严重下降,给予血管活性药物无法纠正时,停止麻醉药物(丙泊酚和舒芬太尼)的泵注,待血流动力学恢复后再次开始。术中前降支桥血管再通后,根据需要开始泵注肾上腺素0. 03~0.1 μg/(kg·min)。
1.3 观察指标 记录患者一般情况、术前合并症、术前检查、麻醉时间、手术时间、诱导期去甲肾上腺素用量、麻醉期丙泊酚和舒芬太尼的用量、术中正性肌力药物评分[3]、再通血管数量、机械通气时间、CCU停留时间和术后住院时间;记录患者诱导前(T0)、气管插管前(T1)、气管插管后3 min(T2)、手术开始时(T3)、劈开胸骨时(T4)、取完乳内动脉后(T5),吻合回旋支或对角支时(T6)、吻合完血管远端时(T7)、吻合完血管近端后5 min(T8)、以及手术结束时(T9)的心率(HR)、MAP及 BIS。记录T3~T9的CO、CI、SVR及PVR。在 T3~T4及 T6-T9分别抽取桡动脉血和肺动脉血1 ml,计算心肌氧供(DO2)和氧耗量(VO2)。由于T4与T5时间点十分接近,且两时间点间血流动力学变化并不显著,故笔者认为DO2以及VO2在T4及T5时间点应非常接近,故只记录T3~T4及 T6~T9的DO2以及VO2而未对T5进行记录;除此之外,记录患者术后并发症发生情况。
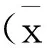
2 结 果
40例患者均顺利接受了手术并康复出院。两组患者的性别构成比、年龄、体质量指数(BMI)、术前合并症、术前血红蛋白(Hb)、术前肌酐(Cr)、术前射血分数(EF)、术前每搏量(SV)值、麻醉时间、手术时间、诱导期去甲肾上腺素用量、术中正性肌力药物评分、再通血管数量、机械通气时间、CCU 停留时间和术后住院时间差异均无统计学意义。见表1。D 组麻醉期丙泊酚用量及舒芬太尼用量明显少于 C 组(P<0.05),维持期去甲肾上腺素用量明显高于 C 组(P<0.05)。见表1。
与 C 组相比,在 T0~T9各时间点,D 组 HR降低,差异有统计学意义(P<0.05),两组组内比较差异无统计学意义;在 T3~T9各时间点,D 组 MAP降低,差异有统计学意义(P<0.05);两组组内比较各时间点差异无统计学意义;两组 BIS值比较差异无统计学意义。见图1。
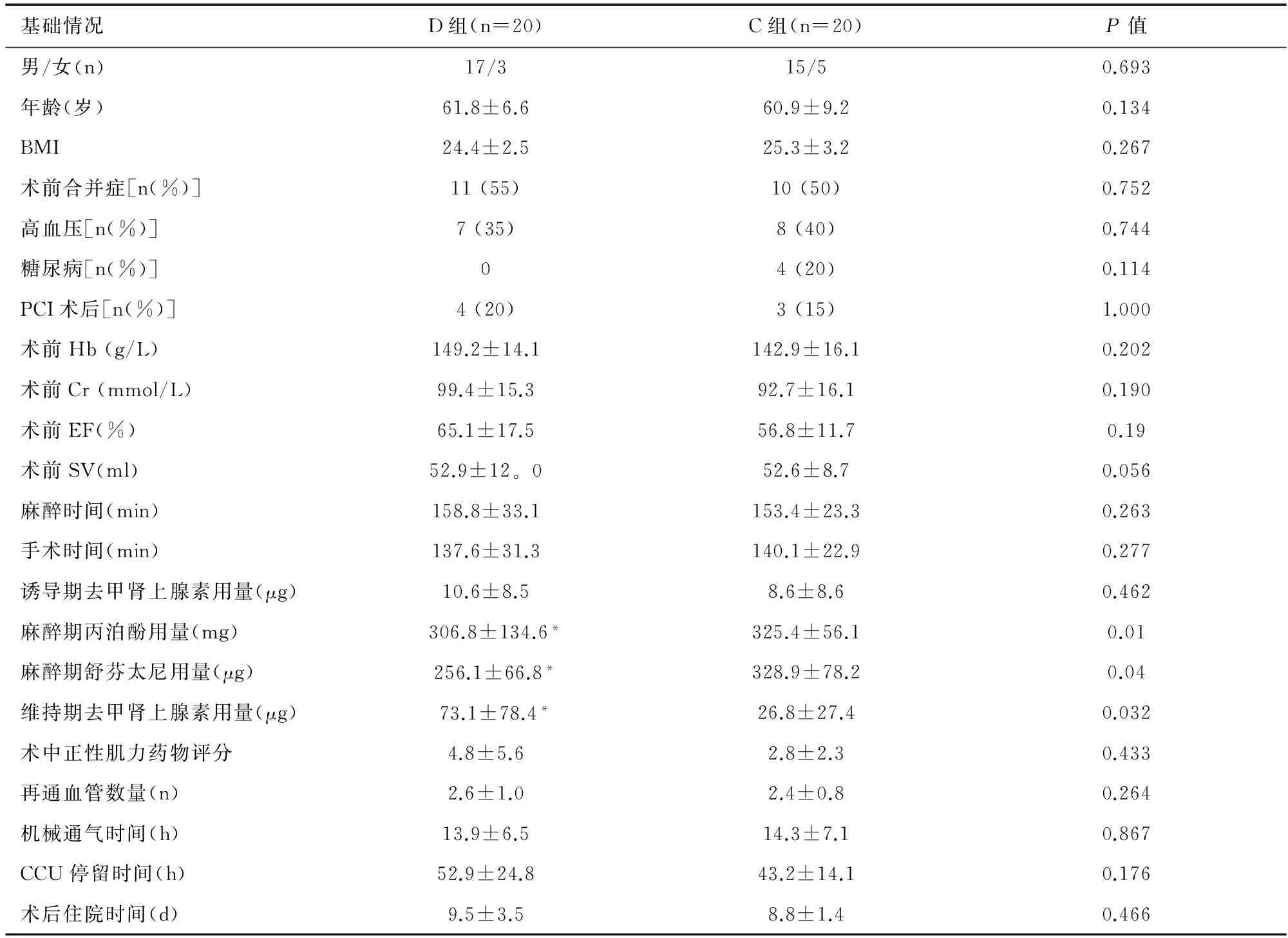
表1 两组患者一般情况和临床参数的比较
注:与 C 组相比,*P<0.05。

注:与 C 组相比,*P<0.05。图1 麻醉期各时间点血流动力学监测
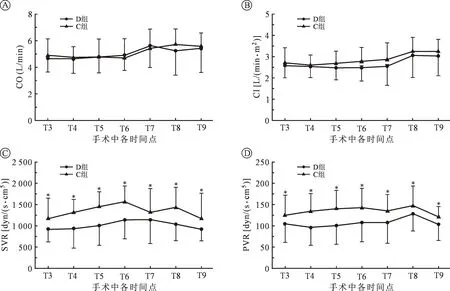
注:与 C 组相比,*P<0.05。图2 手术中各时间点漂浮导管数据监测
与 C 组相比,在 T3~T9各时间点,D 组SVR 及 PVR 均降低,差异有统计学意义(P<0.05);D 组CO及 CI 与 C 组相比差异无统计学意义;两组组内比较各时间点差异无统计学意义,见图2。
与 C 组相比,在 T3~T4及 T6~T9各时间点,D 组VO2均降低,差异有统计学意义(P<0.05);D 组DO2与 C 组相比差异无统计学意义;两组组内比较各时间点差异无统计学意义(图3)。
两组术后各并发症发生率差异均无统计学意义,见表2。

表2 两组患者术后并发症的比较[n(%)]
3 讨 论
CABG手术技术应用广泛且非常成熟,能够有效改善心肌缺血,实现完全再血管化,提高患者生存率、减少心脏事件的发生率。而 OP-CABG 手术时间短,术后恢复快,避免了体外循环对机体的不利影响,从而降低了严重心脑血管不良事件的发生率[1]。
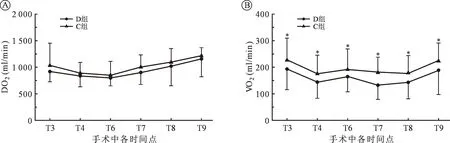
注:与 C 组相比,*P<0.05。图3 手术中各时间点心肌氧供和氧耗监测
OP-CABG虽然避免了体外循环的使用,但是整个手术过程是在心脏不停跳的情况下进行,搬动心脏可引起心率增快或减慢、血压降低、室性心律失常,严重者甚至出现循环衰竭,需紧急转为体外循环下手术。OP-CABG 手术麻醉的要点在于最大限度的心肌保护、维持血流动力学和心脏节律的稳定性,良好的术后镇痛和术后早期活动[4]。冠心病的病理生理基础是心肌的氧供需失衡,因此,麻醉中控制较慢的心率对心肌氧的供需平衡尤为重要,有利于增强心脏对缺血的耐受力。
盐酸右美托咪定是美托咪定的活性右旋异构体,是一种新型高选择性α2肾上腺素能受体激动剂,可能是通过激动脑干蓝斑,引发并保持自然非动眼睡眠状态,产生镇静、镇痛作用,其作用是可乐定的8倍,其半衰期约为2 h。因此,右旋美托咪定与传统α2肾上腺素受体激动剂相比,其选择性更强、特异性更高、效能更大,目前已成为临床麻醉界备受关注的麻醉辅助药物之一。近年来有研究显示OP-CABG手术过程中使用右美托咪定辅助麻醉能起到减慢心率、维持心律以及稳定血流动力学的作用[5],并且因为节省阿片类药物的用量在术后镇痛方面起到积极的作用[6]。Cheng 等[7]研究显示,与丙泊酚相比,在复杂性先天性心脏病患儿手术中使用右美托咪定可以维持血压和心率的稳定性,但在氧供需平衡方面,二者似乎并无差别。Gu等[8]研究提示,与丙泊酚相比,在法洛四联症患儿麻醉诱导阶段使用右美托咪定,可以改善肺泡氧合,减少心肌氧耗,增加动脉血氧含量,在麻醉维持阶段两者并无差异。Chi等[2]研究证明在 OP-CABG 患者使用1 μg/kg负荷剂量继而0.6 μg/(kg·h)的右美托咪定维持,可以降低术后心肌肌钙蛋白I以及肌酸激酶同工酶水平从而减轻术后心肌损伤。闫睿等[9]将1 μg/kg负荷剂量继而0.3 μg/(kg·h)的右美托咪定维持用于老年冠心病患者肺叶切除术,可以显著降低其术中的心肌氧耗,从而能减少心脏不良事件的发生。同样地,吴城等[10]研究认为,将0.5 μg/(kg·h)的右美托咪定用于老年胸腔镜下食管癌手术患者,可以显著降低其术中心肌氧耗量,对血流动力学影响小,改善心肌氧供。然而,纵使上述诸多研究证实了右美托咪定在 OP-CABG 及其他类型手术中的积极作用,其在OP-CABG 术中心肌氧耗方面的作用却从未得到直接证明。
因此,本实验将0.5 μg/(kg·h)的右美托咪定用于 OP-CABG 患者,从麻醉诱导前10 min持续至手术结束,观察其对血流动力学和心肌氧供需平衡的影响。结果发现,右美托咪定组(D 组)麻醉期间丙泊酚和舒芬太尼用量明显少于对照组(C 组),证实了右美托咪定减少麻醉药物和阿片类药物的用量。另外,D 组在手术中各个时间点的 HR、MAP、SVR 及 PVR较对照组均维持在较低水平,其主要机制可能为右旋美托咪定通过激动交感神经末梢的突触前膜α2肾腺素能受体,降低交感神经活性,抑制交感神经冲动的发放,进而降低交感神经的张力,增加迷走神经的兴奋性,从而抑制去甲肾上腺素的释放,降低血浆中儿茶酚胺的浓度,使乙酰胆碱释放增多,可启动心肌细胞膜上 M 型胆碱胆能受体,产生降低血压、减慢心率、减慢房室传导的作用,可有效减缓因手术应激状态下异常增高的血压和心率,使围术期血流动力学趋于稳定[11]。与此同时,血压仍在有效维持冠状动脉灌注的范围内,有利于保护心脏。另外,本研究中 D 组患者 VO2显著下降的同时 DO2及 CO、CI 变化不明显,这说明右美托咪定能缓解应激反应、降低心肌氧耗、增加了心肌储备从而产生心肌保护效应[12]。
本研究有以下几点不足之处。第一,本试验缺乏右美托咪定不同剂量之间的互相比较,因此,无法得知0.5 μg/(kg·h)是否是维持 OP-CABG 患者心肌氧供需平衡的最佳剂量。第二,本试验缺乏心肌损伤和应激反应的实验室指标。第三,本试验样本量相对较小导致术后并发症发生率的观察统计无阳性结果。下一步试验应扩大样本量以明确右美托咪定在维持 OP-CABG 患者最佳心肌氧供需平衡的基础上是否对患者的预后有积极的作用。
综上所述,在 OP-CABG 患者中从麻醉诱导前10 min 至手术结束使用0.5 μg/(kg·h)的右美托咪定,可以显著减少麻醉药物的用量,并可维持手术期间血流动力学的稳定,显著降低患者的心肌氧耗,可能会减少术后不良事件的发生,有利于患者的恢复。
[1]Lamy A, Devereaux PJ, Prabhakaran D,etal. Effects of off-pump and on-pump coronary-artery bypass grafting at 1 year[J]. N Engl J Med, 2013, 368(13): 1179-1188.
[2]Chi X, Liao M, Chen X,etal. Dexmedetomidine attenuates myocardial injury in off-pump coronary artery bypass graft surgery[J]. J Cardiothorac Vasc Anesth, 2016, 30(1): 44-50.
[3]Jin ZX, Zhou JJ, Xin M,etal. Postconditioning the human heart with adenosine in heart valve replacement surgery[J]. Ann Thorac Surg,2007,83(6):2066-2072.
[4]Hemmerling TM, Romano G, Terrasini N,etal. Anesthesia for off-pump coronary artery bypass surgery[J]. Ann Card Anaesth, 2013, 16(1): 28-39.
[5]王洋, 李林, 宋丹丹,等. 右美托咪定对非体外循环冠状动脉旁路移植术患者的影响[J]. 临床麻醉学杂志, 2014, 30(5): 421-425.
[6]Khalil MA, Abdel Azeem MS. The impact of dexmedetomidine infusion in sparing morphine consumption in off-pump coronary artery bypass grafting[J]. Semin Cardiothorac Vasc Anesth, 2013, 17(1): 66-71.
[7]Cheng X, Zuo Y, Zhao Q,etal. Comparison of the effects of dexmedetomidine and propofol on hemodynamics and pxygen balance in children with complex congenital heart disease undergoing cardiac surgery[J]. Congenit Heart Dis, 2015, 10(3): E123-130.
[8]Gu H, Bai J, Liu J. Effects of dexmedetomidine versus propofol on SPO2 in children with tetralogy of fallot during anesthesia[J]. Int J Clin Exp Med, 2015, 8(12): 22550-22556.
[9]闫睿, 于文华, 张冰. 右美托咪定对老年冠心病患者肺叶切除术中心肌氧供需平衡的影响[J]. 中国临床医学, 2015,22(1): 51-53.
[10]吴城, 江能, 肖旺频. 右美托咪啶对老年胸腔镜下食管癌手术患者心肌氧供需平衡的平衡影响[J]. 中国内镜杂志, 2011, 17(11):1151-1154.
[11]Potts AL, Anderson BJ, Holford NH,etal. Dexmedetomidine hemodynamics in children after cardiac surgery[J]. Pediatr Anaesth, 2010, 20(5):425-433.
[12]Ji F, Li Z, Nguyen H,etal. Perioperative dexmedetomidine improves outcomes of cardiac surgery[J]. Circulation, 2013, 127(15): 1576-1584.
Effects of dexmedetomidine on oxygen supply-demand balance in patients undergoing off-pump coronary artery bypasss grafting surgery
Zhang Hui, Zhang Tao-yuan, Wang Miao, Lei Chong, Hou Li-hong, Zhi Wei-wei, Chen Wei
DepartmentofAnesthesia,theAffiliatedHospitaloftheFourthMilitaryMedicalUniversity,Xi'an, 710032,China
ChenWei;Email:windvv@126.com
Objective To observe the effects of the dexmedetomidine on oxygen supply-demand balance in patients undergoing off-pump coronary artery bypass grafting surgery (OP-CABG). Methods 40 patients with ASA grade II-III coronary artery disease planned to be corrected with OP-CABG surgery were randomly divided into D group and C group, 20 cases in each group. In D group, dexmedetomidine was infused 0.5 μg/(kg·h) from 10 min before anesthesia induction until the end of surgery, and C group
equal volume of normal saline. We documented the basic information of all the patients, time of anesthesia and surgery, the dosage of norepinephrine during induction and maintenance, the dosage of propofol and sufentanial during anesthesia, the inotrope score during surgery, the number of revascularized vessels, mechanical ventilation time, CCU stay, in-hospital stay. Hemodynamic parameters were recorded at the following 10 time points: before the anesthesia induction (baseline, T0), before intubation (T1), three minutes after intubation (T2), initiation of surgery (T3), after the sternotomy (T4), after dissection of internal mammary artery (T5), at anastomosis of circumflex coronary artery or diagonal artery (T6), after the anastomosis of distal vessels (T7), 5 minutes after revascularization (T8) and end of surgery (T9). Cardiac output (CO), cardiac index (CI), systemic vascular resistance (SVR) and pulmonary vascular resistance (PVR) were recorded from T3 to T9. Oxygen supply (DO2) and oxygen consumption (VO2) were recorded from T3 to T4 and from T6 to T9. The postoperative complications in both groups were also recorded. Results Compared with C group, the dosage of propofol (P=0.01), and sufentanil in D group were less (P=0.04), The dosage of norepinephrine during the anesthesia maintenance in D group was much higher than that in C group (P=0.032). Heart rate and mean arterial pressure were significantly reduced in D group from T0 to T9. SVR and PVR were remarkably decreased from T3 to T9. VO2in D group were much less from T3 to T4 and from T6 to T9. No significant changes were found in the other endpoints. Conclusion Dexmedetomidine infusion at the rate of 0.5 μg/(kg·h) from 10 min before anesthesia induction until the end of surgery can reduce anesthetics consumption, maintain stable hemodynamics during the anesthesia and can improve the oxygen supply-demand balance with depressed oxygen consumption while maintaining the oxygen supply, which can be safely used in the patients undergoing OP-CABG surgery.
Dexmedetomidine; Off-pump coronary artery bypass grafting surgery; Oxygen supply-demand balance
10.13498/j.cnki.chin.j.ecc.2017.02.06
710032 西安,第四军医大学第一附属医院麻醉科(张 慧、张涛元、王 淼、雷 翀、侯丽宏),心脏外科(支伟伟);邮编 西安,西北妇女儿童医院儿外科(陈 伟)
陈伟,E-mail: windvv@126.com
2016-12-05)
2016-12-29)
