潮白河流域人工复合土层系统去除甲氧苄氨嘧啶的模拟研究
2017-06-21刘芹芹张发旺余和春
刘芹芹,李 淼,张发旺,余和春,张 泉,刘 翔
(1.中国地质科学院,北京 100037;2.中国地质大学(北京),北京 100084;3.清华大学环境学院,北京 100084;4.北京国环清华环境工程设计研究院有限公司,北京 100083)
潮白河流域人工复合土层系统去除甲氧苄氨嘧啶的模拟研究
刘芹芹1,2,3,李 淼3,张发旺1,余和春2,张 泉4,刘 翔3
(1.中国地质科学院,北京 100037;2.中国地质大学(北京),北京 100084;3.清华大学环境学院,北京 100084;4.北京国环清华环境工程设计研究院有限公司,北京 100083)
基于潮白河流域再生水的场地回灌,为提高抗生素甲氧苄氨嘧啶(TMP)的去除率,降低其进入地下水的风险,选用价格低廉对TMP有高效去除性能的黏土陶粒作为吸附剂,构建去除TMP的人工复合土柱。吸附实验研究结果显示黏土陶粒对TMP吸附容量达到151.824 μg/g,具有去除再生水中TMP能力;TMP在黏土陶粒解吸过程中存在解吸滞后性的现象。柱实验研究结果表明此人工复合土柱能够有效地去除再生水中TMP,去除率高于95%,其去除机制主要是吸附与生物降解协同作用。本研究建立的人工复合土层系统能有效地去除再生水中TMP,对实际场地回灌工程具有指导性作用。
人工复合土层;吸附;甲氧苄氨嘧啶;生物降解;潮白河流域;场地回灌
药物类化合物(如抗生素)在生态环境中的存在大约有30年了。因其持续性进入生态环境中而被认为是“伪持久性”污染物[1]。20世纪90年代,抗生素被广泛使用,与此同时,随着分析技术的发展,尤其是高效液相色谱串联质谱仪(LC/MS/MS)的发展,研究者们开始关注环境中的抗生素。磺胺类抗生素作为第一批人工合成抗生素,以对氨基苯磺酰胺为基本化学结构,以取代基不同而种类不同,因其价格低廉而广泛使用,且在土壤,动物粪便,水环境等[2~5]都有检出,其中甲氧苄氨嘧啶(TMP)与磺胺甲恶唑联合作为处方药联合治疗各种细菌感染(尿路病原体,呼吸道病原体以及皮肤病原体等),几乎不被人体吸收而直接以母体或转换形式通过尿液和粪便排泄到环境,并且在水环境中检出率极高[6]。TMP作为人为污染源进入到环境中,其长期存在于环境中可能会对陆生生物和水生生物存在潜在的危害风险。
TMP在人类和动物体内几乎不被代谢而直接以母体形式排泄进入污水处理厂。TMP在污水处理厂中几乎未被去除而直接进入环境水体中,随后经过水文地球化学过程在地表水、地下水以及沉积物中迁移转化。目前大量研究报道地表水[7]、地下水[8~10]、海水[11~12]、饮用水[13~15]和医用废水[16~17]等水体中均存在甲氧苄氨嘧啶,医用废水中甲氧苄氨嘧啶含量为136~5 000 ng/L,污水处理厂废水检测浓度范围为0.5~7 900 ng/L,地表水、海水存在浓度一般为2~321 ng/L。相比其对地表水的污染,其对地下水的污染较小[18~19],一般未检出或检出浓度较低(4~100 ng/L)。
研究区域位于北京市潮白河流域,其再生水补给直接进入河道,通过河道入渗进入地下水,再生水回灌区位于潮白河冲积扇,由上到下依次为潜水层、承压含水层Ⅰ和承压含水层Ⅱ。再生水回灌过程中抗生素已经成为进入地下水潜在危险物质,尤其是磺胺类抗生素。故本研究选取TMP作为潜在的抗生素污染物研究对象,通过建立模拟潮白河区域人工复合土层,提高TMP去除率,降低其进入地下水的风险。模拟潮白河流域人工复合土层主要基于吸附和生物降解相结合原理,对实际场地TMP抗生素去除工程的构建具有指导性作用。选取价格低廉且吸附性能好的黏土陶粒作为TMP去除的吸附剂,火山岩因其孔隙多,含有丰富矿物元素,不易堵塞土柱,布气均匀,有利于微生物挂膜,反冲洗时微生物膜也不易脱落。粉质黏土和中粗砂取自潮白河流域且与火山岩共同构成人工复合土柱生物降解层。结合吸附实验和柱实验共同解释人工复合土层去除TMP的机理。
1 实验部分
1.1 化学试剂
甲氧苄氨嘧啶(Trimethoprim,TMP)标准品,99.5%纯,购自德国Dr.Ehrenstorfer GmbH公司;甲醇,色谱纯,购自美国J.T.Baker;乙腈,色谱纯,购自美国J.T.Baker;甲酸,色谱纯,购自美国Fisher;浓盐酸,优级纯,购自北京化工厂;氯化钙,分析纯,购自北京化工厂;叠氮化钠,购自美国sigma公司。高纯水仪购自美国Millipore公司提供,去离子水仪为Aquapro公司提供,型号为AR2-100L-P00。TMP理化性质见表1。

表1 TMP理化性质Table 1 Thephysicochemical properties of TMP
注:Kow为正辛醇-水分配系数;pKa为解离常数。
1.2 检测方法
实验所用仪器为超高液相色谱(型号Waters UPLC)串联两级质谱(型号Waters TQD),仪器为waters公司提供,其色谱条件以及质谱工作条件参考吴苗苗[21]建立实验方法。质谱工作条件见表2。

表2 TMP质谱工作参数Table 2 The TMP working parameters in mass spectrum
1.3 人工复合土层建立
建立人工复合土柱的目的是通过吸附和生物降解协同作用去除抗生素TMP。预实验筛选对TMP具有高吸附性能且成本较低的黏土陶粒作为吸附层材料。因吸附剂是将水相TMP吸附转移到固相,并未真正意义上去除TMP,随着吸附的进行,势必会达到吸附饱和的状态,亟需微生物降解作用进一步提高TMP去除效果,故在构建人工复合土柱时,对降解层材料也进行优化选取。依据其有利于微生物附着且足够坚硬能够搭建人工复合土层筛选原则,多孔且利于微生物附着生长的火山岩碎石被筛选出,将火山岩、中粗砂和粉质黏土作为降解层,因火山岩、中粗砂和粉质黏土吸附作用较弱,但仍有部分吸附作用,故将降解层定为吸附降解层。
人工复合土柱为有机玻璃柱,内径9 cm,外径10 cm,柱高65 cm,底座直径22 cm。土柱上部和下部分别设有取水口。土柱从下而上分为三个部分,0~15 cm为支撑层,填充为3~5 cm鹅卵石,15~40 cm为吸附层,填料为黏土陶粒,40~55 cm为吸附降解层,填充材料为火山岩∶粉质黏土∶中粗砂=2∶3∶1。支撑层与吸附层和吸附层与吸附降解层中间均有滤网隔开(图1)。实验使用蠕动泵进水,进水速率为5 mL/min,水力负荷为1.13 m/d,以1 d为一周期,干湿比为1∶1。人工复合土柱的表观渗透速率(即从土柱进水到出水经历的土柱的距离除以时间得到表观渗透速率)为120.11 m/d,平均孔隙度为0.29。人工复合土柱的运行分四个阶段,第一阶段为以0.01 mol/L CaCl2去离子水溶液反冲洗14 d,主要通过连续反冲洗将原有可溶性杂质洗脱。第二阶段是在第一阶段连续回灌后使用一定浓度配水TMP去离子水回灌60 d。第三阶段为第二段实验结束后用0.01 mol/L CaCl2去离子水溶液反冲洗土柱10 d(因个人原因土柱被放置10 d后才进行反冲洗10 d),目的为将土柱吸附的部分TMP洗脱。第四阶段是在第三阶段实验后回灌一定配水TMP浓度再生水。本实验再生水取自清华大学中水站出水。清华大学紫荆学生公寓中水回用工程主要收集学生公寓生活污水及洗浴水,利用一体化膜生物反应器对废水进行深度处理后用于校园绿化及校园内冲洗厕所。
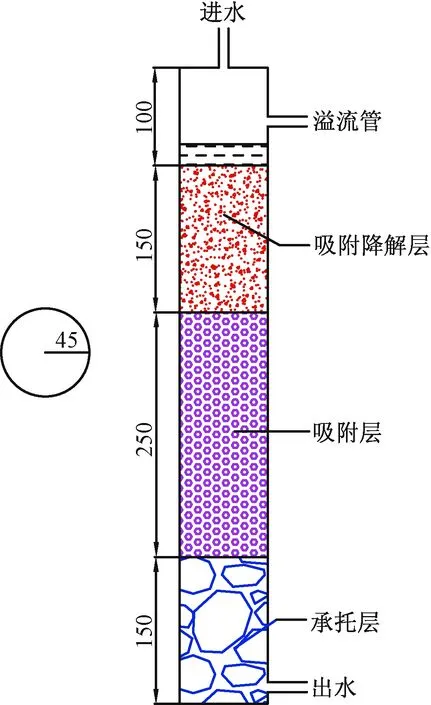
图1 人工复合土柱结构图,单位(mm)Fig.1 Schematic diagram of the artificial composite soil column. The values are given in mm
1.4 吸附实验
土水比的确定应能确保吸附实验的液相平衡浓度在初始的0.3~0.7范围内,且平衡浓度仍然在仪器检测限之上。在吸附动力学研究中,按照确定的土水比,将黏土陶粒和1 000 μg/L TMP溶液(0.01 mol/L CaCl2和200 mg/L NaN3溶液作为背景溶液)添加于锥形瓶内,25 ℃、150 rpm条件下避光震荡100 h,在0 min,5 min,30 min,1 h,2 h,8 h,12 h,24 h,36 h,48 h,72 h,84 h,100 h分别定时取样0.5 mL,过0.22 μm滤膜后上机测试样品。参照OECD guide line 106批平衡方法设置。根据土水比和吸附动力学研究结果,置于一系列50 mL离心管,加入25 mL质量浓度为25~800 μg/L TMP溶液,摇匀后在25 ℃、150 rpm下震荡平衡后在3 000 rpm下离心10 min,取上清液过0.22 μm滤膜,上机测试。吸附实验结束后,进行解吸附实验,将上清液倒出,加入等体积0.01 mol/L CaCl2和200 mg/L NaN3组成的土壤背景液,混匀后同样放入恒温振荡器下,平衡时间及震荡条件与吸附实验相同,在3 000 rpm下离心10 min,取上清液1 mL过0.22 μm滤膜上机测试,同样操作循环3次,进行三次解吸实验。以上所有实验均设置2个平行样。
2 实验结果
2.1 吸附实验结果
2.1.1 吸附动力学
TMP土水比确定为1∶100,吸附动力学确定的平衡时间为72 h,通过对吸附动力学采用伪二级动力学模型,见式(1)和双室一级动力学模型,见式(2),黏土陶粒对TMP吸附量计算公式见式(3),其拟合结果见表3。
(1)伪二级动力学模型:
(1)
(2)双室一级动力学模型:
Qt=Qe[f1(1-e-k1t)+f2(1-e-k2 t)]
(2)
(3)黏土陶粒对TMP吸附量计算:
(3)
式中:Qe——抗生素TMP在黏土陶粒平衡吸附量/(μg·g-1);
C0——溶液初始浓度/(μg·L-1);
Ce——吸附平衡浓度/(μg·L-1);
V——溶液体积/L;
M——吸附剂质量/g;
t——反应时间/h;
Qt——反应时间t时TMP在黏土陶粒吸附量/(μg·g-1);
k——伪二级动力学吸附速率常数/h-1;
k1——快吸附室吸附速率常数/h-1;
k2——慢吸附室的吸附速率常数/h-1;
f1与f2——快吸附室和慢吸附室的贡献率。

表3 TMP伪二级动力学与双室一级动力学拟合结果Table 3 Fitting results of pseudo-second order kinetic model and the first-order kinetic two-apartment model to the experimental data
从拟合结果表明,双室一级动力学模型拟合结果优于伪二级动力学拟合结果(R2>0.98),TMP伪二级动力学拟合的吸附速率为5.710/h,通过双室一级动力学拟合对TMP快吸附速率常数为2.556/h而慢吸附速率分别为0.053/h,与向熙[22]的研究结果在同一水平上,快吸附明显优于慢吸附。
2.1.2 等温吸附
有机物在吸附剂的等温吸附模型有很多种,本研究选用常用的Freundlich模型(式(4))、Langmuir模型(式(5))和Dubinin-Ashtakhov(DA)模型(式(6))定量描述TMP在黏土陶粒等温吸附。
(1)Freundlich模型
Qe=KfCen
(4)
(2)Langmuir模型
(5)
(3)Dubinin-Ashtakhov(DA)模型
(6)
式中:Kf——Freundlich模型拟合得到的吸附容量参数,为单位浓度时的吸附量/(L·g-1);
Qe——平衡状态溶质的吸附浓度/(μg·g-1);
n——吸附等温线非线性因子;
Qm——吸附剂的最大吸附量/(μg·g-1),与吸附位有关;
KL——吸附平衡常数/(L·μg-1),值越大其吸附能力越强;
ε——有效吸附潜能/(kJ·mol-1);
Cs——溶质的溶解度/ (μg·L-1);
R——气体常数,取8.314 ×103kJ/(mol·K);
T——绝对温度/K;
E——“相关因子”/(kJ·mol-1);
b——拟合参数。
Langmuir模型描述的是由大量活性相同的吸附位点所形成的单层表面吸附,且吸附容量与吸附剂体积密切相关。

表4 TMP等温吸附实验拟合结果Table 4 Fitting results of TMP isothermal adsorption experiment
根据计算所得等温吸附方程的相关系数R2可知,Freundlich模型、Langmuir模型和DA模型均能较好地拟合TMP在黏土陶粒的吸附等温线,DA拟合效果最好,R2为0.991。TMP等温吸附很好地适合DA模型,通过拟合结果n值小于1,表明在黏土陶粒吸附是非均相的。TMP的Qm为151.824 μg/g,表明黏土陶粒有很好的吸附性能,而通过Freundlich模型、Langmuir模型也能得出一致的结论。而TMP“相关因子”E拟合结果为22.247 kJ/mol,表明吸附过程存在化学吸附过程。
2.1.3 解吸
TMP在黏土陶粒解吸数据采用Freundlich模型进行拟合,拟合结果见图2。其中,解吸滞后性系数(Hysteresisindex,HI)采用式(7)。Nd为解吸等温线的非线性系数;Ns为吸附等温线的非线性系数。0≤HI≤1,HI越小说明解吸滞后性越明显。
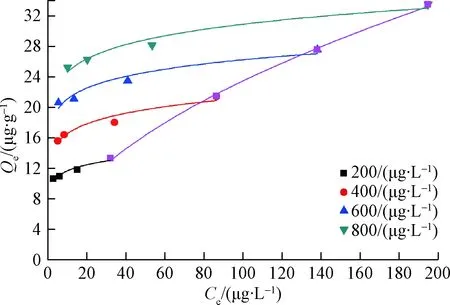
图2 TMP在黏土陶粒上的解吸等温线Fig.2 The desorption isotherm of TMP on clay ceramsites
(7)
利用Freundlich模型拟合得到TMP的Ns值为0.522。吸附剂的某些吸附位点如微孔、致密的无机矿物晶格等,可能对有机物会产生不可逆吸附,从而使得吸附质从吸附剂上的解吸速度变慢,表现出解吸滞后性。从表5中可以看出,TMP在黏土陶粒的解吸均存在解吸滞后性现象。从这种意义上说,抗生素在土壤介质中的吸附能力越强,解吸能力就越弱,同吴苗苗[21]、向熙[22]的研究结果保持一致。滞后的原因除了与有机质本身性质有关外,还与吸附剂的比表面积以及有机质含量有关。TMP被吸附进入到孔隙结构中,或一些化学吸附都会产生解吸滞后性。

表5 TMP在黏土陶粒的解吸滞后性Table 5 The desorption hysteresis of TMP on clay ceramsites
2.2 柱实验结果
在前60 d回灌一定初始浓度TMP去离子水过程中,除第一天外,出水浓度基本随进水浓度变化而变化,其平均去除率达到64.90%,前60 d回灌过程TMP平均去除率较高。在25 d和44 d提高进水TMP浓度,其出水浓度明显提高,结合吸附实验研究结果即黏土陶粒对TMP吸附容量高,判断人工复合土柱前60 d对TMP去除作用主要是吸附作用。通过pH数据监测结果,见图4,进水pH在6.4~7.0之间变化,TMP的pKa为3.24和6.76,故在进水pH条件下,TMP主要以分子和阴离子状态存在,此时部分分子态TMP可能通过疏水性作用而被吸附在黏土陶粒上,而以阴离子形式存在的TMP可能与黏土陶粒表面的金属离子以阳离子架桥作用或与Fe、Al等形成金属复合物而被吸附在黏土陶粒表面[23~24]。经过10 d反冲洗土柱后,回灌一定配水浓度TMP再生水,TMP去除率先升高后降低而后再升高趋势,最后维持在稳定去除水平上。TMP生物降解作用从91 d已经开始凸显,直至119 d,TMP出水浓度保持平稳,在此阶段变动的进水情况下并未呈现出水波动现象,表明TMP达到稳定的生物降解阶段。119 d之后其TMP进水浓度、出水浓度及去除率见表6,TMP去除率均高于95%。与Jewell等人[25]天然土层研究TMP去除相比较,人工复合土层前期去除效率明显高于天然土层,且人工复合土层微生物作用更明显且时间提前(天然土柱需要超过7个月微生物作用才显著),可能与人工复合土层填料易于微生物挂膜有关。监测DO随时间变化结果,见图5,在70 d之后因回灌进水为深度处理后的再生水,故进水DO值较低,但出水DO值有明显升高,表明人工复合土柱是一个好氧环境,可能好氧环境有利于微生物生长。综上,人工复合土层能够有效去除TMP。

图3 TMP在人工复合土柱进出水浓度随时间变化Fig.3 The TMP influent and effluent concentrations variation over time

图4 pH随时间变化情况Fig.4 The variability of pH over time
3 结论
(1)吸附实验表明黏土陶粒对TMP吸附容量达到151.824 μg/g,能有效去除水体的TMP。
(2)通过吸附解吸实验结果表明TMP在黏土陶粒的解吸存在解吸滞后性现象。

表6 稳定生物降解期间TMP进水浓度、出水浓度及去除率Table 6 Thevariation of TMP influent concentrations, effluent concentrations and removal rates during the time of stable TMP biodegradation

图5 DO随时间变化情况Fig.5 The variability of DO over time
(3)人工复合土层处理系统运行结果显示,此人工复合土层能够有效地去除TMP,其去除率高达95%。去除机理主要是实验前期的吸附结合实验后期生物降解协同作用共同去除水体中TMP。对实际去除水体TMP再生水原位处理工程的构建具有指导性意义。
[1] Richardson B J, Lam P K S, Martin M. Emerging chemicals of concern: Pharmaceuticals and personal care products (PPCPs) in Asia, with particular reference to Southern China[J]. Marine Pollution Bulletin, 2005, 50(9): 913-920.
[2] Mompelat S, Le Bot B, Thomas O. Occurrence and fate of pharmaceutical products and by-products, from resource to drinking water[J]. Environment International, 2009, 35(5): 803-814.
[3] Tong L, Huang S, Wang Y,etal. Occurrence of antibiotics in the aquatic environment of Jianghan Plain, central China[J]. Science of the Total Environment,2014, 497/498: 180-187.
[4] Batt A L, Snow D D, Aga D S. Occurrence of sulfonamide antimicrobials in private water wells in Washington County, Idaho, USA[J]. Chemosphere, 2006, 64(11): 1963-1971.
[5] Jacobsen A M, Halling-S, rensen B,etal. Simultaneous extraction of tetracycline, macrolide and sulfonamide antibiotics from agricultural soils using pressurised liquid extraction, followed by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2004, 1038(1/2): 157-170.
[6] Huovinen P, Sundström L, Swedberg G,etal. Trimethoprim and sulfonamide resistance[J]. Antimicrobial Agents & Chemotherapy, 1995, 39(2): 279-289.
[7] Pal A, Gin K Y, Lin A Y,etal. Impacts of emerging organic contaminants on freshwater resources: Review of recent occurrences, sources, fate and effects[J]. Science of The Total Environment, 2010, 408(24): 6062-6069.
[8] Chen G, Li M, Liu X. Fluoroquinolone antibacterial agent contaminants in soil/groundwater: aliterature review of sources, fate, and occurrence[J]. Water, Air, & Soil Pollution, 2015, 226:418.
[9] Sui Q, Cao X, Lu S,etal. Occurrence, sources and fate of pharmaceuticals and personal care products in the groundwater: a review[J]. Emerging Contaminants, 2015(1): 14-24.
[10] Vulliet E, Cren-Olive C. Screening of pharmaceuticals and hormones at the regional scale, in surface and groundwaters intended to human consumption[J]. Environmental Pollution, 2011, 159(10): 2929-2934.
[11] Chen H, Liu S, Xu X,etal. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea: Spatial distribution, source analysis and ecological risks[J]. Marine Pollution Bulletin, 2015, 95(1): 365-373.
[12] El Shafay S M, Ali S S, El-Sheekh M M. Antimicrobial activity of some seaweeds species from Red sea, against multidrug resistant bacteria[J]. The Egyptian Journal of Aquatic Research, 2016, 42(1): 65-74.
[13] Paul Westerhoff, Yeomin Yoon, Shane Snyder A,etal. Fate of endocrine-disruptor, pharmaceutical, and personal care product chemicals during simulated drinking water treatment processes[J]. Environmental Science & Technology, 2005, 39(17): 6649-6663.
[14] Kleywegt S, Pileggi V, Yang P,etal. Pharmaceuticals, hormones and bisphenol A in untreated source and finished drinking water in Ontario, Canada-Occurrence and treatment efficiency[J]. Science of The Total Environment, 2011, 409(8): 1481-1488.
[15] Stackelberg P E, Furlong E T, Meyer M T,etal. Persistence of pharmaceutical compounds and other organic wastewater contaminants in a conventional drinking-water-treatment plant[J]. Science of The Total Environment, 2004, 329(1/3): 99-113.
[16] Kümmerer K, Henninger A. Promoting resistance by the emission of antibiotics from hospitals and households into effluent[J]. Clinical Microbiology & Infection the Official Publication of the European Society of Clinical Microbiology & Infectious Diseases, 2003, 9(12): 1203-1214.
[17] Lachassagne D, Soubrand M, Casellas M,etal. Impact of sludge stabilization processes and sludge origin (urban or hospital) on the mobility of pharmaceutical compounds following sludge landspreading in laboratory soil-column experiments[J]. Environmental Science and Pollution Research, 2015, 22(21): 17135-17150.
[18] Loos R, Locoro G, Comero S,etal. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water[J]. Water Research, 2010, 44(14): 4115-4126.
[19] Vulliet E, Cren-Olivé C, Grenier-Loustalot M. Occurrence of pharmaceuticals and hormones in drinking water treated from surface waters[J]. Environmental Chemistry Letters, 2011, 9(1): 103-114.
[20] Ahmed M B, Zhou J L, Ngo H H,etal. Adsorptive removal of antibiotics from water and wastewater: Progress and challenges[J]. Science of The Total Environment, 2015, 532: 112-126.
[21] 吴苗苗. 再生水回灌过程中典型磺胺类抗生素的行为特性研究[D]. 北京:清华大学, 2015:94.[WU M M. The behavior of tipicalsulfanomides in soil by groundwater recharge with reclaimed water[D]. Beijing: Tsinghua University, 2015: 94. (in Chinese)]
[22] 向熙. 人工复合土层去除再生水中典型内分泌干扰物的研究[D]. 北京:清华大学, 2015:88.[XIANG X. The removal of typical EDCs in reclaimed water by artificial composite soil treatment system [D]. Beijing: Tsinghua University, 2015: 88. (in Chinese)]
[23] Gu C, Karthikeyan K G. Interaction of tetracycline with aluminum and iron hydrous oxides[J]. Environmental Science & Technology, 2005, 39(8): 2660-2667.
[24] Mackay A A, Canterbury B. Oxytetracycline sorption to organic matter by metal-bridging[J]. Journal of Environmental Quality,2005, 34(6): 1964-1971.
[25] Jewell K S, Castronovo S, Wick A,etal. New insights into the transformation of trimethoprim during biological wastewater treatment[J]. Water Research, 2016, 88: 550-557.
责任编辑:张若琳
The study of removing trimethoprim by simulating the Chaobai Riverbasin with artificial composite soil treatment system
LIU Qinqin1,2,3, LI Miao3, ZHANG Fawang1, YU Hechun2, ZHANG Quan4, LIU Xiang3
(1.ChineseAcademyofGeologicalScience,Beijing100037,China; 2.ChinaUniversityofGeosciences(Beijing),Beijing100084,China; 3.SchoolofEnvironmentTsinghuaUniversity,Beijing100083,China;4.BeijingGuohuanTsinghuaEnvironmentEngineeringDesign&ResearchInstituteCo.Ltd,Beijing100083,China)
Based on the reclaimed water recharge of Chaobai River, clay ceramsites were chosen as adsorbent in this study, which has the character of low price and high adsorption capacity of trimethoprim (TMP), in order to reduce the amount of TMP entering into environment. The adsorption capacity of TMP reached 151.824 μg/g, which has the ability of removing TMP from reclaimed water. Desorption experimental results showed that the desorption hysteresis of TMP in clay ceramsites was delayed. We systematically investigated the removal of TMP by an artificial composite soil treatment system. The results showed that the artificial composite soil system could effectively remove TMP and the remove rate was higher than 95%. The combination of adsorption effect and biodegradation is the TMP major removal mechanism. This artificial composite soil treatment system can effectively remove TMP from the reclaimed water, and it has a guiding role in the field recharge.
artificial composite soil treatment system; adsorption; trimethoprim; biodegradation;Chaobai River basin;reclaimed water recharge
2016-10-16;
2016-12-10
北京市自然科学基金(J150004);国家自然科学基金(51408335);国家自然科学基金重点项目(41130637)
刘芹芹(1987-),女,博士研究生,主要从事水文地质以及水污染研究。E-mail:liuqq2008@163.com
刘翔(1965-),男,教授,博士生导师,主要从事土壤/地下水污染治理理论与技术,水资源保护于利用技术等。 E-mail:x.liu@tsinghua.edu.cn
10.16030/j.cnki.issn.1000-3665.2017.03.22
P641.3;X143
A
1000-3665(2017)03-0151-07
