脂肪酸单甘油酯的酶催化合成及其表征
2017-06-21王楠吴望波张桂菊王瑞徐宝财
王楠,吴望波,张桂菊,王瑞,徐宝财
(北京工商大学 食品学院,北京市食品风味化学重点实验室,北京市食品添加剂工程技术研究中心,北京, 100048)
脂肪酸单甘油酯的酶催化合成及其表征
王楠,吴望波,张桂菊*,王瑞,徐宝财*
(北京工商大学 食品学院,北京市食品风味化学重点实验室,北京市食品添加剂工程技术研究中心,北京, 100048)
以癸酸甲酯、月桂酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯和硬脂酸甲酯为原料,与甘油进行脂肪酶催化酯交换反应制备脂肪酸单甘油酯,产物为脂肪酸单甘油酯和少量脂肪酸双甘油酯的混合物,其中脂肪酸单甘油酯的质量分数均在91%以上,最高可达95.9%。随着碳链长度的增加,脂肪酸甲酯的转化率降低,脂肪酸单甘油酯的质量分数也降低。采用气相色谱-质谱联机、核磁共振氢谱和红外光谱,对柱层析分离后的脂肪酸单甘油酯进行了结构表征。
脂肪酸单甘油酯;脂肪酸甲酯;酶催化合成;酯交换反应
脂肪酸单甘油酯是全球需求量最大的非离子乳化剂,主要应用于食品、化妆品及制药工业,其中70%用于食品工业。脂肪酸单甘油酯的制备方法主要有化学法和酶催化法。化学法是在高温(220~260 ℃)及碱催化剂条件下,由动植物油脂经甘油解反应制得[1]。该方法反应温度高、能耗大,而且副反应多,产品的质量差、颜色深,所得产物为脂肪酸单甘油酯、双甘油酯和三甘油酯的混合物,单甘油酯的纯度一般为45%~55%[2]。酶催化法制备脂肪酸单甘油酯,反应条件温和、选择性高、产品质量好,是科学家们广泛关注的研究热点。酶催化法合成脂肪酸单甘油酯主要有酯化法、甘油解法、水解法和酯交换法等,其中甘油解法由于原子经济性高备受关注[3-4],所得产物中脂肪酸单甘油酯的纯度可达65%~80%[5-8]。这可以满足一般实际应用的需求,但是在人造黄油、起酥油、冰淇淋和奶油等食品加工中,要求脂肪酸单甘油酯的纯度达到90%以上,因此需要通过高能耗、高成本的分子蒸馏进行分离提纯,以获得高纯度的脂肪酸单甘油酯[9-12]。此外,可采用基团保护法制备高纯度脂肪酸单甘油酯,即选用丙酮、硼酸等基团保护剂将甘油的其中两个羟基保护起来,剩余1个羟基与脂肪酸及其衍生物发生反应,可制备纯度高于90%的脂肪酸单甘油酯[13-16]。但这种方法额外增加了保护与脱除保护的过程,无疑会增加成本。
采用脂肪酸甲酯与甘油的酶催化酯交换反应,选择性高,可获得高纯度的脂肪酸单甘油酯[17]。本研究分别以癸酸甲酯、月桂酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯及硬脂酸甲酯为原料,叔丁醇作为反应溶剂,在固定化脂肪酶催化作用下与甘油进行酯交换反应制备脂肪酸单甘油酯,并对5种脂肪酸单甘油酯进行了提纯和结构表征。
1 实验部分
1.1 试剂与仪器
癸酸甲酯、月桂酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯、硬脂酸甲酯(纯度>99%,百灵威科技有限公司);叔丁醇、甘油(分析纯,国药集团化学试剂有限公司);乙腈、丙酮(色谱纯,北京迪马欧泰科技发展中心);固定化脂肪酶(Novozyme 435,丹麦诺维信生物技术有限公司)。
立式恒温振荡器(IS-RSV1),苏州精骐有限公司;高效液相色谱(Agilent1200),安捷伦科技有限公司;电子天平(BSA423S),赛多利斯科学仪器有限公司;傅里叶变换红外光谱仪(Nicolet iS10),赛默飞世尔科技有限公司);核磁共振仪(AV300 MHz,德国 Bruker 公司);三重四极杆气质联用仪(GC7890/7000B,安捷伦科技有限公司)。
1.2 方法
1.2.1 脂肪酸单甘油酯的合成
50 mL具塞锥形瓶中,依次加入5 g脂肪酸甲酯和一定量的甘油、叔丁醇,其中底物质量分数(脂肪酸甲酯相对于叔丁醇的质量分数)为30%,底物摩尔比(脂肪酸甲酯与甘油的摩尔比)为1∶5,再加入Novozyme 435脂肪酶,酶添加量(相对于脂肪酸甲酯的质量分数)为7%,待体系混合均匀,置于立式恒温振荡器,设置反应温度55 ℃、振荡器转速220 r/min,开始反应,并分别于反应开始后10 min、20 min、30 min、40 min、50 min、1 h、1.5 h、2 h、4 h取样进行液相色谱分析。
反应结束后,过滤,回收脂肪酶,滤液中加入50 mL乙醇/蒸馏水(40∶10,v/v),用30 mL正己烷萃取3次,合并正己烷相,旋蒸除去溶剂,回收未反应的脂肪酸甲酯。乙醇/水相用30 mL二氯甲烷萃取3次,合并有机相,旋蒸,得白色粉末状固体,用液相色谱(HPLC)分析脂肪酸单甘油酯和脂肪酸双甘油酯的质量分数。
1.2.2 脂肪酸单甘油酯的提纯
柱层析分离方法参照文献[18-19]。称取30 g硅胶加入100 mL石油醚中,然后装入玻璃层析柱(φ3 cm×40 cm),称取2 g脂肪酸单甘油酯样品溶于石油醚,并加入层析柱中。先后采用不同比例的石油醚∶乙酸乙酯(体积比分别为5∶1, 1∶1)进行梯度洗脱,依次得到脂肪酸双甘油酯和脂肪酸单甘油酯,旋蒸除去溶剂,待分析。
1.2.3 脂肪酸单甘油酯的液相色谱分析
采用高效液相色谱-示差折光检测器(HPLC-RID)对原料脂肪酸甲酯及反应中生成的脂肪酸单甘油酯、脂肪酸双甘油酯进行分析,外标法定量。色谱柱:Agilent Eclipse Plus C18(4.6 mm×250 mm,5μm);分析条件:柱温为35 ℃,流动相为乙腈/丙酮(1∶1,v/v),流速为1 mL/min,进样量20 μL,检测器温度为40 ℃。
1.2.4 脂肪酸单甘油酯的表征
气相色谱-质谱联机(GC-MS)分析:EI全扫描,He作为载气。进样器温度50 ℃,检测器温度250 ℃,总流量22 mL/min,进样量为1.0 μL,分流比20∶1,隔垫吹扫流量3 mL/min,离子源温度230 ℃。溶剂延迟时间4 min;扫描范围40~500 amu。升温程序:从50 ℃以30 ℃/min的速度升到220 ℃,再以2 ℃/min升到250 ℃保持5 min,再以15 ℃/min升温到290 ℃。
核磁共振氢谱(1H-NMR)分析:将5种脂肪酸单甘油酯样品用氘代氯仿配成相应的溶液,采用Bruker AV300MHz核磁共振谱分析仪进行数据采集。
红外光谱(IR)分析:采取KBr压片法,取脂肪酸单甘油酯样品与KBr混匀压成薄片,采用傅里叶变换红外光谱仪对样品进行红外光谱分析,测试波数范围4 000~400 cm-1。
2 结果和讨论
2.1 脂肪酸单甘油酯的合成
癸酸甲酯、月桂酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯和硬脂酸甲酯分别与甘油进行酶催化反应合成脂肪酸单甘油酯,反应体系中原料脂肪酸甲酯及生成的脂肪酸单甘油酯和脂肪酸双甘油酯的质量分数随反应时间的变化如图1~图5所示。
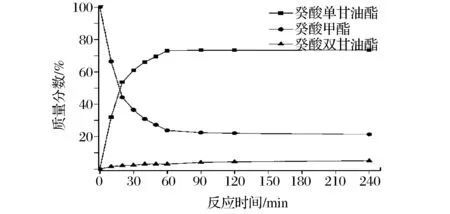
图1 癸酸单甘油酯的合成Fig.1 The synthesis of glycerol monocaprate
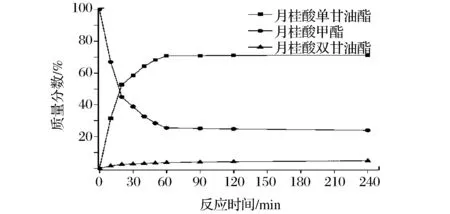
图2 月桂酸单甘油酯的合成Fig.2 The synthesis of glycerol monolaurate

图3 肉豆蔻酸单甘油酯的合成Fig.3 The synthesis of glycerol monomyristate

图4 棕榈酸单甘油酯的合成Fig.4 The synthesis of glycerol monopalmitate
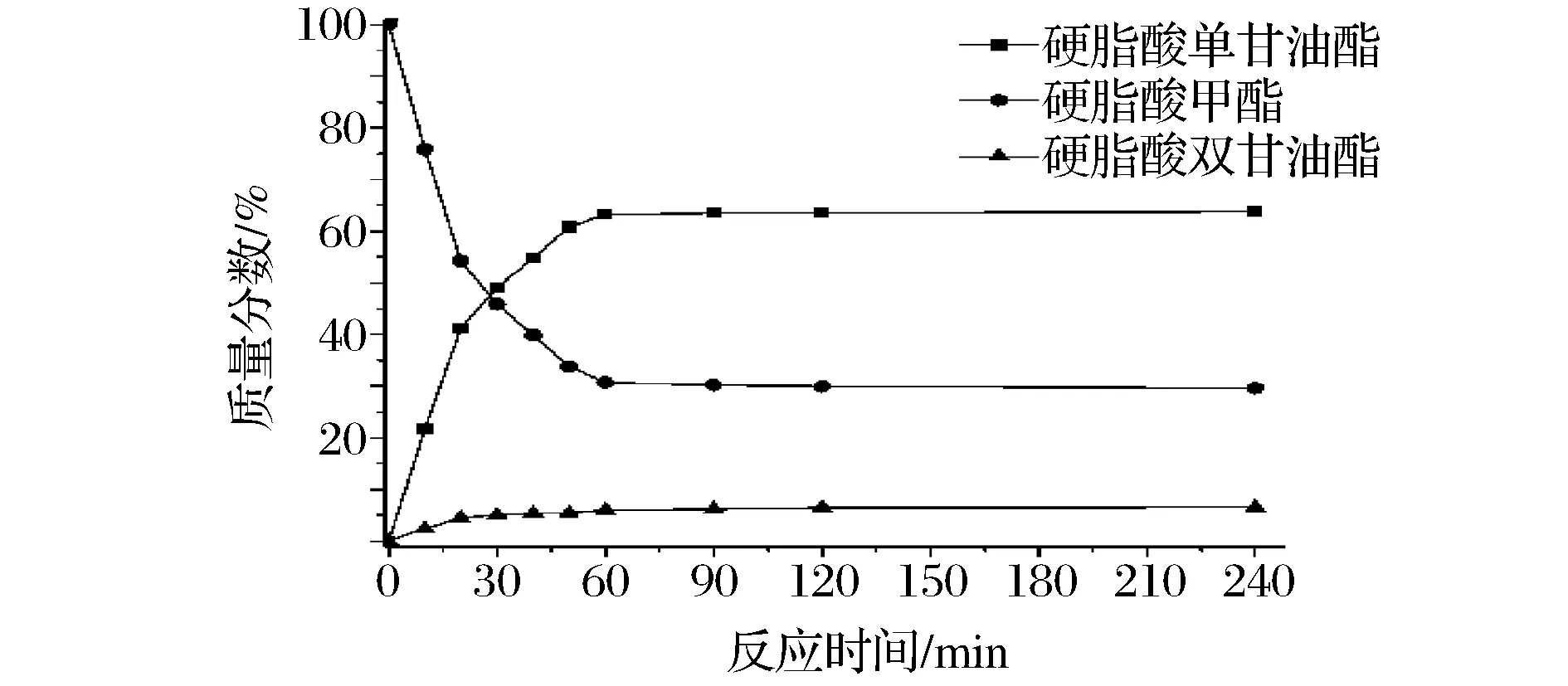
图5 硬脂酸单甘油酯的合成Fig.5 The synthesis of glycerol monostearate
从图1-图5可以看出,反应刚开始时脂肪酸甲酯和甘油的反应速率很快,30 min时反应体系中脂肪酸单甘油酯的质量分数即可达50%左右。之后反应速率降低,1 h后反应达到平衡,脂肪酸甲酯、脂肪酸单甘油酯及脂肪酸双甘油酯的质量分数基本保持不变。反应达到平衡后反应体系中脂肪酸甲酯的转化率及脂肪酸单甘油酯和双甘油酯的质量分数见表1。经过后处理回收未反应的脂肪酸甲酯,产物中脂肪酸单甘油酯的质量分数也见表1。

表1 脂肪酸甲酯的转化率及脂肪酸单甘油酯和双甘油酯的质量分数
从表1中可知,癸酸甲酯的转化率最高,达到了76.2%,硬脂酸甲酯的转化率最低为69.3%。反应达到平衡后,体系中癸酸单甘油酯的质量分数最高为73.1%,而癸酸双甘油酯的质量分数最低为3.1%;硬脂酸单甘油酯的质量分数最低为63.3%,而硬脂酸双甘油酯的质量分数为6.1%。以上数据表明,在脂肪酸甲酯与甘油的酶催化酯交换反应中,选择性高,脂肪酸单甘油酯的质量分数均可达91%以上,其中癸酸单甘油酯的质量分数最高为95.9%。不同的碳链长度对脂肪酸甲酯的转化率及反应的选择性均有一定的影响,碳链越长,脂肪酸甲酯的转化率越低,所得的脂肪酸单甘油酯的质量分数也越低[20]。
2.2 脂肪酸单甘油酯的表征
酶催化反应结束后,经后处理回收未反应的月桂酸甲酯,所得产物为脂肪酸单甘油酯和少量脂肪酸双甘油酯的混合物。按照1.2.2部分的方法经柱层析分离提纯,除去脂肪酸双甘油酯,得脂肪酸单甘油酯纯品,采用GC-MS和1HNMR、IR进行结构表征。
2.2.1 GC-MS分析
5种脂肪酸单甘油酯的GC-MS分析结果如图6所示。

A-癸酸单甘油酯;B-月桂酸单甘油酯;C-肉豆蔻酸单甘油酯;D-棕榈酸单甘油酯;E-硬脂酸单甘油酯图6 脂肪酸单甘油酯的GC-MS总离子流图Fig.6 GC-MS total ion chromatorgraphy of fatty acid monoglycerides
从图6可以看出,癸酸单甘油酯的保留时间为7.77 min,峰面积百分比为99.6%;月桂酸单甘油酯的保留时间为9.53 min,峰面积百分比为99.6%;肉豆酸单甘油酯的保留时间为12.20 min,峰面积百分比为99.7%;棕榈酸单甘油酯的保留时间为16.09 min,峰面积百分比为99.7%;硬脂酸单甘油酯的保留时间为20.66 min,峰面积百分比为99.3%。
癸酸单甘油酯(EI-MSm/z):215.1,173.1,155.1,134,98;月桂酸单甘油酯(EI-MSm/z):243.1,201.1,183.1,134,98;肉豆酸单甘油酯(EI-MSm/z):271,229.1,211.1,134,98;棕榈酸单甘油酯(EI-MSm/z):299.1,257.1,239.2,134,98;硬脂酸单甘油酯(EI-MSm/z):327.1,285.1,267.2,134,98。EI-MS碎片离子峰符合脂肪酸单甘油酯的化学结构,与文献报道一致[21]。
2.2.21H-NMR分析
5种脂肪酸单甘油酯样品的1H-NMR分析结果如图7所示。

A-癸酸单甘油酯;B-月桂酸单甘油酯;C-肉豆蔻酸单甘油酯;D-棕榈酸单甘油酯;E-硬脂酸单甘油酯图7 脂肪酸单甘油酯的1H-NMR图Fig.7 1H-NMR spectra of fatty acid monoglycerides
癸酸单甘油酯 (CDCl3,300 MHz),δ:0.884 (t,J = 13.2 Hz,3H,CH3),1.268 (m,12H, 6CH2),1.632 (m,2H,CH2),2.356 (t,J = 15.3 Hz,2H,CH2CO),3.602 (dd,J = 6.0,5.7 Hz,1H,CHOH),3.705 (dd,J = 3.9,3.9 Hz,1H,CHOH),3.938 (m,1H,CHOH),4.179 (m,2H,CH2OCO)。
月桂酸单甘油酯 (CDCl3,300MHz),δ:0.886 (t,J = 13.2 Hz,3H,CH3),1.264 (m,16H,8CH2),1.634 (m,2H,CH2),2.357 (t,J = 15.0 Hz,2H,CH2CO),3.604 (dd,J = 5.7,5.7 Hz,1H,CHOH),3.707 (dd,J = 3.9,3.9 Hz,1H,CHOH),3.940 (m,1H,CHOH),4.181 (m,2H,CH2OCO)。
肉豆蔻酸单甘油酯 (CDCl3,300MHz),δ:0.882 (t,J = 13.2 Hz,3H,CH3),1.258 (m,20H,10CH2),1.627 (m,2H,CH2),2.351 (t,J = 15.0 Hz,2H,CH2CO),2.566 (bs,2H,OH),3.596 (dd, J=6.0,5.7 Hz,1H,CHOH),3.700 (dd,J=3.9,3.9 Hz,1H,CHOH),3.933 (m,1H,CHOH),4.171 (m,2H,CH2OCO)。
棕榈酸单甘油酯 (CDCl3,300MHz),δ:0.888 (t,J = 13.2 Hz,3H,CH3),1.263 (m,24H,12CH2),1.637 (m,2H,CH2),2.205 (bs,2H,OH),2.361 (t,J = 15.0 Hz,2H,CH2CO),3.609 (dd,J=6.0,5.7 Hz,1H,CHOH),3.689 (dd,J = 3.9,3.9 Hz,1H,CHOH),3.944 (m,1H,CHOH),4.185 (m,2H,CH2OCO)。
硬脂酸单甘油酯 (CDCl3,300MHz),δ:0.890 (t,J = 13.2 Hz,3H,CH3),1.264 (m,28H,14CH2),1.639 (m,2H,CH2),2.362 (t,J = 15.0 Hz,2H,CH2CO),3.612 (dd, J = 5.7,5.7 Hz,1H,CHOH),3.714 (dd,J = 3.9,3.9 Hz,1H,CHOH),3.947 (m,1H,CHOH), 4.188 (m,2H,CH2OCO)。
从图7可以看出,5种脂肪酸单甘油酯的1H NMR谱非常相似,这是因为它们的化学结构相似,由长碳链的酰基和甘油两部分组成,如图8所示。酰基碳链上质子的化学位移位于0.882~2.362 ppm之间,而甘油部分质子的化学位移位于3.596~4.188 ppm之间。其中甘油部分2号碳原子为手性碳, 1和3号碳原子上的2个质子不等价,因此3号碳原子上的2个质子分别表现出两个二重峰(dd),但是1号碳原子上的2个质子表现出多重峰(m)。甘油部分的2个游离羟基为活泼氢,存在质子交换反应,肉豆蔻酸单甘油酯和棕榈酸单甘油酯的谱图中出现羟基质子的宽峰,而其他3种脂肪酸单甘油酯的谱图中没有观察到明显的羟基质子峰,可能是与羰基附近的亚甲基质子峰发生了重叠。上述结果与文献报道一致[13, 15]。

癸酸单甘油酯n=6,月桂酸单甘油酯n=8,肉豆蔻酸单甘油酯n=10,棕榈酸单甘油酯n=12,硬脂酸单甘油酯n=14图8 脂肪酸单甘油酯的结构式Fig.8 Structure of fatty acid monoglycerides
2.2.3 红外光谱分析


A-癸酸单甘油酯;B-月桂酸单甘油酯;C-肉豆蔻酸单甘油酯;D-棕榈酸单甘油酯;E-硬脂酸单甘油酯图9 脂肪酸单甘油酯红外光谱图Fig.9 IR spectra of fatty acid monoglycerides
3 结论
以脂肪酶Novozyme 435为催化剂,采用癸酸甲酯、月桂酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯和硬脂酸甲酯等脂肪酸甲酯为原料,与甘油进行酶催化酯交换反应制备相应的脂肪酸单甘油酯。原料脂肪酸甲酯的转化率69.2%~76.2%,随着碳链长度的增加,转化率降低,即反应活性降低。生成物为脂肪酸单甘油酯和少量脂肪酸双甘油酯的混合物,其中脂肪酸单甘油酯的质量分数均在91%以上,最高可达95.9%。经柱层析分离得到的五种脂肪酸单甘油酯纯品,采用气相色谱-质谱联机、核磁共振氢谱及红外光谱对其进行纯度分析和结构表征。
脂肪酸甲酯与甘油的酶催化酯交换反应,速率快,反应1h就达到平衡;另外反应选择性高,生成脂肪酸单甘油酯的选择性高于90%,不经分子蒸馏提纯即可获得高纯度的脂肪酸单甘油酯。但是,目前脂肪酸甲酯的转化率较低,是下一步研究工作亟待解决的问题。
[1] SONNTAG N O V.Glycerolysis of fats and methyl esters-Status,review and critique[J].Journal of the American Oil Chemists Society,1982,59(10):795A-802A.
[2] DAMSTRUP M L,JENSEN T,SPARSΦ F V,et al.Solvent optimization for efficient enzymatic monoacylglycerol production based on a glycerolysis reaction[J].Journal of the American Oil Chemists Society,2005,82(8):559-564.
[3] 葛赞,钟凯,吴维高,等.酶催化法合成单甘酯的研究进展[J].中国食品添加剂,2012(5):212-218.
[4] 张桂菊,徐宝财,赵秋瑾,等.酶催化法合成食品乳化剂的研究进展[J].食品安全质量检测学报,2014,5(1):115-122.
[5] ZHONG Nan-jing,LILin,XUXue-bing,et al.An efficient binary solvent mixture for monoacylglycerol synthesis by enzymatic glycerolysis[J].Journal of the American Oil Chemists' Society,2009,86(8):783-789.
[6] VOLLF,KRÜGER R L,CASTILHOS F D,et al.Kinetic modeling of lipase-catalyzed glycerolysis of olive oil[J].Biochemical Engineering Journal,2011,56 (3):107-115.
[7] NAIK M K,NAIK S N,MOHANTYS.Enzymaticglycerolysis for conversion of sunflower oil to food based emulsifiers[J].Catalysis Today,2014,237(6):145-149.
[8] 邓成龙,张桂菊,吴望波,等.响应面法优化月桂酸单甘油酯的酶催化合成工艺[J].日用化学工业,2016,46(7):377-381.
[9] FREGOLENTE L V,BATISTELLA C B,MACIEL F R,et al.Optimization of distilled monoglycerides production[J].Applied Biochemistry & Biotechnology,2006,129-132:680-693.
[10] ZHU Qi-si,LITie,WANG Yong-hua,et al.A two-stage enzymatic process for synthesis of extremely pure high oleic glycerol monooleate[J].Enzyme & Microbial Technology,2011,48(2):143-147.
[11] ZHABao-ping,CHENZhong-wei,WANGLi,et al.Production of glycerol monolaurate-enriched monoacylglycerols by lipase-catalyzed glycerolysis from coconut oil[J].European Journal of Lipid Science and Technology,2014,116(3):328-335.
[12] SOLAESA A G,SANZ M T,FALKEBORGM,et al.Production and concentration of monoacylglycerols rich in omega-3 polyunsaturated fatty acids by enzymatic glycerolysis and molecular distillation[J].Food Chemistry,2016,190:960-967.
[13] GHANDI M,MONSTASHARI A,KAREGARM,et al.Efficient Synthesis of α-monoglycerides via solventlesscondensation of fatty acids with glycerol carbonate[J].Journal of the American Oil Chemists Society,2007,84(7):681-685.
[14] 管培庆,董殿权.月桂酸单甘酯的合成与提纯[J].广州化工,2011,39(10):98-99.
[15] WANG Xiao-san,JIN Qing-zhe,WANGTong,et al.An improved method for the synthesis of 1-monoolein[J].Journal of Molecular Catalysis B Enzymatic,2013,97(2):130-136.
[16] ITABAIANA I,GONCALVES K M,ZOUMPANIOTI M,et al.Microemulsion-based organogels as an efficient support for lipase- catalyzed reactions under continuous-flow conditions[J].Organic Process Research & Development,2014,18(11):1 372-1 376.
[17] 吴望波,张桂菊,王瑞,等.高纯度单月桂酸甘油酯的酶催化合成[J].精细化工,2016,33(8):909-914.
[18] ZHAO Yan-jun,LIU Jun-feng,DENGLi,et al.Optimization ofCandidasp. 99-125 lipase catalyzed esterification for synthesis of monoglyceride and diglyceride in solvent-free system[J].Journal of Molecular Catalysis B:Enzymatic,2011,72(3):157-162.
[19] 董昌婷,曾桂凤,周永生,等.固体碱催化脂肪酸甲酯甘油解制备单甘酯[J].精细化工,2016,33(2):157-161.
[20] 谷玉杰,马石刚,吕剑.合成系列高纯度单脂肪酸甘油酯[J].日用化学工业,2006,36(1):12-14.
[21] 贾海涛,马育松,陈瑞春.气相色谱-质谱联用法测定香肠中3种单甘油酯[J].食品科学,2014,35(6):94-97.
Enzymatic synthesis and characterization of monoglycerides
WANG Nan, WU Wang-bo, ZHANG Gui-ju*, WANG Rui, XU Bao-cai*
(School of Food and Chemical Engineering, Beijing Key Laboratory of Flavor Chemistry, Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology and Business University, Beijing 100048, China)
Monoglycerides were prepared by the transesterification of fatty acid methyl esters such as methyl caprate, methyl laurate, methyl myristate, methyl palmitate and methyl stearate with glycerol in the presence of Novozyme 435 lipase as catalyst. The product is a mixture of monoglycerides and a small amount of diglycerides, which contained monoglycerides above 91%, and up to 95.9%. With the increase of carbon chain length, the conversion of fatty acid methyl esters decreased, and the content of monoglycerides in the products also decreased. After being purified by column chromatography, the final products was characterized by Gas chromatography - mass spectrometry (GC-MS), H nuclear magnetic resonance (1H NMR) and infrared spectra (IR).
fatty acid monoglycerides; fatty acid methyl ester; enzymatic synthesis; transesterification
10.13995/j.cnki.11-1802/ts.201705001
硕士研究生,助理实验师(张桂菊副教授和徐宝财教授为通讯作者,E-mail:zhangguiju@th.btbu.edu.cn;xubaoc@btbu.edu.cn)。
国家自然科学基金(21676003,21403010);“十二五”国家科技支撑计划项目(2014BAE03B01);北京市教委科技计划重点项目(KZ201510011010);北京市教委市属高校创新能力提升计划项目(TJSHG201510011020)
2016-12-06,改回日期:2017-01-06
