牛传染性鼻气管炎gB基因TaqMan探针及SYBR Green1荧光定量PCR方法的建立与比较
2017-06-21张喜喜李永清周双海
张喜喜 , 许 健 , 李永清 , 周双海
(1.北京农学院动物科技学院 , 北京昌平102206 ; 2.北京市农林科学院畜牧兽医研究所 , 北京海淀100097)
牛传染性鼻气管炎gB基因TaqMan探针及SYBR Green1荧光定量PCR方法的建立与比较
张喜喜1,2, 许 健2, 李永清2, 周双海1
(1.北京农学院动物科技学院 , 北京昌平102206 ; 2.北京市农林科学院畜牧兽医研究所 , 北京海淀100097)
为建立牛传染性鼻气管炎病毒(IBRV)荧光定量PCR检测方法,本研究利用IBRVgB基因序列设计引物及相应探针,分别建立TaqMan探针与SYBR Green 1荧光定量PCR方法,并对两种方法的敏感性等综合比较。结果显示,SYBR Green 1荧光定量PCR方法的相关系数(R2)为0.998,扩增效率(E)为95.7%;TaqMan探针荧光定量PCR方法的R2为0.999,E为108.3%;两种方法的敏感性均为0.2 TCID50,变异系数均小于3%。综合结果显示,两种检测方法无显著差异。最后,本研究成功建立了检测IBRV的荧光定量PCR,将为IBRV的临床检测提供方法。
牛传染性鼻气管炎病毒 ;TaqMan 探针荧光定量PCR ; SYBR Green 1 荧光定量PCR ; 临床检测
牛传染性鼻气管炎(IBR)是由牛传染性鼻气管炎病毒(IBRV)引起牛的一种呼吸道疾病,以高热、呼吸困难、鼻炎、鼻窦炎和上呼吸道炎症为主要特征[1]。此病毒主要以潜伏感染和持续性感染为主,病牛长期甚至终生带毒,给防控工作带来了极大的困难。临床症状多种多样:有呼吸道型、生殖道型、流产型、脑膜脑炎型[2]。目前此病毒感染过我国多省份地区的牛群,同时由于没有适当的免疫防护措施,该病呈上升趋势,对牛群肥育率、产奶量和繁殖影响极大,给养牛业造成了严重危害[3]。没有特效药物可以治疗牛传染性鼻气管炎,截至目前,疫苗接种和扑杀是主要的防控措施。所以建立检测牛传染性鼻气管炎的方法显得尤为重要。
牛传染性鼻气管炎又称为牛I型疱疹病毒,属于疱疹病毒科疱疹病毒亚科水痘病毒成员,所以具有疱疹病毒科成员所共有的形态特征,是一种双链DNA病毒[4]。IBRV的gB基因在病毒感染过程中起重要作用,而gB基因还具有高度保守性,可以用于建立SYBR Green 1与TaqMan探针荧光定量PCR来检测IBRV。
1 材料与方法
1.1 病毒与细胞 IBRV病毒、MDBK细胞、牛病毒性腹泻病毒、牛口蹄疫病毒,猪伪狂犬病病毒及鸡马立克病毒均来自北京市农林科学院畜牧兽医研究所。
1.2 主要试剂 胶回收试剂盒,购自Bioteke;小提质粒试剂盒与小片段连接试剂盒,购自TianGen;TOP10感受态细胞,购自康为世纪生物科技有限公司;PGM-T vector、DNA 片段胶回收试剂盒和质粒小提试剂盒,均购自QIAGEN生物制品有限公司;SYBR®Green I Real-time PCR Master Mix,购自Bio-Rad;Marker DM-2000,购自康维世纪生物科技有限公司;Low MolecμLar weight DNA Ladder,购自BioLabs;PremixExTaq(probe qPCR),购自TaKaRa生物科技有限公司;引物与探针均在上海生工生物工程技术服务有限公司合成。
1.3 主要仪器 德国耶拿PCR仪,Bio-Rad iQTM5荧光定量PCR仪,恒温金属浴,37 ℃摇床,生物安全柜,离心机。
1.4 引物与探针系列
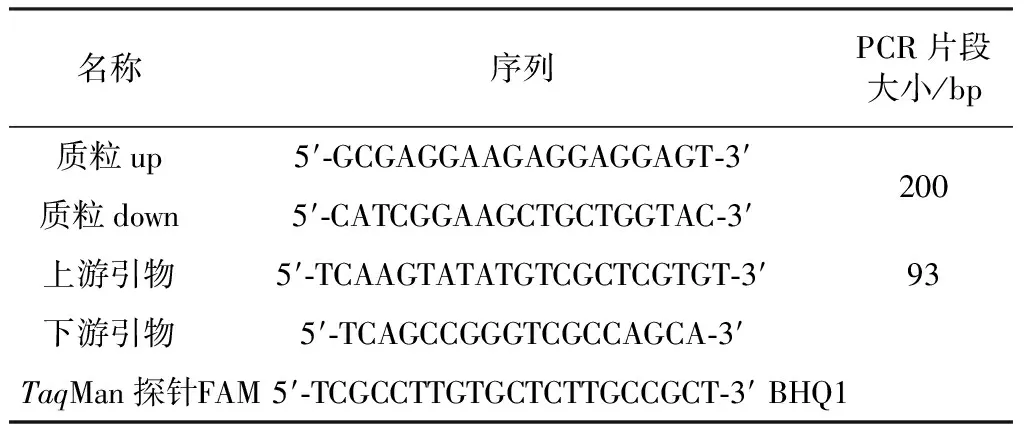
表1 引物与探针的设计
1.5 病毒 DNA 的提取 按照DNA提取试剂盒步骤,从接毒后的细胞中提取IBRV的DNA于-40 ℃冻存备用。
1.6 目的片段扩增及质粒标准品制备 将病毒DNA进行PCR扩增,反应体系为:2×TaqMaster Mix 12.5 μL ,引物质粒up和质粒down 各1 μL,DNA模板2 μL,加水补齐25 μL体系。反应条件为94 ℃ 5 min, 94 ℃ 20 s,60 ℃ 20 s,72 ℃ 30 s 35个循环,72 ℃ 10 min,4 ℃ forever。
按照 DNA 片段胶回收试剂盒说明书回收纯化目的片段,连接到 pGM-T vector 载体,转化大肠杆菌 TOP10 感受态细胞,最终得到质粒,并送上海生工生物工程技术服务有限公司进行测序。对IBRV-PGMT-T 质粒浓度进行测定,换算成拷贝数。
1.7 SYBR Green 1荧光定量PCR与TaqMan探针荧光定量PCR的建立
1.7.1 荧光定量PCR条件的优化 (1)退火温度的优化:在荧光定量PCR仪上进行温度梯度扩增,温度在52 ℃~57 ℃之间,分析其熔解曲线和扩增曲线,Ct值出现早的和熔解曲线无特异峰值的为最佳退火温度;(2)引物浓度的优化:在荧光定量PCR仪上引物浓度为10 μmol/L,分别取0.2 μL~1 μL八个连续浓度梯度进行荧光定量PCR找出最佳引物浓度。TaqMan探针与SYBR Green 1荧光定量PCR引物浓度一致。TaqMan 探针(1 μmol/L)分别取1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7 μL,水补足20 μL体系,摸索最佳探针浓度。
1.7.2 标准曲线的建立 对 IBRV质粒标准品进行10倍梯度稀释,选取其中8个连续梯度的质粒 DNA 作为模板进行 Real-time PCR 扩增。SYBR Green 1反应体系为:10 μL SYBR®Green I Real-time PCR Master Mix,上下游引物(10 μmol/L)各0.4 μL,2 μL 质粒,ddH2O补足至 20 μL。TaqMan探针反应体系:PremixExTaq(probe qPCR) 10 μL,上下游引物各0.4 μL,TaqMan探针6.5 μL,水0.7 μL,DNA 2 μL。两者反应程序为:95 ℃预变性10 min;95 ℃ 30 s,56 ℃ 30 s,40个循环;然后95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s 以得到熔解曲线。PCR反应结束后,荧光定量 PCR 仪将自动生成扩增曲线、熔解曲线、标准曲线与回归方程。同时将 PCR 产物在 3%琼脂糖凝胶上进行电泳,确定 PCR 产物大小。
1.7.3 特异性试验 将牛病毒性腹泻病毒、牛口蹄疫病毒,和同为疱疹科病毒的猪伪狂犬病病毒、鸡马立克病病毒等病毒 DNA 或 cDNA 分别作为模板,同时进行上述 Real-time PCR 扩增,以检测其特异性。
1.7.4 重复性试验 对质粒标准品进行 10 倍梯度稀释,选取第3、4、5稀释度的重组质粒 DNA,每个浓度用建立的两种荧光定量PCR 方法进行6次重复性检测,计算Ct平均值与变异系数,来评价该两种方法的可重复性。
1.7.5 敏感性试验 培养MDBK细胞,进行IBRV的TCID50,然后提取病毒DNA,稀释至200 TCID50、 20 TCID50、2 TCID50、0.2 TCID50、0.02 TCID50,分别进行TaqMan探针荧光定量PCR与SYBR Green 1荧光定量PCR,得出检测最低浓度。
1.8 临床样品检测及统计分析 取20份某牛场阳性血清检测,进行建立的两种荧光定量PCR检测,分别统计检出率。
2 结果
构建的质粒经NanoDrop 测定,OD260/OD280为1.93,浓度为357.2 ng/μL,换算成拷贝数为1.013×1011copies/μL。
2.1 荧光定量PCR条件摸索
2.1.1 退火温度的选择 采用荧光定量PCR仪进行温度梯度扩增,温度在52 ℃~56 ℃之间,随着温度增高,扩增效率先提高后下降,在54.6 ℃达到最高。所以温度选54.6 ℃为最佳退火温度。如图1所示。
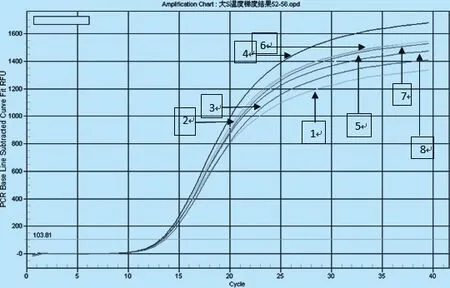
图1 荧光定量PCR温度梯度扩增结果注:1~8分别为52 ℃~56 ℃之间随机温度
2.1.2 引物浓度的优化 模板为标准品的第3个稀释样品,引物浓度为10 μmol/L,分别取0.2 μL~1.0 μL九个连续浓度,从扩增曲线与其所对应的Ct值可以看出最佳引物取值为0.4 μL(10 μmol/L),见图2。
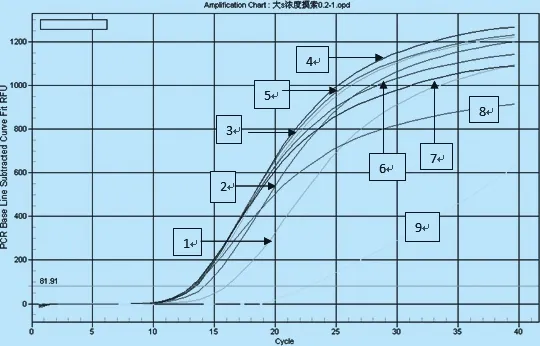
图2 引物浓度的优化注:1~9分别为0.2~1.0 μL九个浓度梯度所对应的编号扩增曲线
2.1.3TaqMan探针与引物浓度比例摸索 体系中PremixExTaq(probe qPCR) 取10 μL,上下游引物各取0.4 μL(10 μmol/L),探针(1 μmol/L)分别取1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7 μL,其余用水补足20 μL。最终选择TaqMan探针取6.5 μL。
2.2 荧光定量PCR标准曲线的建立
2.2.1 SYBR Green 1荧光定量PCR 将所构建的质粒标准品进行10倍梯度稀释,从中选取中间8个连续梯度建立标准曲线,即进行荧光定量PCR扩增,结果显示,扩增曲线平滑规则,熔解曲线为单峰,标准曲线显示出良好的扩增效率和重复效率,见图3。
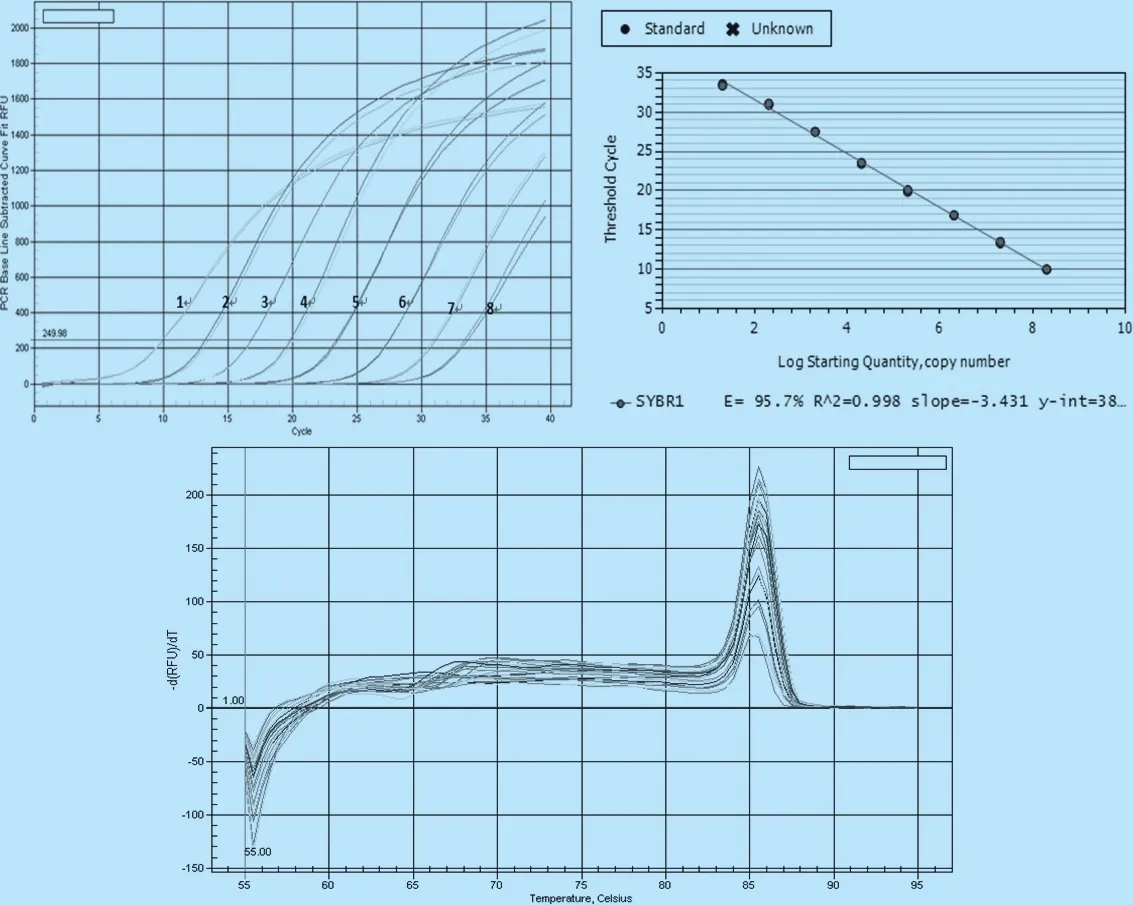
图3 SYBR Green 1荧光定量PCR扩增曲线、熔解曲线和标准曲线
2.2.2TaqMan探针荧光定量PCR结果 进行TaqMan探针荧光定量PCR扩增,与SYBR Green 1 荧光定量做法一致,结果显示,扩增曲线平滑规律,标准曲线显示出较高的扩增效率、重复性良好,见图4。

图4 TaqMan探针荧光定量PCR扩增曲线与标准曲线
2.2.3 特异性试验 将牛病毒性腹泻病毒、牛口蹄疫病毒,和同为疱疹科病毒的猪伪狂犬病病毒、鸡马立克病病毒等病毒 DNA 或 cDNA 分别作为模板,同时进行上述 Real-time PCR 扩增,未发现有扩增信号,表明特异性良好。
2.2.4 重复性试验 对质粒标准品进行10倍梯度稀释,选取3个浓度的重组质粒 DNA,每个浓度用建立的 Real-time PCR 方法进行6 次重复性检测,计算Ct平均值与变异系数,来评价两者方法的可重复性。由图5、图6结果可看出变异系数均小于3%(<5%)。
2.2.5 敏感性试验 进行两者的敏感性试验,从结果来看,两者并没有显著差别,可以检测到最低浓度为0.2 TCID50。具体结果见图7。
2.2.6 临床检测 取20份某牛场阳性血清检测,进行本人建立的荧光定量PCR检测和普通PCR检测,分别统计两者检出率均为100%,都比普通PCR检出率高,两者没有区别。

图5 SYBR Green 1荧光定量PCR第3、4、5稀释度质粒重复试验的扩增曲线和对应扩增Ct值

图6 TaqMan探针荧光定量PCR第3、4、5稀释度质粒重复试验的扩增曲线和扩增曲线对应的Ct值

图7 SYBR Green 1荧光定量PCR敏感性试验与TaqMan探针荧光定量PCR敏感性试验
3 讨论
牛传染性鼻气管炎(IBR) ,又称“红鼻病”或“坏死性鼻炎”,是由牛传染性鼻气管炎病毒(IBRV)引起的牛的一种急性、热性、接触性传染病。该病被世界动物卫生组织(OIE)列为B类动物传染病,为法定报告传染病。IBRV感染牛后可侵染多个部位,导致持续性感染、免疫抑制,造成牛群大范围感染,给IBR防控和根除造成极大困难。其发病率及传播速度较高、较快,不仅威胁到饲养人员的生命安全,还造成严重的经济损失。有学者讨论,捕杀阳性病牛是对该病预防的最明显和有效的防制措施[5],损失太大,所以及早检测出阳性病牛是关键。
牛传染性鼻气管炎是由牛传染性鼻气管炎病毒(IBRV)引起的一种急性传染病,临床症状分为5大类型,呼吸道型、生殖道型、结膜炎型、流产型、脑炎型。牛传染性支气管炎病毒又命名为1型牛疱疹病毒(BHV-1),为双股DNA病毒,全长约138 kb。IBRV大约编码40种结构蛋白,有11种为结构蛋白。gB基因具有高度保守性,此基因的同源性在所有疱疹病毒科最高,所以不同疱疹病毒之间的进化关系可以利用此基因进行分析,并由此可以检测IBRV[6]。
本研究根据IBRVgB基因保守序列设计引物,构建质粒,进行SYBR Green 1荧光定量与TaqMan探针荧光定量PCR,两者共用1对引物扩增,建立了检测IBRV方法并比较两者方法。其中SYBR Green 1荧光定量PCR扩增效率为95.7%,TaqMan探针荧光定量PCR 扩增效率为108.3%(0.8~1.2之间),表示条件优化提高扩增效率;SYBR Green 1荧光定量PCR R2=0.998,TaqMan探针荧光定量PCR R2=0.999(R2﹥0.99),表示线性比较好;SYBR Green 1荧光定量PCR熔解曲线无非特异峰值,表示引物特异性良好,扩增曲线平滑有规律;敏感性试验中检测到最低浓度值为0.2 TCID50。综上所有试验结果表明SYBR Green 1荧光定量与TaqMan探针荧光定量PCR两者差别不大。
曲光刚等[7]2012年建立TaqMan荧光定量PCR敏感性试验中检测到质粒最低浓度为11个拷贝/μL。陈圣军等[8]2013年建立的牛传染性鼻气管炎病毒SYBR Green 1荧光定量的检测敏感度为360 copies/25μL,乔波等[9]2015建立的传染性鼻气管炎病毒TaqMan-MGB荧光定量 PCR 检测敏感度为14.9拷贝/μL,本试验建立的SYBR Green 1荧光定量PCR与TaqMan探针荧光定量PCR检测到最低质粒浓度为100 copies/μL。2009年,唐泰山等[10]建立的IBRV-gB基因TaqMan荧光定量PCR敏感性试验中检测下限为0.02 TCID50;蒋珊珊等2013年建立的gB基因的TaqMan荧光定量PCR敏感性试验中检测到最低浓度为0.2TCID50[11],本研究敏感试验中两者荧光定量PCR检测到最低浓度也为0.2TCID50。 所有建立的方法由于引物不同,探针不同,得到的结果就会不同,临床上检测IBRV的方法会越来越多。
本研究建立的IBRV-gB SYBR Green 1荧光定量PCR和TaqMan探针荧光定量PCR增加了临床检测牛传染性鼻气管炎病毒的方法,使临床检测增加了更多的选择,并且在本试验中比较了SYBR Green 1荧光定量PCR和TaqMan探针荧光定量PCR两者结果,两者没有明显的区别。
[1] 李继昌,于少军,刘忠贵. 牛传染性鼻气管炎病的研究进展[J]. 黑龙江畜牧兽医,2002,04:50-51.
[2] 王泽民. 牛传染性鼻气管炎的临床症状及防治[J]. 养殖技术顾问, 2014(2):152-152.
[3] 齐晓雪. 牛传染性鼻气管炎病毒gD基因的表达及ELISA诊断方法的建立[D]. 大庆:黑龙江八一农垦大学, 2015.
[4] Thonur L, Maley M, Gilray J,etal. One-step mμLtiplex real time RT-PCR for the detection of bovine respiratory syncytial virus, bovine herpesvirus 1 and bovine parainfluenza virus 3[J]. Bmc Veterinary Research, 2012, 8(1):1-9.
[5] 张国丰,任科研,李昱洁,等. 牛传染性鼻气管炎的危害及防制[J]. 吉林畜牧兽医,2013,34(11):57.
[6] 冯宝海, 宋玲玲, 王洪梅,等. 牛传染性鼻气管炎病毒研究进展[J]. 安徽农业科学, 2011, 39(10):5893-5895.
[7] 曲光刚,王金良,郭广君,等. IBRVgB基因TaqMan探针荧光定量PCR检测方法的建立[J]. 中国兽医学报,2012,32(12):1787-1791.
[8] 陈圣军, 孔繁德, 徐淑菲,等. SYBR Green I实时荧光定量PCR检测牛传染性鼻气管炎病毒[J]. 中国畜牧兽医文摘, 2013,33(9):32-34.
[9] 乔波,陈楠楠,赵静虎,等. 牛传染性鼻气管炎病毒TaqMan-MGB荧光定量PCR方法的建立[J]. 中国预防兽医学报,2015,37(4):282-285.
[10] 唐泰山,邓碧华,王凯民,等. 牛传染性鼻气管炎病毒实时荧光定量PCR检测方法的建立[J]. 动物医学进展,2009,30(4):14-16.
[11] 蒋珊珊,赵莎莎,狄和双,等. 牛传染性鼻气管炎病毒的荧光PCR检测方法[J]. 江苏农业科学,2013(01):45-47.
The establishment and comparison of real-time fluorescent quantitative PCR assay with TaqMan probe and SYBR Green 1 real-time PCR of gB gene ininfectiousbovinerhinotracheitisvirus
ZHANG Xi-xi1,2, XU Jian2, LI Yong-qing2, ZHOU Shuang-hai1
(1.College of Animal Science and Veterinary Medicine, Beijing University of Agriculture, Beijing 102206, China;2.Institute of Animal Husbandry and Veterinary Medicine, Beijing Municipal Academy of Agriculture and Forestry Sciences, Beijing 100097, China)
To establish the real-time fluorescent quantitative PCR assay to detectinginfectiousbovinerhinotracheitisvirus(IBRV), primers and one corresponding TaqMan probe were designed. Real-time fluorescent quantitative PCR assay with TaqMan probe and SYBR Green 1 real-time PCR were separately carried out and their sensitivities were comprehensively compared. The results showed that the correlation index (R2) was 0.998, and amplification efficiency (E) was 95.7% for in SYBR Green 1 real-time PCR; For the real-time fluorescent quantitative PCR assay withTaqman probe, R2 was 0.999 and E was 108.3%. Their sensitivities was 0.2TCID50; the variations was no more than 3%. All results showed that there was no obvious difference in both methods. In conclusion, two methods of detection of IBRV are established and can be used for clinical tests.
InfectiousBovineRihinotracheitisVirus; real-time fluorescent quantitative PCR assay with TaqMan probe ; SYBR Green 1 real-time PCR ; clinical tests
LI Yong-qing
2016-10-19
现代农业技术体系北京市奶牛创新团队岗位专家自助经费项目(bjcystx-ny-3)
张喜喜 (1990-),女,硕士生,主要从事畜禽疾病防控研究,E-mail:1573566425@qq.com
李永清,E-mail:chunyudady@sina.com
S858.23
A
0529-6005(2017)05-0042-05
