纳米ZnO/壳聚糖复合膜的性能及在冷鲜猪肉保藏中的应用
2017-06-19匡衡峰胡长鹰温晓敏吕景泉
匡衡峰,胡长鹰,温晓敏,吕景泉
1(暨南大学 包装工程研究所,广东 珠海,519070) 2(暨南大学 食品科学与工程系,广东 广州,510632) 3(广东普通高校产品包装与物流重点实验室,广东 珠海,519070)
纳米ZnO/壳聚糖复合膜的性能及在冷鲜猪肉保藏中的应用
匡衡峰1,胡长鹰2,3*,温晓敏2,吕景泉2
1(暨南大学 包装工程研究所,广东 珠海,519070) 2(暨南大学 食品科学与工程系,广东 广州,510632) 3(广东普通高校产品包装与物流重点实验室,广东 珠海,519070)
对以50 nm ZnO和壳聚糖为原料制备的复合抗菌膜性能进行了研究。通过红外光谱仪(FTIR)、X-晶体衍射(XRD)、扫描电镜(SEM)、X射线分析显微镜(XGT)分析纳米颗粒分布和膜形态,抑菌圈和抑菌率分析膜对大肠杆菌和金黄色葡萄球菌的抑菌效果,同时研究复合膜作为包装衬垫在鲜猪肉冷藏保鲜中的效果。结果表明纳米ZnO能很好地融入壳聚糖基体中,能改善壳聚糖膜内部结晶,并能提高复合膜的抑菌圈效果,且低浓度复合膜抑菌圈效果更明显;添加浓度为10%的复合膜比空白壳聚糖膜抑菌率提高10%,达到93%;复合膜在冷藏条件下能较好控制鲜猪鲜肉的挥发性盐基氮和微生物总数,作为内包装衬垫在鲜肉鲜度的控制上有明显效果。
壳聚糖;纳米ZnO;复合抗菌膜;鲜肉保鲜
壳聚糖是仅次于纤维素的第二大天然可再生聚合物,在医疗、食品、材料等领域都有广泛应用[1-3]。壳聚糖能溶于弱的醋酸或甲酸中,在食品包装中主要通过涂膜[4]或制成膜材来使用。通过溶液成膜法可以将壳聚糖制成具有较好物理机械性能和优良透明性的包装膜材[5-7]。在成膜过程中添加有效成分可以改进膜的性能[8],这也是近年研究壳聚糖膜改性的热点。
壳聚糖膜材中添加纳米材料可以增加膜内部交联,促进膜内部结晶进而提高膜材的各项物理性能[9-10]。ZnO能与壳聚糖分子良好结合并改善膜的机械性能和抗菌性能[6],以涂膜和成膜方式在包装中应用较多。美国FDA将ZnO认定为一般安全物质[11],有研究表明ZnO不会对人体细胞DNA造成损伤,但纳米ZnO可以通过粒子释放离子,激发活性氧和直接接触破坏的方式对微生物的细胞生长产生抑制作用[12]。近年研究表明纳米ZnO不同粒径、添加量、形貌等对壳聚糖复合膜机械性能、透氧透湿性能以及抗菌效果有明显影响[13- 14]。研究同时也表明壳聚糖复合膜容易发生溶胀,且封口性能不好,作为外包装来使用有一定不足。本研究将不同浓度50 nm颗粒状ZnO加入壳聚糖中,制备厚度适中的纳米复合膜,并将复合膜作为内包装衬垫应用在冷鲜肉保藏中,探究在新包装形式下复合抗菌膜的实际应用效果。
1 材料与方法
1.1 材料与试剂
壳聚糖(分析纯,脱乙酰度≥90.0%),上海泰坦科技股份有限公司;纳米ZnO(50 nm,纯度99.8%),aladdin试剂;PBS缓冲液,武汉博士德生物;丙三醇(分析纯),上海泰坦科技股份有限公司;乙酸(分析纯),广州化学试剂厂;吐温-80(分析纯),天津化学试剂厂;LB营养琼脂、LB肉汤,天津博科科技有限公司;大肠杆菌、金黄色葡萄球菌,暨南大学食品科学与工程系提供。
1.2 仪器与设备
铺膜设备(15 cm×24 cm 有机玻璃板,误差小于0.5 cm),实验室自制;SW-CJ-1B 型单人单面净化工作台,苏州净化设备有限公司;PYX-250S-B型生化培养箱,韶关市科力仪器有限公司;数位式游标卡尺,日本三丰公司;数显测厚仪,品牌AICE/艾测;UV-9600 型紫外可见分光光度计,北京瑞利分析仪器公司;EQUINOX55 型傅立叶红外光谱仪,德国布鲁克光谱仪器公司;PHILIPS XL30ESEM型扫描电子显微镜,荷兰飞利浦公司;XD-2 X射线衍射仪,北京微构分析;XGT-5200X HORIBA X射线分析显微镜,日本;STD-XG挥发性盐基氮检测仪,厦门斯坦道科学仪器;PH-3C精密pH计,上海仪电科学仪器。
1.3 实验方法
1.3.1 纳米ZnO/壳聚糖膜的制备方法
根据YOUSSEF等的方法[6],称取一定量的壳聚糖溶于100 mL的体积分数为3%乙酸溶液中,搅拌至壳聚糖完全溶解,加入体积分数为0.5%的甘油搅拌30 min,加入体积分数为0.1%吐温-80作为乳化剂搅拌10 min。另取烧杯加入20 mL蒸馏水,按设计比例加入纳米ZnO,搅拌、超声分散,最后混合两烧杯溶液继续搅拌20 min。利用溶液成膜法将全部溶液倒在水平有机玻璃板上,放置于鼓风干燥箱中50 ℃烘干7 h,然后从玻璃板上揭下膜材25 ℃下备用。其中按照粒径+ZnO/壳聚糖质量比进行编号,5010表示50 nm添加量浓度为10%(W/W,ZnO/Chitosan)的配方,5003表示50 nm添加浓度为3%(W/W,ZnO/Chitosan)的配方,空白膜记为CS;对照组采用同等面积聚乙烯膜,记为PE。
1.3.2 复合膜基本参数测定
研究中复合膜主要作为内包装衬垫来使用,需要测定膜材的不透明度、厚度、克重、含水量参数[15]。
1.3.2.1 膜厚度测定及克重计算方法[16]
取备用膜材利用数位式游标卡尺测定膜上分散的10个点,记录取平均值;称量3 cm×3 cm膜材质量,计算单位面积膜质量,平行3次,单位g/m2。
1.3.2.2 复合膜不透明度测定[17]
测定600 nm可见光波长处膜的透过率值,按照以下公式计算,5次平行

(1)
式中:T600为样品在600 nm处光透过率;X为膜材厚度,mm。
1.3.2.3 复合膜含水量测定[5-6]
室温下取膜材剪切为3 cm×3 cm片状,恒重记为m0;放入干燥玻璃培养皿中,105 ℃条件下烘干24 h,记录质量m1,含水量以以下公式进行计算
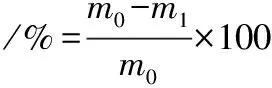
(2)
1.3.3 膜微观结构表征[8,17]
1.3.3.1 红外光谱分析
利用红外光谱仪衰减全反射ATR对壳聚糖复合膜进行扫描分析(测试过程中膜材对折2次),扫描波数范围600~4 000 cm-1,分辨率4 cm-1,连续扫描64次。
1.3.3.2 纳米颗粒宏观分布状况分析
截取3 cm×3 cm膜材放置于XGT-5200 X射线分析显微镜扫描平台,连续扫描2次。
1.3.3.3 X射线衍射分析
取2 cm×3 cm的膜材紧贴于载玻片进行测试,测试采用铜靶,扫速8°/min,记录步长0.05°,扫描角度(2θ)5°~80°。
1.3.3.4 扫描电镜分析
利用直径打孔器6 mm取膜材一片紧贴于贴有导电胶的铜台表面,喷金处理后在扫面电子显微镜下扫描,信号采用InLens信号,加速电压5 kV,拍取20 000倍和40 000倍清晰图像。
1.3.4 抑菌性能及实际应用
1.3.4.1 复合膜抑菌圈实验[17]
当反常出现后,当自然界以某种方式违反支配常规科学所做的预测后,此时科学共同体成员则会对反常的现象和领域进行一定的研究,以便找出问题所在,通过调整范式来消解这种反常。“发现始于意识到反常,即始于认识到自然界总是以某种方法违反支配常规科学的范式所做的预测。”[2]44由此可见,出现反常现象后,调整范式是关键的一步。范式有能力迫使科学共同体成员去处理这种反常,因此,范式不仅仅是被动的被利用的,它也有主动的一面。科学共同体依赖于范式的时候,范式便由被动的状态变为主动的状态,由静态转变为动态。
取各批次膜材,用打孔机截取3个直径6 mm圆片,实验前将圆片在紫外灯下照射10 min;大肠杆菌、金黄色葡萄球菌使用前连续活化6次,取吸光度值A600约等于0.1的菌液备用;试验在超净工作台进行,每组平行3次,记录37.5 ℃培养24 h抑菌圈外圈直径(mm)。
1.3.4.2 抑菌率实验
抑菌率实验参照振荡烧瓶法进行[18]。
1.3.4.3 鲜肉保藏应用
选取当天宰杀未经冷藏冷冻处理新鲜猪肉(纯瘦肉)切片,控制厚度在1 cm左右,单面面积约50~70 cm2(需保证膜材能完全覆盖),上下面各贴一层复合膜,保证贴合的平整。将复合膜贴合的鲜肉置于塑料保鲜盒内,以保鲜膜封口,4 ℃冷藏储存。以鲜肉的pH,挥发性盐基氮、微生物总量来衡量肉品质。保鲜盒和保鲜膜封装前需要紫外灯下处理30 min,鲜肉封装在无菌区域进行。
鲜肉pH按国家标准GB/T 9695.5—2008方法测定[19];鲜肉微生物菌落总数按照GB/T4789.17—2003方法检验[20]和GB 47892—2010方法测定[21];挥发性盐基氮检验采用挥发性盐基氮快速检测仪测定,仪器执行标准GB 2707—2005[22]。
1.3.5 数据处理
试验数据利用Origin Pro 8作图,数据采用Minitab 17和SPSS 19进行分析。
2 结果与分析
2.1 膜材主要参数

表1 膜材主要参数
注:同列中不同字母表示相关性分析时差异的显著性(P<0.05),表2同。
结果表明纳米ZnO的加入能降低膜材水分含量,特别是高浓度复合膜表现更明显,这是由于纳米颗粒的加入改善了膜材内部分子联接状况,形成了更加致密的网络结构,不利于水分子在成型过程中的存留;同时由于膜内部分子向规整转变,添加纳米ZnO提高了膜材的透明度。
2.2 红外光谱
复合膜红外光谱图见图1。

(a)5003;(b)5010;(c)CS图1 复合膜红外光谱图Fig.1 FTIR spectra of composite films
复合膜内部不同组分的交联对膜材的性能有重要影响,同时内部基团的变化是判断各组分相容性的重要依据,红外光谱分析可以反映膜材内部各组分之间的交联和内部基团变化情况[8]。图中红外光谱表明壳聚糖主要的吸收峰为900 cm-1处的环伸缩振动吸收峰;1 050 cm-1处的—OH伸缩振动吸收峰;1 170 cm-1的C—O—C氧桥反对称伸缩;1 380 cm-1处的CH3对称变形振动吸收峰;1 600 cm-1的N—H面内弯曲振动吸收;1 650 cm-1处的水分子的弯曲振动;3 400 cm-1处的宽—OH和—NH吸收振动宽吸收峰;2 950 cm-1的—CH对称和反对称吸收,这与VASEEHARAN[14]和彭勇[23]等的结果基本一致。纳米ZnO粉末的红外图谱表明纳米ZnO表面有大量羟基存在,使得纳米ZnO易发生团聚,并能与某些特征基团作用[24-25]。纳米ZnO的加入主要引起复合膜吸收峰的变化在500~700 cm-1处的氢键吸收由复杂多峰变成单一尖吸收峰;1 500 cm-1左右出现明显的肩峰吸收;添加3%的纳米ZnO在3 400 cm-1左右—OH和—NH吸收峰降低明显,并发生红移,说明此处有新的氢键生成[6],分析原因主要是膜中O—Zn—O与壳聚糖内部基团的吸附和振动造成,特别是在含有羟基和氨基的容易形成氢键的部位纳米ZnO的影响更明显。
2.3 X射线衍射
复合膜晶体衍射图见图2。

(a)CS;(b)5003;(c)5010;(d)ZnO图2 复合膜晶体衍射图Fig.2 XRD spectra of composite films
复合膜中添加物质的不同能影响膜材内部的结晶,结晶能提高膜材的透明度和机械性能,利用X射线衍射可以分析膜材内部结晶状况。结晶分析表明纳米ZnO的加入促进了膜材内部由无定型状态向结晶状态转变。空白壳聚糖膜在21°左右出现较弱衍射吸收峰,这与曾少甫[17]和JAYASURIYA[26]的研究结果基本相符;5003复合膜在12.7°、17.6°和23.1°处出现明显衍射峰;5010复合膜在12.7°和23.1°处出现明显衍射峰。
2.4 XGT和扫描电镜
复合膜X射线分析显微镜图和电子显微镜图见图3。
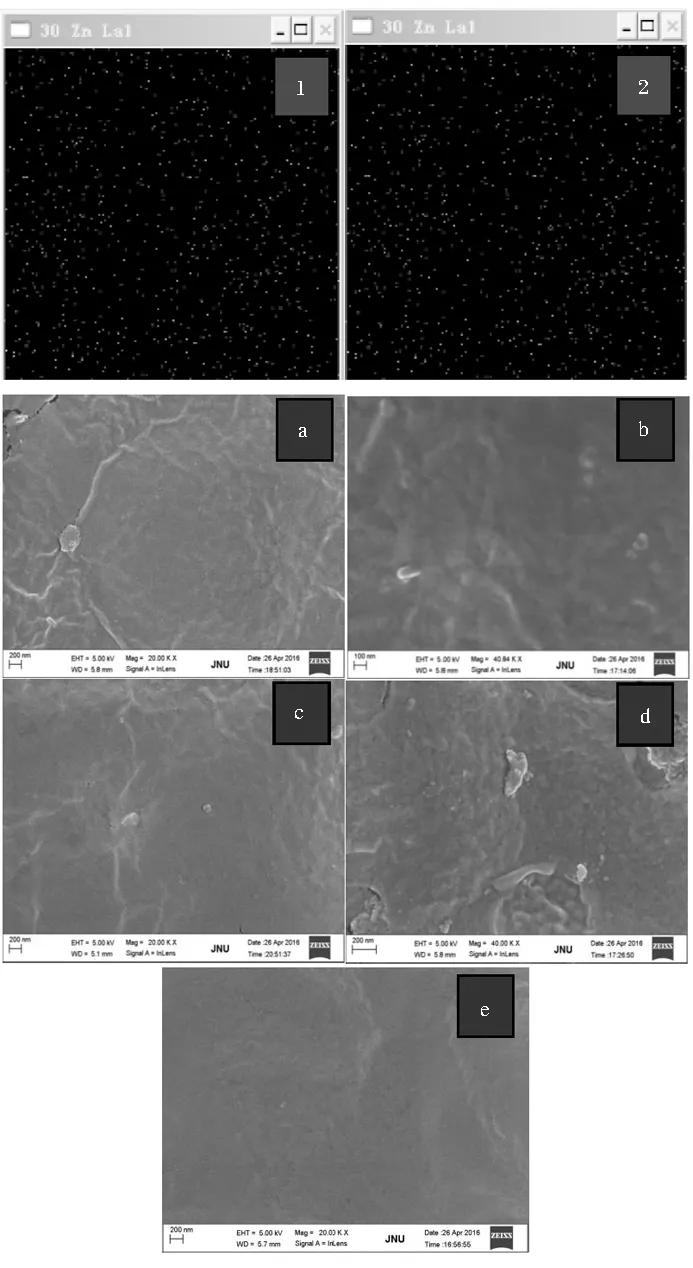
(1)5003;(2)5010;(a)3% 20 000倍;(b)3% 40 000倍;(c)10% 20 000倍;(d)10% 40 000倍;(e)CS 20 000倍图3 复合膜X射线分析显微镜图和电子显微镜图Fig.3 XGT and SEM spectra of composite films
XGT分析表明复合膜中锌元素的分布比较均匀,未在宏观上出现明显的空白或过度集中区域。电镜扫描结果表明50 nm ZnO能与壳聚糖基体较好的融合,没有明显的相分离和开裂出现。5010组复合膜中纳米颗粒发生了一定的团聚,颗粒变大,团聚影响了膜材的平整性。
2.5 抑菌圈
复合膜抑菌结果见表2。

表2 复合膜抑菌圈
抑菌圈壳聚糖膜本身具有一定的抑菌性,添加纳米ZnO能显著提高膜的抑菌圈效果。综合2种试验菌的结果,5003组抑菌圈比5010组更明显,结合电镜扫描分析原因是在抑菌圈琼脂基实验中高添加浓度复合膜中纳米粒子团聚导致纳米颗粒在膜材内部和培养琼脂表面难以释放并扩散,降低了纳米粒子与菌液接触的几率,而接触是纳米ZnO抗菌的主要方式[27]。同时抑菌圈实验表明纳米ZnO复合膜对具有代表性革兰氏阴性菌(E.coli)和革兰氏阳性菌(S.aureus)都有抑制效果。
2.6 抑菌率
复合膜抑菌率结果见图4。
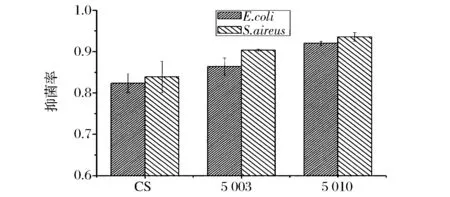
图4 复合膜抑菌率Fig.4 Antibacterial rate of composite films
抑菌率实验表明壳聚糖膜本身对大肠杆菌和金黄色葡萄球菌具有抑制作用,抑菌率超过80%,这与抑菌圈实验结果一致。纳米ZnO能显著提高膜的抑菌能力,其中5003和5010组与CS组对比差异明显(P<0.05),不同添加量组之间不表现出明显抑菌差异。抑菌率与抑菌圈结果有一定的差异,原因是利用改良振荡烧瓶实验法的过程中膜材中的纳米ZnO粒子更容易释放进入菌液中发挥抑菌作用;复合膜对大肠杆菌和金黄色葡萄球菌不表现明显的抑菌差异,这与JIANG[28]等得到的结果一致。
2.7 鲜肉保藏
复合膜鲜肉保藏结果见表3。
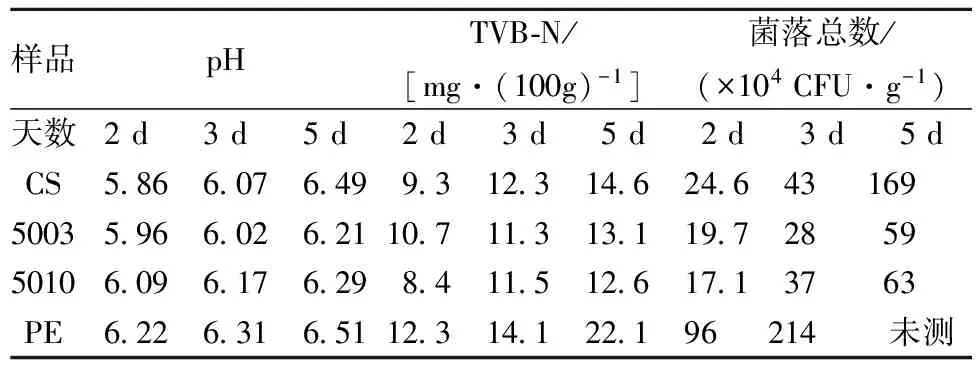
表3 复合膜鲜肉保藏
注:肉包装前初始数据:pH 5.94;TVB-N 7.23; 菌落总数:6.7×104CFU /g;标准一级鲜肉限定值pH:6.2,TVB-N:15 mg/100g,菌落总数:1×106CFU /g。
分析表3数据,空白壳聚糖膜在鲜肉试验中能有效控制挥发性盐基氮和菌落总数的增长,但对鲜肉的pH的控制效果不是很明显,第4天pH已经达不到鲜肉标准,其它指标能保持到第5天仍不超标;5003和5010组对3个指标均有明显控制作用,除pH指标在第5天超标外,其他2项指标在第5天仍处于正常鲜肉指标范围;纳米ZnO复合膜对鲜肉中微生物的控制最显著,两实验组在挥发性盐基氮和菌落总数的控制上不表现明显差异。实验结果表明在作为衬垫层的鲜肉冷藏实验中复合膜对鲜肉的鲜度控制有显著的作用,能延长鲜肉鲜度期至少2 d;5010复合膜在该试验中效果没有明显优于5003复合膜,这可以为节省纳米ZnO的使用提供参考。
3 结论
不同添加浓度50 nm ZnO在壳聚糖膜中宏观上分布均匀,微观上不引起内部相分离和开裂。纳米ZnO能与壳聚糖分子内部官能团发生相互作用,促进了壳聚糖内部分子由无序向部分结晶状态转变,从而促进复合膜性能的提升。复合膜对大肠杆菌和金黄色葡萄球菌均表现出强的抑制作用;复合膜抑菌圈实验中,3%添加浓度的复合膜抑菌圈试验效果优于10%高添加浓度复合膜,而在振荡法抑菌试验中浓度为10%的添加浓度复合膜抑菌率明显高于3%添加浓度复合膜,这表明复合膜材抑菌性能的提升一定程度上依赖于膜材中纳米颗粒的释放和扩散。
膜材作为内包装衬垫,能在冷藏条件下很好控制鲜肉的挥发性盐基氮值和菌落总数值,不同添加浓度复合膜对猪肉保鲜无明显差异,所以在复合膜实际应用配方设计中,可以选择较低浓度来设计制作膜材,减少纳米ZnO的用量。
[1] SHAHIDI F. Food applications of chitin and chitosans[J]. Trends in Food Science & Technology, 1999,10(10):37-51.
[2] SUDHEESH KUMAR P T, LAKSHMANAN V, ANILKUMAR T V, et al. Flexible and microporous chitosan hydrogel/nano ZnO composite bandages for wound dressing: in vitro and In vivo evaluation[J]. ACS Applied Materials & Interfaces, 2012,4(5):2 618-2 629.
[3] 荆迎军, 郝友进, 渠晖, 等. 壳聚糖的抑菌活性分析及其抑菌机理的研究[J]. 中国抗生素杂志, 2006(6):361-365.
[4] 洪英, 钟泽辉, 薛琼. 壳聚糖纳米氧化锌涂膜保鲜苹果的研究[J]. 包装工程, 2011(7):43-46.
[5] SANUJA S, AGALYa A, UMAPATHY M J. Synthesis and characterization of zinc oxide-neem oil-chitosan bionanocomposite for food packaging application[J]. International Journal of Biological Macromolecules, 2015,74:76-84.
[6] YOUSSEF A M, ABOU-YOUSEF H, EL-SAYED S M, et al. Mechanical and antibacterial properties of novel high performance chitosan/nanocomposite films[J]. International Journal of Biological Macromolecules, 2015,76:25-32.
[7] WANG Y, ZHANG Q, ZHANG C, et al. Characterisation and cooperative antimicrobial properties of chitosan/nano-ZnO composite nanofibrous membranes[J]. Food Chemistry, 2012,132(1):419-427.
[8] 刘婧, 胡长鹰, 曾少甫. 壳聚糖/尼泊金酯共混膜的制备及性能研究[J]. 食品与机械, 2016(3):131-136.
[9] LIU Y, KIM H. Characterization and antibacterial properties of genipin-crosslinked chitosan/poly(ethylene glycol)/ZnO/Ag nanocomposites[J]. Carbohydrate Polymers, 2012,89(1):111-116.
[10] REGIEL-FUTYRA A, Kus-Likiewicz M, Wojtya S, et al. The quenching effect of chitosan crosslinking on ZnO nanoparticles photocatalytic activity[J]. RSC Adv., 2015,5(97):80 089-80 097.
[12] ESPITIA P J P, SOARES N D F F, COIMBRA J S D R, et al. Zinc oxide nanoparticles: Synthesis, antimicrobial activity and food packaging applications[J]. Food and Bioprocess Technology, 2012,5(5):1 447-1 464.
[13] SASEEHARAN K, SHAHEDI M. Physical, mechanical, and antimicrobial properties of ethylene vinyl alcohol copolymer/chitosan/nano-ZnO (ECNZn) nanocomposite films incorporating glycerol plasticizer[J]. Journal of Food Measurement and Characterization, 2016.10(1):1-11.
[14] VASEEHARAN B, SIVAKAMAVALLI J, THAYA R. Synthesis and characterization of chitosan-ZnO composite and its antibiofilm activity against aquatic bacteria[J]. Journal of Composite Materials, 2014,49(2):177-184.
[15] 张春月, 焦通, 刘云, 等. 纳米氧化锌在抗菌食品包装中的应用研究进展[J]. 食品科学, 2014,35(11):274-279.
[16] GBT 6672—2001 塑料薄膜和薄片厚度测定 机械测量法[S]. 中国标准出版社, 2001.
[17] 曾少甫, 胡长鹰, 刘婧. 壳聚糖/肉桂醛复合抗菌降解膜的制备及性能[J]. 食品科学, 2016,37(10):6-11.
[18] 孔杰.银_壳聚糖纳米复合材料的制备_表征及抗菌性能研究[D]. 广州:暨南大学, 2013.
[19] GB/T 9695.5—2008 肉与肉制品 PH测定[S]. 卫生部 北京: 中国标准化出版社, 2008.
[20] GB/T4789.17—2003 食品微生物检验 肉与肉制品检验[S]. 卫生部 北京: 中国标准出版社, 2003.
[21] GB 47892—2010 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 卫生部 北京: 中国标准化出版社, 2010.
[22] GB 2707—2005 鲜(冻)畜肉卫生标准[S]. 卫生部 北京: 中国标准出版社, 2005.
[23] 彭勇.可食性壳聚糖活性包装膜成膜组分研究[D]. 上海: 上海交通大学, 2014.
[24] MALLAKPOUR S, MADANI M. A review of current coupling agents for modification of metal oxide nanoparticles[J]. Progress in Organic Coatings, 2015,86:194-207.
[25] SABUNCU S, ÇULHA M. Temperature-dependent breakdown of hydrogen peroxide-treated ZnO and TiO[J]. Beilstein Journal of Nanotechnology, 2015,6(1):1 897-1 903.
[26] JAYASURIYA A C, ARYAEI A, JAYATISSA A H. ZnO nanoparticles induced effects on nanomechanical behavior and cell viability of chitosan films[J]. Materials Science and Engineering, 2013,33(7):3 688-3 696.
[27] PETROCHENKO P E, ZHANG Q, BAYATI R, et al. Cytotoxic evaluation of nanostructured zinc oxide (ZnO) thin films and leachates[J]. Toxicology in Vitro, 2014,28(6):1 144-1 152.
[28] JIANG Y, O NEILL A J, DING Y. Zinc oxide nanoparticle-coated films: fabrication, characterization, and antibacterial properties[J]. Journal of Nanoparticle Research, 2015,17(4):2 993-2 996
The property of nano-ZnO/chitosan composite film and its application in chilled fresh pork preservation
KUANG Heng-feng1, HU Chang-ying2, 3*, WEN Xiao-min2, LYU Jing-quan2
1(Packaging Engineering Institute of Jinan University, Zhuhai 519070, China) 2(Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China) 3(Key Laboratory of Product Packaging and Logistics of Guangdong Higher Education Institutes, Zhuhai 519070, China)
Nano zinc oxide (50 nm) at different concentration 10% and 3%(w/w, ZnO/Chitosan)were mixed with chitosan to prepare the composite film by solution casting method. The functional groups, the crystallinity and morphology were tested using FTIR, XRD and SEM, XGT. The inhibition zone and antibacterial rate method were used to testing the antibacterial activity. At last, the composite films were applied as the pad in fresh pork packaging at 4 ℃. The results showed that Nano zinc oxide improved the crystallinity of composite film dramatically, and Nano zinc oxide could well dissolve in chitosan matrix. The inhibition zone test showed that chitosan film had antibacterial againstE.coliandS.aureus, and Nano zinc oxide could increase the inhibition zone, especially at lower concentration. The antibacterial rate for composite film was 93%, 10% increase than the control film. The composite film controlled TVB-N and CFU number in fresh pork’s very well.
chitosan; Nano zinc oxide; composite antibacterial film; pork preservation
10.13995/j.cnki.11-1802/ts.201704040
硕士研究生(胡长鹰教授为通讯作者,E-mail:hucy0000@sina.com)。
国家自然科学基金(31571762)
2016-07-13,改回日期:2016-09-20
