多波长褪色光度法测定鲜柠檬中的柠檬酸
2017-06-19江虹庞向东洪歆何婷婷
江虹,庞向东,洪歆,何婷婷
(长江师范学院 化学化工学院,武陵山片区绿色发展协同创新中心,重庆,408100)
多波长褪色光度法测定鲜柠檬中的柠檬酸
江虹*,庞向东,洪歆,何婷婷
(长江师范学院 化学化工学院,武陵山片区绿色发展协同创新中心,重庆,408100)
建立了测定柠檬酸的多波长分光光度法。在pH 6.15 的Tris-盐酸缓冲溶液中,灿烂绿与柠檬酸在可见光区发生褪色反应,生成具有3个明显负吸收峰的绿色离子缔合物,并出现褪色现象。最大、次大和最小的负吸收波长分别位于652、582和426 nm处。柠檬酸在0.02~3.84 mg/L(652 nm 和582 nm)和0.48~3.84 mg/L(426 nm)内遵从比尔定律,表观摩尔吸光系数(κ)分别为 3.33×104、2.84×104和1.44×104L/(mol·cm),定量限为 0.019 g/100 g(652 nm 和582 nm)和 0.45 g/100 g(426 nm)。采用双波长或三波长叠加法测定,它们的灵敏度分别可达6.16×104L/(mol·cm)和7.61×104L/(mol·cm),定量限均为0.019 g/100 g。还探讨了适宜的反应条件、主要分析化学性质及络合比。方法用于新鲜柠檬中柠檬酸含量的测定,回收率为98.85%~101.1%,相对标准偏差(n=6)为2.2%~2.5%。
柠檬;柠檬酸;灿烂绿;单波长;双波长;三波长;褪色反应;分光光度法
柠檬酸为食用酸类,具有增强人体内正常代谢,促进脂肪分解,快速减肥,降血压、排出血液中毒素、美白、祛斑、防虫、清洁污渍等作用。柠檬酸对人体虽无直接危害,但它在人体内会促进钙的排泄和沉积,若长期食用含柠檬酸的食品,可能导致低钙血症,增加患十二指肠癌的几率[1]。为了有效控制柠檬酸的用量,保障人们的身体健康,对柠檬中柠檬酸的分析具有一定意义。
目前,测定柠檬酸的方法主要有:高效液相色谱法[2-9],气相色谱法[10-11], 离子色谱法[12-14],液相色谱-质谱联用法[15],电化学法[16-17]和分光光度法[18-19]等。高效液相色谱法仪器较贵,不易普及,且样品的前处理麻烦。气相色谱法快速,但样品的前处理较复杂。离子色谱法能很好地测定有机酸含量,但因淋洗液和柱子填料的特殊性,对样品中的含量有严格限定,不易普及。电化学法中有的分离度较高,但灵敏度低,稳定性和重现性较差,有的线性范围窄,选择性较差。分光光度法所用仪器价廉,操作简便,易于普及,长期以来受到人们的青睐。目前,用可见分光光度法测定柠檬酸的报道较少,且存在方法灵敏度差,线性范围窄[3-4]问题。因此,进一步研究灵敏度高、选择性好,线性范围宽的测定柠檬酸的分光光度法有一定意义。实验发现,以灿烂绿为探针,在可见光区,单波长法、双波长法及三波长法均可用于柠檬酸的测定,且方法有较高的灵敏度和选择性。方法用于新鲜柠檬中柠檬酸的测定,结果满意。
1 材料与方法
1.1 材料与试剂
试验试剂:柠檬酸(citric acid,CTA)标准溶液:192.1 mg/L 贮备液,用时稀释10倍。灿烂绿(brilliant green, BRG)溶液:1.0×10-3mol/L。Tris(三羟甲基氨基甲烷)-HCl缓冲溶液:0.20 mol/L Tris溶液与0.10 mol/L HCl混合,用酸度计测定,配成pH 3.0~9.5的系列溶液。所用试剂均为分析纯,实验用水为二次蒸馏水。
样品:重庆地区3种新鲜柠檬(1#~3#),市售。
1.2 仪器与设备
U-3010型紫外-可见分光光度计,日本日立公司;pHS-3C 精密酸度计,上海虹益仪器仪表有限公司。
1.3 样品处理
分别取1#~3# 新鲜柠檬多个,去皮,去核,将果肉榨汁后搅匀。准确称取1# 柠檬汁 10.567 2 g,2# 柠檬汁10.312 9 g,3# 柠檬汁 10.663 4 g,过滤后,将滤液分别置于1 000 mL容量瓶中,用水定容。取上述各溶液10 mL 分别置于100 mL 容量瓶中,用水定容,摇匀,即为各待测液。
1.4 实验方法
于10 mL 具塞比色管中,准确加入3.0 mL 1.0×10-3mol/L灿烂绿溶液,0.5 mL pH 6.15 Tris-HCl缓冲溶液,摇匀,再加适量的19.21 mg/L 柠檬酸标准溶液或样液,用水定容,摇匀,15 min 后,在紫外-可见分光光度计上,用1.0 cm 比色皿,以试剂空白作参比,扫描吸收光谱,记录可见光区652、582和426 nm处体系的吸光度值。
2 结果与讨论
2.1 吸收光谱特征
从图1可知,在可见光区,柠檬酸几乎无吸收(曲线1),灿烂绿有较强吸收,最大吸收波长为620 nm(曲线2)。当在灿烂绿的酸性溶液中(绿色)加入适量柠檬酸标准溶液后,产生明显的褪色现象,可见光区,光谱曲线上出现3个较强的褪色峰(曲线3~8)。最大褪色峰位于652 nm,红移32 nm;次大褪色峰位于582 nm,蓝移38 nm;最小褪色峰位于426 nm,紫移194 nm。波移说明柠檬酸和灿烂绿在弱酸性的Tris-HCl缓冲溶液中反应确实生成了新物质。新物质的吸光度绝对值与一定浓度范围的柠檬酸的质量浓度在652、582和426 nm 处均有线性关系(曲线3~8),且服从朗伯-比尔定律。故此3个波长处,均可用单波长法测定柠檬酸的含量。再根据吸光度的加和性,双波长叠加(652 nm+582 nm)法或三波长叠加(652 nm+582 nm+426 nm)法均可用于柠檬酸的定量分析,且灵敏度比单波长法约高2~5倍。
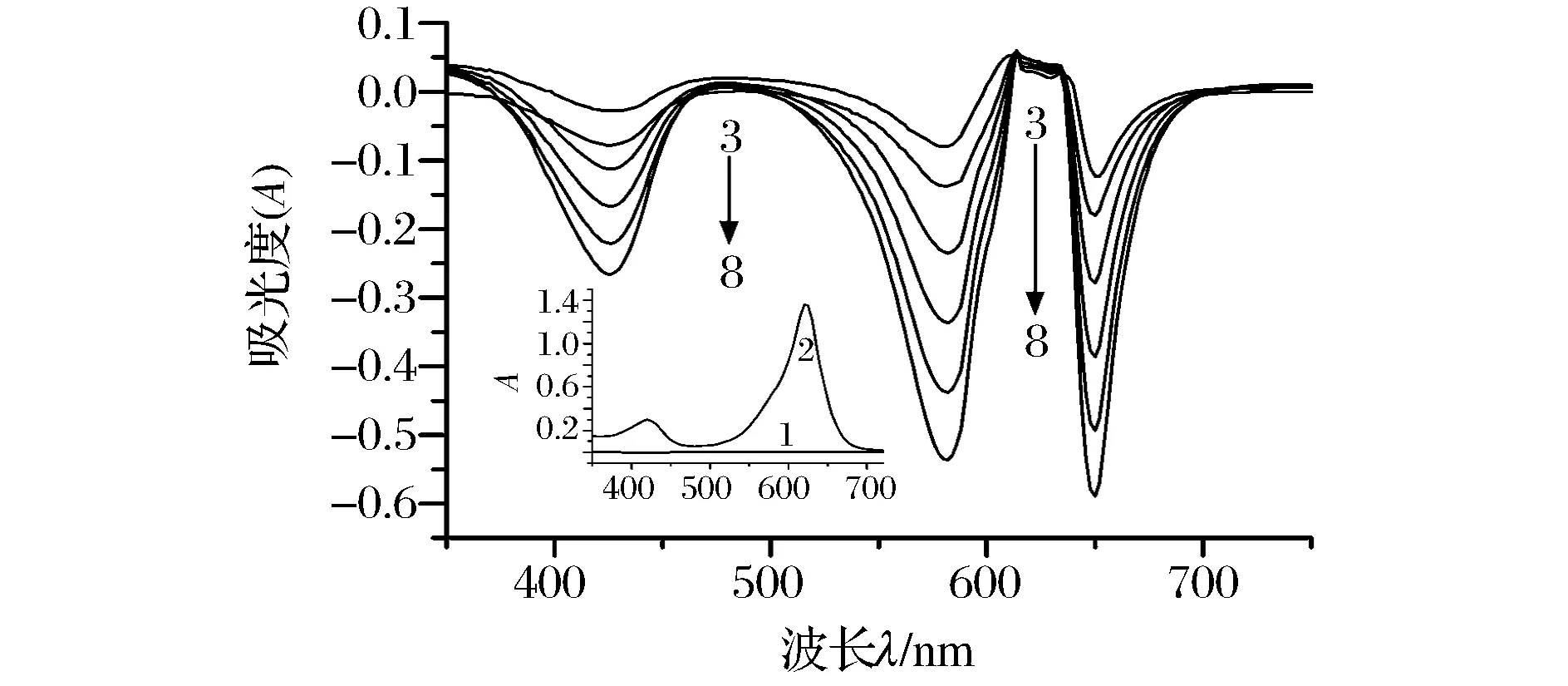
图1 吸收光谱Fig.1 The absorption spectra注:1-1.92 mg/L柠檬酸(水作参比);2-3.0×10-5 mol/L灿烂绿(水作参比); 3~8,分别为0.384、0.768、1.54、2.31、3.07、3.84 mg/L柠檬酸与3.0×10-4 mol/L灿烂绿的混合液(试剂空白作参比); 溶液pH均为6.15
2.2 反应条件
2.2.1 pH 值
考察了不同pH 值的Tris-HCl缓冲溶液对体系在可见光区3个负吸收波长处的吸光度绝对值(│A│)的影响,结果见图2。可见,pH值在 5.6~6.8内,体系在各负吸收波长处的│A│较大,其灵敏度较高。实验用pH 6.15 的Tris-HCl缓冲溶液,适宜用量0.5 mL。
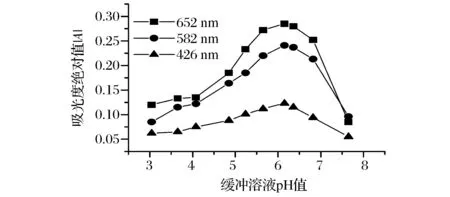
图2 pH值对│A│的影响Fig.2 Effect of buffer pH on │A│
2.2.2 灿烂绿溶液的浓度
考察了不同浓度的灿烂绿溶液对体系在可见光区3个负吸收波长处│A│的影响,结果见图3。可见,灿烂绿溶液在2.5~3.5 mol/L内,│A│较大,灵敏度较高。当灿烂绿溶液的浓度<2.5 mol/L 时,由于反应不完全,其│A│较小;当灿烂绿溶液的浓度>3.5 mol/L 时,因灿烂绿过量太多,其自身的光吸收使体系的│A│变小。实验用1.0×10-3mol/L 灿烂绿溶液3.0 mL。

图3 灿烂绿溶液浓度对│A│的影响Fig.3 Effect of brilliant green concentration on │A│
2.2.3 试剂加入顺序
考察了各试剂在不同加入顺序时对体系在可见光区3个负吸收波长处的│A│的影响。结果表明按任一顺序加入各试剂,其│A│值基本不变。故实验可按任意顺序加入试剂。
2.2.4 反应时间及稳定性
考察了不同放置时间对体系在可见光区3个负吸收波长处的│A│的影响,结果见图4。可见,开始时,随着体系溶液放置时间的增加,3个负吸收波长处的│A│均在逐渐增大,表明此时的反应并未完全,当时间增至10 min 后,各波长处体系的│A│均趋于平稳,表明反应在10 min内即可反应完全,其稳定时间至少1.5 h。实验选在10 min 后测定。

图4 时间对│A│的影响Fig.4 Effect of time on │A│
2.3 标准曲线
按实验方法配制柠檬酸的标准系列溶液, 并扫
描吸收光谱,作A-ρ标准曲线(图5)。该方法的一元线性回归方程、回归系数、线性范围、表观摩尔吸光系数及定量限等见表1。
2.4 络合比
用摩尔比法和连续变化法测得体系络合比为柠檬酸∶灿烂绿=2∶3,即 CTA2BRG3。
反应机理:灿烂绿是一种三苯甲烷类的碱性染料,其分子结构中2个乙氨基上的氮原子接受质子形成大阳离子,而柠檬酸的分子结构上有3个羧酸根离子,3 mol灿烂绿大阳离子与2 mol柠檬酸阴离子以静电引力结合生成离子缔合物CTA2BRG3。
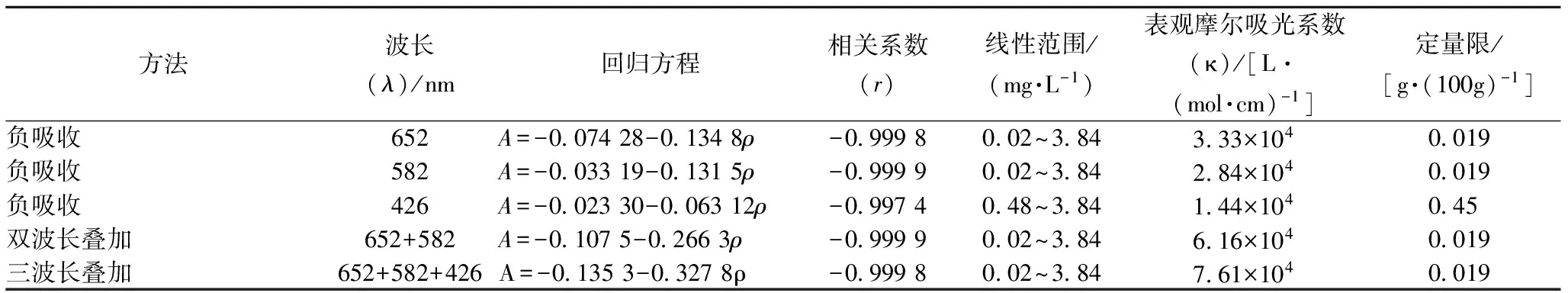
表1 标准曲线相关参数
2.5 共存物质的影响
在652 nm 处,考察了一些常见物质对测定1.92 mg/L柠檬酸的影响。结果表明,当相对误差不大于 ±5% 时,以下物质不干扰测定:100倍的葡萄糖、蔗糖、麦芽糖、D-果糖、L-色氨酸、L-白氨酸、L-赖氨酸、K+、Na+、NH4+、NO3-、Cl-、PO43-、SO42-;50倍的Ba2+、Sr2+、Mg2+、Ca2+、S2O32-、SO32-;30倍的苹果酸、酒石酸、山梨酸、苯甲酸、抗坏血酸、Mn2+、Pb2+、Fe2+、C2O42-、CO32-;5倍的Cu2+、Al3+、Fe3+。可见,食品中常见的有机酸、糖类及大多数常见阴、阳离子不干扰测定。虽然Cu2+、Al3+、Fe3+的允许量较小,但它们在柠檬中的共存量一般很小。故方法有较好的选择性。
2.6 样品分析
取1.3中各待测样液1.0 mL,按1.4的实验方法,采用灵敏度相对最高的三波长法进行分析,各平行测定6份,同时做加标回收试验(n=6),判断方法的准确度和精密度,结果见表2。
3 结论
以灿烂绿为探针测定柠檬酸的多波长褪色光度法,操作简便,试剂价廉易得,样品处理简单、安全,线性范围较宽,准确度、精密度和灵敏度均较高,完全能满足定量分析要求,方法适于批量新鲜柠檬中柠檬酸的快速分析。

表2 样品分析结果及回收试验(n=6)
[1] 彭圣娟,丁素芳. 活化溴酸钾-溴酚蓝-钒催化体系动力学光度法测定柠檬酸[J]. 中国卫生检验杂志,2011,21(8):1 845-1 846.
[2] 张娥珍,崔素芬,辛明,等. HPLC法同时测定不同种类芒果中10种有机酸的研究[J].食品科技, 2014,39(3): 276-280.
[3] 孙全,张景勍,傅亚,等. RP-HPLC 法同时测定半夏药材中4 种有机酸的含量[J].药物分析杂志, 2015,35(6):1 062-1 066.
[4] 刘书来,郭元帅,许凯希,等.高效液相色谱法测定秘鲁鱿鱼肌肉中的有机酸[J].食品与发酵工业,2015,41(10):135-139.
[5] 叶秀娟,郑炯,索化夷,等.高效液相色谱法测定永川豆豉中的6种有机酸[J].食品科学, 2014,35(20):114-118.
[6] 徐玉涛,李珂珂,王贺新,等.高效液相色谱法对蓝莓果实中8个有机酸含量的测定[J].食品科学, 2015,36(18):127-131.
[7] ZHENG Huiwen, ZHANG Qiuyun, QUAN Junping,et al. Determination of sugars, organic acids, aroma components, and carotenoids in grapefruit pulps [J]. Food Chemistry, 2016,205:112-121.
[8] 赵艳,张凤枰,杨发树,等.高效液相色谱法同时测定饲料添加剂中6种有机酸含量[J].中国粮油学报, 2015,30(2):127-129.
[9] 云环,刘鑫,何悦,等.固相萃取-超高效液相色谱法同时测定乳制品中6种有机酸[J].分析试验室, 2014,33(5):609-613.
[10] 张霞,刘志华,杨光宇,等.固相萃取富集/气相色谱法测定烟草中的9种有机酸[J].分析测试学报, 2014,33(5):545-550.
[11] 陈立新,陈麒宇,江帆.毛细管气相色谱法分析土壤中苹果酸、柠檬酸和丙二酸[J].分析仪器, 2010(5):43-46.
[12] 刘瑞,聂黎行,孙焕,等.离子排斥色谱法测定生脉注射液中的有机酸[J].分析化学, 2012,40(3): 489-490.
[13] 熊建飞,周光明,许丽,等.离子色谱法测定山楂和乌梅中的有机酸[J].食品科技, 2012,37(9):284-287.
[14] 陈建华,陈魏,胡德聪.离子色谱法测定低钠盐中有机酸的含量[J].检验检疫学刊, 2014,24(1):41-43.
[15] 黄思棋,刘晓雪,张华,等. LC-MS法测定果蔬中6种有机酸[J].食品科技, 2016,41(1): 275-279.
[16] AWASTHI S, SRIVASTAVA A, SINGLA M L. Voltammetric determination of citric acid and quinine hydrochloride using polypyrrole-pentacyanonitrosylferrate/platinum electrode[J].Synthetic Metals, 2011,161 (15): 1707-1712.
[17] 彭振磊,张育红,李诚炜,等.毛细管电泳法快速测定催化剂生产废水中的柠檬酸[J].石油化工, 2013,42 (12):1 388-1 392.
[18] 朱军利.分光光度法定量测定柠檬酸及其盐的含量[J].分析试验室, 2012,31(2): 115-117.
[19] 蔡艳,高烨,王晓菊.食品中柠檬酸的阻抑动力学光度法检测[J].长春师范学院学报:自然科学版,2013,32(3):50-53.
Determination of citric acid in the fresh lemon by multi-wavelength color fading spectrophotometry
JIANG Hong*, PANG Xiang-dong, HONG Xin, HE Ting-ting
(College of Chemistry and Chemical Engineering, Yangtze Normal University, Chongqing Key Collaborative Innovation Center for Green Development in Wuling Mountain Areas, Yangtz Normal University, Chongqing 408100,China)
A fast multi-wavelength color fading spectrophotometry for quantifying citric acid in fresh lemon was developed. In Tris-hydrochloric acid buffer pH 6.15 solution , brilliant green reacted with citric acid to form a green ion association complex with obvious three negative absorption peak and bleaching effect in visible area. The maximum and the second largest and the smallest negative absorption wavelength was located at 652 nm and 582 nm and 426 nm respectively. Beer’s law was obeyed in definite mass concentration range within 0.02-3.84 mg/L(652 nm and 582 nm) or 0.48-3.84 mg/L(426 nm) of citric acid. Their apparent molar absorptivity (κ) were 3.33×104and 2.84×104and 1.44×104L/(mol·cm) respectively with the limitation of quantitation of 0.019 g/100 g(652 nm 和582 nm) and 0.45 g/100 g(426 nm). The sensitivity of double wavelengths or three-wavelength superposition were 6.16×104L/(mol·cm) and 7.61×104L/(mol·cm) respectively with the quantitative limits were 0.019 g/100 g. The optimum reaction conditions, the main properties of analytical chemistry and the compound ratio were studied. The method were applied to determine the content of citric acid in fresh lemon with spiked recoveries and RSD% (n=6) in the ranges of 98.85%-101.1% and 2.2%-2.5% respectively.
lemon; citric acid; brilliant green; single wavelength; double wavelength; three-wavelength; color-fading reaction; spectrophotometry
10.13995/j.cnki.11-1802/ts.201704036
学士,教授(本文通讯作者,E-mail: jianghongch @163.com)。
重庆市教委科技基金资助项目(KJ1401226);长江师范学院科技基金资助项目(2015CXX080)
2016-07-01,改回日期:2016-11-12
