转基因食品定量检测方法的验证
2017-06-19饶红韩玥郭铮蕾徐姗李伟谷强林远辉
饶红,韩玥,郭铮蕾,徐姗,李伟,谷强,林远辉
(北京出入境检验检疫局,北京,100026)
转基因食品定量检测方法的验证
饶红,韩玥*,郭铮蕾,徐姗,李伟,谷强,林远辉
(北京出入境检验检疫局,北京,100026)
按欧盟联合研究中心(Joint Reaserch Center,JRC)的欧盟网络转基因实验室(European Network of GMO laboratories,ENGL)方法验证工作组编制的指南文件的要求,对《GB/T 19495.5—2004 转基因产品检测核酸定量PCR检测方法》进行方法验证。分别验证了脱氧核糖核酸(deoxyribonucleic acid,DNA)提取质量,方法的准确度、重复性和相对定量限4个指标。经过验证,选用的DNA提取试剂盒提取质量合格;检测值在可接受参考值的±25%内,准确度良好;相对可重复性标准偏差均小于25%,重复性良好;相对定量限为0.1%转基因含量。依照指南对国标进行了验证,结果证明该指南在实验室进行方法验证中具有指导性作用。
转基因食品检测;定量检测;方法验证
在开始检测之前,实验室应能够正确地应用标准方法,如果标准方法发生了变化,应重新进行验证[1]。目前,国际上通用的检测实验室认可标准是《ISO/IEC 17025:2005 检测和校准实验室能力的通用要求》,在国内被转化为《CNAS-CL01:2006 检测和校准实验室能力认可准则》,作为检测实验室认可和管理所依据的标准。实际工作中,一个检测实验室开展检测前最关键的是能够证明具备正确进行检测的能力,如果是依照标准方法进行检测,那么实验室应能够准确理解标准并正确使用。17025和CL01只给出了方法验证的定义。但是对于具体如何进行方法验证没有给出具体指南。在国际和国内,各领域实验室都在开展本领域内检测方法验证的相关研究,但是关于转基因检测方法的验证,一直以来少有科学性、有效性的依据。本文修改采用了欧盟联合研究中心(Joint Reaserch Center,JRC)的权威指南文件:《Verification of analytical methods for GMO testing when implementing interlaboratory validated methods》(EUR 24790 EN,JRC)进行转基因检测方法验证的研究。欧盟联合研究中心是欧盟委员会的内部科研机构,其发布的文件在转基因检测领域公认为权威的指导性文件。实验室在进行方法验证时需要识别相应的人员能力、设施和环境、设备、检测所需试剂耗材和标物是否满足检测方法标准的要求等[2-4]。如果标准方法发生了变化,应重新验证。验证应有记录。总之,实验室在将方法引入检测之前,应从“人”、“机”、“料”、“法”、“环”等方面验证其有能力按照标准方法开展检测活动。
在满足了“人”、“机”、“料”、“环”的硬件要求后,还应通过试验证明结果的准确性和可靠性,如标准给出的精密度、线性范围、定性检测限和定量检测限等方法特性指标[5],必要时应进行实验室间比对或参加能力验证。“法”,即标准方法规定的各项特性指标在实验室能否实现,就成为了方法验证中最重要的技术内容,也是实验室最应着力验证的目标。
由欧盟联合研究中心(JRC)的欧盟网络转基因实验室(European Network of GMO laboratories,ENGL)方法验证工作组编制的《JRC科学技术报告-经确认的转基因检测分析方法的验证》(Verification of analytical methods for GMO testing when implementing interlaboratory validated methods)[6],由JRC作为指南性文件发布。本文按照该指南要求,以《GB/T 19495.5—2004 转基因产品检测核酸定量PCR检测方法》[7]为实例,对该标准中转基因玉米实时荧光PCR检测方法进行了方法验证。经试验研究,验证了该方法的脱氧核糖核酸(deoxyribonucleic acid,DNA)提取效率、准确度、重复性、相对定量限4个特性指标[8],这些指标均达到了该指南文件的技术要求,说明今后检测实验室可以此指南文件为依据开展相关领域的方法验证活动。
1 材料与设备
1.1 主要材料
DNA提取试剂盒(QIAGENDNeasy® Plant Mini Kit),DEPC水(生工Sangon Biotech),PCR反应预混液(AB TaqMan® Gene Expression Master Mix),引物,探针,浓度分别为5、1、0.5、0.1%的GA21品系阳性标准物质(AOCS0407-B),玉米渣(超市购买)。
1.2 主要仪器
紫外分光光度仪(BECKMAN COULTER DU 800),实时荧光定量PCR仪(ABI 7900),高速冷冻离心机(eppendorf Centrifuge 5810R),台式小型离心机(eppendorf Centrifuge 5424),漩涡振荡器(IKA MS2),PCR反应管(Axygen),10、20、100、200、1000 uL微量进样器(eppendorf)。
1.3 引物和探针
引物探针序列按照《GB/T 19495.5—2004转基因产品检测核酸定量PCR检测方法》附录E中转基因玉米GA21的zSSIIb基因(玉米内源基因)和结构特异基因(GA21品系结构特异性基因)的序列合成,见表1。

表1 引物和探针序列
2 方法与结果
2.1 提取DNA
使用QIAGENDNeasy® Plant Mini Kit,分别对浓度5%、1%、0.5%、0.1%的GA21品系阳性标准物质和超市购买的纯玉米渣进行DNA提取。
2.2 DNA 提取质量验收
对纯玉米渣每次同时进行2份平行提取,连续3次[9]。2个平行提取的DNA连续4倍稀释(1∶1,1∶4,1∶16,1∶64和1∶256)的5个点的ZEIN基因(玉米内源基因)进行检测[10],3次检测结果见表2~表4、图1~图3。为了评估抑制剂的存在,4个稀释度的样品的Ct值用线性回归计算得到一个等式。从线性回归推算出的“未稀释”样品的Ct值与同一个样品的测量Ct值进行对比。JRC指南中规定,当同时满足回归线的斜率在-3.6~-3.1;判定系数(R2)≥0.98;测量Ct和推算Ct的差(ΔCt)低于0.5这3个条件时,则证明该提取方法是适宜的,提取产物中不含抑制剂。其中,未稀释浓度的推导Ct值用excel中函数中INTERCEPT求得。
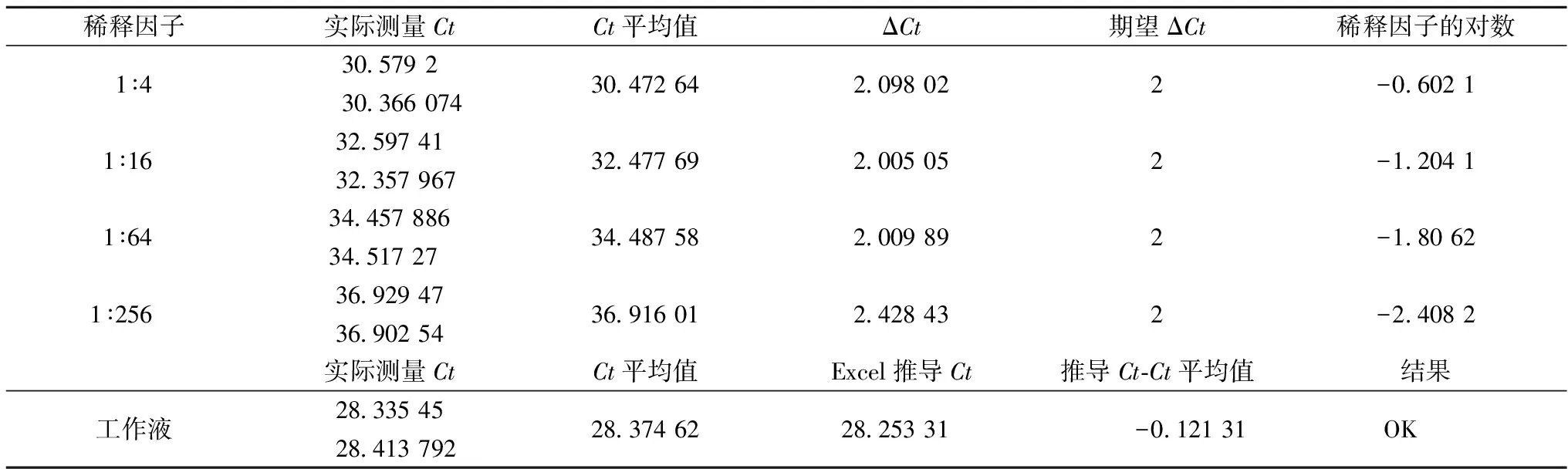
表2 第1次试验ΔCt

表3 第2次试验ΔCt
续表3

稀释因子实际测量CtCt平均值ΔCt期望ΔCt稀释因子的对数1∶163152034431593453155691996782-120411∶6433557655336374833597572040672-180621∶256360848835903545实际测量Ct35994212396642-24082Ct平均值Excel推导Ct推导Ct⁃Ct平均值结果工作液27538067274242627481162734129-013987OK

表4 第3次试验ΔCt

图1 第1次试验斜率R2Fig.1 The slope R2 of the first test

图2 第2次试验斜率R2Fig.2 The slope R2 of the second test
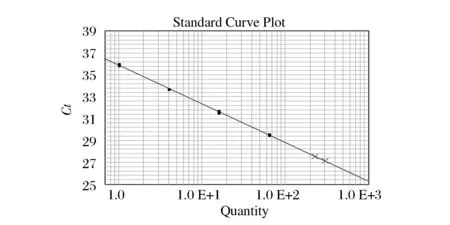
图3 第3次试验斜率R2Fig.3 The slope R2 of the third test
从图表的结果可见,3次试验的ΔCt分别为-0.121 31、-0.139 87、0.071 57;线性回归方程的斜率分别为-3.54 4、-3.545、-3.540;R2系数分别为0.996、0.997、0.999。3次试验均满足JRC指南中规定的3项要求[11],可见使用QIAGEN DNeasy©Plant Mini Kit试剂盒提取的产物中不含抑制剂,提取质量合格,可以用于后续试验。
2.3 提取物浓度的测定
用BECKMAN COULTER DU 800紫外分光光度计分别GA21品系阳性标准物质(+)和超市购买的纯玉米渣(-)的提取产物进行检测,得到如下结果(见表5)。

表5 提取物DNA相对浓度
利用公式(1)计算提取物的绝对浓度(copies/μL),结果见表6。
提取物绝对浓度/(copies·μL-1)=(6.02×1023)×(DNA浓度ng/μL×10-9)/(玉米基因组碱基数2.4×109×345)
(1)

表6 提取物DNA绝对浓度
2.4 准确度、重复性、定量限试验设计
JRC指南中规定,需要16个PCR平行结果,才可以比较准确地计算出所验证方法的准确度、重复性、定量限,试验设计的实例见图4。

图4 准确度、重复性、定量限试验设计实例Fig.4 Example of accuracy, repetitive and LOQ experiment design
按照图4的设计进行PCR试验,得到的试验结果见表7和表8。
2.5 准确度验证
JRC指南中规定,准确度应在可接受参考值的±25%内。对方法的准确度进行验证时,检测条件(反应量、 PCR仪等)应该和日常检测一致。至少选择包括接近定量限在内的3个不同浓度水平进行验证[12-13]。每个浓度水平要得到16个PCR平行的结果(见2.4)。平均值的计算使用公式(2)。
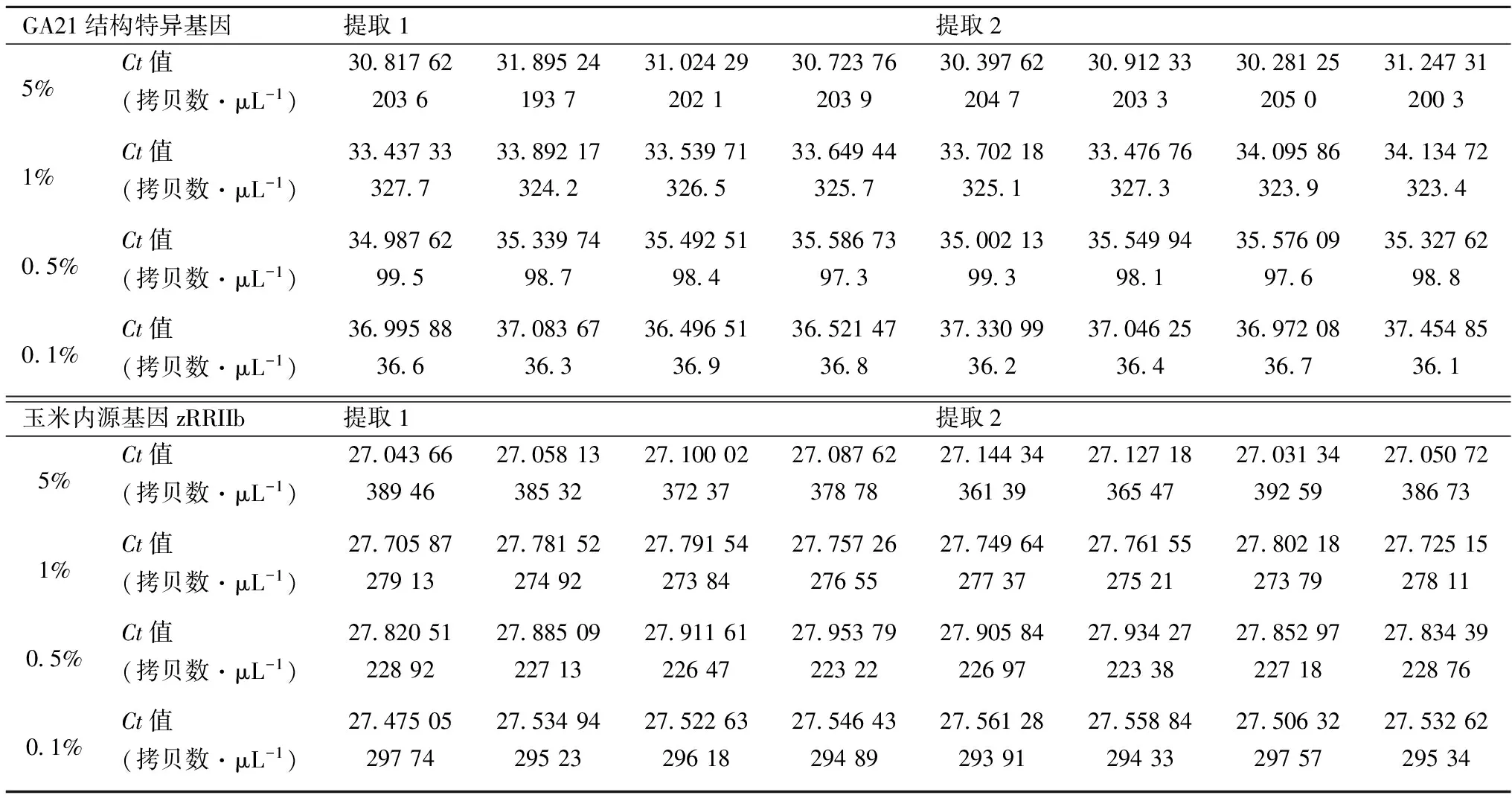
表7 PCR Plate 1 不同转基因水平提取物检测Ct值
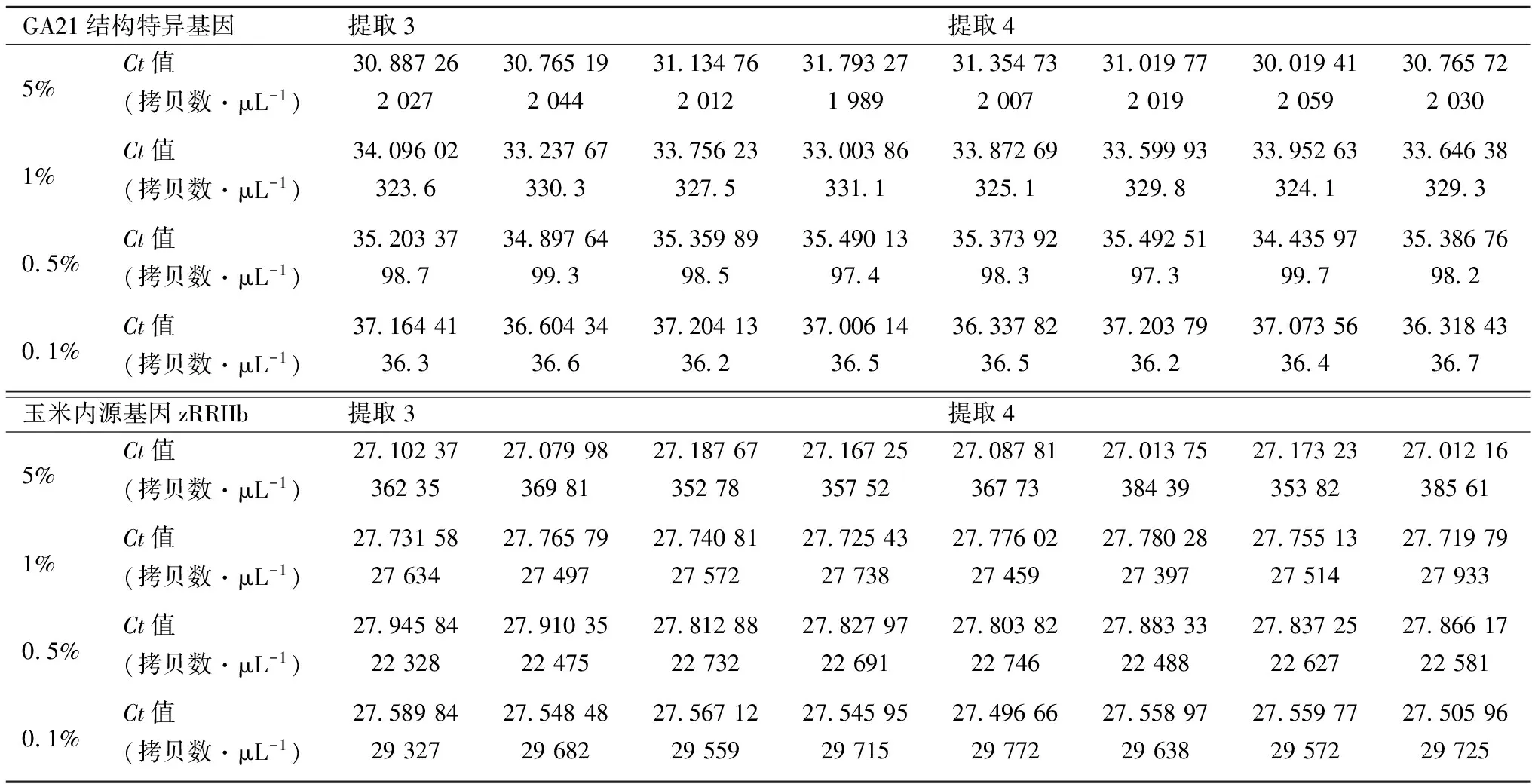
表8 PCR Plate 2 不同转基因水平提取物检测Ct值
(2)
根据表7、表8的结果进行计算得到以下结果。
2.5.1 5%转基因水平
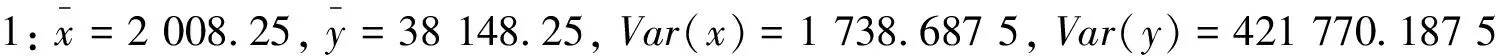
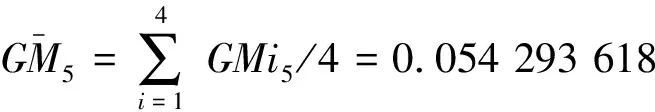
2.5.2 1%转基因水平


2.5.3 0.5%转基因水平


2.5.4 0.1%转基因水平
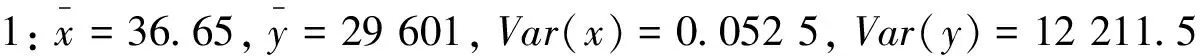

2.6 重复性验证
按照JRC指南要求,接着应对重复性进行验证。重复性(Repeatability)是在使用相同方法和正确操作情况下,由同一操作人员,在同一实验室,使用同一仪器,并在短期内,作多个单次测试结果,在一定概率水平(一般指95%)两个独立测试结果的最大差值。使用可重复性标准偏差(Repeatability standard deviation,RSDr)来衡量重复性的优劣。JRC指南规定RSDr应≤25%。
对方法重复性的验证需要在重复条件下通过PCR平行试验进行评估[14]。重复性应适用于所有转基因水平的测试。检测条件(反应量、 PCR仪等)应该和日常检测一致。至少要得到16个独立测量结果(见2.4)。选取5%、1%、0.5%、0.1%这4个不同转基因含量的样品进行检测。方差、标准偏差、总体的标准差平均数、相对可重复性标准差分别通过公式(3、4、5、6)计算得到。
(3)
(4)
(5)
式中:n表示每个提取的复制数,n=4;k表示每个反应管分别的标准差数量,k=4;分母的区间是16-8=8。
(6)
根据表7、8的结果进行计算得到以下结果。
2.6.1 5%转基因水平

使用公式(3)得出4个方差Var15= 1.997 92×10-6、Var25= 3.912 42×10-6、Var35=1.268 47×10-6、Var45= 3.909 1×10-6。使用公式(4)得出4个标准偏差sd15= 0.001 413 5、sd25= 0.001 978、sd35= 0.001 126 3、sd45= 0.001 977 1。使用公式(5)和之前计算的结果得到sdGM5= 0.002 039。使用公式(6)计算出5%转基因水品的相对可重复性标准偏差RSDr=3.76<25,可见在5%转基因水平下,依据JRC指南的规定所验证方法的重复性满足指南要求。
2.6.2 1%转基因水平

使用公式(3)得出4个方差Var11=9.382 69×10-9、Var21=8.315 36×10-9、Var31= 1.274 07×10-8、Var41=1.644 86×10-8。使用公式(4)得出4个标准偏差sd11=9.686×10-5、sd21=9.119×10-5、sd31=0.000 112 9、sd41=0.000 1283。使用公式(5)和之前计算的结果得到sdGM1=0.000 132 6。使用公式(6)计算出1%转基因水品的相对可重复性标准偏差RSDr=1.12<25,可见在1%转基因水平下,依据JRC指南的规定所验证方法的重复性满足指南要求。
2.6.3 0.5%转基因水平

使用公式(3)得出4个方差Var10.5=2.780 19×10-9、Var20.5= 2.248 61×10-9、Var30.5=1.936 46×10-9、Var40.5=1.760 45×10-9。使用公式(4)得出4个标准偏差sd10.5=5.273×10-5、sd20.5=4.742×10-5、sd30.5=4.401×10-5、sd40.5=4.196×10-5。使用公式(5)和之前计算的结果得到sdGM0.5=5.720 26×10-5。使用公式(6)计算出0.5%转基因水平的相对可重复性标准偏差RSDr=1.31<25,可见在0.5%转基因水平下,依据JRC指南的规定所验证方法的重复性满足指南要求。
2.6.4 0.1%转基因水平

使用公式(3)得出4个方差Var10.1=8.128 1×10-11、Var20.1=9.508 5×10-11、Var30.1=6.876 41×10-11、Var40.1=4.712 58×10-11。使用公式(4)得出4个标准偏差sd10.1=9.016×10-6、sd20.1=9.751×10-6、sd30.1=8.292×10-6、sd40.1=6.865×10-6。使用公式(5)和之前计算的结果得到sdGM0.1=1.046 88×10-5使用公式(6)计算出0.1%转基因水平的相对可重复性标准偏差RSDr=0.85<25,可见在0.1%转基因水平下,依据JRC指南的规定所验证方法的重复性满足指南要求。
四个转基因含量水平样品的相对可重复性标准差分别为3.76、1.12、1.31、0.85%,均小于25%,证明本方法的重复性满足指南要求。
2.7 相对定量限(LOQrel)
JRC指南规定验证一个方法的相对定量限(LOQrel)可用一个低转基因浓度的阳性对照样品的至少10次PCR平行来测量,如果所有平行的结果都是阳性,这表示LOQrel低于或等于该阳性对照水平。在做重复性验证的同时,我们得到了4个不同转基因含量水平的分别16个检测结果,见表9。
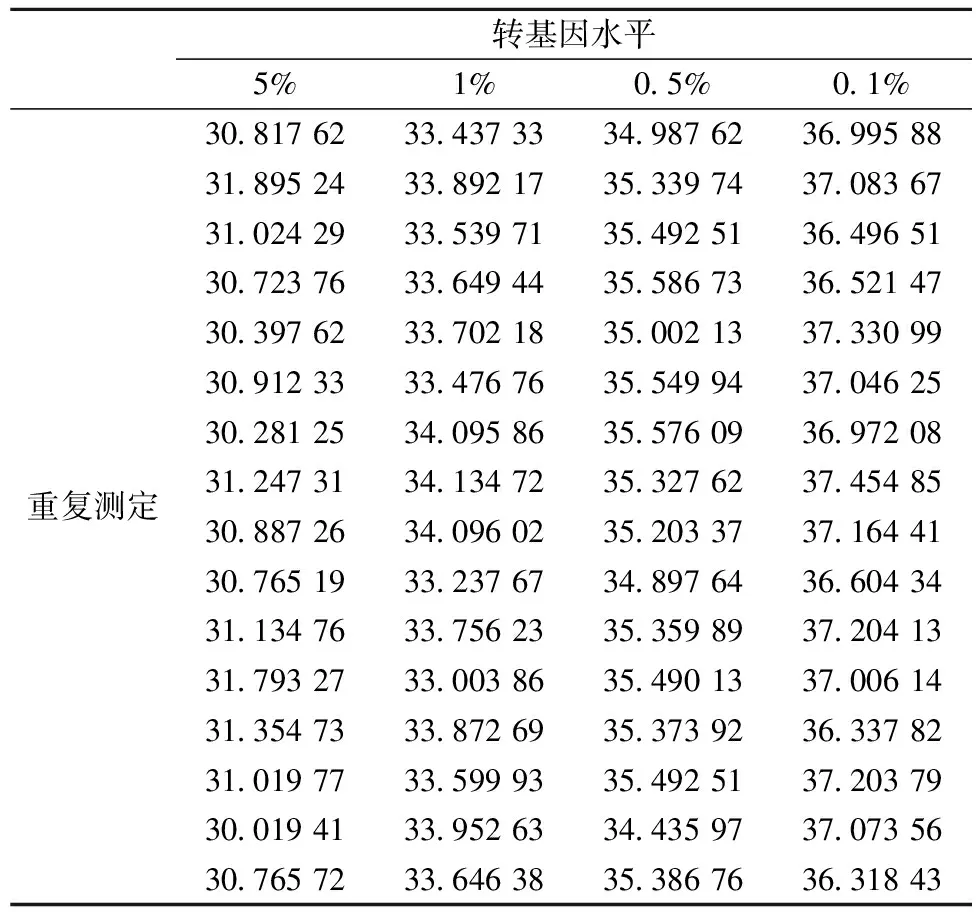
表9 相对定量限(LOQrel)结果
从表9可见, 0.1%这一转基因水平全部检出。所以该标准方法的相对定量限(LOQrel)为0.1%。
3 讨论
本文依据JRC指南性文件对《GB/T19495.5—2004转基因产品检测核酸定量PCR检测方法》进行了方法验证。验证了使用DNA提取试剂盒提取产物不含抑制剂,该方法重复性良好,且该方法的相对定量限为0.1%转基因浓度水平。证明我实验室的检测过程和结果能够满足GB/T19495.5-2004国标的检测需求,本文可作为实验室方法验证的实例参考使用,具有良好的可行性和适用性。
该JRC指南性文件适用于包括食品转基因检测在内的所有分子生物学检测,充分考虑到了分子生物学检测中的关键控制点,并科学细化了验证步骤。尽管关注的是PCR方法的验证,但是DNA提取方法的评估是转基因检测和分子生物学检测的关键步骤,因为在食品转基因检测中DNA提取的质量对最终结果有重要影响,该指南性文件在此指标上给出了详细规定,通过我们的试验研究,证明具有良好的可操作性,便于实验室在日常引入新方法及方法发生变更时进行方法验证时参考使用。
通过本文的试验研究,可以看出,《JRC科学技术报告-经确认的转基因检测分析方法的验证》这一指南性文件,可用于指导检测实验室开展转基因检测方法验证工作,特别对分子生物学定量检测的方法验证具有指导意义。
[1] CNAS-CL01:2005 检测和校准实验室能力认可准则[S].
[2] ISO 13843:2000 Water quality-guidance on validation of microbiological methods[S].
[3] Procedure for the decelopment and management of food microbiological methods Part 2. Data requirements and submission templates for methods section B. Data requirements and submission templates for qualitative methods,2008[S].
[4] ISO 16140:2003 Microbiology of food and animal feeding stuffs — Protocol for the validation of alternative methods[S].
[5] FELDSINE P, ABEYTA C, ANDREWS W H. AOAC International Methods Committee Guidelines for validation of qualitative and quantitative food microbiological official methods of analysis, 2004[S].
[6] JRC Scientific and Technical Reports-Verification of analytical methods for GMO testing when implementing interlaboratory validated methods. Guidance document from the European Network of GMO laboratories(ENGL)[S].
[7] GB/T 19495.5:2004 转基因产品检测核酸定量PCR检测方法[S].
[8] AOAC® Official methods validation program[S].
[9] EN/TS 21568:2006 Foodstuffs. Methods of analysis for the detection of genetically modified organisms and derived products. Sampling strategies.European Committee for Standardisation,Brussels, Belgium[S].
[10] International standard (ISO) 21571, Foodstuffs. Methods of analysis for the detection of genetically modified organisms and derived products-Nucleic acid extraction. International Organisation for Standardisation, Geneve, Switzerland, 2006[S].
[11] CIABATTI I, FROIIO A, GATTO F, et al. In-house validation and quality control of real-time PCR methods for GMO detection: a practical approach[J].Dev Biol,2006,126: 79-86.
[12] SCHOLTENS I M J, KOK E, HOUGS L,et al.Increased efficacy for in-house validation of real-time PCR GMO detection methods[J].Analytical and Bioanalytical Chemistry, 2010,396 (6):2 213-2 227.
[13] International standard (ISO) 21569, Foodstuffs. Methods of analysis for the detection of genetically modified organisms and derived products-Qualitative nucleic acid based methods. International Organisation for Standardisation, Geneve, Switzerland,2006[S].
[14] HOLST-JENSEN A, BERDAL K G. The modular analytical procedure and validation approach and the units of measurement for genetically modified materials in foods and feeds[J].Journal of AOAC International,2004,87(4):927-936.
Verification of the quantitative method for GMO foods
RAO Hong, HAN Yue*, GUO Zheng-lei, XU Shan, LI Wei, GU Qiang, LIN Yuan-hui
(Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing 100026,China)
According to the requirements of Guidance document from the European Network of GMO laboratories(ENGL) of JRC, “GB/T 19495.5—2004 Detection of genetically modified organisms and derived products—Quantitative PCR methods based on nucleic acid” including four typical indexes, DNA extraction, accuracy, repeatability and LOQrel, was verified. After verification, DNA extraction kit was qualified. The trueness was within ± 25% of the accepted reference value. RSDr<25.LOQrel was 0.1% GMO content. The verification on the national standard confirms that the guidance is applicable for method verification in laboratory.
GMO testing in foods; quantitative testing; method verification
10.13995/j.cnki.11-1802/ts.201704033
硕士,主任技师(韩玥为通讯作者,E-mail:hanyuedella2@163.com)。
2016-11-18,改回日期:2017-01-04
