松树蕈多糖乙酰化修饰工艺及其抗氧化活性
2017-06-19徐田甜陈义勇
徐田甜,陈义勇
(常熟理工学院 生物与食品工程学院,江苏 常熟,215500)
松树蕈多糖乙酰化修饰工艺及其抗氧化活性
徐田甜,陈义勇*
(常熟理工学院 生物与食品工程学院,江苏 常熟,215500)

松树蕈多糖;乙酰化;响应面;抗氧化
松树蕈(Tricholomamatsutake)又名松口蘑、松茸等,属于担子菌门(Basidiomycota),担子菌纲(Basidiomycetes),伞菌目(Agaricates)口蘑科(Tricholomaceae),口蘑属(Tricholoma)[1]。研究表明松树蕈多糖(polysaccharides fromtricholomamatsutake,TMP)具有抗肿瘤[2]、美白[3]和抗辐射[4]等作用,具有重要的医疗价值和很高的市场开发前景。分子修饰对多糖活性有很大的影响,对多糖进行化学修饰,可以提高多糖的活性[5~7]。乙酰化修饰是糖类物质的一种常见的修饰方法[6],目前,对于松树蕈多糖的研究主要集中在提取方法上,而对松树蕈多糖的修饰研究未见报道。
为此,本文对TMP乙酰化修饰工艺进行探讨,并利用响应面法对TMP乙酰化化修饰工艺条件进行优化研究,同时探讨了乙酰化松树蕈多糖(acetylation of polysaccharides fromtricholomamatsutake,Ac-TMP)的抗氧化活性。
1 材料和方法
松树蕈(苏州兴福斋食品科技有限公司提供)。
1,1-二苯基-2-苦苯肼/DPPH,三羟甲基氨基甲烷/Tris,上海楷洋生物技术有限公司;无水乙醇、NaOH、乙酸酐、乙醚、石油醚、H2O2、FeSO4、HCl、水杨酸、酚酞、邻苯三酚等以上试剂均为分析纯。
1.1 仪器与设备
DJ-04粉碎机,上海淀久中药机械制造有限公司;HH-2智能数显恒温水浴锅,金坛市杰瑞尔电器有限公司;CR22GⅡ高速冷冻离心机,日本HITACHI公司;RE-52A型旋转蒸发仪,上海亚荣生化仪器有限公司;SHB-B95型循环水式多用真空泵,郑州长城科工贸有限公司;DHG-9030A型电热恒温鼓风干燥箱,上海三发科学仪器有限公司;ME104E型分析天平,瑞士METTLER TOLEDO公司;FE20型pH计,瑞士METTLER TOLEDO公司;722分光光度计,上海菁华科技仪器有限公司;UVmini-1240紫外分光度计,日本岛津;NicoletIS10 傅里叶红外光谱仪,美国 Thermo Electron 公司。
1.2 实验方法
1.2.1 松树蕈多糖(TMP)的制备
冷冻松树蕈经解冻、洗涤、干燥、粉碎后,按料液比1∶30(g∶mL),加入蒸馏水,水浴浸提温度为80 ℃,浸提时间为4 h。松树蕈多糖提取液经4 500 r/min离心10 min,合并上清液。将上清液减压浓缩至一定体积,经乙醚或石油醚脱脂和Sevage[V(三氯甲烷)∶V(正丁醇)=5∶1]法除蛋白后,加入4倍体积的体积分数为95%的乙醇,4 ℃条件下进行醇沉24 h后,离心,沉淀经30 ℃鼓风干燥后得到TMP。
1.2.2 乙酰化松树蕈多糖(Ac-TMP)的制备
Ac-TMP的制备参照文献[8]的方法并适当调整,精确称取100 mg的TMP样品,加入10 mL蒸馏水,完全溶解,用NaOH溶液(0.5 mol/L)调pH为9,一定温度下,向多糖溶液滴加一定量的乙酸酐,滴加完毕后,恒温反应一段时间后,待反应结束,用HCl调pH至中性,将反应液装入截留分子量为14 000的透析袋中,用蒸馏水透析48 h,透析液经减压浓缩后,用4倍体积分数为95%的乙醇醇沉24 h,沉淀经30 ℃鼓风干燥得到乙酰化松树蕈多糖(Ac-TMP)。
1.2.3 乙酰化取代度的测定[9]
称量乙酰化松树蕈多糖10 mg,加入10 mL NaOH溶液(0.01 mol/L)将其完全溶解。以酚酞为指示剂,HCl溶液(0.01mol/L)进行滴定,滴定终点为红色消失[9]。取代度(DS)按下式计算:
(1)
(2)
式中:A为乙酰基含量,%;V0为加入NaOH溶液的体积,mL;C0为NaOH溶液的浓度,(mol/L);V1为消耗HCl溶液的体积,mL;C1为HCl溶液的浓度,mol/L;m为样品质量,g。
1.2.4 单因素实验
1.2.4.1 料液比对TMP乙酰化反应的影响
取100 mg TMP,反应时间为4 h,反应温度为50 ℃,分别考察了不同料液比(g∶mL)1∶20、1∶25、1∶30、1∶35和1∶40对TMP乙酰化反应的影响,进而确定最佳料液比。
1.2.4.2 反应时间对TMP乙酰化反应的影响
取100 mg TMP,料液比为1∶35(g∶mL),反应温度为50 ℃,分别考察了1、2、3、4和5 h不同的反应时间对TMP乙酰化反应的影响,进而确定最佳反应时间。
1.2.4.3 反应温度对TMP乙酰化反应的影响
取100 mg TMP,料液比为1∶35(g∶mL),反应时间为3 h,分别考察了30、40、50、60和70 ℃不同的反应温度对TMP乙酰化反应反应的影响,进而确定最佳反应温度。
1.2.5 响应面试验设计
在单因素试验结果的基础上,采用Box-Benhnken 的中心组合试验设计原理,以乙酰化取代度为指标,设计以料液比、反应时间、反应温度为反应主要考察因素,利用Design-Expert软件系统进行响应面分析和优化TMP乙酰化的工艺条件。
1.2.6 Ac-TMP的结构表征
1.2.6.1 红外光谱分析
分别取一定量充分干燥的TMP和Ac-TMP,与一定量KBr充分混匀后压片,在400~4 000 cm-1范围下进行红外光谱扫描。
1.2.6.2 扫描电镜分析
分别取一滴4×10-3mg/ mL的TMP和Ac-TMP溶液于解理后的云母片上,1%锇酸熏蒸固定2 h ,喷金,扫描电镜下观察。
1.2.7 Ac-TMP的抗氧化活性测定
1.2.7.1 羟基自由基(·OH)清除能力的测定[10]
配FeSO4溶液(9 mmol /L),水杨酸-乙醇溶液(9 mmol /L),H2O2溶液(8.8 mmol/L)。将TMP和Ac-TMP配成0.2、0.4、0.6、0.8、1.0 mg/mL 5种不同浓度。每2 mL样品中各加1 mL的FeSO4溶液和2 mL水杨酸-乙醇溶液,最后加入2 mL H2O2溶液,启动反应,在室温下反应1 h。用蒸馏水代替样品溶液作空白调零,于510 nm波长处测定其吸光度。羟基自由基的清除率用下式计算:
(3)
式中:A0,标准空白管的吸光度;A1,对照管的吸光度;A2,测定管的吸光度。
1.2.7.2 DPPH自由基清除能力的测定[11]
用无水乙醇配DPPH溶液(0. 1 g /L)。将TMP和Ac-TMP配成0.2、0.4、0.6、0.8、1.0 mg/mL 5种不同浓度。每1 mL样品待测液和1.0 mL DPPH溶液(需现用现配)振荡摇匀,对照样为1.0 mL蒸馏水和1.0 mL DPPH溶液混合,常温避光反应30 min后于波长517 nm处比色,以蒸馏水作参比调零。DPPH自由基清除率计算式为:
(4)
式中,A0,对照组吸光度;A,样品待测液吸光度。

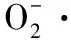
(5)
2 结果与讨论
2.1TMP的乙酰化修饰
2.1.1 单因素实验结果分析
2.1.1.1 料液比对TMP乙酰化反应的影响
料液比对TMP乙酰化反应的影响见图1。由图1知,随着料液比的增加,多糖取代度先升高后降低,当料液比为在1∶35时,乙酰化取代度达到最大,之后随着料液比的增大,取代度逐渐下降,因此确定适宜的料液比为1∶35。
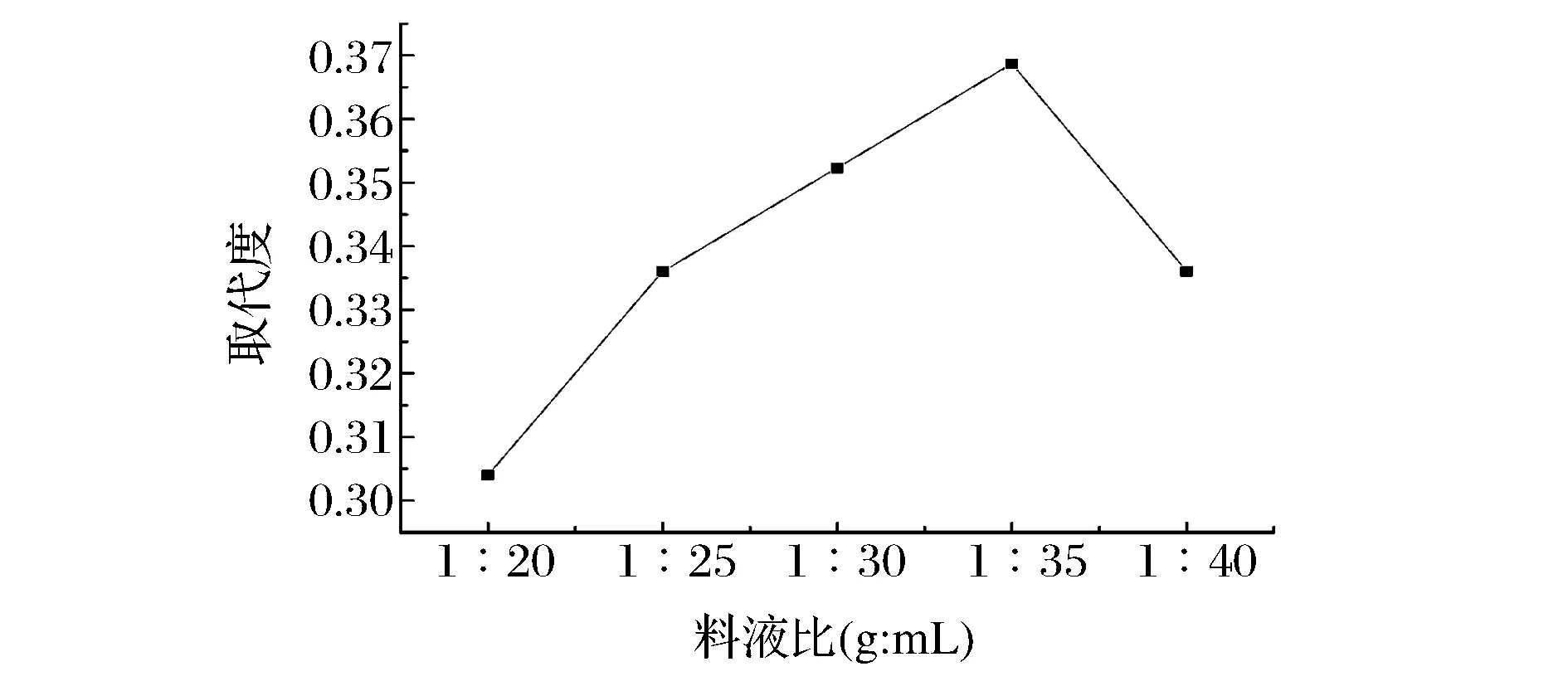
图1 料液比对取代度的影响Fig.1 Effect of polysaccharides-to-acetic anhydrideratioon substitution degree of Ac-TMP
2.1.1.2 反应时间对TMP乙酰化反应的影响
反应时间对TMP乙酰化反应的影响见图2。由图2知,反应时间对多糖取代度的影响较大,随着时间的增长,多糖取代迅速提高,到3 h时,达到最高值,此后,随着时间的延长,取代度较大幅度的下降,因此确定适宜的反应时间为3 h。
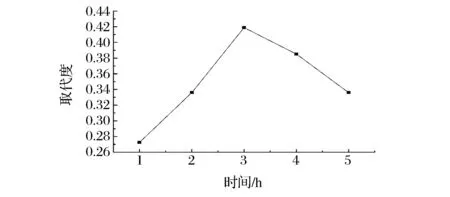
图2 反应时间对取代度的影响Fig.2 Effect ofreaction time on substitution degree of Ac-TMP
2.1.1.3 反应温度对TMP乙酰化反应的影响
反应温度对TMP乙酰化反应的影响见图3。由图3知,反应温度对取代度的影响十分明显。在30~40 ℃内,随着反应温度的上升,取代度迅速增大,反应温度超过40 ℃后,取代度明显下降,因此确定适宜的反应温度为40 ℃。
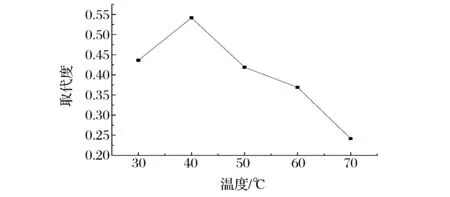
图3 反应温度对取代度的影响Fig.3 Effect of reaction temperature on substitution degree of Ac-TMP
2.1.2 TMP乙酰化工艺条件优化
2.1.2.1 响应模型的建立与分析
在单因素试验结果的基础上,以乙酰基取代度为指标,设计以料液比(A)、反应时间(B)、反应温度(C)三因素的回归方程来拟合因素与响应值之间的函数关系,实验因素和水平设计见表1,响应面试验设计方案及结果见表2,响应面分析得出的回归模型参数方差分析见表3。
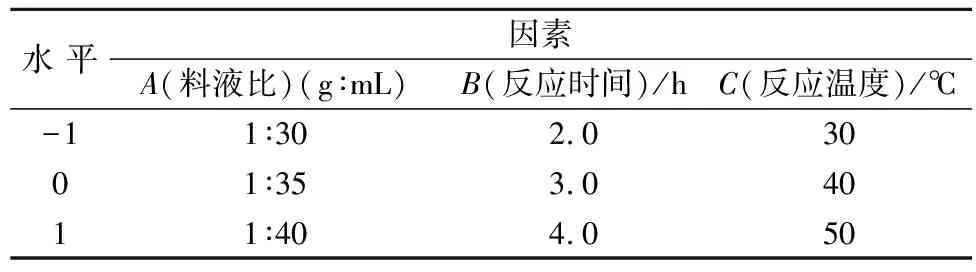
表1 响应面分析试验因素与水平
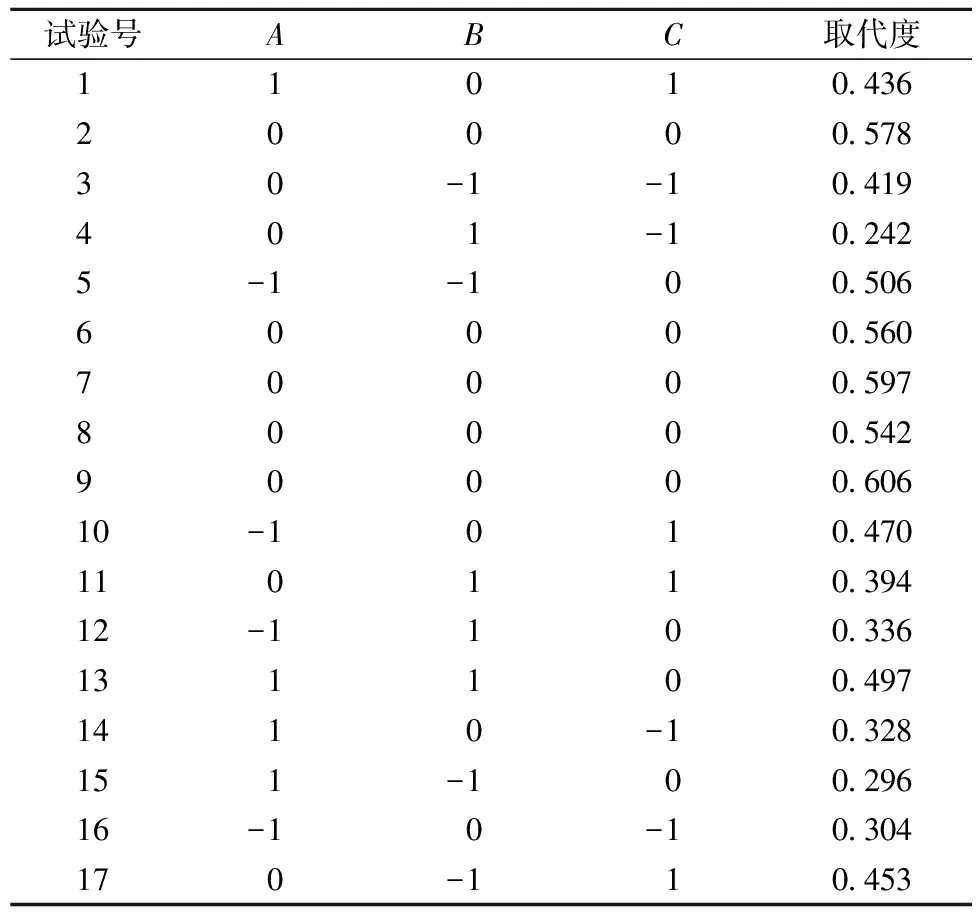
表2 响应面试验设计及结果
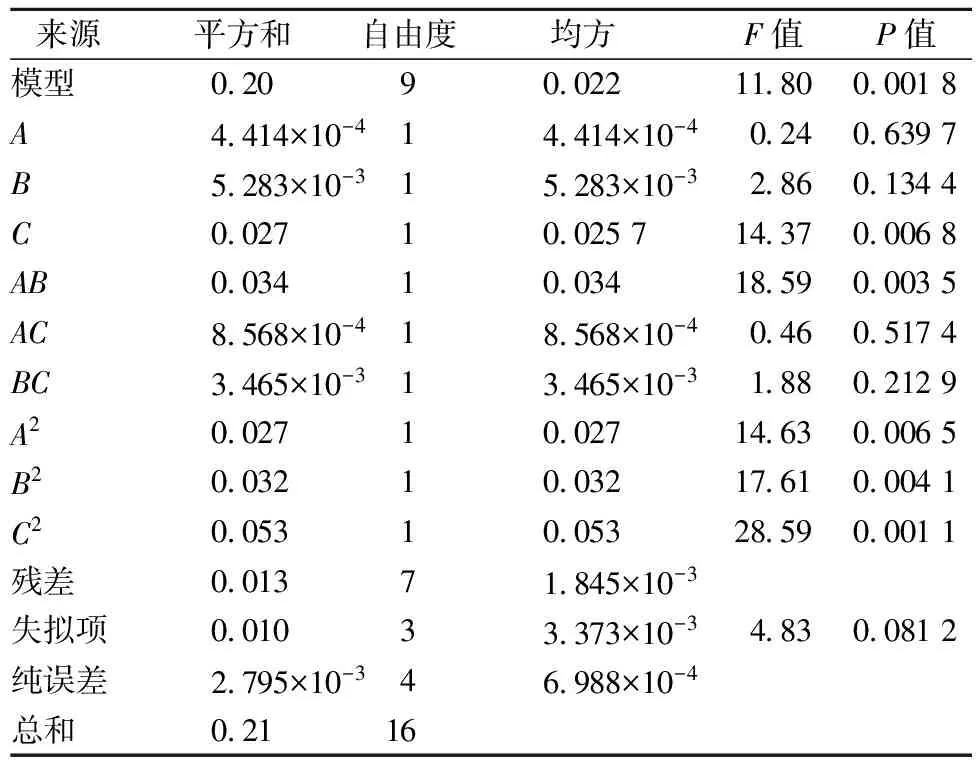
表3 回归模型方差分析
注:P<0.05为差异显著;P<0.001为差异极显著。
利用Design-Expert软件对表2中的试验结果进行二次方程拟合,得到TMP对料液比、反应时间和反应温度的二次多项回归方程的模型为:
Y=0.58-7.428×10-3A-0.026B+0.058C+0.093AB-0.015AC+0.029BC-0.080A2-0.088B2-0.11C2
从表3方差分析结果来看,模型的F值为11.80,P<0.05,表明拟合得到的模型显著。同时,失拟误差项P>0.05,不显著,说明未知因素对试验结果干扰很小,模型选择较合适。模型的总回归系数R2=0.938 2,说明该模型的拟合程度较好,用于评估各因素对TMP乙酰化取代度的影响较为准确。
从表3还可知,试验组合中的各因素中反应温度影响最大。影响程度大小的顺序为:反应温度(C)>反应时间(B)>料液比(A)。
2.1.2.2 响应面图分析
试验得到的响应面图见图4。从图4分析得出,温度对乙酰化取代度的影响最为显著,表现为曲线最陡;时间的影响次之,而图中料液比曲线最平滑,因此影响最不显著。时间和料液比两者之间的交互作用显著,温度与时间的交互作用次之,而温度和料液比的交互作用不太明显。
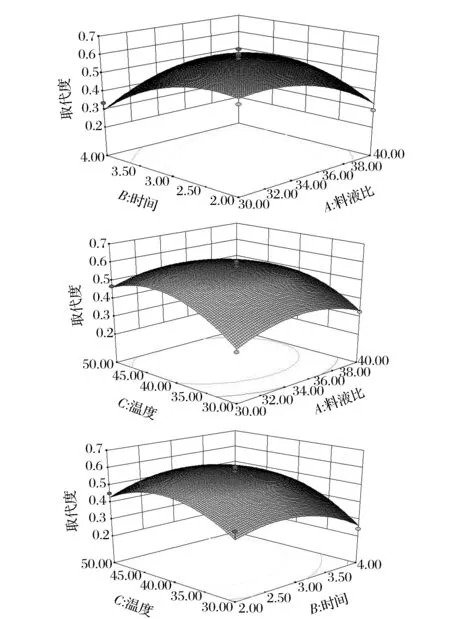
图4 两因素交互作用对取代度的影响Fig.4 Effects of cross-interaction of two factors on substitution degree of Ac-TMP
2.1.2.3 最佳工艺条件确定及验证实验
利用Design-Expert 8.06软件对响应面试验结果进行分析,预测得到TMP乙酰化的最佳工艺条件为:料液比1∶34.07(g∶mL),反应时间为2.8 h,反应温度为42.42 ℃。在该优化条件下,乙酰化松树蕈多糖取代度达0.587。为了检验响应面试验预测结果的可靠性,采用最佳工艺条件对TMP进行乙酰化修饰。考虑实验实施的可行性,将预测工艺条件调整为料液比1∶34(g∶mL),反应时间为2.8 h,反应温度为42 ℃,在此条件下测得的Ac-TMP的取代度为0.588,与预测值误差很小,验证了该预测试验的可靠性。
2.2 结构表征分析
2.2.1 红外光谱


图5 TMP和Ac-TMP的红外光谱图Fig.5 Infrared spectra of TMP and Ac-TMP
2.2.2 电镜分析
TMP和Ac-TMP的电镜图见图6。由图6知,TMP样品呈片状,表面形貌平滑,提高放大倍率,也是光滑表面。由图7知,Ac-TMP样品呈孔隙状,表面形貌粗糙。TMP属于天然高分子凝胶,糖链间通过氢键交联,乙酰化修饰后,很有可能糖苷键被切断,由酯基取代,导致糖链间氢键交联键密度变小, 畴结构变大,即表面粗糙度增加[13]。

图6 TMP电镜观察Fig.6 Scanning electron microscope observation of TMP

图7 Ac-TMP电镜观察Fig.7 Scanning electron microscope observation of Ac-TMP
2.3 Ac-TMP的抗氧化作用
2.3.1 Ac-TMP对·OH清除作用
Ac-TMP对·OH清除作用见图8。由图8可知,在一定质量浓度范围内,TMP和Ac-TMP对·OH的清除作用都随着浓度升高而增强,与TMP相比,Ac-TMP对·OH的清除能力有极为明显的减弱(P<0.01)。乙酰化多糖生物活性不仅受到乙酰基数量的影响,还与取代的位置相关,O-3位具有乙酰基时,多糖抗肿瘤活性最强;O-5位具有乙酰基时,抗肿瘤活性显著减弱;当O位全部乙酰化时,活性消失[14]。与TMP相比,Ac-TMP对·OH的清除作用下降的原因可能可能与取代基的位置及取代度的多少有关。曲瑾郁[15]等对蛹虫草多糖进行乙酰化修饰,发现修饰后的多糖对·OH的清除能力减弱。乙酰基能改变多糖分子的定向性和横向次序,从而改变了多糖的空间排布,因此对其活性产生影响。王雪松等证实不是所有的基团的加入都会提高多糖的活性, 有些基团的加入甚至会降低活性[16]。但是也有研究发现,乙酰化灵芝多糖[17]、南瓜多糖[18]、青钱柳叶多糖[19]比未修饰多糖抗氧化作用有了一定程度的提高,这可能是由于不同来源的多糖种类、结构差异导致修饰前后多糖抗氧化活性差异。
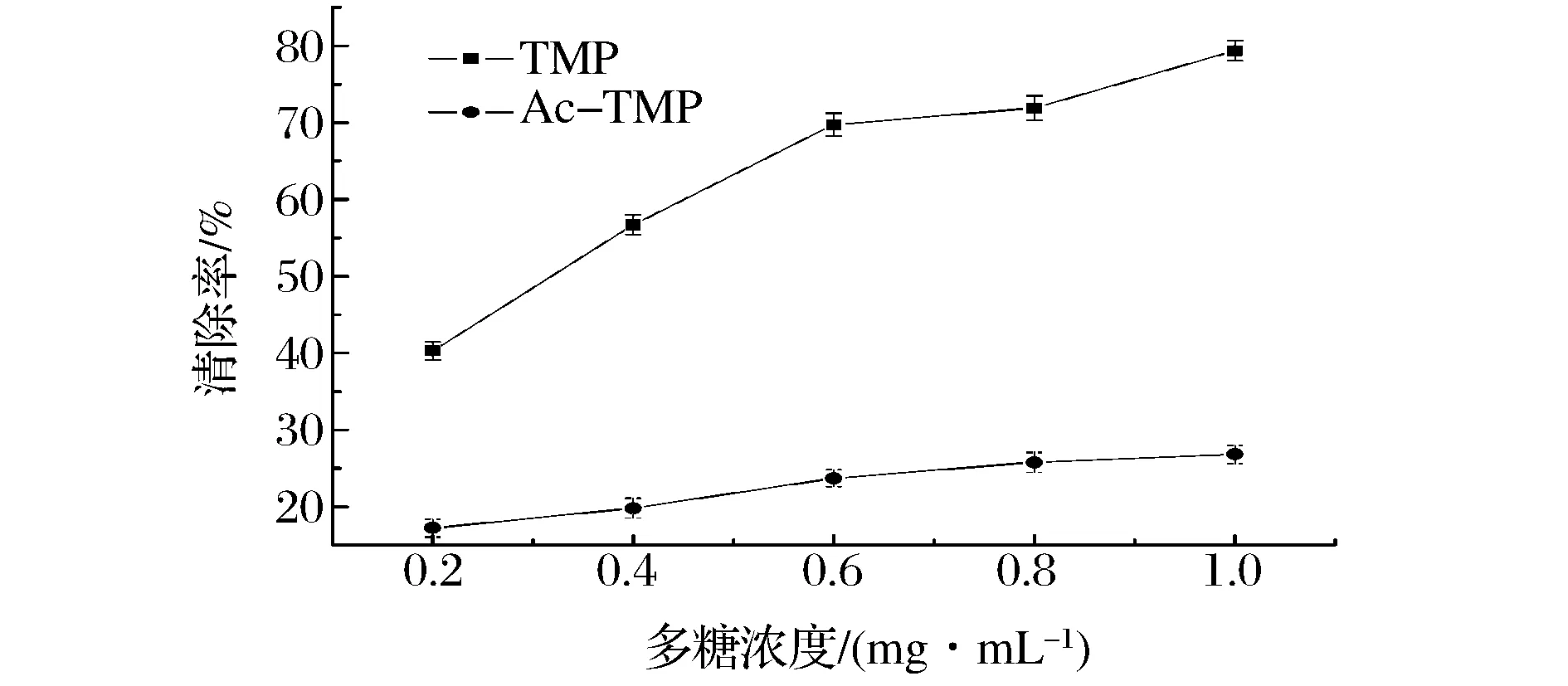
图8 TMP和Ac-TMP对·OH的清除作用Fig.8 Scavenging capacity of TMP and Ac-TMP on hydroxyl free radicals
2.3.2 Ac-TMP对DPPH自由基清除作用
Ac-TMP对DPPH自由基清除作用见图9。
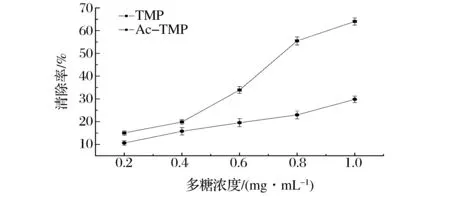
图9 TMP和Ac-TMP对DPPH自由基的清除作用Fig.9 Scavenging capacity of TMP and Ac-TMP on DPPH free radicals
由图9可知,在一定质量浓度范围内,TMP和Ac-TMP对DPPH自由基均有一定的清除作用,且随着浓度上升,清除作用逐步增强,当多糖质量浓度大于0.6 mg/mL,Ac-TMP对DPPH自由基的清除作用明显弱于TMP(P<0.01),可能是因为松树蕈多糖对不同自由基的活性部位不同,在乙酰化修饰后,不同的活性部位被修饰,从而导致抗氧化活性的差异。曲瑾郁[15]等对蛹虫草多糖进行乙酰化修饰,发现修饰后的多糖对DPPH自由基的清除能力减弱。

图10 TMP和Ac-TMP对的清除作用Fig.10 Scavenging capacity of TMP and Ac-TMP on superoxide anion free radicals
3 结论
本文以TMP为原料,采用乙酸酐法对TMP进行乙酰化修饰,同时以取代度为指标,利用响应面优化分析确定TMP乙酰化修饰最佳工艺条件为料液比1∶34.07(g∶mL),反应时间为2.8h,反应温度为42.42 ℃。在此优化条件下,Ac-TMP的取代度达到0.587。
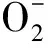
乙酰化修饰作为一种常用的分子修饰方法,它能够改变多糖分子的定向性和横向次序,从而改变糖链的空间排布。本研究通过松树蕈多糖进行乙酰化修饰,对于研究多糖构效关系,进而探寻多糖的活性中心、阐明结构与功能的关系及松树蕈多糖的开发与应用具有重要的意义。乙酰基的取代位置、取代度大小、乙酰化产物的空间构象等均可影响其抗氧化活性,目前其构效关系和作用规律尚不清楚,仍有待进一步研究。
[1] 张娅,李宝才,项朋志,等.松茸多糖超声提取物抗氧化活性研究[J].化学与生物程,2011,28(9):75-79.
[2] 刘刚,王辉,张洪,等.松茸多糖体外抗肿瘤活性研究[J].中华中医学刊,2013,31(2):267-270.
[3] 程华,刘月恒,刘晓英,等.松茸多糖的分离纯化和美白功效研究[J].日用化学 工业,2013,43(2):134-138.
[4] 陈月月,李雪静,王宏芳,等.松茸多糖抗辐射功能的初步研究[J].天然产物研究与开发,2006(18):989-991.
[5] 李玉华,王凤山,贺艳丽.多糖化学修饰方法研究概况[J].中国生化药物杂志,2007,28(1):62-65.
[6] 张难,吴远根,莫丽萍,等.多糖的分子修饰研究进展[J].贵州科学,2008,26(3):66-71.
[7] 孟思彤,徐艳芝,王振月. 多糖的化学修饰对其生物活性影响研究进展[J]. 天然产物研究与开发,2014(26):1901-1905.
[8] 宋逍,辛亚洲,赵鹏,等.响应面法优化金银花多糖乙酰化工艺[J].食品工业科技,2013(17):262-265.
[9] 黄丹菲,聂少平,江乐明,等. 乙酰化大粒车前子多糖的制备及其生物活性研究[J]. 食品科学,2013,34(22):1-4.
[10] 刘莹,赵杰,许琳.乙酰化修饰金针菇多糖衍生物的抗氧化研究[J].食品与发酵工业,2014,40(7):88-91.
[11] 渠深玲,玉愿成,罗莉,等.羧甲基化修饰对大枣多糖抗氧化活性的影响[J].河南工业大学学报,2012,3(6):18-21.
[12] 周林,郭祀远,郑必胜,等.裂褶多糖的乙酰化及光谱分析[J].华南理工大学学报,2006,34(12):88-91.
[13] 秦利鸿,曹建波,易伟松.绿茶多糖的扫描电镜制样新方法及原子力显微镜观察[J].电子显微学报,2009,28(2):162-167.
[14] 李玉华,王凤山,贺艳丽. 多糖化学修饰方法研究概况[J].中国生化药物杂志,2007,2(1):62-65.
[15] 曲瑾郁,任大明. 蛹虫草多糖的化学修饰及体外抗氧化能力[J]. 食品科学,2011,32(15):58-61.
[16] 王雪松. 积雪草多糖的分离纯化、化学结构、生物活性构效关系及葡聚糖和半乳聚糖的化学修饰研究[D]. 上海:中科院上海生命科学院上海药物研究所, 2004.
[17] CHEN Y,ZHANG H,WANG YX,et al.Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J].Food Chemistry ,2014,156(3):279-288.
[18] SONG Y,YANG Y,ZHANG Y Y,et al. Effect of acetylation on antioxidant and cytoprotective activity of polysaccharides isolated from pumpkin (Cucurbitapepo, lady godiva)[J].Carbohydrate Polymers, 2013, 98(1): 686-691.
[19] XIE J H,ZHANG F,WANG Z J,et al. Preparation, characterization and antioxidant activities of acetylated polysaccharides from Cyclocarya paliurus leaves[J].Carbohydrate Polymers ,2015,133: 596-604.
[20] SIU KC, CHEN X, WU JY. Constituents actually responsible for the antioxidant activities of crude polysaccharides isolated from mushrooms[J]. Journal of Functional Foods, 2014, 11(21):548-556.
[21] 杨春瑜,杨春莉,刘海玲,等.乙酰化黑木耳多糖的制备及其抗氧化活性研究[J].食品工业科技,2015,36(23):105-110.
Acetylated modification and antioxidant activity of polysaccharides fromTricholomamatsutake
XU Tian-tian, CHEN Yi-yong*
(School of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500,China)
Polysaccharides fromTricholomamatsutake(TMP) was actylated by acetic anhydride, and its acetylated modification was studied. Effect of polysaccharides-to-acetic anhydride ratio, reaction time and reaction temperature on the substitution degree of actylated polysaccharides fromTricholomamatsutake(Ac-TMP) were investigated through the single factor experiment. The optimization of acetylation was obtained by response surface experiments with BoxBehnken design. Antioxidant activityinvitroof Ac-TMP was assessed by DPPH, hydroxyl and superoxide anion free radical scavenging assays. The optimal conditions were: polysaccharides-to-acetic anhydride ratio 1∶34.07(g∶mL), reaction time 2.8 h and reaction temperature 42.42 ℃.Under the above conditions, the degree of substitution was 0.587. Compared with TMP, scavenging capacities of Ac-TMP against hydroxyl free radicals and DPPH free radicals were reduced, but the scavenging capacity against superoxide anion free radicals was improved.
polysaccharides fromTricholomamatsutake; acetylation; response surface methodology; antioxidant activity
10.13995/j.cnki.11-1802/ts.201704026
本科生(陈义勇副教授为通讯作者,E-mai:chenyyxp@126.com)。
国家星火计划项目(No 2015GA690021)
2016-04-28,改回日期:2016-09-22
