超声预处理影响金枪鱼皮胶原酶解工艺及机理初探
2017-06-19黄丹丹马良韩霜杨晖张宇昊
黄丹丹,马良,2,韩霜,杨晖,张宇昊,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学,国家食品科学与工程实验教学中心,重庆,400715)
超声预处理影响金枪鱼皮胶原酶解工艺及机理初探
黄丹丹1,马良1,2,韩霜1,杨晖1,张宇昊1,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学,国家食品科学与工程实验教学中心,重庆,400715)
以金枪鱼皮为原料,研究超声时间、超声功率、超声料液比等因素对酶解效果的影响;并从鱼皮胶原结构和酶解液分子量分布的角度分析了超声预处理提高酶解效率的原因。结果表明,超声预处理时间为20 min、功率为30%(195 W)、料液比为1∶15(g∶mL)时,水解度(DH)可达14.89%,羟脯氨酸(Hyp)含量为0.046 g,比未处理组DH(4.90%)、Hyp含量(0.015 g)均有明显提高。傅里叶红外光谱(FTIR)结果表明超声通过断裂金枪鱼皮胶原蛋白氢键,松散三螺旋结构,利于蛋白酶与胶原三螺旋区内部酶切位点的接触从而提高酶解效率。酶解液分子量分布对比显示未处理组10 kDa以下小分子量占45.62%,超声预处理后为88.67%,提高了94.36%。因此超声预处理促进了胶原三螺旋区的活性肽段的释放,为金枪鱼皮胶原小分子活性肽的高效开发奠定基础。
超声;预处理;金枪鱼皮;酶解液
金枪鱼又称吞拿鱼、鲔鱼,是一种重要的世界经济鱼类,一般被加工成寿司、罐头等产品,加工过程产生的鱼皮、鱼鳞副产品富含胶原蛋白,但未得到充分利用,造成极大的资源浪费和环境污染。研究表明,胶原多肽具有多种生物活性功能,王雪芹[1]从鲐鱼胶原蛋白中提取的多肽具有抗氧化和抗疲劳功能,KATO等[2]从非洲鲫鱼鱼皮中提取的胶原多肽通过动物实验证明具有减脂作用,SAIGA等[3]提取的鸡肉胶原蛋白多肽和KIM等[4]从猪皮中提取的胶原多肽均具有抑制血管紧张素(ACE)转化的功能。多肽序列和氨基酸分析显示,这些生物活性肽均富含脯氨酸(Pro)或羟脯氨酸(Hyp),说明其主要来源于胶原蛋白三螺旋结构区域。但胶原蛋白的三螺旋结构异常稳定,很难被金属基质蛋白酶以外的商品蛋白酶降解。为了在酶解过程中可以更多地释放胶原蛋白三螺旋区的活性肽段,提高酶解效率,通常在胶原类物质酶解前对原料进行预处理以初步破坏三螺旋结构,暴露内部位点。热处理[5]、碱液处理[6]、酸液处理[7]等方法经常被采用,但这些处理过程繁琐,耗时长,因此亟需探索一些简单高效的预处理方式。
超声是一种绿色高效的加工方式,广泛应用于食品工业,它是通过在液体中产生空化作用,引起介质特性变化,具有高效、操作简单、技术易推广等优点。STEFANOVIC等[8]文章中指出超声预处理应用于不同蛋白,通过解旋蛋白肽链,可提高蛋白水解度和提高具ACE抑制活性多肽的释放。本课题组[9]研究了酸、碱、热、超声、超高压5种预处理对猪皮制备ACE抑制肽的影响,结果表明单纯的超声预处理对酶解过程具有一定的促进作用,能够破坏胶原蛋白结构,暴露三螺旋区酶切位点,提高酶解效率,促进三螺旋区的活性肽段释放,但提高程度有限。金枪鱼皮属于水产原料,其胶原结构不及哺乳动物胶原稳定,更容易被破坏。因此尽管单纯的超声预处理对于猪皮胶原多肽的酶解促进有限,但有可能高效地促进鱼皮胶原三螺旋区活性肽段的释放。
本实验通过超声对金枪鱼鱼皮进行预处理后再进行酶解,以水解度(DH)、Hyp含量为指标研究金枪鱼胶原酶解工艺的超声预处理条件,通过傅里叶红外光谱(FTIR)初步分析超声预处理金枪鱼皮蛋白二级结构的变化机理,高效液相色谱(high performance liquid chromatography,HPLC)分析超声预处理组金枪鱼皮酶解液中多肽的分子量分布情况,旨在考察超声预处理是否可有效促进金枪鱼皮胶原的酶解,释放胶原螺旋区多肽。
1 材料与方法
1.1 材料与仪器
金枪鱼鱼皮,山东中鲁远洋(烟台)食品有限公司;蛋白酶K(货号P6556;>30U/mg)、邻苯二甲醛(OPA)、N-乙酰半胱氨酸、细胞色素C、杆菌肽、L-谷胱甘肽,Sigma公司;牛血清蛋白,如吉生物试剂公司;抑肽酶,Amresco公司;乙腈、三氟乙酸为色谱纯,其余试剂均为分析纯。
PHS-25型数显酸度计,杭州雷磁分析仪器厂;SHZ-B水浴恒温振荡器,上海将任实验设备有限公司;5810型台式高速离心机,德国Eppendorf公司;KQ-100B型超声波清洗器,昆山市超声仪器有限公司;UV-2450紫外分光光度计、LC-20A高效液相色谱,日本岛津公司;Spectrum 100 红外光谱,美国PerkinElmer公司;JY92-IIN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 金枪鱼皮前处理
将鱼皮置于清水中清洗,去除可见脂肪及表面污物,刮去鱼鳞后,剪成1 cm×1 cm 的小块,保存于-20 ℃冰箱中,备用。
1.2.2 金枪鱼皮基本成分分析
鱼皮中水分的测定参照 GB5009.3—2010;灰分的测定参照 GB5009.4—2010;粗脂肪的测定参照GB/T14772—2008;蛋白质的测定参照GB5009.5—2010;鱼皮中羟脯氨酸含量的测定参照 GB/T 9695.23—2008,胶原蛋白的含量通过羟脯氨酸含量乘以转化系数11.1计算[10],结果如表1所示。

表1 金枪鱼皮基本成分
金枪鱼皮胶原蛋白含量为17.17%,占粗蛋白总量的81.45%,含量较高,是提取胶原多肽的良好材料。
1.2.3 酶的选择
从蛋白数据库(http://www.uniprot.org/)查得金枪鱼皮氨基酸序列,根据蛋白理论酶切资源库(http://web.expasy.org/peptide_cutter/)推荐能作用于金枪鱼皮的化学试剂及酶制剂进行理论水解度计算,结果显示蛋白酶K的理论水解度最高,为28.77%,其中三螺旋区酶切位点数为253,三螺旋区理论水解度达24.83%。蛋白酶K有很高的蛋白水解活性,适宜温度、pH范围广,酶解条件易于控制,酶切位点主要在脂肪族氨基酸和芳香族氨基酸。因此,本实验选择蛋白酶K作为酶制剂。
1.2.4 金枪鱼皮超声预处理
将保存于冰箱中的样品取出,室温下解冻,称取2 g鱼皮,加入0.1 mol/L pH 7.5的磷酸缓冲液,超声预处理(探头置于液面下1 cm左右,工作/间歇时间为5 s/10 s)后进行酶解。经测定,超声前后溶液pH不变,这与ULUKO[11]、JAMBRAK[12]等人研究结果一致,因此超声结束后不再调节pH。
1.2.5 酶解液的制备
金枪鱼皮经预处理后,按酶底比1 mg/g加入蛋白酶K,置于37 ℃水浴恒温振荡器中酶解2 h,90 ℃水浴15 min灭酶,冷却;6 000 r/min离心15 min,用0.45 μm滤膜过滤上清液,即为酶解液,一部分冷冻干燥制成冻干粉备用。未处理组不经超声预处理,其他条件与正交试验最优组一致。
1.2.6 水解度的测定
5 mmol/L OPA工作液的制备:由10 mL 50 mmol/L OPA溶液,10 mL 50 mmol/L NAC溶液,5 mL 20%(w/v)SDS溶液和75 mL 0.1 mol/L硼酸盐缓冲液(pH 9.4)配制而成,现配现用,注意避光。
取40 μL酶解液与4.8 mL 5 mmol/L OPA工作液于试管中,反应10 min后,于λ340 nm下测定吸光值。空白对照组除用水代替酶解液外,其他条件不变。水解度的计算公式(1)、(2)如下:
(1)
(2)
式中:n为水解液中断裂的肽键数;N为胶原蛋白理论肽键数;A340为样品在340nm处的吸光值;M为蛋白质的分子量,Da;d为稀释系数,根据使用的样品量进行计算;ε为340nm处消光系数(6 000mol·cm);c为蛋白质浓度,g/L。
1.2.7 羟脯氨酸的测定
样品羟脯氨酸含量测定参照GB/T 9695.23—2008,称取50 mg酶解液冻干粉,用5 mL硫酸于105 ℃水解样品,再进行过滤、稀释测得羟脯氨酸含量W。样品中羟脯氨酸的计算见公式(3):
(3)
式中:X为酶解液中羟脯氨酸质量,g;W为水解样中的羟脯氨酸含量,%;m为水解冻干粉的质量,g;V1为冷冻干燥酶解液体积,mL;V为酶解液总体积,mL。
1.2.8 金枪鱼皮超声预处理最佳水解条件的确定
以超声时间20、40、60、80 min,超声功率10%、20%、30%、40%(总功率为650 W),超声料液比(g∶mL)1∶5、1∶10、1∶15、1∶20进行单因素试验,研究不同超声预处理条件对金枪鱼皮水解度的影响。基于上述3个条件选取3个水平,依据L9(34)正交试验表设计正交试验,根据极差与方差分析结果确定最佳预处理条件。
1.2.9 金枪鱼皮胶原结构分析
将最佳预处理条件及未处理的金枪鱼皮冻干,再各取2 mg剪碎与溴化钾混合,研磨均匀,于60 ℃下烘干,取适量压片,使用Spectrum 100红外光谱仪进行扫描,扫描范围400~4 000 cm-1.,分辨率4 cm-1,扫描次数64次。
1.2.10 酶解物分子量分布测定
各取5 mg最佳水解条件及未处理组的酶解液冻干粉溶于2 mL流动相中,采用HPLC法分析水解液中多肽分子量分布情况。色谱柱:TSK gel G2000 SWXL凝胶色谱柱(7.8 mm×300 mm);流动相:30%乙腈(含0.1%(v/v)三氟乙酸);流速:0.5 mL/min等度洗脱;检测波长:220 nm;柱温:30 ℃;上样量:10 μL。
选用4种分子量标准多肽样品细胞色素C(Mw=12 384 Da)、抑肽酶(Mw=6 511.44 Da)、杆菌肽(Mw=1 422.69 Da)、谷胱甘肽(Mw=612.63 Da),其分子量的HPLC图谱如图1所示。
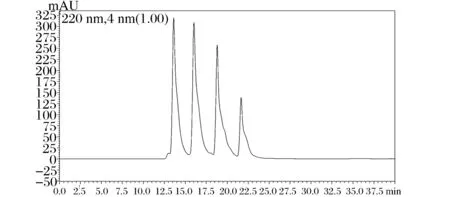
图1 标准样品的HPLC图谱Fig.1 HPLC spectrogram of standard sample
2 结果与分析
2.1 不同超声预处理条件对金枪鱼皮水解度的影响
2.1.1 超声时间对金枪鱼皮水解度的影响
超声功率为40%,料液比为1∶10,不同超声时间对金枪鱼皮水解度的影响如图2所示,与金枪鱼皮未处理组相比,不同超声时间(20、40、60和80 min)处理后酶解液DH、Hyp含量均显著升高(P<0.05),Hyp作为胶原蛋白三螺旋区的特征氨基酸,其在酶解液中的含量与DH变化趋势一致,说明超声预处理可促进蛋白酶K对胶原三螺旋区域的酶解。超声处理时间为40 min时,酶解液DH为14.25%,Hyp含量为0.039 g,二者均达到最大值。超声可以通过在溶液中产生的空化作用破坏鱼皮结构和化学键,疏松蛋白结构[13],促进酶解过程中鱼皮胶原酶切位点与蛋白酶K的结合;不同时间超声处理对酶解影响的差异可能主要与蛋白结构被破坏的程度以及酶切位点的暴露程度有关[14]。

图2 超声预处理时间对酶解金枪鱼皮水解度的影响Fig.2 Effects of ultrosound pretreament time on degree hydrolysate of tuna skin注:小写字母(abc)为DH的显著性分析结果(P<0.05);大写字母(ABC)为Hyp含量的显著性分析结果(P<0.05)(下同)
2.1.2 超声功率对金枪鱼皮水解度的影响
超声时间为40min,料液比(g∶mL)为1∶10,不同超声功率对金枪鱼皮水解度的影响如图3所示,结果表明随着超声功率的增大,金枪鱼皮酶解液DH和Hyp含量呈先上升后下降的趋势,当功率为30%(195 W)时,DH和Hyp含量最大,分别为14.80%和0.027 g。较低或较高的超声功率均会降低胶原蛋白三螺旋区的酶切位点的暴露程度。也就是说适当的超声功率可以更好的暴露胶原三螺旋区的位点,超声功率过大时,超声的空化效应和热效应强烈,反而不利于酶解反应效率的提高。这一变化趋势与HUANG[13]、吕鹏[15]、马海乐[16]等的报道一致。
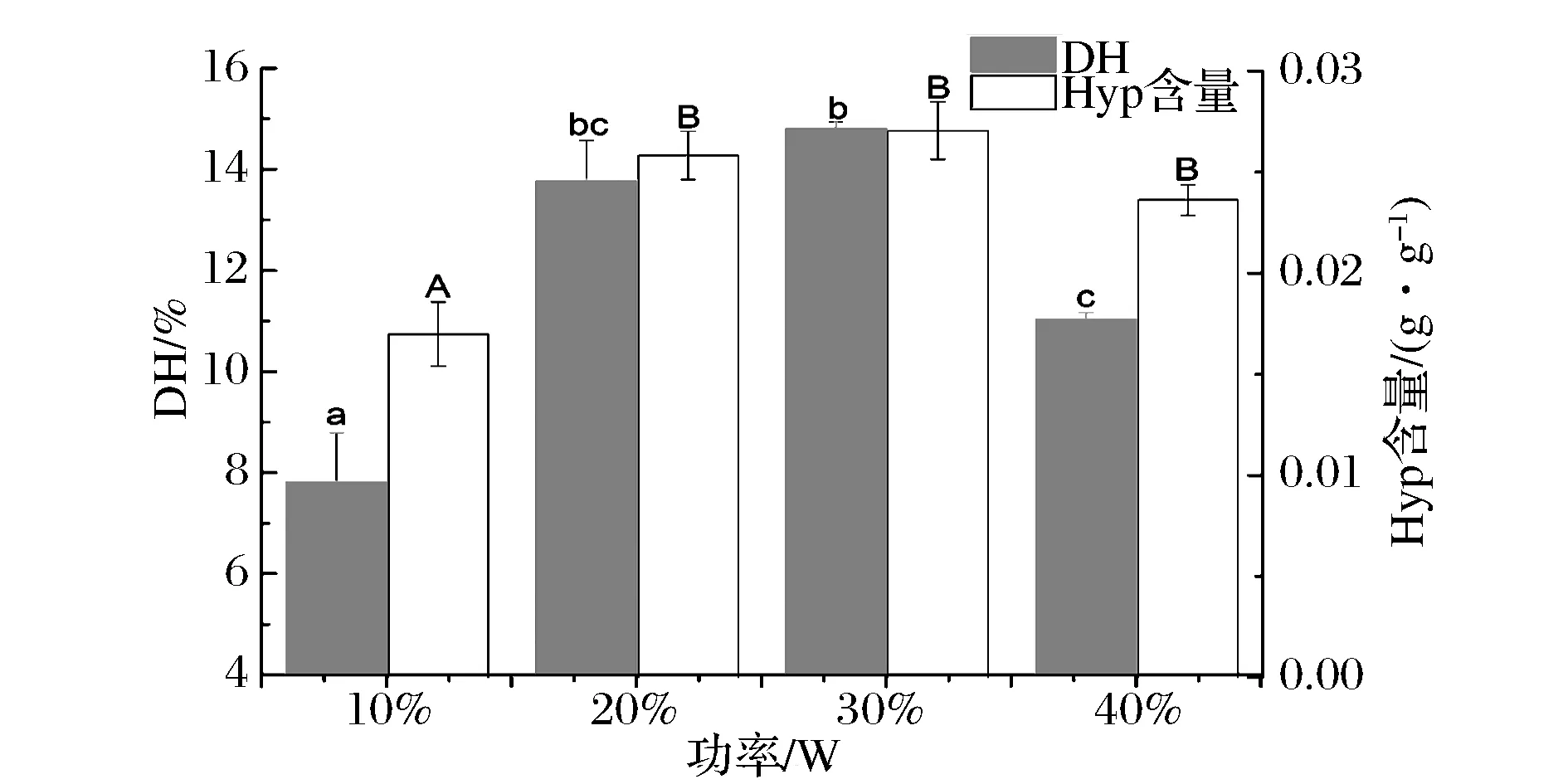
图3 超声预处理功率对酶解金枪鱼皮水解度的影响Fig.3 Effects of ultrosound pretreament power on degree hydrolysate of tuna skin
2.1.3 超声料液比对水解度的影响
超声功率为30%,超声时间为40 min,不同料液比对金枪鱼皮水解度的影响如图4所示,随着超声液料比逐渐增大,金枪鱼皮酶解液DH和Hyp含量呈先上升后下降的趋势,当料液比(g∶mL)为1∶15时,DH为14.13%,Hyp含量为0.027 g。研究[17]指出超声波产生的空化作用与黏度系数有很大关系,黏滞系数大的液体难以产生空化泡,而且传播过程中损失也大,因此较低的液料比不利于空化泡的传递;但料液比过高,因为总体积的增加,可能会降低空化作用的效果,导致酶解效率的降低[18]。因此,选择合适料液比才有利于超声破坏金枪鱼皮胶原、松散三螺旋结构,使蛋白酶K更易接触胶原结构内部酶切位点。
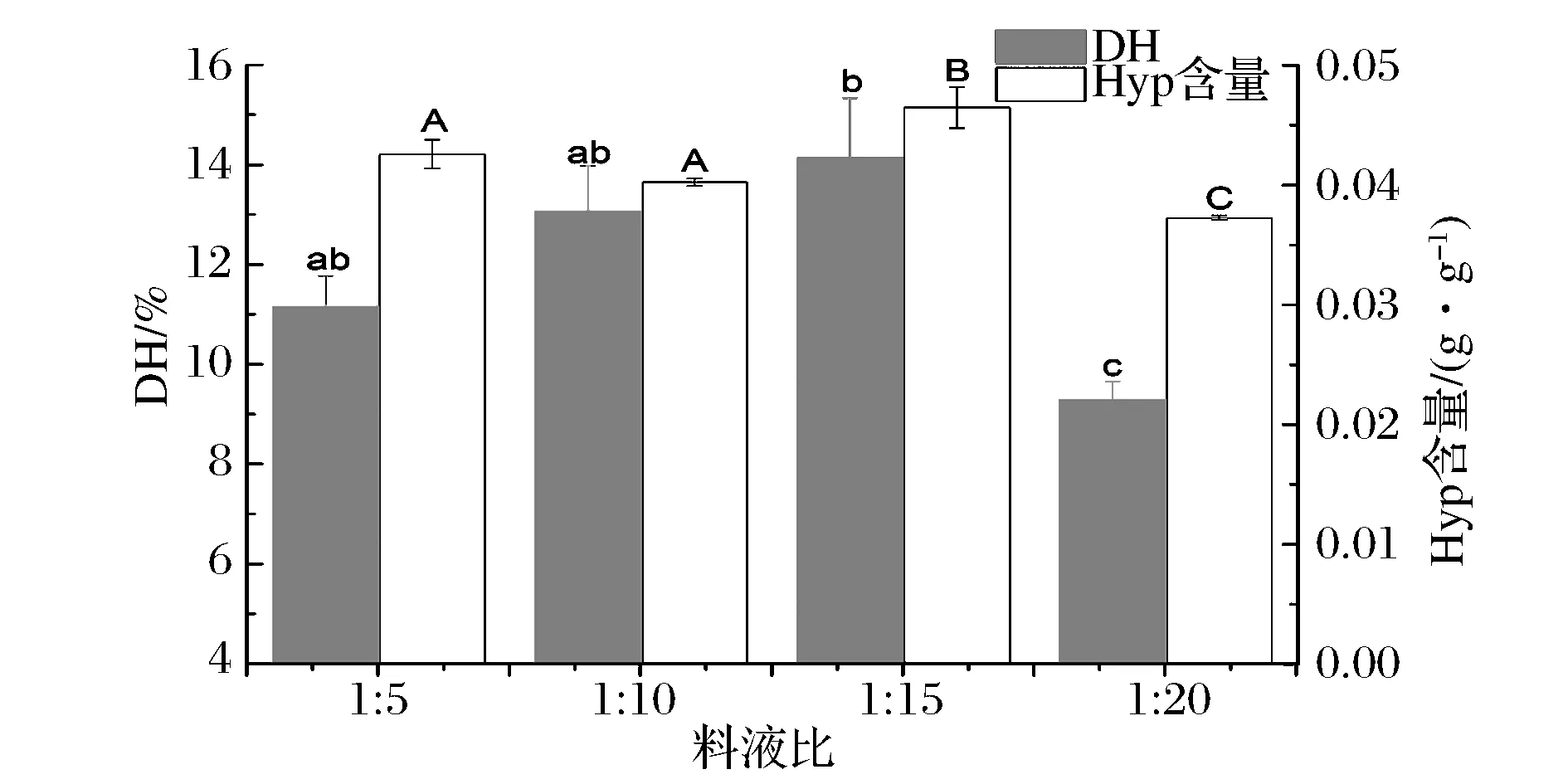
图4 超声预处理料液比对酶解金枪鱼皮水解度的影响Fig.4 Effects of ultrosound pretreamentsolid-liquid ratio on degree hydrolysate of tuna skin
2.2 金枪鱼皮超声预处理的最佳水解条件
为确定超声波预处理对制备金枪鱼皮酶解液的最佳工艺条件,在单因素试验的基础上,选择超声预处理时间、功率和料液比进行3因素3水平L9(33)正交试验。结果如表2所示。
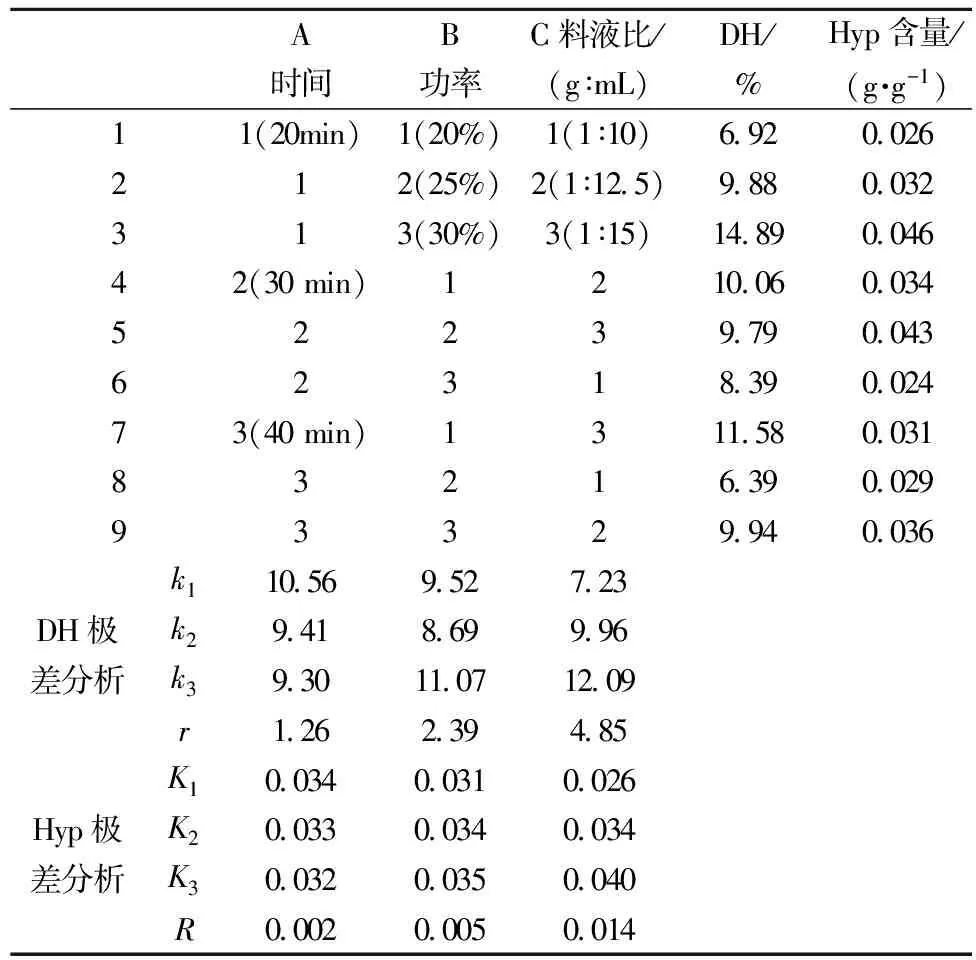
表2 超声预处理优化酶解金枪鱼工艺的L9(33)正交试验结果
由表2可知,超声料液比对酶解液DH值和Hyp含量影响最大,其次是超声功率,超声时间对酶解液DH和Hyp含量影响最小(C>B>A),正交试验最优组合为A1B3C3,即超声处理时间30min,超声功率为30%,料液比(g∶mL)为1∶15。在这种超声预处理条件下,酶解液DH值和Hyp含量均为最大值,说明超声预处理能有效地破坏金枪鱼皮胶原蛋白构象,暴露三螺旋区酶切位点,提高酶解过程金枪鱼皮水解度和三螺旋区活性肽段的释放效率。
2.3 FTIR分析超声预处理金枪鱼皮胶原结构的变化
采用傅里叶红外光谱分析预处理后鱼皮胶原蛋白的结构变化,结果如图5所示。
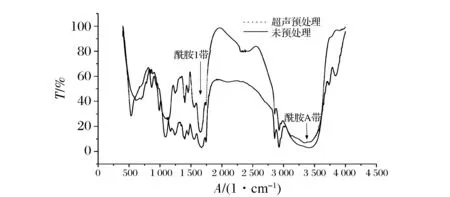
图5 超声预处理鱼皮与未处理鱼皮结构分析Fig.5 The infrared spectrogram of tuna skin collagen that treated with and without ultrasonic
酰胺A带(3 400~3 440 cm-1)是N—H或O—H伸缩振动的吸收峰,由图5可知,超声处理组酰胺A带蓝移,这是由于超声破坏胶原蛋白分子间的氢键,N—H基团的分子肽段参与了氢键形成;酰胺I带(1 600~1 700cm-1)是氨基酸残基CO伸缩振动吸收峰,主要表征了胶原三螺旋结构的二级结构,对其进行高斯拟合分析(图6),结果(表3)表明超声预处理后鱼皮结构α螺旋含量降低,降幅为49.36%,无规则卷曲含量上升了45.63%,β折叠含量无明显变化,β转角含量略有上升,这与刘斌等人[19]研究的超声处理使牛血清蛋白α螺旋降低及胡爱军等人[20]研究的超声使鱼肉蛋白结构由α螺旋向无规则卷曲变化趋势一致。这是因为超声破坏了蛋白的网络结构,使氢键断裂,紧密的α螺旋结构变为较为伸展的无规则卷曲结构,在这一过程中,胶原三螺旋区的位点被更多的暴露,提高酶解过程中DH和胶原三螺旋区活性肽段释放效率。
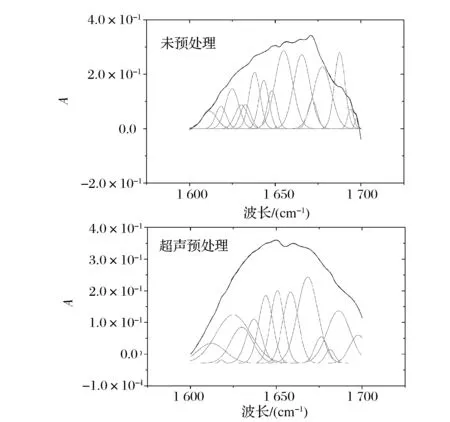
图6 酰胺I带的曲线拟合Fig.6 Curvefitted results of amideⅠbands

β折叠/%无规则卷曲/%α螺旋/%β转角/%未处理29009111611816141669超声预处理3070816254922243816
2.4 HPLC法分析多肽分子量分布
如图7所示,超声预处理组主要为小分子物质,经计算10 kDa以下分子量超声处理组含量为88.67%,未处理组为46.39%,近代研究表明[21],分子量分布与肽的活性密切相关,与蛋白质相比,小分子肽更易消化吸收,具有抗肿瘤、抗氧化、降血压等多重生物活性功能。金枪鱼皮经超声预处理后,酶解过程可释放更多来源于三螺旋区的小分子多肽,这些多肽富含Hyp和Pro,可能具有多种功能活性。因此,超声预处理可以作为金枪鱼皮胶原肽制备的有效前处理手段。
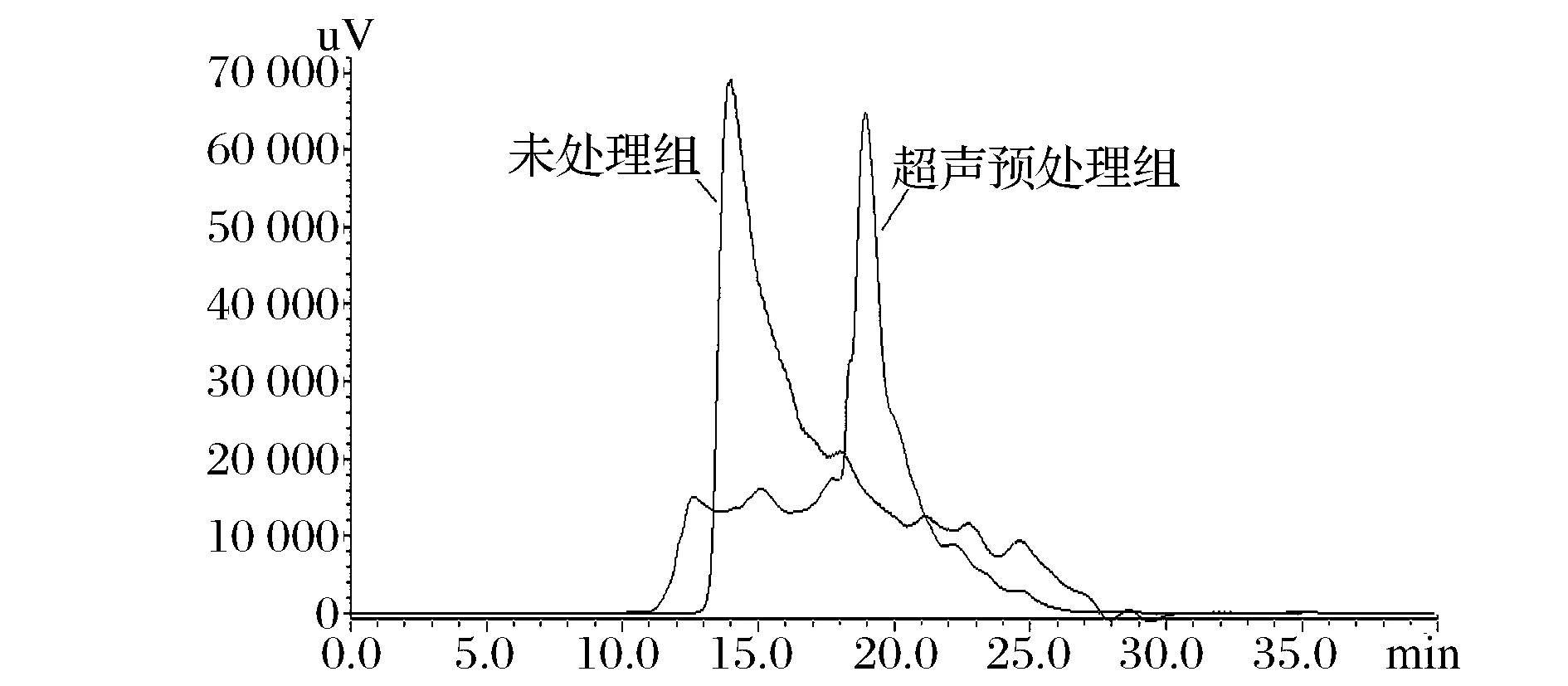
图7 超声预处理与未预处理金枪鱼皮酶解液多肽分子量分布Fig.7 Peptide molecular weight distribution of hydrolysate tuna skin with and without ultrasonic
3 结论
单因素和正交试验对金枪鱼皮酶解液制备的研究表明,当超声时间为20 min、超声功率30%(195 W)、料液比(g∶mL)为1∶15时,酶解液DH为14.89%,Hyp含量为0.046 g;而未处理鱼皮酶解液DH和Hyp含量分别为4.90%和0.015 g,说明超声预处理对蛋白酶K酶解金枪鱼皮有明显的促进作用,可显著提高酶解液DH和三螺旋区Hyp的释放。
FTIR分析蛋白二级结构表明超声预处理破坏了金枪鱼皮胶原蛋白构象,松散了三螺旋结构,利于蛋白酶K作用酶切位点,使酶解过程更有效进行;超声预处理后酶解液主要为小分子多肽,与未处理组相比小分子含量提高了94.36%,因此酶解液中潜藏多种生物活性功能多肽。超声预处理可显著提高酶解效果,释放大量源于三螺旋区的小分子多肽,为金枪鱼皮胶原多肽的高效制备以及进一步提取制备生物活性肽奠定了理论基础。
[1] 王雪芹.鲐鱼多肽的抗氧化活性与抗疲劳作用研究[D].青岛:中国科学院研究生院(海洋研究所),2014.
[2] KATO S,MATSUI H,SAITOH Y,et al.Fish collagen-containing drink is subcutaneously absorbed and attenuates the UVA-induced tissue-integrity destruction and DNA damages in 3D-human skin tissue model[J].Journal of Functional Foods,2011,3(1):50-55.
[3] SAIFA A I,IWAI K,HAYAKAWA T,et al.Angiotensin I-converting enzyme-inhibitory peptides obtained from chicken collagen hydrolysate[J].Journal of Agricultural and Food Chemistry,2008,56(20):9 586-9 591.
[4] KIM S K,BYUN H G,PARK P J,et al.Angiotensin I converting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry,2001,49(6):2 992-2 997.
[5] HIMAYA S W A,NGO D H,RYU B M,et al.An active peptide purified from gastrointestinal enzyme hydrolysate of Pacific cod skin gelatin attenuates angiotensin-1 converting enzyme (ACE) activity and cellular oxidative stress[J].Food Chemistry,2012,132(4): 1 872-1 882.
[6] 李幸,赵玲,刘淇,等.不同预处理真鳕鱼皮胶原蛋白肽的比较[J].农产品加工(学刊),2014(3):9-11;14.
[7] 闵建华. 蚕蛹蛋白活性多肽的酶法制备[D].西安:陕西师范大学,2009.
[8] STEFANOVIC A B, JOVANOVIC J R, GRBAVCIC S Z, et al. Impact of ultrasound on egg white proteins as a pretreatment for functional hydrolysates production[J]. European Food Research and Technology,2014,239(6): 979-993.
[9] 黄丹丹,马良,蔡路昀,等.预处理对酶解过程中胶原ACE抑制肽释放的影响[J].现代食品科技,2016,32(7):85-90.
[10] 张华. 比目鱼皮抗氧化肽的制备及分离纯化[D].天津:天津大学,2013.
[11] ULUKO H, ZHANG Shu-wen, LIU Lu, et al. Effects of microwave and ultrasound pretreatments on enzymolysis of milk protein concentrate with different enzymes[J]. International Journal of Food Science & Technology, 2013, 48(11): 2 250-2 257.
[12] JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J]. Journal of Food Engineering, 2008, 86(2): 281-287.
[13] HUANG L, LIU B, MA H, et al. Combined effect of ultrasound and enzymatic treatments on production of ACE inhibitory peptides from wheat germ protein[J]. Journal of Food Processing and Preservation, 2014, 38(4): 1 632-1 640.
[14] 丁青芝,马海乐,骆琳,等.超声处理对菜籽蛋白酶解效果的影响[J].农业工程学报,2009,25(1):294-299.
[15] 吕鹏, 庄重, 凌建亚,等.超声对酶的影响[J].生物技术通讯, 2004,15(5):534-536.
[16] 马海乐,耿静静,骆琳,等.超声波预处理对燕麦蛋白制备ACE抑制肽的影响[J].农业机械学报,2010,41(9):133-137.
[17] 陈辉,强颖怀,葛长路.超声波空化及其应用[J]. 新技术新工艺,2005(7):63-65.
[18] 王希搏.鱼鳞有机酸钙、胶原蛋白及胶原多肽联产工艺与工厂设计[D].武汉:华中农业大学,2013.
[19] 刘斌,马海乐,李树君,等.应用FTIR研究超声对牛血清白蛋白二级结构的影响[J].光谱学与光谱分析,2010,30(8):2072-2076.
[20] 胡爱军,卢秀丽,郑捷,等.超声处理对鲢鱼鱼肉蛋白结构的影响[J].现代食品科技,2012,28(8):894-897.
[21] 李莹.泥鳅蛋白源ACE抑制肽的酶法制备及其降压活性研究[D].南京:南京农业大学,2012.
The effect of ultrasonic pretreatment on hydrolysate of Tuna skin and study on its mechanism
HUANG Dan-dan1, MA Liang1,2, HAN Shuang1, YANG Hui1, ZHANG Yu-hao1,2*
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
Using tuna skin as raw materials, the effects of ultrasonic time, ultrasonic power, and ultrasonic solid-liquid ratio on hydrolysate were studied. The collagen structure of tuna skin and the molecular weight of hydrolysate were determined to explain the reason why ultrasonic could improve hydrolysis. The results showed that when the ultrasonic time was 20 min, ultrasonic power was 30%(195 W), ultrasonic solid-liquid ratio was 1∶15, the hydrolysis degree was up to 14.89%, hydroxyproline content was 0.046 g, which were significantly higher than those in the group without pretreatment .The results of FTIR showed that ultrasonic could break the structure of collagen efficiently. The peptides less than 10 kDa in ultrasonic pretreatment group accounted for 88.67%, while those in group without pretreatment accounted for 45.62%. Ultrasonic Pretreatment promote release of active peptide from triple helical of collagen, which has important implication for the further preparation and application of active peptides.
ultrasonic; pretreatment; tuna skin; hydrolysate
10.13995/j.cnki.11-1802/ts.201704022
在读硕士研究生(张宇昊教授为通讯作者,E-mail:zhy1203@163.com)。
重庆市研究生科研创新项目(CYS2015075);国家自然科学基金项目(31301425);中央高校基本科研业务费重大项目(XDJK2015A015);中国博士后科学基金面上项目(2014M562267);中国博士后科学基金特别资助项目(2015T80951);重庆市基础科学与前沿技术研究重点项目(cstc2015jcyjBX0116);第四批重庆市高等学校优秀人才支持计划
2016-10-21,改回日期:2016-11-10
