混合糖发酵产油脂酵母菌的筛选及脂肪酸组成分析
2017-06-19张艳平白新鹏郭书贤王冬梅
张艳平, 白新鹏, 郭书贤, 王冬梅
1(海南大学 食品学院,海南 海口,570100) 2(南阳理工学院 生物与化学工程学院, 河南 南阳,473000) 3(南阳市工业微生物重点实验室,河南 南阳,473000)
混合糖发酵产油脂酵母菌的筛选及脂肪酸组成分析
张艳平1, 白新鹏1, 郭书贤2,3*, 王冬梅2,3
1(海南大学 食品学院,海南 海口,570100) 2(南阳理工学院 生物与化学工程学院, 河南 南阳,473000) 3(南阳市工业微生物重点实验室,河南 南阳,473000)
从海南土壤中分离的12株野生酵母菌株中,筛选到一株能够利用混合糖发酵高产油脂的酵母菌株YP-32,在葡萄糖∶木糖(质量比)为2∶1条件下发酵120 h,生物量、油脂产量和油脂含量达到最大,分别为22.33 g/L、13.39 g/L和60.42%;该菌株利用5种不同比例混合糖产油脂的脂肪酸组成均以C16和C18系脂肪酸为主,其中油酸含量最高,其次为棕榈酸和硬脂酸,这3种脂肪酸含量占总脂肪酸含量的90%以上,与植物油脂脂肪酸组成相似,可以作为生物柴油油源。通过形态特征及26S rDNA D1/D2和ITS区域序列分析,初步鉴定菌株YP-32为油脂酵母属的Lipomycesorientalis,为我国分布新纪录。
产油脂酵母菌;筛选;混合糖发酵;脂肪酸组成;鉴定;海南省
微生物油脂是继植物油脂、动物油脂之后又一可开发利用新油脂资源[1-3]。微生物油脂除可替代动植物油脂生产食用油脂外,还可作为生物柴油的替代原料[4-5]。与传统的植物油脂获取方法相比较,微生物油脂的诸多优点[6]使其有广阔的工业化应用前景[7-8]。
目前,霉菌和酵母是较为理想的产油脂微生物,尤其产油脂酵母得到了广泛地研究,主要集中在3个方面:(1)产油酵母的选育,包括野生产油脂酵母的分离筛选及菌株的诱变[9-11]。这些研究多集中在以葡萄糖为碳源对菌种进行选育,不利于微生物油脂的工业化生产。(2)发酵条件的优化,影响微生物油脂合成的因素主要包括:碳源、碳氮比、pH值、接种量、培养时间等[12]。李静[13]通过摇瓶培养考察了6种金属离子(Mg2+、Ca2+、Fe3+、Zn2+、Mn2+、Cu2+)对斯达油脂酵母(Lipomycesstarkeyi1809)生长和油脂蓄积的影响,研究发现当培养基中缺失Mg2+或Fe3+或Zn2+明显抑制菌体生长和油脂积累。(3)利用多种有机质类物质作为碳源考察微生物的产油脂特性,如玉米和小麦秸秆、甘蔗渣、工业废水等。孙军德[14]以玉米秸秆的酸水解液为基质,利用弯隐球酵母(Cryptococcusalbidun)发酵产油脂,菌体生物量达到8.91g/L,油脂得率达到11.63%;YU等[15]用小麦秸秆的稀酸水解液进行酵母发酵产油,油脂含量为33.5%;王华等[16]以啤酒废水为底物利用Lipomycesstarkeyi发酵产油脂,菌体生物量为12.28 g/L,油脂含量为35.80%。这些研究为资源的利用和能源的再生奠定了基础。
木质纤维素是我国最丰富的可再生资源,充分水解可得到同时含有葡萄糖和木糖等单糖的混合糖[17]。利用木质纤维素水解液作为底物生产生物燃料和生物产品具有重要的经济和环境意义[18]。然而,大多数微生物对木质纤维素水解液利用效率较低,这是由于微生物对五碳糖不能利用或利用率较低,使得木质纤维素资源化为生物产品存在较大困难[19-20]。因此,筛选获得在混合糖条件下高产油脂的微生物菌株已成为微生物油脂技术领域的重要课题之一,我国学者在这方面也取得了不少研究成果[17,21-22]。本文通过对海南土壤中分离的产油脂酵母的筛选,以期得到能够利用混合糖(葡萄糖和木糖)的高产油脂酵母菌株,并通过高产油脂菌株以不同配比的混合糖为碳源所产油脂的脂肪酸组成分析,为利用混合糖及木质纤维素水解液发酵法生产微生物油脂提供依据和基础。
1 材料与方法
1.1 菌株
从海南省土壤中分离获得12株产油脂酵母菌株,菌株信息见表1。
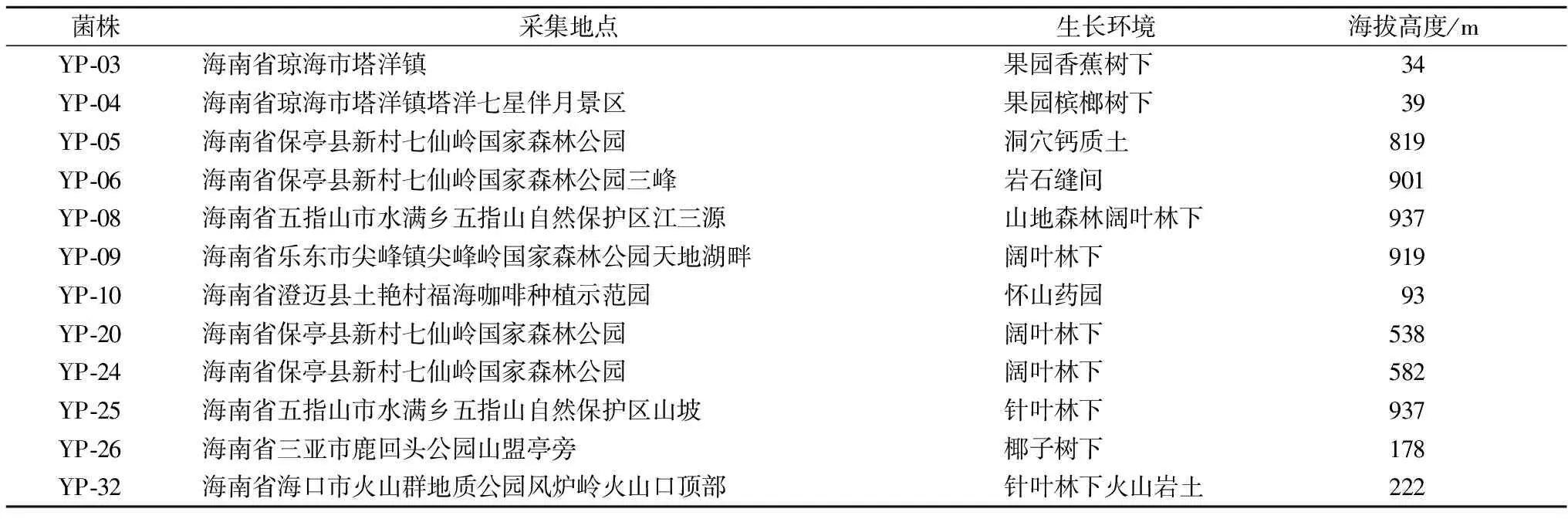
表1 菌株信息
1.2 试剂与仪器
葡萄糖、木糖、酵母粉、蛋白胨、琼脂、玉米粉琼脂、(NH4)2SO4、KH2PO4、MgSO4·7H2O、香兰素、98%浓硫酸、85%磷酸、95%乙醇。
电热恒温培养箱(101-2A)、数显恒温摇床(HZQ-B)、立式压力蒸汽灭菌锅(LDZX-50FB)、电子精密天平(FA1004)、pH数字酸度计(PHS-3C)、电子恒温水浴锅、紫外可见分光光度计(752N)、电脑型生物显微镜(XSP-13CC)、超净工作台(SW-CJ-2G)、大型全温摇床(HZQ-B)、气相色谱仪(Agilent Technologies 7890A),液相色谱仪(Aglient 1100)。
1.3 培养基
① YEPD平板、斜面保藏培养基:葡萄糖 20.0 g,酵母粉10.0 g,蛋白胨 10.0 g,琼脂 15.0 g,蒸馏水1 000 mL,pH 6.5。
② 液体种子培养基:葡萄糖 20.0 g,酵母粉10.0 g,蛋白胨 10.0 g,蒸馏水 1 000 mL,pH 6.5。
③ 产孢子培养基:玉米粉琼脂22 g,蒸馏水1 000 mL,pH 6.0。
④ 限氮发酵培养基:葡萄糖70.0 g,酵母粉0.5 g,(NH4)2SO42.0 g,KH2PO41.0 g,MgSO4·7H2O 0.5 g,蒸馏水1 000 mL,pH 5.8~6.0。
1.4 实验方法
1.4.1 培养方法
① 斜面培养:将保藏的菌株划线接种至YEPD固体斜面培养基,28 ℃恒温箱中培养3 d。
② 摇瓶种子培养:活化后的菌株接两环于液体种子培养基中,120 r/min,28 ℃恒温摇床培养3 d。
③ 摇瓶发酵培养:取种子培养液,按10%接种量接种于限氮发酵培养基中,28 ℃,140 r/min培养120 h。
1.4.2 测定方法
(1)菌体生物量的测定:采用干重法[23]测定菌体生物量。
(2)油脂的测定:单糖初筛时油脂的测定采用磷酸香草醛显色法[24],混合糖复筛时油脂的测定采用酸热法[21]。
(3)计算公式:
细胞干重/(g·L-1)=(管与干重的总质量-空管质量)×1000/V
(1)
发酵液油脂含量/(g·L-1)=提取油脂的质量/量取发酵液体积
(2)
菌体油脂含量/%=提取油脂的质量/发酵液生物量
(3)
油脂系数/(g·L-1)=油脂产量/耗糖量×100
(4)
(4)葡萄糖和木糖含量测定:利用液相色谱仪进行葡萄糖和木糖含量测定[25]。
色谱柱:Eclipse XDB-C18(150 mm×4.6 mm,5.0 μm),流动相:水,柱温:65 ℃,检测器池温:40 ℃,流速:0.5 mL/min,进样体积:20 μL,工作站:Agilent Rev.B.02.01。
(5)脂肪酸组成分析:样品甲酯化[26],利用气相色谱仪进行脂肪酸组成分析。
色谱柱条件:为 TM 石英毛细管柱(25 m×0.25 mm×0.25 μm);柱温:175 ℃;气化温度:280 ℃;进样量:0.3~0.5 μL;检测器温度:270 ℃,工作站:Agilent Chemstation B.03。
1.4.3 形态学观察
参照THE YEASTS,A TAXONOMIC STUDY[27](第五版)对菌株进行形态特征观察。
1.4.4 分子生物学鉴定
将目标菌株进行26S rDNA D1/D2区和ITS序列的分子生物学鉴定。
基因扩增:20 μL反应体系,纯化的PCR产物1 μL,BigDye 8 μL,引物1 μL,灭菌去离子水10 μL。反应条件:96 ℃ 1 min,25个循环(96 ℃ 10 s,50 ℃ 5 s,60 ℃ 4 min),72 ℃延伸10 min。由PCR产物电泳结果切割所需DNA目的条带,所得PCR 扩增原液经过DNA胶回收试剂盒(SK1131)回收纯化,电泳再次检测后通过自动测序仪得到供试菌株PCR扩增片段的原始序列。将测序结果用Chromas参照正反序列图谱人工校对。用校正后的序列在GenBank数据库中进行同源序列搜索(BLAST),根据同源序列搜索结果采用Clustal X1.83进行序列比对,采用Mega 4.1软件构件系统树,发育树的生成采用neighbor-joining法。依据系统发育树,并结合形态学特征确定其种类。
2 结果与分析
2.1 菌株利用单糖产油脂的筛选
将12株从海南省土壤中分离得到的野生酵母菌株分别以葡萄糖、木糖为碳源的摇瓶培养120 h,各菌株产油脂能力见表1。
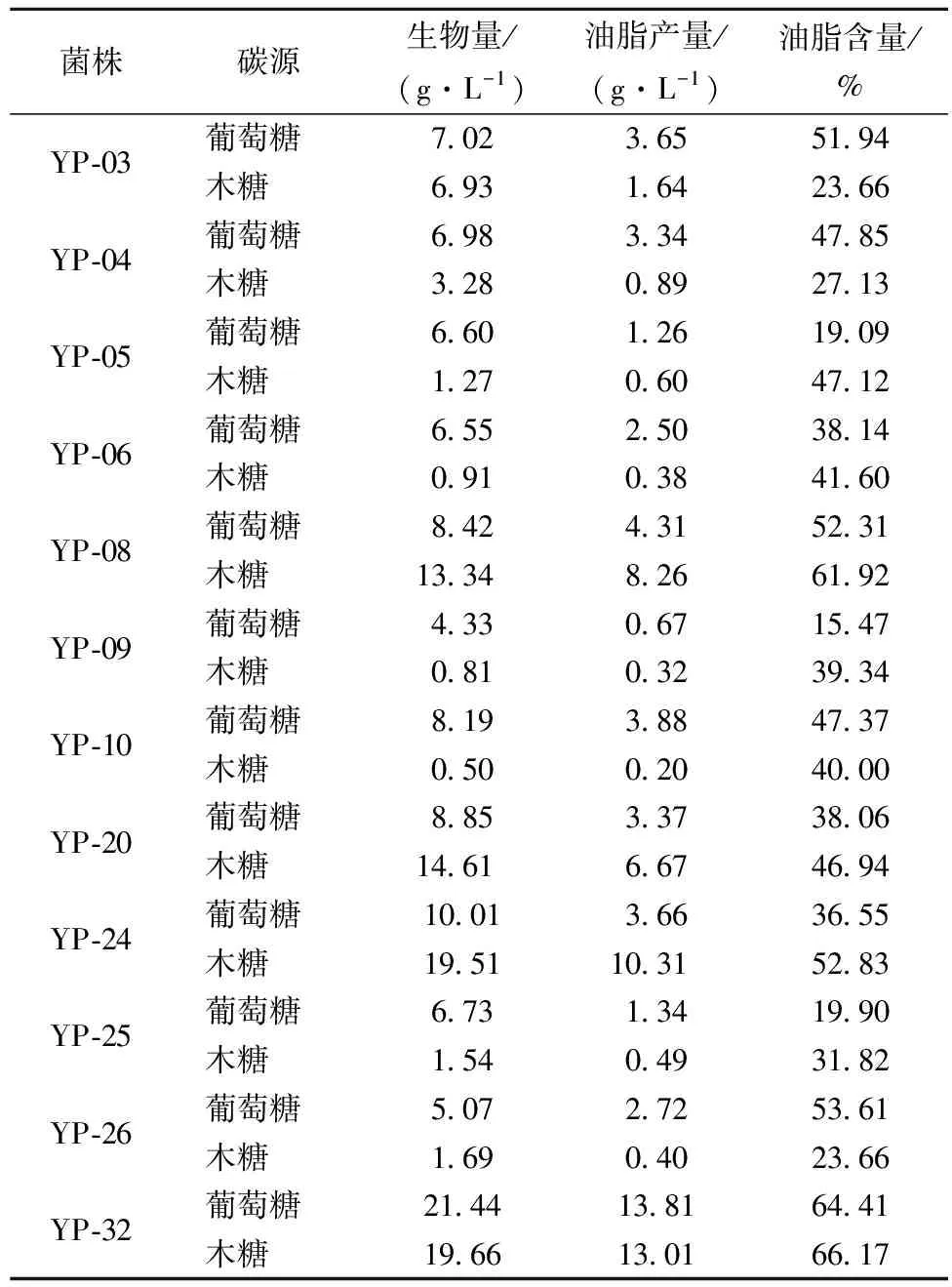
表1 菌株单糖发酵产油脂能力
从表1中可以看出,其中YP-08、YP-20、YP-24、YP-32这4株酵母菌株产油脂能力较好,均可利用葡萄糖和木糖进行发酵产油脂,其余8株菌株利用木糖发酵产油脂能力较差。就生物量而言,菌株YP-32最高,YP-24次之,YP-08和YP-20最差;就油脂产量和油脂含量而言,菌株YP-32最高,YP-08次之,YP-20和YP-24最差。菌株YP-08、YP-20和YP-24利用木糖产油脂能力高于葡萄糖;菌株YP-32利用葡萄糖和木糖产油脂能力差别较小,生物量、油脂产量和油脂含量均分别达到19 g/L、13 g/L和64%以上。
2.2 菌株利用混合糖产油脂能力的筛选
将YP-08、YP-20、YP-24、YP-32这4株菌株以3种比例混合糖(葡萄糖∶木糖分别为2∶1,1∶1,1∶2)为碳源进行摇瓶培养120 h,各菌株的产油脂能力见表2。
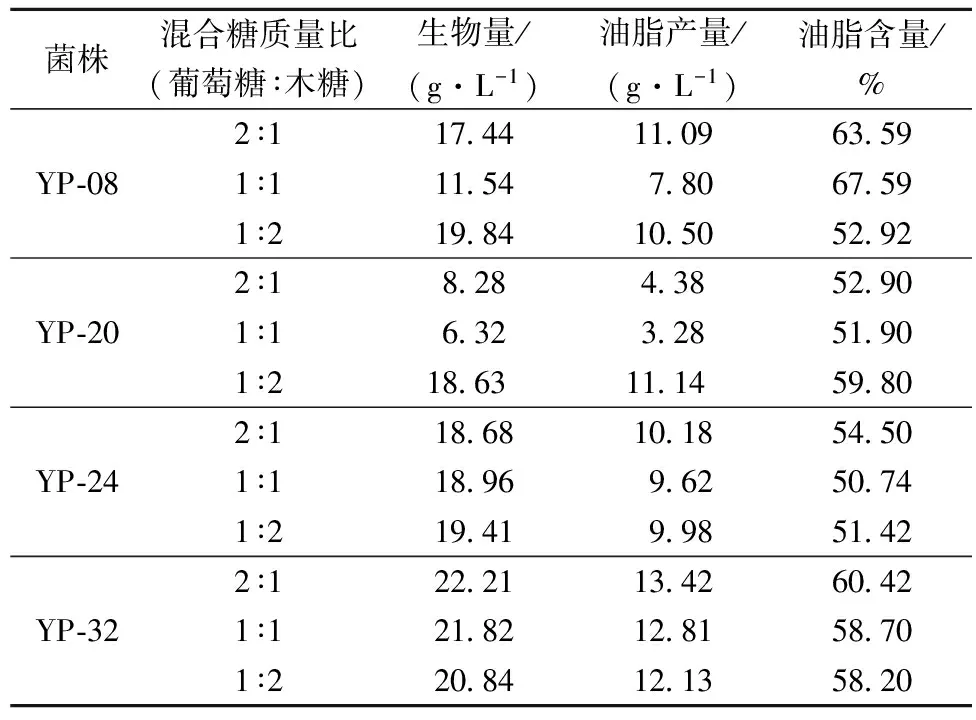
表2 菌株混合糖发酵产油脂能力
从表2中可知,4株酵母菌株均可利用混合糖进行发酵产油脂,其中菌株YP-08、YP-32和 YP-24利用混合糖发酵产油脂能力较高,菌株YP-20较差。菌株YP-08和YP-24在混合糖质量比例为2∶1时产油脂能力最高,1∶2时次之,1∶1时最差;菌株YP-32在混合糖比例为2∶1时产油脂能力最高,1∶2时最差;就油脂含量而言,菌株YP-08高于菌株YP-32,但综合生物量、油脂产量和油脂含量来看,菌株YP-32利用混合糖产油脂能力最好,其中在混合糖比例为2∶1时,菌株YP-32产油脂能力最高,生物量、油脂产量和油脂含量分别达到22.21 g/L、13.39 g/L和 60.42%。
通过对12株野生酵母菌株在利用单糖和混合糖进行发酵产油脂能力进行综合比较分析可以看出,菌株YP-32在单糖和混合糖中产油脂能力均最强,为本文筛选出的目标菌株。
2.3 菌株YP-32利用混合糖发酵产油脂分析
2.3.1 发酵过程中残糖变化
菌株YP-32在以混合糖为碳源的限氮发酵培养基中发酵培养,每隔24 h采样离心后,测定发酵上清液中葡萄糖和木糖含量,结果见图1。

图1 菌株YP-32混合糖(葡萄糖和木糖)发酵残糖变化曲线Fig.1 The residual sugar curve of strain YP-32 with mixed sugar fermentation注:“G”代表葡萄糖,“X”代表木糖
由图1可以看出,当碳源为单糖时,两种培养基中单糖的浓度随时间逐渐减少,发酵144 h,葡萄糖培养基中的单糖已消耗完全,而木糖培养基中的单糖含量为2.22 g/L。当碳源为混合糖时,发酵初始,培养基中葡萄糖首先被消耗,此时木糖的利用量很少;发酵96 h,葡萄糖消耗完全,此时木糖利用的速率开始增大;发酵144 h,木糖的含量接近零。发酵结束时,培养基中的碳源均被完全利用,这说明菌株YP-32对葡萄糖和木糖的利用效果较好,但对葡萄糖和木糖的利用是非同步的。
2.3.2 产油脂能力的比较
菌株YP-32在限氮培养基中发酵培养120 h,测定计算出该菌株的生物量、油脂产量、油脂含量、油脂系数等指标结果见表3,图2为发酵后菌体细胞和脂肪球形态。
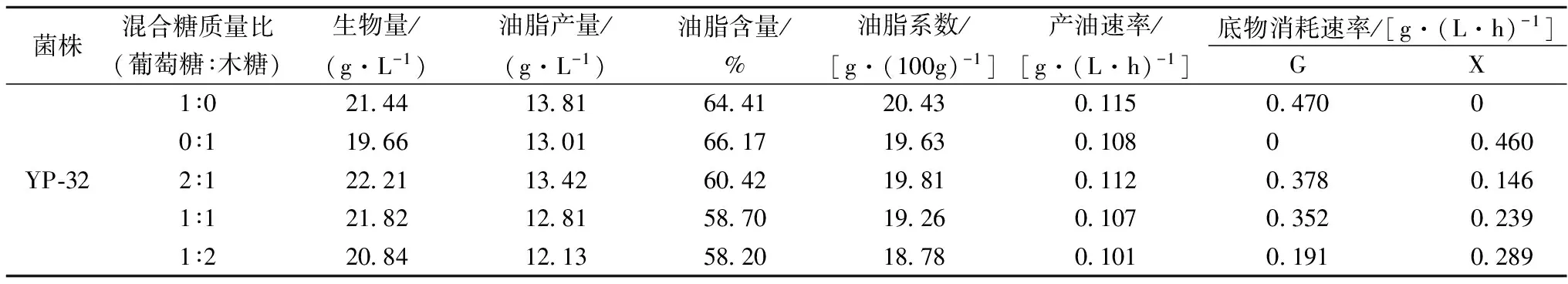
表3 菌株YP-32混合糖发酵产油脂能力比较
由表3可知,当碳源为单糖(葡萄糖或木糖)时,生物量、油脂产量、油脂含量和油脂系数差别不大;当碳源为混合糖(葡萄糖与木糖不同比例)时,其油脂含量和油脂系数相比于单糖时均有微小的下降;随着木糖含量的增加,菌体的生物量,油脂产量,油脂含量和油脂系数有所下降。当碳源为单糖时,葡萄糖和木糖的消耗速率接近,分别为0.470 g/(L·h)和0.460 g/(L·h);当碳源为混合糖时,葡萄糖消耗速率高于木糖,随着葡萄糖比例的减少,葡萄糖消耗速率逐渐降低,木糖消耗速率逐渐增加,这说明菌株YP-32利用混合糖中葡萄糖和木糖是非同步的;以产油脂速率来看,碳源为葡萄糖时,产油速率最大达到0.115 g/(L·h);碳源为混合糖时,葡萄糖∶木糖(质量比)为2∶1时,产油脂速率达到0.112 g/(L·h),略低于碳源为葡萄糖时的产油脂速率,且随着木糖含量的增加,产油脂速率有微小的下降。
从图2中可以看出,当碳源为葡萄糖及葡萄糖∶木糖(质量比)为2∶1的混合糖时,菌体细胞和脂肪球最大;增加木糖比例,菌体细胞和脂肪球较小。
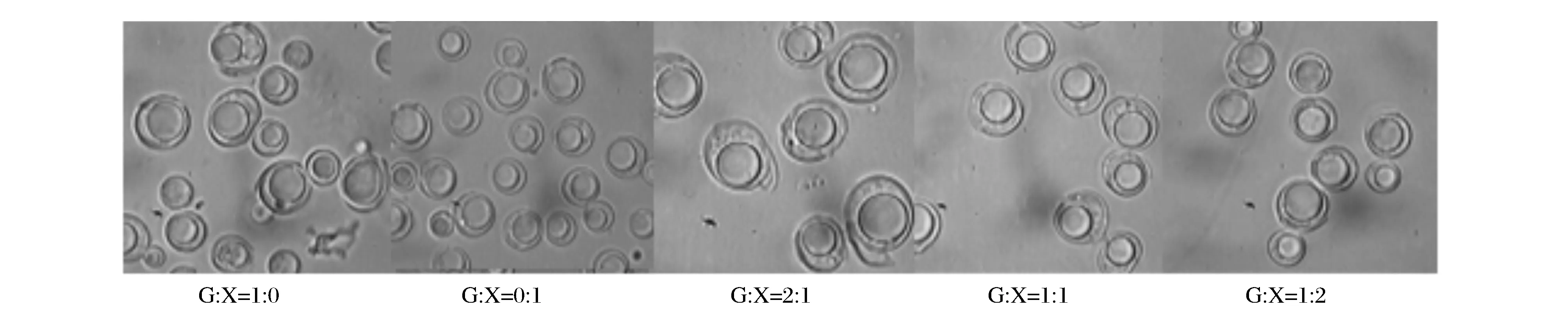
图2 菌株YP-32混合糖发酵细胞及脂肪球形态Fig.2 Cell morphology and lipid globule of strain YP-32 after fermentation with mixed sugar注:“G”代表葡萄糖,“X”代表木糖
2.4 油脂脂肪酸组成分析
菌株YP-32分别以葡萄糖、木糖和混合糖为碳源的限氮发酵培养基进行发酵120 h,用酸热法提取油脂,分析脂肪酸组成,结果如表4。

表4 菌株YP-32产油脂的脂肪酸组成分析
注:-表示未检出。
从表4中可以看出,菌株YP-32以5种不同比例的葡萄糖、木糖为碳源产油脂的脂肪酸组成相似,均以C16和C18系脂肪酸为主,且均以油酸为主,其次为棕榈酸和硬脂酸,且这3种脂肪酸占总脂肪酸含量的90%以上。从不饱和脂肪酸所占比例来看,碳源为木糖时,不饱和脂肪酸含量所占比例最高,达到48.29%,其次为混合糖质量比例为1∶2;混合糖比例为2∶1和1∶1时,两者的不饱和脂肪酸含量最低。
2.5 菌株YP-32形态学特征
参照The yeasts,a taxonomic study第五版对菌株YP-32进行形态学观察,结果见图3。在YEPD液体培养基中,25 ℃培养3 d镜检,细胞呈圆形或椭圆形,细胞大小为(2.5~9.0 μm)×(3.0~9.9 μm),可观察到脂肪球颗粒,有性繁殖形成子囊孢子,孢子为椭圆体,数量从1到4不等。在YEPD固体平板上,菌落形态为圆形,表面光滑、湿润、粘稠,不透明。

图3 菌株YP-32菌体细胞及子囊孢子Fig.3 Morphology and ascospore of strain YP-32
2.6 菌株YP-32分子生物学鉴定
菌株YP-32的26S rDNA D1/D2和ITS区域序列长度分别为588 bp和514 bp。将菌株YP-32的26S rDNA D1/D2和ITS区域序列与GenBank数据库中的序列进行同源性比较,该菌株与Lipomyces orientalis的26S rDNA D1/D2和ITS序列相似性均达到99%。从系统发育树图4可以看出,菌株YP-32在26S rDNA D1/D2和ITS发育树上与Lipomyces orientalis处于同一分枝聚为一群,表明菌株YP-32 与Lipomyces orientalis的亲缘关系最近,为我国分部新纪录。

图4 菌株YP-32 26S rDNA D1/D2和ITS区域序列系统发育树Fig.4 Phylogenetic tree of 26S rDNA D1/D2 and ITS domain sequence of strain YP-32
3 讨论
(1)孔祥莉等[13]在研究斯达氏油脂酵母Lipomycesstarkeyi利用混合糖发酵产油脂的特性的过程中发现Lipomycesstarkeyi利用木糖发酵产油脂能力与葡萄糖相当;HU等[9]研究了皮状丝孢酵母Trichosporoncutaneum在混合糖条件下对葡萄糖和木糖利用情况,结果表明增加木糖比例,产油脂能力有微小的下降;本文中的菌株YP-32在混合糖条件发酵培养的过程中利用木糖的产油脂能力微小于葡萄糖,与HU研究结果相一致;以上菌株均在葡萄糖∶木糖(质量比)为2∶1发酵120 h,产油脂能力达到最高,菌株YP-32油脂产量和油脂含量分别为13.42g/L和60.42%,均高于同条件下的Lipomycesstarkeyi和Trichosporoncutaneum的产油能力,这说明目标菌株YP-32能够高效地利用混合糖为碳源发酵产油脂。
(2)HU等[9]研究了Trichosporoncutaneum在以5种比例的混合糖为碳源条件下发酵产油脂脂肪酸的组成情况,油脂脂肪酸组成均以棕榈酸为主,其次为油酸和硬脂酸,其中油酸含量在混合糖比例为1∶2时最高为39.0%,不饱和脂肪酸种类较为单一;本文菌株YP-32的油脂中脂肪酸以油酸为主,在木糖为碳源条件下最高达到48.29%,其次为棕榈酸和硬脂酸,不饱和脂肪酸种类较多。Trichosporoncutaneum油脂不饱和脂肪酸比例在葡萄糖∶木糖为1∶2和1∶0条件下分别达到最高和最低,分别为39.6%和32.3%;菌株YP-32在混合糖比例0∶1和1∶1条件下不饱和脂肪酸比例达到最大和最小,分别为48.29%和44.84%。
4 结论
(1)从海南土壤中分离的12株野生酵母菌株中筛选得到1株能够利用混合糖(葡萄糖、木糖)发酵高产油脂的酵母菌株YP-32,该菌株在3种比例混合糖(葡萄糖∶木糖(质量比)为2∶1,1∶1,1∶2)条件下产油脂能力均较好,其中在葡萄糖∶木糖为2∶1产油脂能力最好,发酵120 h的生物量、油脂产量和油脂含量分别为22.21 g/L和13.42 g/L和60.42%。
(2)菌株YP-32以5种比例的混合糖为碳源发酵产油脂脂肪酸组成相似,均以C16和C18系脂肪酸为主,其中油酸含量最高,其次为棕榈酸和硬脂酸,且这3种脂肪酸含量占90%以上。
(3)通过形态特征和26S rDNA D1/D2和ITS区域序列分析,初步鉴定菌株YP-32为Lipomycesorientalis,为我国分布新纪录。
[1] 薛飞燕,张栩,谭天伟.微生物油脂的研究进展及展望[J].生物加工过程,2005,3(1):23-27.
[2] 贾彬,王亚南,何蔚红,等.生物柴油新原料-微生物油脂[J].生物技术通报,2014(1):19-26.
[3] RATLEDGE C,WYNN J P.The biochemisty and molecular biology of lipid accumulation in oleaginous microorganisms[J].Adv Appl Microbiol,2002,2(51):1-51.
[4] RATLEDGE C.Microorganisms for lipids[J].Acta Biotechnol,1991,11(5):429-438.
[5] 赵宗宝.加快微生物油脂研究为生物柴油产业提供廉价原料[J].中国生物工程杂志,2005,25(2):8-11.
[6] LUQUE R,LOVEET J C,DATTA B,et al.Biodiesel as feasible petrol fuel replacement:a multidisciplinary overview[J].Energy &Environmental Science,2010,3(11):1 706-1 721.
[7] 刘波,孙艳,刘永红,等.产油微生物油脂生物合成与代谢调控研究进展[J].微生物学报,2005,45(1):153-155.
[8] Li Qiang,Du Wei,Liu De-hua.Perspectives of microbial oils for biodiesel production[J].Applied Microbiology and Biotechnology, 2008,80(5):749-756.
[9] 许振杰,胡容,李珍,等.高产油脂红酵母的选育及培养条件优化[J].食品科学,2011,32(11):209-215.
[10] 李艾,郝玉芹.产油脂酵母菌株的筛选及发酵条件的初步研究[J].唐山学院学报,2014,27(3):87-90.
[11] 孔凡敏.产油脂酵母菌株的选育[D].泰安:山东农业大学,2010.
[12] 石婷婷.产油脂微生物菌株的选育[D].济南:山东轻工业学院,2012.
[13] 李静.金属离子对斯达油脂酵母发酵产油脂的影响[D].杨凌:西北农林科技大学,2010.
[14] 孙军德,杨冉.产油酵母菌的筛选及其利用玉米秸秆发酵产油研究[J].沈阳农业大学学报,2010,41(3):335-338.
[15] YU Xiao-chen,ZHENG Yu-bin,DORGAN K M,et al.Oil production by oleaginous yeasts using the hydrolysate from pretreatment of wheat straw with dilute sulfuric acid.Bioresource Technology, 2011,102(10):6 134-6 140.
[16] 王华,刘欢,郭书贤,等.啤酒生产废水培养斯达油脂酵母发酵产油脂培养基的优化[J].中国油脂,2011,36(8):31-36.
[17] HU Cui-min,WU Si-guo,WANG Qian,et al.Simultaneous utilization of glucose and xylose for lipid production by Trichosporon cutaneum[J].Biotechnlogy for Biofuels,2011,4(25):2-8.
[18] 黄超.基于木质纤维素水解液的发酵性丝孢酵母发酵产油脂的研究[D].广州:华南理工大学,2011.
[19] RUBIN E M.Genomics of cellulosic biofuels[J]. Nature, 2008, 454(7206):841-845.
[20] ZALDIVAR J,NIELSEN J,OLSSON L.Fuel ethanol production from lignocelluloses:a change for metabolic engineering and process integration[J].Applied Microbiology and Biotechnology,2001,56(1):17-34.
[21] 孔祥利.斯达氏油脂酵母2#利用葡萄糖和木糖混合发酵产油脂的研究[D].大连:辽宁师范大学,2007.
[22] 宋兆齐,王莉,梁峰.混合糖发酵产油脂酵母菌的筛选[J].中国酿造,2012,31(6):65-68.
[23] 曲威,刘波,吕建州,等.高产油脂斯达油脂酵母菌株的选育及摇瓶发酵条件的初步研究[J].辽宁师范大学学报(自然科学版): 2006, 29(1): 88-92.
[24] 胡元维,任路静,张丽,等.基于微孔板比色法的微生物胞内油脂快速检测方法的建立及应用[J].中国油脂,2013,38(7):89-94.
[25] 孙守兵.高效液相色谱法测定转化糖电解质注射液中果糖和葡萄糖的含量[J].中国新药与临床志,2010,29(12):916-918.
[26] 赵永芳.生物化学技术原理及其应用[M].武汉大学出版社,1988.
[27] KURTZMAN C P,Fell J W, BOEKHOUT T.The yeasts, a taxonomic study,5th edition[M].Amsterdam: Elsevier Science Publishers B.V, 2011:554-555.
Screening of oil-producing yeast strains by co-fermentation of glucose and xylose and lipid-acid component analysis
ZHANG Yan-ping1, BAI Xin-peng1, GUO Shu-xian2,3*, WANG Dong-mei2,3
1(School of Food, Hainan University, Haikou 570100,China) 2(School of Biological and Chemical Engineering, Nanyang Institute of Technology, Nanyang 473000, China) 3(Key Laboratory for Industrial Microbiology of Nanyang City, Nanyang 473000, China)
In this paper, the strain YP-32 which could use mixed sugar of glucose and xylose as carbon source to produce lipid were screened from 12 wild yeast strains from the soil of Hainan province. The biomass, lipid concentration and lipid content of the strain reached 22.33 g/L, 13.39 g/L and 60.42% respectively by fermenting with 2∶1 of glucose and xylose as carbon source. Simultaneously, lipid-acid component was analyzed. There was almost no difference in lipid-acids component by using different mixed sugar ratios as carbon source. Results showed that C16 and C18 series were main fatty acids. Oleic acid content was the highest, palmitic acid and stearic acid were next in all samples and the sum of them accounted for over 90% of total content of lipid acids. The lipid component of this strain was similar to plant oil and could be used as biodiesel source. The strain was primarily identified asLipomycesorientalisby the morphology feature, 26S rDNA D1/D2 and ITS domain sequence analysis. The strain is a new record for distribution in our country.
oleaginous yeast; screening; mixed sugar fermentation; lipid-acid component; identification; Hainan province
10.13995/j.cnki.11-1802/ts.201704006
硕士研究生(郭书贤教授为通讯作者,E-mail: guoshux@163.com)。
河南省基础与前沿技术项目(132300410087);河南省基础与前沿技术研究项目(102300410059)
2016-09-12,改回日期:2017-01-04
