植物乳杆菌SCP53生物膜的形成条件
2017-06-19张国丽彭瑶魏露余茜敖晓琳刘书亮赵珂
张国丽,彭瑶,魏露,余茜,敖晓琳*,刘书亮,赵珂
1(四川农业大学 食品学院,四川 雅安,625000) 2(四川农业大学 资源环境学院,四川 成都,611100)
植物乳杆菌SCP53生物膜的形成条件
张国丽1,彭瑶1,魏露1,余茜1,敖晓琳1*,刘书亮1,赵珂2
1(四川农业大学 食品学院,四川 雅安,625000) 2(四川农业大学 资源环境学院,四川 成都,611100)
研究了不同状态下植物乳杆菌SPC53生物膜形成能力的情况。通过改变其生长的环境条件与营养状况,采用结晶紫染色法和扫描电镜(scanning electron microscope,SEM)观察,定量及定性分析其生物膜的形成。结果表明:接种量5×107CFU/mL,培养时间36 h,培养温度42 ℃,pH值5.8是植物乳杆菌SCP53生物膜形成的最适培养条件,在MRS肉汤中依次添加200 mg/mL NaCl、75 mg/mL葡萄糖、7.5 mg/mL果胶、75 mg/mL全脂乳粉,可以促进植物乳杆菌生物膜的形成,形成后的生物膜A490值为4.492 3。对照组A490值为0.136 5,扫描电镜结果显示生物膜与浮游菌体有明显差异。
植物乳杆菌;生物膜;形成条件;扫描电镜
1978年美国学者COSTERTON[1-2]提出了Biofilm这一专有名词,它主要是由细菌细胞(附着于生物或者非生物实体表面)和包裹着细菌的水合性基质所组成。当细菌受到各种胁迫,如营养缺乏或营养过剩,低pH值,高渗透压,抗菌剂和抗生素等,在这些不利的环境下,大量的细菌通过自身合成的水合多聚物黏附在固体表面,以固着的方式生长从而形成生物膜。这是细菌所具有的一种非常重要的环境适应机制[3]。
生物膜在食品加工与安全领域具有重要的研究价值[4]。食品工业的原料、食品加工机械表面和管道内以及生产环境中很容易出现生物膜,生物膜的特殊结构可以使其耐受消毒剂的作用而得以残存,进而再次污染食品,若病原菌残存,会造成极大的食品安全隐患。另一方面,生物膜的形成能促进有益微生物对不利环境的适应能力,使其具有良好的稳定性[5],从而可以解决发酵剂在食品中不稳定的问题。如果利用微生物生物膜有利于抵抗环境胁迫压力,同时可增强种群间的交流合作并影响菌体的行为与代谢这一优势,通过调控生物膜的形成促进有益微生物聚集,可以提高发酵菌种稳定性与活力,改善发酵食品品质。
植物乳杆菌作为发酵食品中应用非常广泛的发酵菌种,研究其生物膜形成特性以及后续研究对发酵食品高效、安全的生产具有重要的指导意义。本实验室前期从泡菜样品中分离出1株能发酵产生良好泡菜风味的植物乳杆菌,研究其生物膜形成条件,旨在为其后续在发酵食品中的加工利用提供理论基础。
1 材料与方法
1.1 材料与试剂
菌种:植物乳杆菌(LactobacillusplantarumSCP53,NCBI登录号:AB617650)。
MRS肉汤、结晶紫、乳酸、柠檬酸、胰蛋白胨、(NH4)2SO4、CaCl2、NaCl、FeCl2、CuSO4等试剂均为国产分析纯,果胶、明胶、全脂乳粉等均为市售。
1.2 仪器与设备
3001型酶标仪,Thermo Scientific公司;BPC-250F生化培养箱,上海一恒科学仪器有限公司;DHG-9245A电热鼓风干燥箱,上海一恒科学仪器有限公司;SW-CJ-1F超净操作台,SYQ-DSX-280B压力蒸汽灭菌锅,上海申安医疗器械厂;PHS-4C+酸度计,成都世纪方舟科技有限公司;D2KW-5-4电热恒温水浴锅,北京市永光明医疗仪器有限公司;96孔细胞培养板,Haimen Boyang仪器设备公司;EVO18扫描电镜,Carl Zeiss公司。
1.3 实验方法
1.3.1 生物膜形成菌株的制备
将活化好的植物乳杆菌接入供试培养基,培养基成分及培养条件根据单因素及正交实验在MRS肉汤培养基基础上调整。观察不同条件对植物乳杆菌生物膜形成的影响。
1.3.2 植物乳杆菌生物膜形成的半定量测定
将按比例接种菌株的不同培养基振荡摇匀后按照每孔200 μL的添加量添加到96孔板中,在一定温度下培养,以相应等体积空白培养基作为阴性对照。培养结束后将培养液倒出,每孔加入200~300 μL无菌水清除结合不紧密的游离菌体,自然风干后每孔加入0.5%结晶紫染液50 μL,染色30 min后倒掉染液,每孔加入250 μL无菌水洗涤3次。将孔板倒置,风干。然后用酶标仪在490 nm处检测OD值。以A490值定量生物膜形成量,A490≤0.17时表明无生物膜形成,A490>0.34时表明生物膜大量形成[6]。
1.3.3 植物乳杆菌生物膜形态观察
将约1 cm×1 cm经过70%酒精浸泡、清洁的盖玻片置于优化后的培养基中,在最佳培养条件下让植物乳杆菌自然黏附聚集在玻片上,培养完成之后取出玻片,置于2%戊二醛磷酸缓冲液中,于4 ℃冰箱中固定过夜,次日以磷酸缓冲液冲洗,分别用40%、70%、90%、100%的乙醇依次脱水,每次15 min。脱水后,用醋酸戊酯置换乙醇,再进行干燥、镀金及扫描电镜观察[7]。以MRS肉汤培养基37 ℃下培养36 h作为对照。观察最佳营养条件及培养条件下生物膜的形成情况。
1.3.4 培养条件对植物乳杆菌生物膜形成的影响
1.3.4.1 单因素试验
接种量:按照1.3.1的方法,同时参考任晓镤[8]的方法以5×1010、1×1010、5×109、1×109、5×108、1×108、5×107、1×107CFU/mL接种植物乳杆菌至MRS肉汤培养基,在37 ℃下培养24 h,取出后按照1.3.2的方法测定生物膜形成量。
培养时间:根据不同接种量试验结果,选取最佳接种浓度接种植物乳杆菌至MRS肉汤培养基中,参照任晓镤[8]的方法在37 ℃下培养12、24、36、48、60、72 h,取出后按照1.3.2的方法测定生物膜形成量。
温度:选取最佳接种浓度接种植物乳杆菌至MRS肉汤培养基中,参照任晓镤[8]的方法分别于8、16、20、28、37、42 ℃培养,培养时间依据前期实验结果,取出后按照1.3.2的方法测定生物膜形成量。
pH值:选取最佳接种浓度接种植物乳杆菌至pH值分别为2.8、3.8、4.8、5.8、6.8、7.8、8.8、9.8的MRS肉汤培养基[8],培养温度和时间依据前期实验结果,取出后按照1.3.2测定生物膜形成量。
1.3.4.2 正交实验设计
根据单因素试验结果,选择培养温度、培养时间、培养基pH值、接种量4个因素中合适的水平进行正交试验,以植物乳杆菌生物膜形成量作为主要考察指标,确定培养条件。

表1 培养条件正交因素水平表
1.3.5 营养条件对生物膜形成的影响
在MRS肉汤中按不同比例替换或添加不同物质,改变营养状况,以MRS肉汤作为对照组,实验结果以相对成膜量分析不同物质对其生物膜形成的影响,培养条件采用1.3.4方法中所得的最适培养条件。

(1)
1.3.5.1 单因素试验
酸类物质:对食品中常用的酸类物质乳酸和柠檬酸进行初筛,添加量均为100 mg/mL;最后选取对生物膜形成影响较大的柠檬酸进行试验,考察添加量分别为25、50、75、100、125、150、175、200 mg/mL的培养基对植物乳杆菌生物膜形成的影响[9]。
碳源类物质:对葡萄糖、乳糖、淀粉进行初筛,添加量均为100 mg/mL;最后选取对生物膜形成影响较大的葡萄糖进行试验,考察添加量为25、50、75、100、125、150、175、200 mg/mL的培养基对植物乳杆菌生物膜形成的影响[10]。
氮源类物质:对胰蛋白胨/硫酸铵/乳粉(酪蛋白)进行初筛,添加量均为100 mg/mL;最后选取对生物膜形成影响较大的乳粉进行试验,考察添加量为25、50、75、100、125、150、175、200 mg/mL的培养基对植物乳杆菌生物膜形成的影响。
金属离子:对常见的金属离子Fe2+/Cu2+/Ca2+/Na+进行初筛,添加量均为100 mg/mL;最后选取对生物膜形成影响较大的Na+进行试验,考察添加量(以NaCl计)为25、50、75、100、125、150、175、200 mg/mL的培养基对植物乳杆菌生物膜形成的影响。
增稠剂:对食品加工中常用的增稠剂果胶、明胶进行初筛,添加量均为10 mg/mL;最后选取对生物膜形成影响较大的果胶进行试验,考察添加量为2.5、5.0、7.5、10、12.5、15 mg/mL[9]。
1.3.5.2 正交试验
根据单因素试验结果,选择NaCl、葡萄糖、果胶、乳粉4个对植物乳杆菌生物膜影响较大的因素进行正交试验,以植物乳杆菌生物膜相对形成量作为主要考察指标,确定培养条件。

表2 营养条件正交因素水平表
1.4 数据分析
采用EXCEL2010、SPSS19.0数据分析统计软件对所得数据进行统计与分析。
2 结果与分析
2.1 不同培养条件对植物乳杆菌生物膜形成的影响
2.1.1 接种量对生物膜形成的影响
不同接种量对生物膜形成能力的影响如图1所示。不同接种量水平下所测OD值均小于0.17,说明只改变接种量不能明显促进植物乳杆菌生物膜的形成。接种量为5×107CFU/mL时OD值有最大值,表明该接种量下植物乳杆菌长势最佳。接种量的大小会对细菌生长产生影响,接种量较大时菌体因缺乏营养物质,不能良好生长,接种量过小则可能会导致延滞期增长,细菌总数过小,为促进菌体聚集,选择5×107CFU/mL作为后续实验接种量。

图1 37 ℃下不同接种量植物乳杆菌生物膜的形成能力Fig.1 Lactobacillus plantarum biofilm formation with different inoculum ratio at 37 ℃(不同小写字母代表差异显著,P<0.05)
2.1.2 时间对生物膜形成的影响
生物膜的形成涉及几个明显的阶段:起始的附着、细胞与细胞之间的吸附与增殖、生物膜的成熟及最后细菌的脱离过程等5个阶段[6,11]。本研究中植物乳杆菌SCP53也同样具有明显的几个生物膜形成过程,如图2所示。生物膜形成前期可能由于附着能力不强,容易被洗脱,形成后期由于其脱离解聚等原因导致成膜量也较低。生物膜在36 h处于成熟时期,具有最大的成膜量,其形成量与其他几个时间段具有显著性差异(P<0.05)。
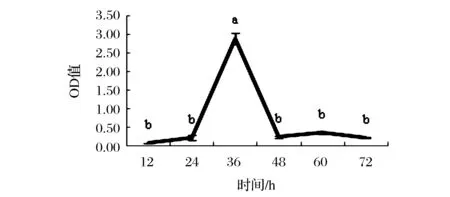
图2 培养时间对生物膜形成能力的影响Fig.2 Lactobacillus plantarum biofilm formation for different time(不同小写字母代表差异显著,P<0.05)
2.1.3 温度对生物膜形成的影响
从图3看出,植物乳杆菌生物膜形成量在不同温度下呈现较大起伏。成膜量较高的有3处,分别在37、20和42 ℃。37 ℃一般为乳酸菌的最适培养温度,而温度极低如8 ℃时,菌体生长受抑制,数量过小,可能不利于聚集成膜,所以二者间成膜量有显著性差异(P<0.05)。42 ℃为适宜的高温胁迫,20 ℃为适宜的低温胁迫,温度的胁迫可能对生物膜形成相关基因的表达等造成影响,促进生物膜形成。高温胁迫较之低温胁迫下生物膜的形成量更多,可能因为低温胁迫下,温度过低,不利于菌体的生长,导致菌体数量累积不够,难以形成较为紧密的生物膜,在受到外力时极易被破坏。

图3 不同温度下培养24 h植物乳杆菌生物膜形成能力Fig.3 Lactobacillus plantarum biofilm formation with different temperature for 24 h(不同小写字母代表差异显著,P<0.05)
2.1.4 不同pH值对生物膜形成的影响
不同pH值对生物膜形成的影响如图4所示。

图4 不同环境pH值对生物膜形成能力的影响Fig.4 Lactobacillus plantarum biofilm formation in different pH(不同小写字母代表差异显著,P<0.05)
在pH值小于3.8以及大于6.8时,植物乳杆菌生物膜的形成能力明显降低,在pH值5.8处有最大成膜量。微生物生长有其最适的pH值范围,pH值过高或过低都不利于其生长,会导致其生长速率过慢,菌体数量过低,难以聚集成膜。虽然较低的pH值可能会胁迫诱导生物膜的形成,但是同时菌体的生长也同样受到抑制,可能在二者的相互作用下最后表现出反促进作用。PAVONI等也提到[12],随pH值增加,由于胞外聚合物的电离官能团增加,絮凝作用增强,但当pH值超过一定范围后絮凝作用下降,生物膜的形成能力随之下降。
2.1.5 培养条件正交实验结果
进行4因素3水平的正交试验,以OD值为评定指标,利用极差分析法对其结果进行极差分析,得出各因素的最佳组合。由表3中可以看出,4个因素中对植物乳杆菌生物膜形成影响的主次顺序为A>B>D>C,即温度时间>接种量>pH值,得出最佳的组合水平为A1B2C2D2,即培养温度42 ℃,培养时间36h,pH值5.8,接种量5×107CFU/mL。

表3 培养条件正交试验结果分析
2.2 不同添加物对植物乳杆菌生物膜形成的影响
2.2.1 不同金属离子对生物膜形成的影响
如图5所示,Cu2+、Ca2+、Fe2+对植物乳杆菌生物膜形成能力没有明显促进作用,与胡学伟[13]、王尧禹[14]的研究结果类似,学者的研究表明Cu2+可以通过抑制胞外多糖的分泌来抑制生物膜的形成;氢氧化钙可通过抑制粪肠球菌毒力因子gelE等的表达来抑制生物膜的形成。
而一定浓度的Na+则可以促进生物膜的形成,与徐文生[10]等对NaCl影响长双歧杆菌生物膜的研究结果类似。如图6所示,低浓度下的Na+对植物乳杆菌生物膜没有促进作用,随着浓度增加到一定范围,生物膜形成量与其浓度正相关,可能是因为细菌受到高渗透压的胁迫诱导,或者高浓度的Na+影响了与生物膜形成相关基因的表达,从而促进了生物膜形成。
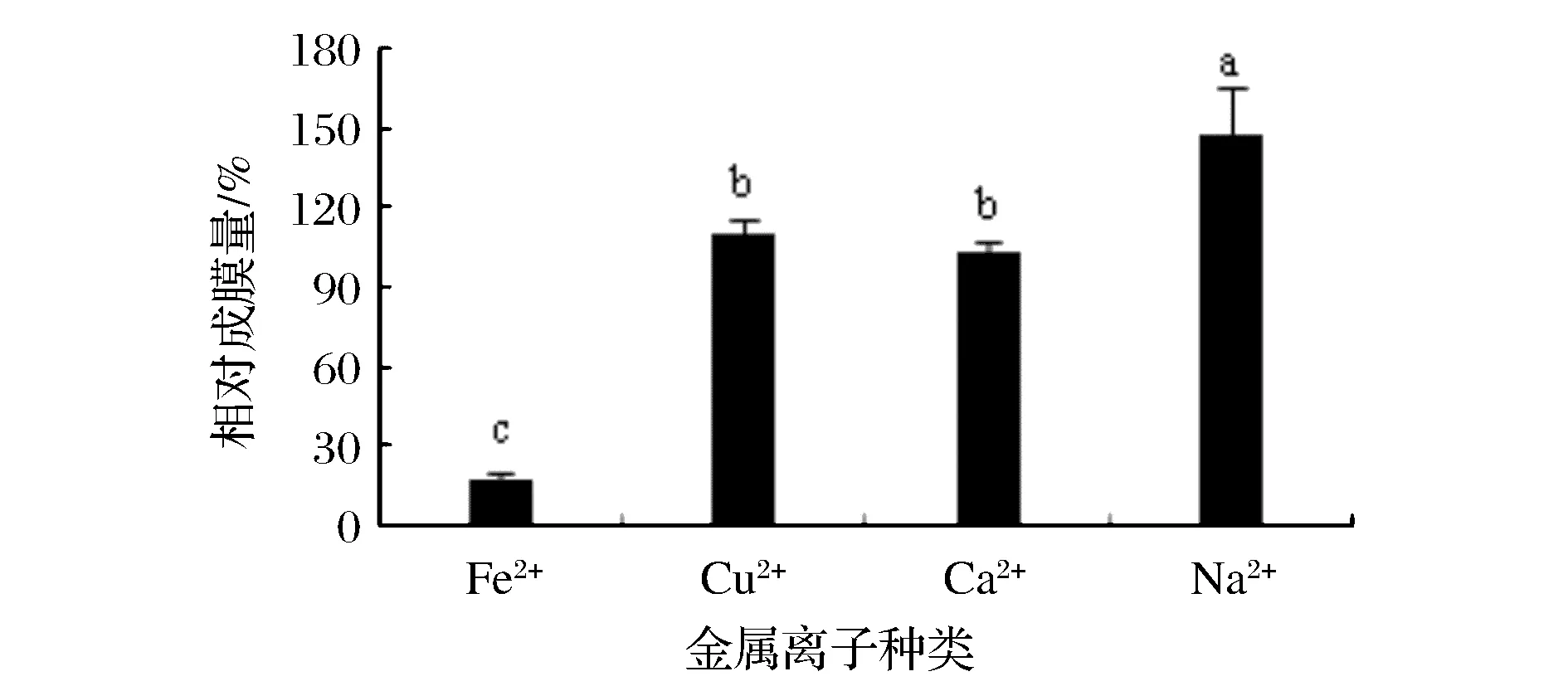
图5 不同金属离子对植物乳杆菌生物膜形成能力的影响Fig.5 The effection of different metal ions on Lactobacillus plantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)

图6 Na+对植物乳杆菌生物膜形成能力的影响Fig.6 The effection of Na+ on Lactobacillus plantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)
2.2.2 不同碳源物质对生物膜形成的影响

图7 不同碳源对植物乳杆菌生物膜形成能力的影响Fig.7 The effection of different carbon sources on Lactobacillus plantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)

图8 葡萄糖对植物乳杆菌生物膜形成能力的影响Fig.8 The effection of glucose on Lactobacillus plantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)
如图7所示,经过初步筛选,葡萄糖对植物乳杆菌生物膜的形成有显著影响,而乳糖与淀粉的添加对植物乳杆菌生物膜形成的影响不明显。如图8所示,葡萄糖在一定浓度内能促进植物乳杆菌生物膜形成,随着浓度的增大,其生物膜相对形成量呈现先增加后减小的趋势,在添加量100 mg/mL处有最大促进作用,浓度再增加时,细菌对其利用率已达最大值,故可能对其成膜能力不再促进。这可能与其对碳氮源的偏好以及利用率有关,也有研究表明,碳源可能影响细胞的生长速率,黏附蛋白基因及参与胞外物质分泌的基因的表达[11,15],从而影响生物膜的形成。
2.2.3 不同氮源物质对生物膜形成的影响
如图9所示,乳粉较之硫酸铵与胰蛋白胨作为氮源物质更有利于生物膜的形成,乳粉的添加对植物乳杆生物膜的形成有显著的促进作用。如图10所示,随着乳粉添加量的增加,成膜量有些许波动,在添加量75 mg/mL处相对成膜量达到最大值469.88%。氮源影响植物乳杆菌生物膜形成的机理可能与碳源的影响机理类似,另外,张燕[16]的研究结果表明,碳氮比的改变会影响生物膜胞外聚合物中蛋白质以及多糖等含量从而影响菌体包被以及生物膜的形成。且乳粉的添加会使培养基形成乳浊液,给生物膜提供更佳的附着点。

图9 不同氮源对植物乳杆菌生物膜形成能力的影响Fig.9 The effection of different nitrogen source on Lactobacillus plantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)
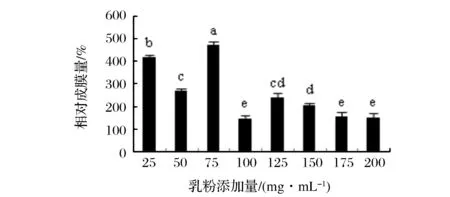
图10 乳粉对植物乳杆菌生物膜形成能力的影响Fig.10 The effection of milk powder on Lactobacillus plantarum biofilm formation(不同小写字母代表差异显著,P<0.05)
2.2.4 不同酸类物质对生物膜形成的影响
有机酸对植物乳杆菌生物膜形成的影响如图11所示,2种有机酸的添加对植物乳杆菌生物膜的形成均无促进作用,从图12可以看出柠檬酸对植物乳杆菌生物膜形成无显著影响,各浓度的影响差异也不显著,可能与有机酸引起的酸度变化影响菌体生长,从而影响其成膜有关,也有学者的研究表明没食子酸、绿原酸分别对白色念珠菌和烟曲霉生物膜同样存在抑制作用,主要机理可能为抑制细胞黏附和菌丝生长,从而抑制生物膜的形成[17]。

图11 不同有机酸对植物乳杆菌生物膜形成能力的影响Fig.11 The effection of different organic acids on Lactobacillus plantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)
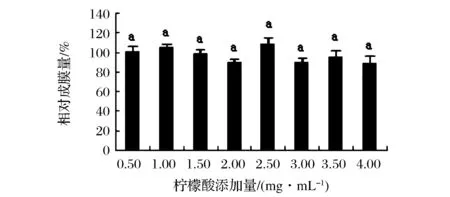
图12 柠檬酸对植物乳杆菌生物膜形成能力的影响Fig.12 The effection of citric acid on Lactobacillu splantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)
2.2.5 不同增稠剂对生物膜形成的影响
发酵食品中增稠剂的应用广泛,可提高产品稠度,降低流动性,保持产品形状。如图13所示,果胶对其成膜的促进作用显著高于明胶。对果胶不同添加量的考察结果如图14所示,添加量超过5.0 mg/mL时,随着果胶添加量的增大,植物乳杆菌生物膜相对形成量减小,可能因为增稠剂添加量增加,培养基的流动性变差,抑制了植物乳杆菌的营养吸收与利用以及浮游菌体的移动,导致聚集度下降,生物膜形成能力降低。浓度较低时,果胶则能粘连部分胞外聚合物,促进菌体聚集,进而促进生物膜形成。但是果胶浓度过低则不利于包裹菌体,在洗脱时黏附能力弱,导致成膜量低。
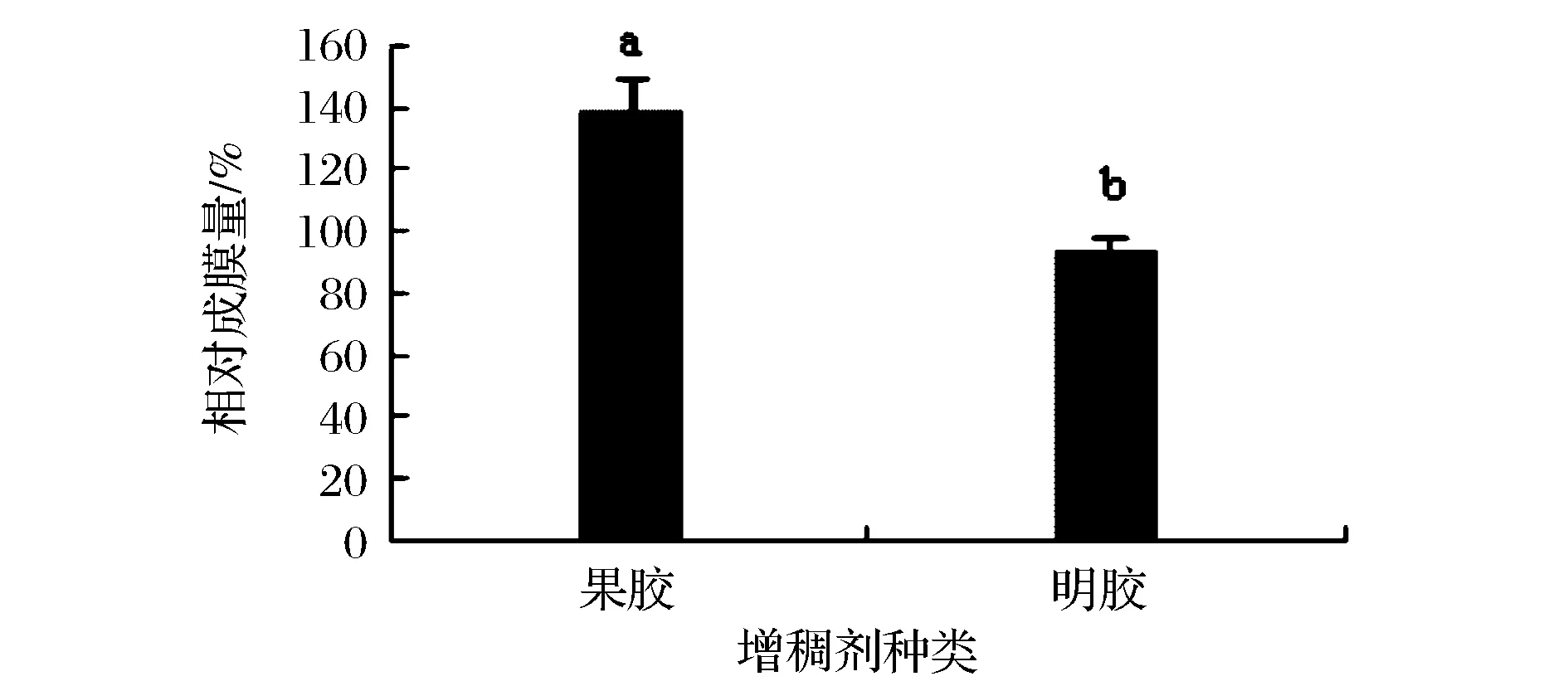
图13 不同增稠剂对植物乳杆菌生物膜形成能力的影响Fig.13 The effection of different thickener on Lactobacillu splantarum biofilm formation ability(不同小写字母代表差异显著,P<0.05)

不同小写字母代表差异显著,P<0.05图14 果胶对植物乳杆菌生物膜形成能力的影响Fig.14 The effection ofpectin on Lactobacillusplantarum biofilm formation ability
2.2.6 营养条件正交实验
在单因素基础上进行4因素3水平正交试验,以相对成膜量为评定指标,利用极差分析法对结果进行极差分析。由表4可以看出,4个因素中对植物乳杆菌生物膜形成影响的主次顺序为A>C>B>D,即NaCl>果胶>葡萄糖>乳粉,得出最佳组合水平为A3B1C3D2,即NaCl添加量为200mg/mL,葡萄糖添加量75mg/mL,果胶添加量7.5mg/mL,乳粉添加量75mg/mL。
2.3 生物膜以及浮游菌株定量分析以及扫描电镜结果
采用扫描电镜和结晶紫染色法对以上最佳实验条件所获得的植物乳杆菌生物膜进行形态观察与定量分析,以普通MRS肉汤培养的植物乳杆菌作为对照。结果表明,生物膜A490值为4.492 3。对照组A490值为0.136 5,如图15所示,经优化实验条件培养的植物乳杆菌生物膜菌体表面被胞外聚合物所包被,膜上有孔洞,具有典型的生物膜结构(图15b),而对照组中植物乳杆菌菌体形态清晰可见,没有包被物,菌体呈游离状态(图15a)。
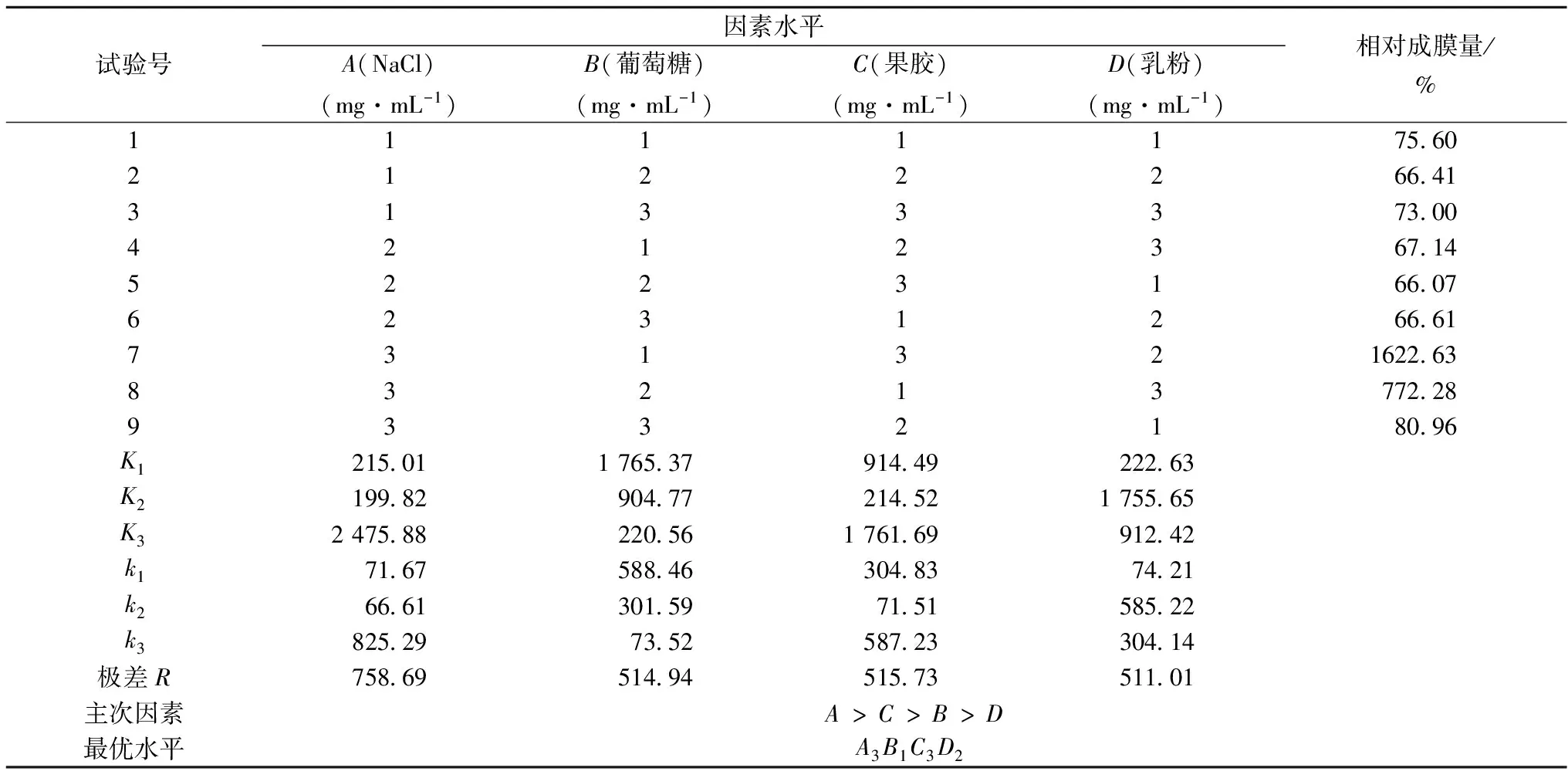
表4 营养条件正交试验结果分析

图15 植物乳杆菌生物膜以及游离菌体扫描电镜图Fig.15 SEM of biofilm and planktonic Lactobacillus plantarum
3 讨论与结论
本实验主要研究了多种环境因素对植物乳杆菌生物膜形成的影响。不同环境因子的影响机理与效果均不同,其中共同机理可能为影响调控生物膜形成基因的转录与表达,这为后续试验提供了思路与方向。
环境中的微生物种类、数量以及活性、运动性等也可能对植物乳杆菌生物膜的形成造成影响。植物乳杆菌自身数量的变化亦可引起生物膜形成量的变化,当细菌达到一定的数量会诱发群体感应,可刺激胞外聚合物分泌以及成分改变,从而影响细菌黏附性继而影响生物膜形成与结构[18-19]。胞外聚合物中的多种有机分子如多糖、蛋白质、核酸等,可以包裹细菌以提高生物膜结构稳定性。另外,多种微生物之间可能存在协同或拮抗关系,各自分泌的产物或群体感应信号都会对其他微生物产生影响,共同应对环境压力的同时形成混合生物膜,但本试验未能一一研究,旨在为后续研究提供参考。
本文研究了能够促进植物乳杆菌生物膜形成的培养条件以及营养条件,优化的培养条件为接种量5×107CFU/mL,培养时间36 h,培养温度42 ℃,pH值为5.8;最佳营养条件为MRS肉汤中添加NaCl 200 mg/mL,葡萄糖75 mg/mL,果胶7.5 mg/mL,全脂乳粉75 mg/mL。对在优化培养条件和营养条件下培养的植物乳杆菌生物膜进行定量分析,生物膜A490值为4.492 3,对照组A490值为0.136 5,扫描电镜观察结果表明该培养方法较之普通的乳酸菌培养方式更有利于植物乳杆菌生物膜的形成,所形成的生物膜较游离菌体具有大量的胞外聚合物包被,整个膜有孔洞,具有典型的生物膜结构。
[1] COSTERTON J W,GEESEY G G,CHENG K J.How bacteria stick.[J]. Scientific American,1978(238):86-95.
[2] COSTERTON J W,STEWART P S,GREENBERG E P.Bacterial biofilms: a common cause of persistent infections[J]. Science,1999,284(5 418):1 318-1 322.
[3] DONLAN R M,COSTERTON J W.Biofilms: survival mechanisms of clinically relevant microorganisms[J].Clinical Microbiology Reviews,2002,15(2):167-193.
[4] YAN X,FRATAMICO P M,GUI J,et al.A centralized database for use in studying bacterial biofilms and quorum sensing in food processing and other environments:MicroBQs.[J].Biofilms in the Food and Beverage Industries,2009:152-166.
[5] 王坤,闫颖娟,姜梅,等.保加利亚乳杆菌和嗜热链球菌生物膜形成研究[J].食品科学,2011,32(19):184-187.
[6] NAICKER P R,KARAYEM K,HOEK K G P,et al.Biofilm formation in invasiveStaphylococcusaureusisolates is associated with the clonal lineage[J].Microbial Pathogenesis,2016,90:41-49.
[7] 李平兰,贺稚非.食品微生物学实验原理与技术[M]. 北京:中国农业出版社, 2005.
[8] 任晓镤,李明杨,任少东,等.诱导植物乳杆菌生物膜形成的环境因素探索[J].食品与发酵工业,2014,40(7):11-15.
[9] 任晓镤,妥彦峰,李明杨,等.外界环境因素对戊糖乳杆菌生物膜形成的影响[J].农业机械学报,2014(11):230-234.
[10] 徐文生,张艳艳, 黄漫青,等.环境因素对长双歧杆菌CICC6069生物膜生成的影响[J].中国食品学报,2012(4):36-42.
[11] JIN Y,SAMARANAYAKE L P,SAMARANAYAKE Y,et al.Biofilm formation of Candida albicans is variably affected by saliva and dietary sugars[J].Archives of Oral Biology,2004,49(10):789-798.
[12] PAVONI J L,TENNEY M W,ECHELBERGER J W F.Bacterial exocellular polymers and biological flocculation[J].Journal (Water Pollution Control Federation),1972,44(3):414-431.
[13] 胡学伟,李姝,荣烨,等.Cu2+对生物膜及其胞外聚合物的影响[J].化工学报,2014,65(03):1 062-1 067.
[14] 王尧禹,吴小玮,董明, 等.氢氧化钙对粪肠球菌生物膜形成相关毒力因子作用的研究[J].大连医科大学学报,2014(6):4.
[15] MARTINEZ L R,CASADEVALL A.Cryptococcus neoformans biofilm formation depends on surface support and carbon source and reduces fungal cell susceptibility to heat,cold,and UV light[J].Applied and Environmental Microbiology, 2007,73(14):4 592-4 601.
[16] 张燕.碳氮比及Ca2+对生物膜及其胞外多聚物组成的研究[D].昆明:昆明理工大学,2014.
[17] 张瑾钰,陈一强,孔晋亮,等.绿原酸、异绿原酸对烟曲霉生物膜抑制作用的体外研究[J].中国感染与化疗杂志, 2014(4):327-333.
[18] JAHID I K,HA S D.The paradox of mixed‐species biofilms in the context of food safety[J].Comprehensive Reviews in Food Science and Food Safety,2014,13(5):990-1 011.
[19] RØDER H L,RAGHUPATHI P K,HERSCHEND J,et al.Interspecies interactions result in enhanced biofilm formation by co-cultures of bacteria isolated from a food processing environment[J].Food Microbiology,2015,51:18-24.
Study on biofilm formation conditions ofLactobacillusplantarumSCP53
ZHANG Guo-li1, PENGYao1, WEI Lu1, YU Xi1, AO Xiao-lin1*, LIU Shu-liang1, ZHAO Ke2
1(College of Food, Sichuan Agricultural University, Ya′an 625000, China) 2(College of Resource and Environmental, Sichuan Agricultural University, Chengdu 611100, China)
The biofilm formation ability ofLactobacillusplantarumSCP53 under different status was studied herein. The biofilm formed byLactobacillusplantarumunder different environmental conditions and nutrition had been quantitatively and qualitatively evaluated through determination of crystal violet stain in OD490and scanning electron microscope(SEM). The results showed that the optimum culture condition for biofilm formation ofLactobacillusplantarumSCP53 was incubation at 42 ℃for 36 h with inoculums size of 5×107CFU/mL and pH value of 5.8. Addition of NaCl (200 mg/mL), glucose (75 mg/mL), pectin (7.5 mg/mL), milk powder (75 mg/mL) in MRS could promote biofilm formation ofLactobacillusplantarum. BiofilmsA490values of formed biofilm was 4.492 3, while this value in control group was 0.136 5. Results from scanning electron microscopy (SEM) showed that there was obvious difference between the biological membrane and planktonic bacteria.
Lactobacillusplantarum; biofilm; formation conditions; scanning electron microscope (SEM)
10.13995/j.cnki.11-1802/ts.201704002
硕士研究生(敖晓琳副教授为通讯作者,E-mail:huavslin@163.com)。
国家自然科学基金(31171726);四川省科技支撑计划项目(2012N0002)
2016-10-13,改回日期:2017-01-03
