低强度脉冲电磁场对钛种植体表面成骨细胞增殖的影响
2017-06-19王菁吴高义
王菁,吴高义
临床医学
低强度脉冲电磁场对钛种植体表面成骨细胞增殖的影响
王菁,吴高义
目的通过研究不同参数的低强度脉冲电磁场(pulsed electromagnetic fields,PEMF)对3种不同的形貌钛片表面成骨细胞活性的影响。方法通过机械抛光、酸蚀喷砂、阳极氧化的方法制备光滑、微米、纳米3种纯钛表面结构,而后将其置于0.1 mT,0.5 mT,1 mT和5 mT的脉冲强度和1 Hz和15 Hz的脉冲功率通过不同组合,检测低强度脉冲电磁场作用下光滑、微米、纳米3种表面的成骨细胞增殖情况。结果扫描电子显微镜显示机械抛光组形成了光滑表面、酸蚀喷砂组形成了微米表面和阳极氧化组形成了纳米表面。MTT法检测低强度脉冲电磁场能有效促进钛表面的成骨细胞的增殖,其中1 mT、15 Hz的组合对光滑、微米、纳米表面促成骨细胞增殖的作用最为显著。结论低强度脉冲电磁场能有效促进种植体表面成骨细胞活性。
脉冲电磁场;参数;钛种植体;成骨细胞
低强度脉冲电磁场(PEMF)作为一种非接触式的物理治疗手段,其具有非电离属性,治疗过程不产热[1]。目前FDI推荐PEMF应用在多种难治的骨组织软骨关节系统相关疾病,特别是对于骨不连、骨折后愈合缓慢、骨质疏松病例骨折愈合等作为一种有效促进人体骨软骨相关疾病的手段推荐应;PEMF的应用能促进骨组织、软骨组织愈合、减轻疼痛和炎症反应,是一种临床重要的辅助疗法[2]。动物实验证明PEMF应用于钛种植体可显著提高种植体骨结合率[3],然而PEMF能否促进钛种植体表面成骨细胞的生物学行为,以及对不同形貌的钛种植体的最优参数的研究尚未见报道。该研究通过表面改性技术制备3种具有代表性的钛种植体表面,研究PEMF能否促进成骨细胞在钛种植体表面增殖以及对PEMF作用于不同形貌钛材料表面成骨细胞的脉冲强度、频率等各项参数进行筛选。
1 资料与方法
1.1 材料与设备纯钛(PT TA2,西北有色金属研究院);SD大鼠乳鼠(第四军医大学动物中心);低糖DMEM培养液(Hyclone);胎牛血清(Gibco);Ⅰ型胶原酶(1%,Sigma);胰蛋白酶(0.25%,Beyotime);茜素红S(Sigma);阳极氧化系统(西安工业大学);酶标仪。
1.2 方法
1.2.1 试件分组及制备线切割纯钛试件而后用SiC砂纸按顺序打磨1500目,使用抛光砂纸高度抛光。将试件置于丙酮溶液、无水乙醇溶液以及去离子水溶液中依次震荡超声15 min,干燥。试件分三组(1)机械抛光组;(2)酸蚀喷砂组:大颗粒氧化铝Al2O3以垂直方式距离20 cm进行试件表面喷砂,时间30 s,而后震荡清洗置于双酸蚀液(180 ml/L HCl:490 ml/L H2SO4=1∶1)30 min,双蒸水清洗;(3)阳极氧化组:使用阳极氧化设备,钛试件为阳极、铂片作为阴极,在0.5 wt%HF的电解液中行阳极氧化处理,双蒸水清洗后干燥备用。
1.2.2 成骨细胞分离与鉴定戊巴比妥钠腹腔注射后,将SD大鼠的乳鼠颅顶骨仔细分离,取出纤维结缔组织,而后将其剪成约0.5 mm×0.5 mm左右的组织小块。使用混合消化液(0.25%胰蛋白酶和1%Ⅰ型胶原酶按1∶1)消化后加入培养液终止消化,接种于平皿中。待第一代细胞铺满平皿80%以上传代,并使用差速贴壁法分离纯化。进行钙结节和ALP染色。
1.2.3 PEMF装置及分组使用第四军医大学生物医学工程系制作的低强度脉冲电磁设备发生器进行试验。目前FDI选用5 Hz和1 Hz作为临床常用安全有效的频率(人体),而强度则使用前期预实验筛选出的0.1 mT、0.5 mT、1 mT和5 mT。分组交叉刺激,刺激时间为1次/d,2 h/次。
1.2.4 MTT法测定材料表面细胞增殖将制备好的3组材料进行紫外照射消毒,将其放置于24孔板中,使用传代后的成骨细胞接于其上,接种密度为2×104个/ml,加液量为每孔1 ml。图1显示了24孔放入产生电磁装置的线圈中。将24孔板置于细胞孵箱中培养24 h后,按1.2.3的分组加载PEMF刺激,检测1 d、4 d和7 d时材料表面的细胞增殖情况。
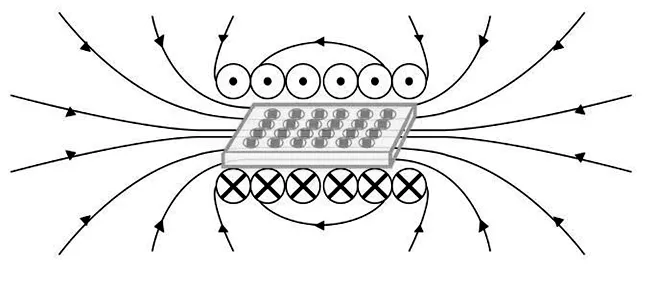
图1 线圈内部电磁场分布示意图(24孔板放置于线圈内部)
2 结果
2.1 成骨细胞培养及鉴定图2显示经消化后接种的成骨细胞在3 d及7 d后的形态(图2),从图中可以看出细胞呈现多角形、长梭形等不规则形态,在7 d后铺满瓶底约80%。图3示培养7 d后,ALP染色可见细胞内明显的点状深染颗粒,细胞汇集中心染色后形成黑色结节。放大观察可见深染颗粒主要集中于胞质内,且随培养时间的延长而加深。图4示培养14 d后的成骨细胞形成了数量较多的钙结节,细胞聚集成簇现象明显,细胞外深染的分泌颗粒数量亦有所增多。
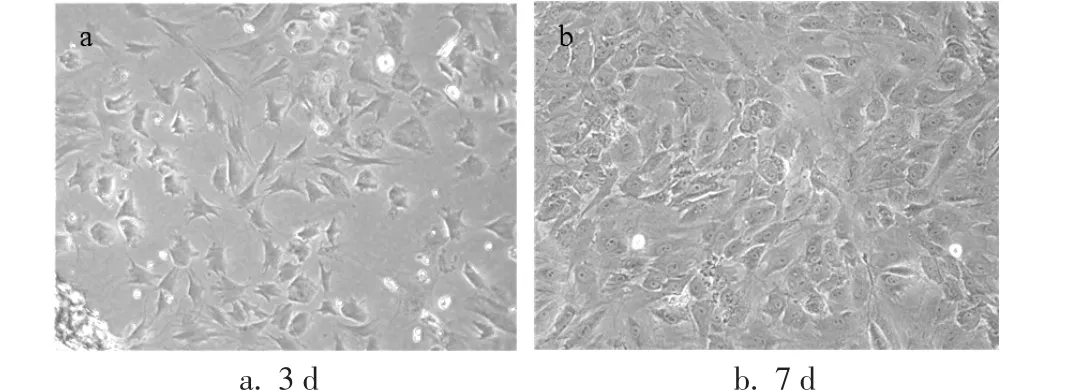
图2 原代培养的成骨细胞(×100)
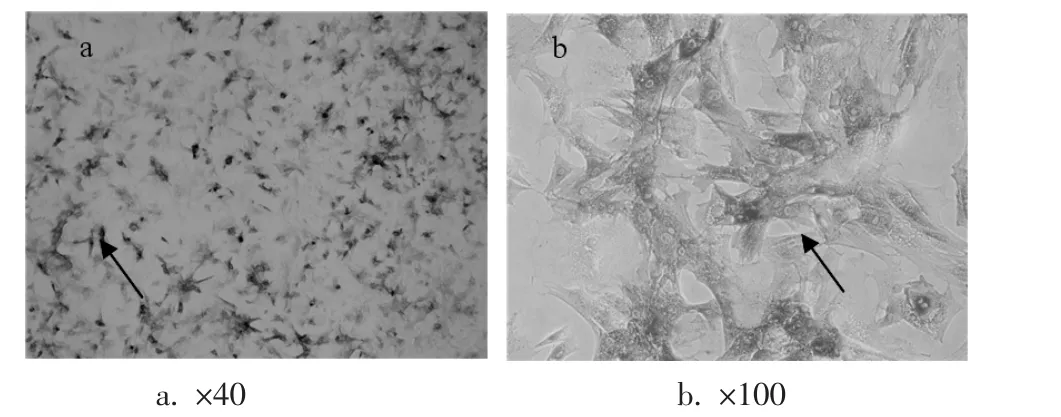
图3 第三代成骨细胞碱性磷酸酶染色7d

图4 第三代成骨细胞茜素红染色14 d
2.2 PEMF促进成骨细胞增殖PEMF能显著促进Flat、Micro、Nano表面成骨细胞增殖,如图5所示。其中Flat组和Micro组均可见T2(15 Hz,0.5 mT)、T3(15Hz,1 mT)、T6(1 Hz,0.5 mT)、T7(1 Hz,1 mT)组细胞的增殖情况与T0组相比变快。T3组的15 Hz,1 mT优于其余参数。与其他材料表面不同,Nano各组参数均显示优于T0组,其中T3和T2组优于其余参数。
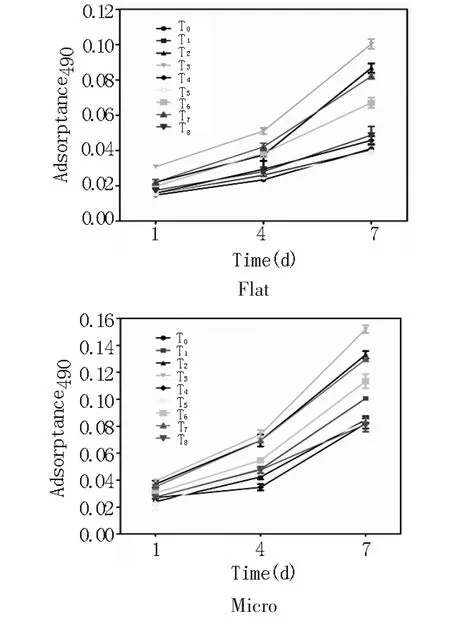
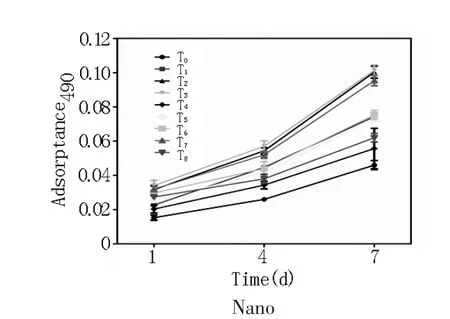
图5 不同参数PEMF对三种钛表面形貌成骨细胞增殖的影响
3 讨论
近年来,众多研究表明种植体表面理化特性是决定种植体成功率的决定因素[4]。目前纯钛是应用最为广泛的种植材料,取得了良好的成功率,然而纯钛的表面耐摩擦系数较低、光滑纯钛并不能引发良好的骨整合[5]。材料表面结构、中心结构、地形学特征对于成骨细胞、骨髓间充质细胞、破骨细胞等生物行为有着不同程度的影响。
“窗口效应”是电磁场作用于细胞和组织的特殊生物学现象,即对于不同的组织种类、不同的细胞,电磁场最优影响区间有着明显差异[6]。文献报道1 Hz和15 Hz是有效促进人体骨组织生成的频率参数[7]。5 mT,1 mT,0.5 mT和0.1 mT四组强度参数是前期预实验培养成骨细胞确定的梯度参数。然而,与培养板表面不同,细胞黏附的基底材料是四级pure titanium,这种材料在空气中表面会形成一层特有的二氧化钛涂层[8]。电磁场对三种材料表面成骨细胞不同的生物效应可能与三种材料不同的二氧化钛分布所导致的电势梯度不同所导致,与平面二氧化钛相比,管状二氧化钛结构会产生更为明显电势差,电磁场作用其上时会产生明显的电流相,从而导致材料极化进而对其上的成骨细胞生物学反应产生影响。
低强度脉冲电磁场促进骨细胞生物学行为的机制尚不明确,目前有研究表明Wnt通路、BMP/ Smad通路在其中扮演着重要角色。然而电信号如何转换成生物学信号?笔者推测,一方面电磁效应促进材料表明电势分布改变,另一方面电磁效应促进细胞极化,使得细胞膜表面受体极化,从而引发级联反应,这种“瀑布式反应”引起多条通路被激活,信号通路的激活使得相关基因蛋白表达改变从而引发一系列生物反应。然而这些推测需要进一步实验验证。综上,PEMF对以上钛种植体表面成骨细胞增殖均有促进作用,不同形貌的材料表面成骨细胞的电磁效应窗口也存在差异。
[1]Wuschech H,van Hehn U,Mikus E,et al.Effects of PEMF on patients with osteoarthritis:Results of a prospective,placebocontrolled,double-blind study[J].Bioelectromagnetics,2015,36(5):576-585.
[2]Tan L,Ren Y,van Kooten TG,et al.Low-intensity pulsed ultrasound(LIPUS)andpulsedelectromagneticfield(PEMF)treatments affect degeneration of cultured articular cartilage explants[J].Int Orthop,2015,39(5):549-557.
[3]Rosso F,Bonasia DE,Marmotti A,et al.Mechanical stimulation(pulsed electromagnetic fields"PEMF"and extracorporeal shock wave therapy"ESWT")and tendon regeneration:A possible alternative[J].Front Aging Neurosci,2015,7(2):211.
[4]Lee JK,Choi DS,Jang I,et al.Improved osseointegration of dental titanium implants by TiO2nanotube arrays with recombinant human bone morphogenetic protein-2:a pilot in vivo study[J]. Int J Nanomedicine,2015,10(10):1145-1154.
[5]Zhou R,Wei D,Yang H,et al.Osseointegration of bioactive microarc oxidized amorphous phase/TiO2nanocrystals composited coatings on titanium after implantation into rabbit tibia[J].J Mater Sci Mater Med,2014,25(12):1307-1318.
[6]Falone S,Marchesi N,Osera C,et al.Pulsed electromagnetic field(PEMF)prevents pro-oxidant effects of H2O2in SK-NBE(2)human neuroblastoma cells[J].Int J Radiat Biol,2016,92(3):281-286.
[7]Pieber K,Schuhfried O,Fialka-Moser V.[pulsed electromagnetic fields(PEMF):results in evidence based medicine][J].Wien Med Wochenschr,2007,157(1):34-36.
[8]Mugnolo G,Filliponi H.Osseointegration of tissue functional rough TiO2-blasted titanium implants:one-year follow-up of 100 implants[J].Dent Implantol Update,2001,12(2):9-15.
[2016-12-16收稿,2017-01-14修回][本文编辑:宋敏]
The effect of low-intensity pulsed electromagnetic field on the osteoblast proliferation of titanium- implant surfaces with different topographies
WANG Jing,WU Gao-yi.Department of Stomatology,the General Hospital of Jinan Military Region,Jinan,Shandong 250031,China
ObjectiveTo compare variouse parameters of pulsed electromagnetic fields(PEMF)on the osteoblast proliferation of pure titanium with different coating.MethodsA polished surface(Flat),a SLA surface(Micro),and an anodized surface(Nano)were prepared using modified technology.The titanium dics with three representative topographies were respectively placed into 1 and 15 Hz frequency parameters and 0.1,0.5,1 and 5 mt intensity parameters.MTT assay was used to investigate the osteoblast activity.Resultsthree representative titanium surface topographies were successfully prepared namely Flat,Micro,and Nano.MTT assay showed the proliferation of osteoblast bioactivity on titanium surfaces can be hagely enhanced by PEMF.The osteoblast proliferationdisplayedthepositivepromotionwiththeparametersof15Hz,1mtonallthethreesurfaces. ConclusionPEMF can improve the osteoblast proliferation on titanium surfaces and the optimal parameter was obtained by screening.
PEMF;Parameter;Titanium implant;Osteoblast
R783.6
A
10.14172/j.issn1671-4008.2017.06.005
250031山东济南,原济南军区总医院口腔科(王菁,吴高义)
