总氨态氮对海湾扇贝幼体存活和生长的影响
2017-06-19袁洪梅杨长奎杨凤闫喜武大连海洋大学水产与生命学院辽宁省贝类良种繁育工程技术研究中心辽宁大连116023
袁洪梅,杨长奎,杨凤,闫喜武(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
总氨态氮对海湾扇贝幼体存活和生长的影响
袁洪梅,杨长奎,杨凤,闫喜武
(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
为确定海湾扇贝Argopecten irradias育苗用水的水质指标,进行了总氨态氮对海湾扇贝幼体存活和生长的影响试验。结果表明:在pH为8.20~8.30、水温为21.5~22.5益、盐度为27~28条件下,总氨态氮对海湾扇贝受精卵孵化率的24 h半数有效浓度(EC50)为3.089 mg/L(非离子氨态氮NH3-N=0.194 mg/L),最大毒物允许浓度(MATC)为0.86~1.80 mg/L(非离子氨态氮NH3-N=0.054~0.113 mg/L);在pH为7.95~8.10、水温为23~25益、盐度为27~28条件下,总氨态氮对浮游期幼虫(2日龄)存活的48 h半致死浓度(LC50)为7.801 mg/L(NH3-N=0.342 mg/L),96 h LC50为2.445 mg/L(NH3-N=0.107 mg/L),144 h LC50为1.294 mg/L(NH3-N=0.057 mg/L);对浮游期生长的144 h EC50为2.023 mg/L (NH3-N=0.089mg/L);浮游期的MATC为0.37~0.66mg/L(NH3-N=0.016~0.029mg/L);总氨态氮浓度臆2.03 mg/L(NH3-N臆0.089 mg/L)时,均有幼体变态为稚贝;变态期(眼点出现至变态成稚贝)幼体眼点出现率的192 h EC50为1.460 mg/L(NH3-N=0.064 mg/L),变态率的408 h EC50为1.927 mg/L (NH3-N=0.085 mg/L)。研究表明,根据各个时期的EC5推测,海湾扇贝育苗期间,在pH为7.95~8.10条件下总氨态氮浓度控制在0.40 mg/L(NH3-N=0.018 mg/L)以下最佳,本研究结果为完善海湾扇贝生态学及育苗期间的水质调控技术提供了参考。
海湾扇贝;总氨态氮;幼体;发育;生长;存活
总氨态氮(TNH+4-N)是植物生长的必需元素[1-2],同时又会对水生生物产生毒害作用[3-6]。目前,关于总氨态氮毒性的研究主要集中在鱼类方面[7-12],对贝类的毒性研究报道也较多。如Epi-fanio等[13]对美国牡蛎和硬壳蛤的研究表明,大规格贝类比小规格的耐受能力强。师尚丽等[14]研究发现,在温度为28益、pH为8.5时,30日龄方斑东方螺的96 h LC50为10.20 mg/L。张永普等[15]研究发现,在温度为25益、pH为8.3时,壳长为
2.72 mm橄榄蚶稚贝的96 h LC50为50.0 mg/L。方军等[16]研究表明,氨态氮浓度高于0.5 mg/L时会显著抑制毛蚶稚贝的生长。许多学者研究表明,在温度升高[17-18]、盐度降低[19]和pH升高[18-21]的条件下,总氨态氮对贝类的毒性增大。
人工育苗条件下,高密度养殖生物的排放和大量施肥投饵后残饵粪便的分解,使得总氨态氮成为海湾扇贝苗种培育过程中最容易积累的有毒物质。杨凤等[21]研究发现,随着pH的升高,总氨态氮对海湾扇贝幼贝(7~8 mm)的毒性增强。栾红兵等[22]研究表明,pH为7.7~8.1时,0.5 mg/L的氨态氮使浮游期幼虫的生长明显减慢。虽然有部分总氮对贝类幼虫毒性的报道,然而关于总氨态氮对贝类幼体发育阶段耐受性的系统研究目前尚未见报道。贝类从受精卵孵化至D形幼虫,再经过生长发育变态为稚贝的阶段,是其生活史中最敏感和重要的发育阶段,研究总氨态氮对海湾扇贝幼体存活和生长的影响,对于确定育苗用水中总氨态氮的水质指标、建立育苗用水的水质调控技术、完善海湾扇贝的健康养殖技术具有重要参考价值。
1 材料与方法
1.1 材料
试验用海湾扇贝取自大连庄河海洋村贝类育苗中心。试验用水为大连市庄河海区经沉淀、沙滤后的海水,总氨态氮为0.37 mg/L,亚硝酸态氮为0.025~0.035mg/L,CODMn为2.4~2.5 mg/L,DO为5.5~6.5 mg/L,pH为7.95~8.30,盐度为27~28。除了总氨态氮用奈氏试剂法测定外,其他水质指标均按照海洋监测规范[23]进行测定。试验用氯化氨为分析纯。
1.2 方法
试验在规格为2 L的塑料桶中进行,试验用水为1 L。基本方法是在预试验基础上[24]按等对数间距设置正式试验的总氨态氮浓度梯度。通过添加高浓度氯化氨母液制备各个浓度,加入氯化氨母液的体积小于试验用水的0.5%。以不添加氯化氨的天然海水作为对照组,以换水前后实测总氨态氮浓度的平均值为试验的真实浓度,水浴控温并遮光。全部试验设置3个重复。
1.2.1 总氨态氮对海湾扇贝孵化率的影响试验试验共设9个总氨态氮浓度组和1个对照组,设定浓度和实测浓度见表1。以40个/mL的密度将受精卵放入各个试验桶中。每天定时搅水以保证溶解氧充足和防止受精卵下沉。温度控制在21.5~ 22.5益,pH控制在8.20~8.30,24 h后测定刚孵化出的D型幼虫密度,同时测定总氨态氮、亚硝酸态氮、pH、DO、CODMn、水温和盐度等水质指标。
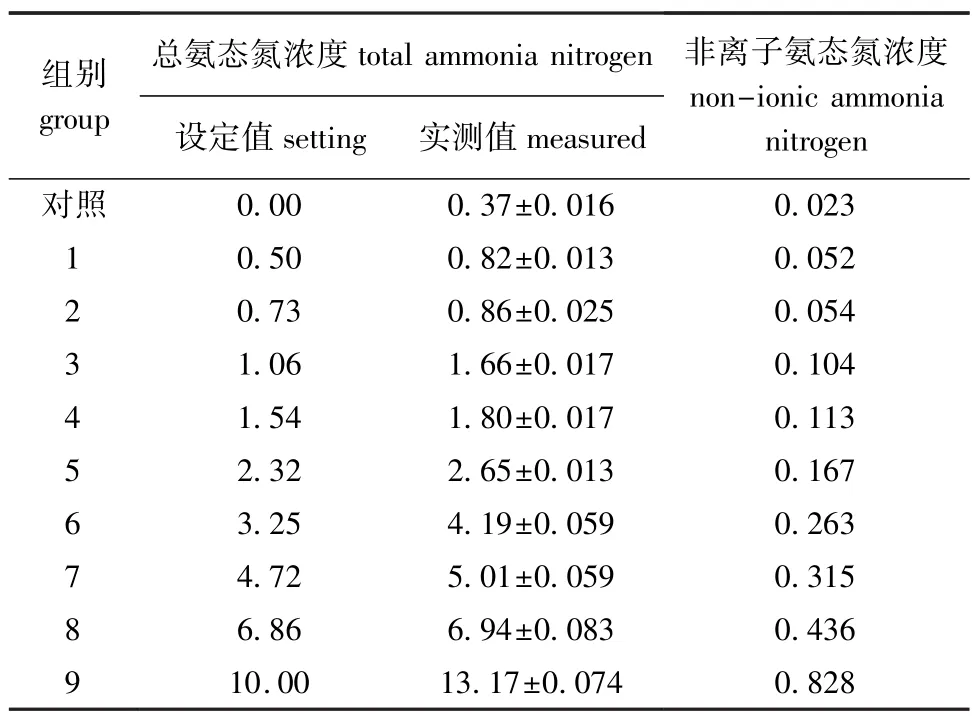
表1 总氨态氮浓度对海湾扇贝孵化率影响的试验设计Tab.1Experimental design for impact of total ammonia nitrogen level on hatching rate in bay scallop Arg-opecten irradians mg/L
孵化率=D形幼虫密度/受精卵密度伊100%。
1.2.2 总氨态氮对海湾扇贝浮游至变态阶段生长和发育的影响试验受试生物为用天然海水孵化出的2日龄D形幼虫。共设置6个总氨态氮浓度组和1个天然海水对照组(表2)。以10个/mL的密度将幼虫放入各试验桶中,并实测各桶中D型幼虫密度。每天换水,换水前后测定水中pH、DO、总氨态氮、亚硝酸态氮、CODMn等水质指标。换水时调节pH,使pH保持在7.95~8.10。每天投饵2次,前3 d投喂叉鞭金藻,3 d后逐渐增加新月藻和小球藻。控温在23~25益,试验连续进行17 d,期间定期测定幼虫密度和壳长,记录出眼点幼虫数、变态稚贝数,计算死亡率、相对生长率、眼点出现率和变态率,其计算公式为
死亡率=(初始D形幼虫密度-存活幼虫密度)/初始D形幼虫密度伊100%,
相对生长率=(结束时壳长-初始壳长)/初始壳长伊100%,
眼点率=出眼点幼虫数/同期总幼虫数伊100%,变态率=变态稚贝数/足面盘幼虫数伊100%。
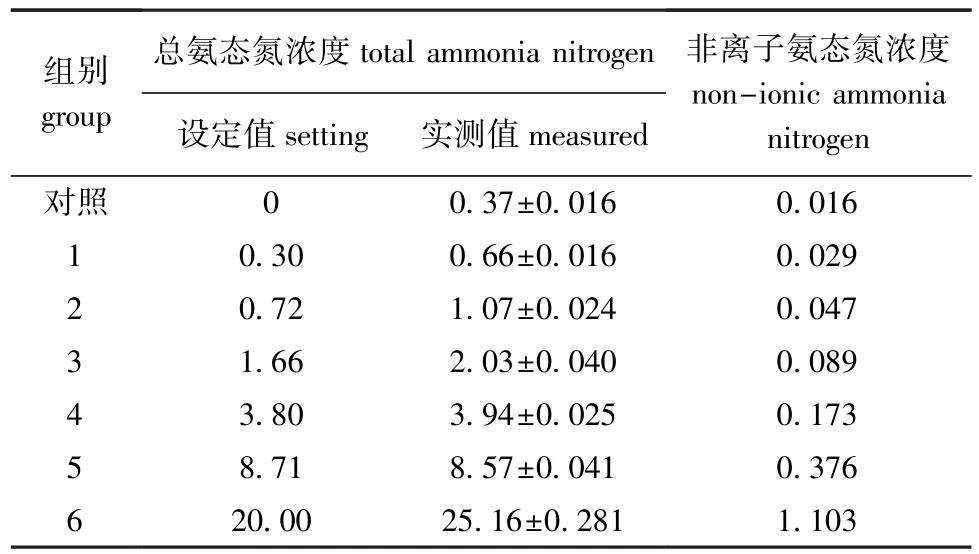
表2 总氨态氮浓度对海湾扇贝浮游至变态阶段影响的试验设计Tab.2Experimental design for impact of total ammonia nitrogen level on animals from pelagic larvae to metamorphosis in bay scallop Argopecten irradians mg/L
1.3 数据处理
试验结果采用SPSS 20.0软件进行方差分析,采用Tukey法进行多重比较,用概率单位法求半致死浓度(LC50)。设定对观测指标(孵化率、死亡率、相对生长、眼点率和变态率)产生5%负面影响的总氨态氮浓度为没有影响的总氨态氮有效浓度(EC5,死亡率相应为LC5),根据观测指标与总氨态氮浓度的关系曲线求半数有效浓度(EC50,使观测指标下降50%所对应的总氨态氮浓度)。根据多重比较结果确定最大毒物允许浓度(MATC,即与对照组无显著差异的最高浓度至与对照组有显著差异的最低浓度)。非离子氨态氮(NH3-N)的含量籽按下式计算:
其中:ks
琢,t为在大气压p、温度t、盐度s条件时的表观电离平衡常数;酌H+为H+活度系数的负常用对数。
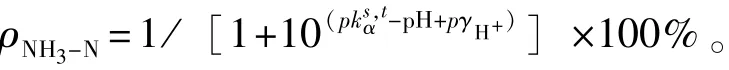
2 结果与分析
2.1 总氨态氮浓度对海湾扇贝孵化率的影响
不同总氨态氮浓度下海湾扇贝的孵化率见表3。多重比较结果表明,总氨态氮浓度臆0.86 mg/L (NH3-N=0.054 mg/L)时,对孵化率无明显影响(P>0.05),总氨态氮浓度逸1.66 mg/L(NH3-N= 0.104 mg/L)时,随着总氨态氮浓度的增大,孵化率显著下降(P<0.05)。推测总氨态氮对孵化率的最大毒物允许浓度(MATC)范围为0.86~1.80 mg/L(NH3-N=0.054~0.113 mg/L)。
经回归分析发现,总氨态氮浓度对数(x)与孵化率(y)呈极显著直线负相关(P<0.01),回归方程为y=-83.583x+90.942(R2=0.9249,n= 9)。由方程求得总氨态氮对海湾扇贝孵化率的24 h EC5为0.894 mg/L(NH3-N=0.056mg/L),24 h EC50为3.089 mg/L(NH3-N=0.194 mg/L)。
2.2 总氨态氮浓度对扇贝浮游至稚贝阶段幼体存
活的影响
从图1可见,随着胁迫时间的延长和总氨态氮浓度的增加,幼体的死亡率逐渐增大。胁迫144 h时,总氨态氮浓度为25.16 mg/L组的幼体100%死亡;胁迫192 h时,总氨态氮浓度为3.94、8.57 mg/L组的幼体全部死亡;至试验结束时(408 h),总氨态氮浓度臆2.03 mg/L的各组均有幼体存活并变态为稚贝。多重比较结果表明,除376 h以外,其他各个时间段死亡率的MATC均为0.37~0.66 mg/L(NH3-N=0.016~0.029 mg/L)。
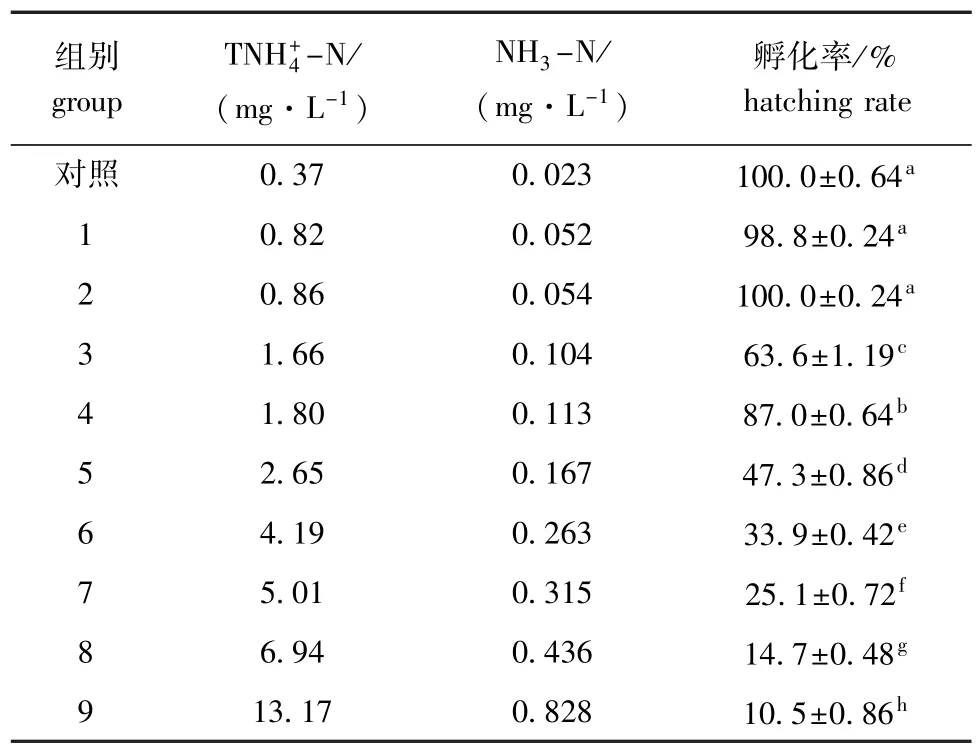
表3 不同总氨态氮浓度下海湾扇贝的孵化率Tab.3Hatching rates in bay scallop Argopecten irradians at different concentrations of TNH+4-N
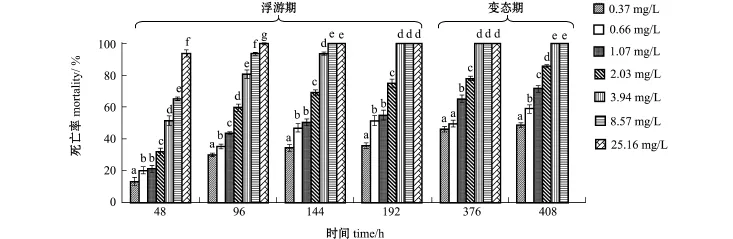
图1 不同总氨态氮浓度下海湾扇贝D形幼虫至稚贝阶段的死亡率Fig.1M ortality of bay scallop Argopecten irradians from D-larvae to juvenile at various TNH+4-N concentrations
经回归分析发现,由各个时间段死亡率换算得到的概率单位(yt)分别与总氨态氮浓度对数(x)呈显著(P<0.05)或极显著(P<0.01)直线相关(图2)。各个时间段的直线方程yt=a+bx参数及根据方程求得的总氨态氮LC5和LC50见表4。随着胁迫时间的延长和幼体的生长发育,其LC5和LC50呈下降趋势,以试验结束时(408 h)的LC5和LC50为最低。
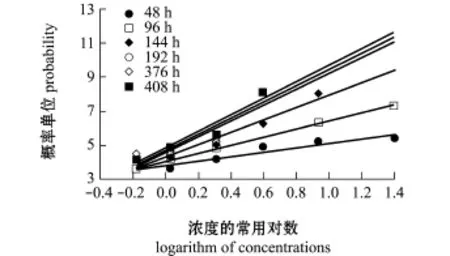
图2 总氨态氮浓度对数与海湾扇贝幼体死亡率概率单位的关系Fig.2Relationship between the logarithm of-N concentrations and probability unit of larval mortality
2.3 总氨态氮浓度对扇贝浮游至稚贝阶段幼体生
长的影响
从图3可见,由于总氨态氮浓度逸25.16 mg/L组的幼体基本无生长,且在96 h后全部死亡,所以图中未列出。随着总氨态氮浓度的增大,扇贝幼体的生长速度显著减慢(P<0.05)。多重比较结果表明,48、96、192 h扇贝幼体相对生长的MATC均为0.66~1.07 mg/L(NH3-N=0.029~0.047 mg/L);144、408 h时的MATC分别为0.37~ 0.66、1.07~2.03 mg/L,相应的NH3-N的MATC分别为0.016~0.029、0.047~0.089 mg/L。表现为浮游期相对生长的MATC<变态阶段的MATC。
经回归分析发现,浮游期幼虫的相对生长(y)与总氨态氮浓度对数(x)呈极显著直线负相关(P<0.01)(图4),以对照组的生长为100%,由方程推算出使浮游期幼虫相对生长降低5%的总氨态氮48、96、144 h EC5分别为0.397、0.546、0.413 mg/L,相应的NH3-N浓度分别为0.017、0.024、0.018 mg/L,48、96、144 h EC50分别为2.495、2.911、2.023 mg/L,相应的NH3-N浓度分别为0.109、0.128、0.089 mg/L。
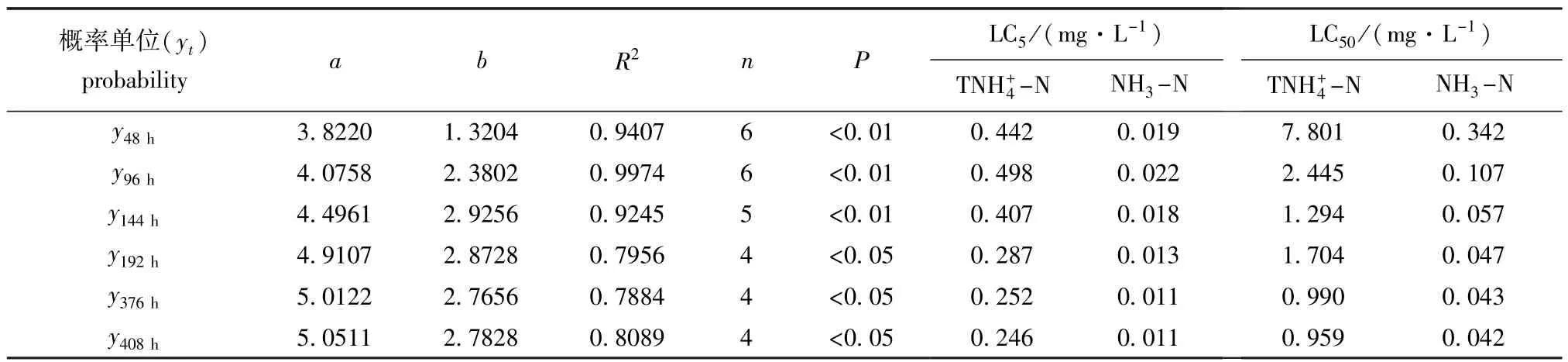
表4 海湾扇贝幼体死亡概率单位(yt)与总氨态氮浓度(x)的回归方程参数及LC5和LC50Tab.4Parameters of regression equation between probability unit(yt)and TNH+4-N(x)concentrations and LC5and LC50for larval bay scallop Argopecten irradians
2.4 总氨态氮浓度对海湾扇贝幼虫眼点出现率的影响
胁迫至第192 h时,总氨态氮浓度臆2.03 mg/L的各试验组有幼虫发育至眼点幼虫。不同总氨态氮浓度下的眼点出现率结果见表5。多重比较结果表明,随着总氨态氮浓度的增大,幼虫眼点出现率显著下降(P<0.05)。推测最大毒物允许浓度为0.37~0.66 mg/L(NH3-N=0.016~0.029 mg/L)。
经回归分析发现,浓度对数(x)与眼点出现率(y)呈显著直线负相关(P<0.05),直线方程为y=-72.948x+53.978(R2=0.9858,n=4)。由方程可求得总氨态氮对海湾扇贝眼点出现率的192 h EC5为0.443 mg/L(NH3-N=0.019 mg/L),192 h EC50为1.460 mg/L(NH3-N=0.064 mg/L)。
2.5 总氨态氮浓度对海湾扇贝幼虫变态率的影响
总氨态氮浓度臆2.03 mg/L的各试验组均有幼虫变态成稚贝。不同总氨态氮浓度下海湾扇贝幼虫变态率结果见表6。多重比较结果表明,随着总氨态氮浓度的增大,幼虫变态率显著下降(P< 0.05)。推测最大毒物允许浓度为0.37~0.66 mg/L(NH3-N=0.016~0.029 mg/L)。
经回归分析发现,总氨态氮浓度(x)与变态率(y)呈极显著直线相关(P<0.01),直线方程为y=-66.161x+60.292(R2=0.9875,n=4)。由方程求得总氨态氮浓度对海湾扇贝幼虫变态率的408 h EC5为0.526 mg/L(NH3-N=0.023 mg/L), 408 h EC50为1.927 mg/L(NH3-N=0.085 mg/L)。
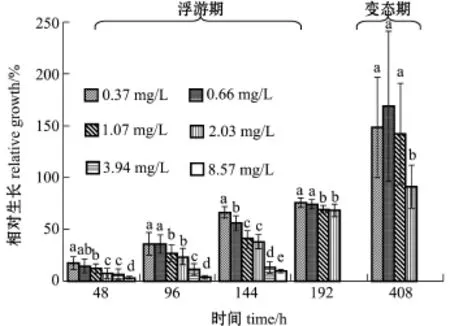
图3 不同总氨态氮浓度下海湾扇贝幼体的相对生长Fig.3Relative grow th of lavral bay scallop Argopecten irradians at different TNH+4-N concentrations
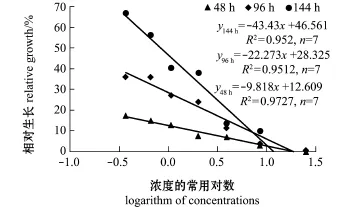
图4 总氨态氮浓度对海湾扇贝幼虫生长的影响Fig.4Influence of total ammonia nitrogen level on the larval grow th of bay scallo Argopecten irradians
表5 不同总氨态氮浓度下海湾扇贝幼虫的眼点出现率Tab.5Success rate of eye-spot larvae at different-N concentrations in baby scallo Argopecten irradians
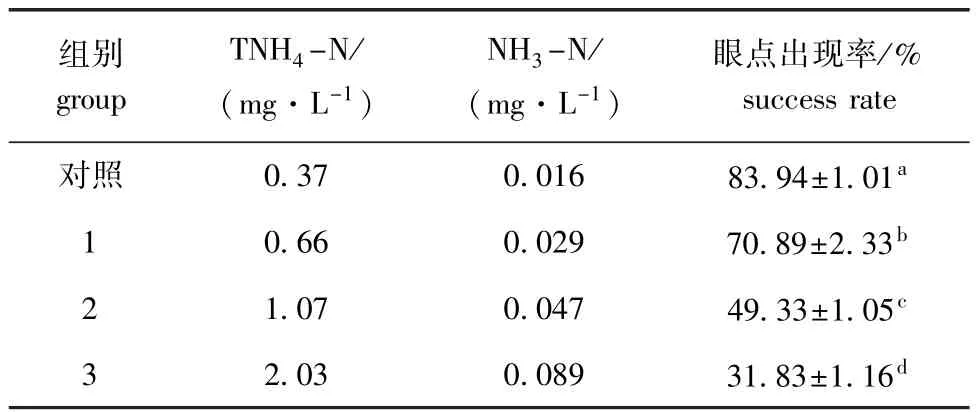
表5 不同总氨态氮浓度下海湾扇贝幼虫的眼点出现率Tab.5Success rate of eye-spot larvae at different-N concentrations in baby scallo Argopecten irradians
组别group TNH4-N/ (mg·L-1) NH3-N/ (mg·L-1)眼点出现率/% success rate对照0.37 0.016 83.94依1.01a1 0.66 0.029 70.89依2.33b2 1.07 0.047 49.33依1.05c3 2.03 0.089 31.83依1.16d
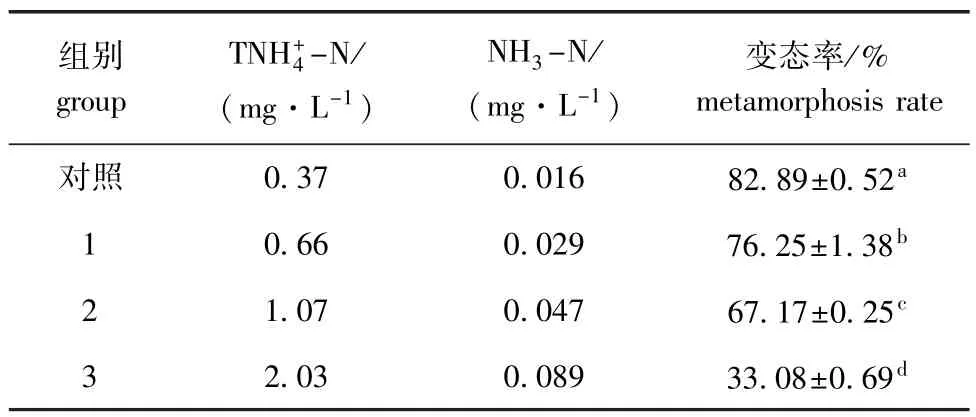
表6 不同总氨态氮浓度下海湾扇贝幼虫的变态率Tab.6Metamorphosis rates of larval bay scallop Argopect-en irradians at different TNH+4-N concentrations
3 讨论
3.1 总氨态氮对海湾扇贝幼体发育和生长的影响
本试验结果表明,随着总氨态氮浓度的增大,受精卵孵化率及浮游至稚贝阶段的幼体死亡率、相对生长率、眼点出现率和变态率均呈下降趋势。但不同发育阶段其影响程度不同。选择耐受性最低的阶段(144 h)作为浮游期生长的代表,各个阶段总氨态氮(非离子氨态氮)的MATC、EC5、EC50(或LC50)见表7。
由表7可见,与其他阶段相比,孵化率的MATC、EC5、EC50或LC50均较高,说明孵化阶段对总氨态氮的耐受能力较强,这可能与受精卵有卵膜保护且胁迫时间较短(24 h)有关。一般毒物的毒性效应为随着受试时间的延长EC50有所下降,但是相对生长的408 h EC50却大于144 h EC50,原因可能是个体小的死亡较多,且随着存活幼体的不断生长,扇贝幼体能力也逐渐增强。半致死浓度LC50和半数有效浓度EC50能够较好地消除个体差异对毒物毒性的反应[25],通常用来比较对毒物的耐受能力。由此得出,不同发育时期海湾扇贝对非离子氨态氮的敏感性顺序为:浮游期死亡率(0.057 mg/L)<眼点率(0.064 mg/L)<变态率(0.085 mg/L)<浮游期相对生长(0.089 mg/L)<孵化率(0.194 mg/L)。即浮游期幼虫存活对总氨态氮最敏感,孵化阶段对总氨态氮浓度的耐受性最强。
文献中报道的总氨态氮对贝类的毒性研究结果较多,但是绝大多数研究对象是幼贝或成贝,由于试验条件不尽相同,很多试验结果无法相互比较。将相近研究条件下的研究结果比较(表8),可以看出,海湾扇贝幼虫的耐受性比稚贝[10]要小很多。也明显小于其他种类的幼贝或成贝[15-16,19,21,26-28]。
3.2 海湾扇贝育苗用水中总氨态氮的安全浓度
综上所述,在pH为7.95~8.10条件下,总氨态氮浓度臆2.03 mg/L(NH3-N臆0.089 mg/L)的各个试验组均有海湾扇贝正常孵化、生长和发育为稚贝。但总氨态氮浓度为0.37~2.03 mg/L时,随着浓度的增加,其负面影响增大。总氨态氮浓度为1.80 mg/L(NH3-N臆0.113 mg/L)时,幼贝孵化率明显下降,浓度为0.66 mg/L(NH3-N臆0.029 mg/L)时,幼贝存活率、相对生长率、眼点出现率和变态率显著下降。假设使各个生长发育指标下降5%的总氨态氮浓度为无影响的有效浓度,由浓度关系曲线推算得到孵化率的EC5为0.894 mg/L(NH3-N=0.056 mg/L),眼点出现率的EC5为0.443 mg/L(NH3-N=0.019 mg/L),变态率的EC5为0.526mg/L(NH3-N=0.023mg/L),浮游期144 h相对生长的EC5为0.413 mg/L (NH3-N=0.018 mg/L)。如从严控制水质,建议非离子氨态氮浓度控制在0.018 mg/L以下,该值略低于渔业水质标准规定的0.020 mg/L[29]。
目前,常见的氨态氮测定方法所测定的均为总氨态氮[23]。由于总氨态氮中非离子氨态氮(NH3-N)的毒性远大于离子铵(-N)的毒性[25],受NH3+H+平衡的左右,总氨态氮对水生生物的毒性随着pH的升高[18-20]、温度的升高[19]和盐度的降低[17]而增大,其中又以pH的影响最为显著。所以,不同pH条件下总氨态氮的安全浓度不同。若只考虑NH3-N的毒性,以NH3-N不超过0.018 mg/L为基准,则可计算得到,盐度为25~ 35、水温为20~25益条件下,pH分别为7.8、8.0、8.2、8.4时,总氨态氮浓度依次控制在0.61、0.39、0.25、0.17 mg/L以下最佳。
总氨态氮主要来自于残饵、粪便的分解和养殖生物的代谢,其毒性又会随pH的升高而增大。所以,海湾扇贝育苗生产中合理控制养殖密度,并适量投喂鲜活饵料,适时检测总氨态氮浓度和pH尤为重要。本试验中所得结论为完善海湾扇贝生态学及育苗期间的水质调控技术提供了参考。
表7 海湾扇贝幼体不同发育阶段对总氨态氮的耐受性比较Tab.7TheN tolerance of larval bay scallop Argopecten irradians at different developmental stages
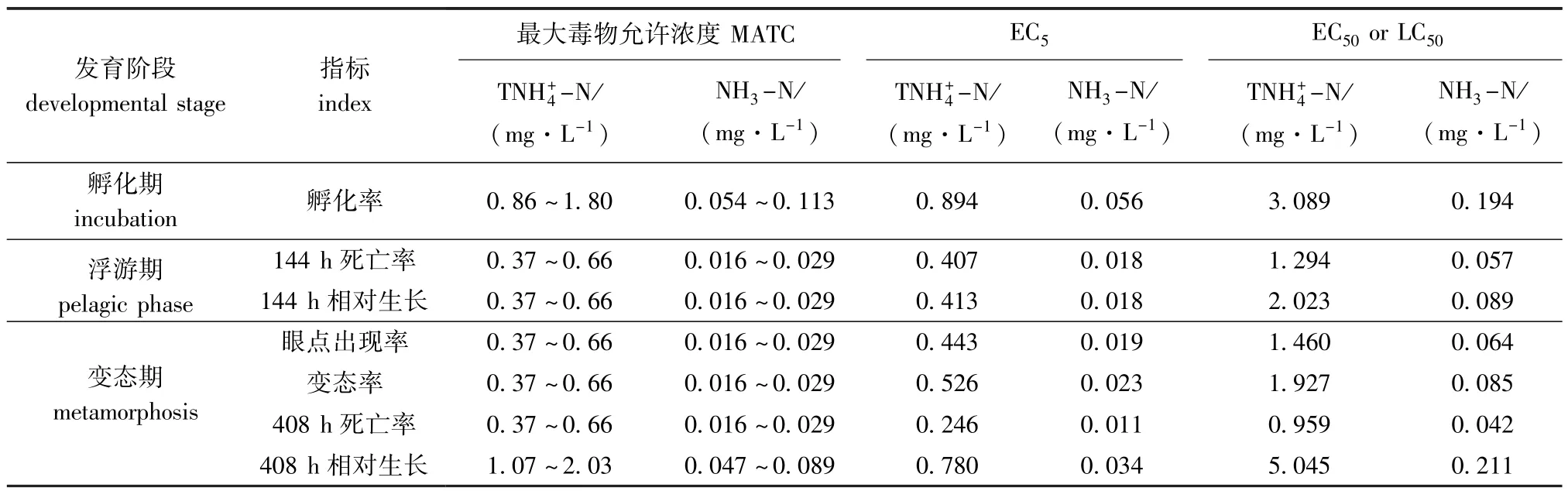
表7 海湾扇贝幼体不同发育阶段对总氨态氮的耐受性比较Tab.7TheN tolerance of larval bay scallop Argopecten irradians at different developmental stages
发育阶段developmental stage指标index最大毒物允许浓度MATC EC5EC50or LC50TNH+4-N/ (mg·L-1) NH3-N/ (mg·L-1) TNH+4-N/ (mg·L-1) NH3-N/ (mg·L-1) TNH+4-N/ (mg·L-1) NH3-N/ (mg·L-1)孵化期incubation孵化率0.86~1.80 0.054~0.113 0.894 0.056 3.089 0.194浮游期pelagic phase 144 h死亡率0.37~0.66 0.016~0.029 0.407 0.018 1.294 0.057 144 h相对生长0.37~0.66 0.016~0.029 0.413 0.018 2.023 0.089变态期metamorphosis眼点出现率0.37~0.66 0.016~0.029 0.443 0.019 1.460 0.064变态率0.37~0.66 0.016~0.029 0.526 0.023 1.927 0.085 408 h死亡率0.37~0.66 0.016~0.029 0.246 0.011 0.959 0.042 408 h相对生长1.07~2.03 0.047~0.089 0.780 0.034 5.045 0.211
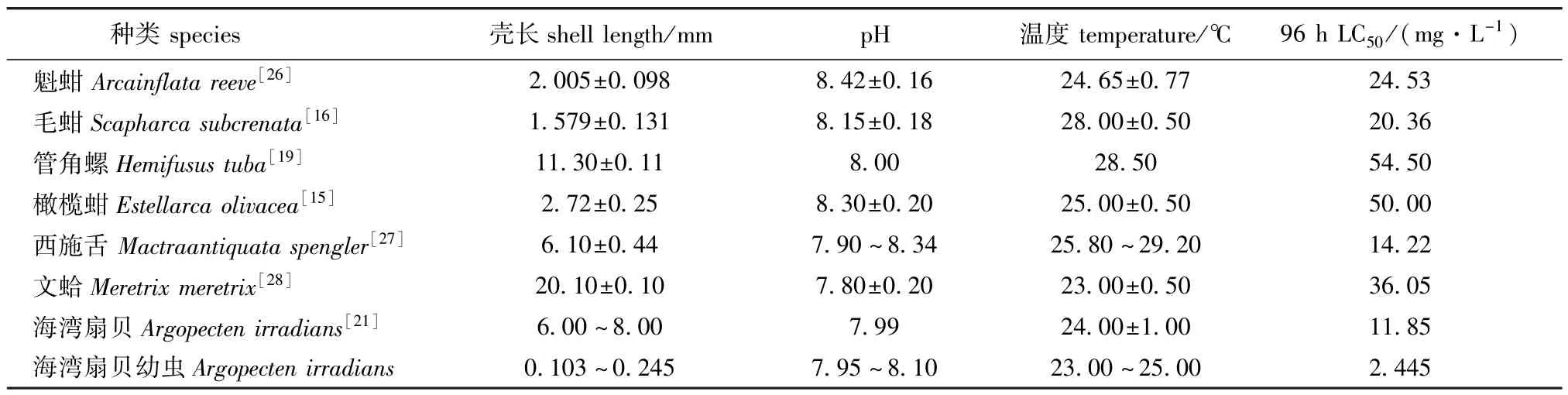
表8 总氨态氮对几种贝类的96 h LC50比较Tab.8Com parison of 96 h LC50of TNH+4-N among differentmolluscs
[1]颜昌宙,曾阿妍,金相灿,等.不同浓度氨氮对轮叶黑藻的生理影响[J].生态学报,2007,27(3):1050-1055.
[2]许秋瑾,金相灿,王兴民,等.氨氮与镉单一和复合作用对沉水植物穗花狐尾藻和轮叶黑藻光合能力的影响[J].环境科学, 2006,27(10):1974-1978.
[3]李跃华,王庆真,王让绪,等.氨氮对罗氏沼虾幼体的影响[J].水产养殖,1994(5):18-20.
[4]余瑞兰,聂湘平,魏泰莉,等.分子氨和亚硝酸盐对鱼类的危害及其对策[J].中国水产科学,1999,6(3):73-77.
[5]朱耘,吴圣杰,华丹.氨对草鱼生长的危害[J].水产学报, 1995,19(2):177-179.
[6]陈坚.环境生物技术[M].北京:中国轻工业出版社,1999.
[7]鲁增辉,王志坚,石蕊.氨氮对稀有鮈鲫胚胎和幼鱼的急性毒性研究[J].西南大学学报:自然科学版,2014,36(1):47-52.
[8]潘坤,王卫民,祝东梅.氨态氮、亚硝态氮、硝态氮对麦穗鱼的急性毒性研究[J].中国农学通报,2012,28(35):96-101.
[9]杜浩,危起伟,刘鉴毅,等.苯酚、Cu2+、亚硝酸盐和总氨氮对中华鲟稚鱼的急性毒性[J].大连水产学院学报,2007,22(2): 118-122.
[10]Dosdat A,Person-Le Ruyet J,Cov侉s D,etal.Effectof chronic ex-posure to ammonia on growth,food utilisation and metabolism of the European sea bass(Dicentrarchus labrax)[J].Aquatic Liv-ing Resources,2003,16(6):509-520.
[11]Cheng Changhong,Yang Fangfang,Ling Renzhi,et al.Effects of ammonia exposure on apoptosis,oxidative stress and immune re-sponse in pufferfish(Takifugu obscurus)[J].Aquatic Toxicolo-gy,2015,164:61-71.
[12]Sun Shengming,Ge Xianping,Zhu Jian,et al.Molecular cloning, immunohistochemical localization,characterization and expression analysis of caspase-8 from the blunt snout bream(Megalobrama amblycephala)exposed to ammonia[J].Fish&Shellfish Immu-nology,2015,47(2):645-654.
[13]Epifanio C E,Srna R F.Toxicity of ammonia,nitrite ion,nitrate ion,and orthophosphate to Mercenaria mercenaria and Crassostrea virginica[J].Marine Biology,1975,33(3):241-246.
[14]师尚丽,冯奕成,郑莲,等.不同pH和盐度下氨氮对方斑东风螺的毒性研究[J].湛江海洋大学学报,2005,25(6):36-40.
[15]张永普,肖国强,林立祝,等.pH和氨氮对橄榄蚶耐受性的影响[J].四川动物,2009,28(1):73-76.
[16]方军,闫茂仓,张炯明,等.pH和氨氮对毛蚶稚贝生长与存活影响的初步研究[J].浙江海洋学院学报:自然科学版,2008, 27(3):281-285.
[17]吕永林,张永普,单赛赛,等.不同温度条件下氨氮对泥蚶的急性毒性影响[J].浙江海洋学院学报:自然科学版,2012,31 (7):54-58,64.
[18]刘炎,姜东升,李雅洁,等.不同温度和pH下氨氮对河蚬和霍甫水丝蚓的急性毒性[J].环境科学研究,2014,27(9):1067-1073.
[19]罗杰,杜涛,刘楚吾,等.不同盐度、pH条件下氨氮对管角螺稚贝毒性影响[J].动物学杂志,2010,45(3):102-109.
[20]陈觉民,王恩明,李何.海水中某些化学因子对魁蚶幼虫、稚贝及成体的影响[J].海洋与湖沼,1989,20(1):15-22.
[21]杨凤,高悦勉,苏延明,等.海湾扇贝幼贝对pH和氨态氮的耐受性研究[J].大连水产学院学报,1999,14(3):13-18.
[22]栾红兵,兰锡禄.氨氮对海湾扇贝幼体的毒性试验[J].海洋科学,1990(1):64-65.
[23]国家海洋局.海洋监测规范[M].北京:海洋出版社,1991.
[24]陈炜,雷衍之,蒋双.离子铵和非离子氨对海蜇螅状幼体和碟状幼体的毒性研究[J].大连水产学院学报,1997,12(1):8-14.
[25]雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[26]张焕,宋国斌,齐晓陆,等.pH和氨氮对魁蚶稚贝生长与存活的影响[J].中国农业信息,2013(13):139-140.
[27]吴进锋,陈素文,陈利雄,等.硫化物和氨对西施舌幼贝的毒性影响研究[J].热带海洋学报,2006,25(1):42-46.
[28]陈坚,胡一箫,许丰瑞,等.氨氮和硫化物对文蛤幼体及成体的急性毒性试验[J].现代农业科技,2010(3):324-325,331. [29]国家环境保护局.GB 11607-1989渔业水质标准[S].北京:中国标准出版社,1990.
Im pact of total ammonia nitrogen on survival and grow th of larval and juvenile bay scallop Argopecten irradians
YUAN Hong-mei,YANG Chang-kui,YANG Feng,YAN Xi-wu
(College of Fisheries and Life Science,Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province,Dalian Ocean University, Dalian 116023,China)
The effect of total ammonia nitrogen evel on survival and growth of larval and juvenile bay scallop Arg-opecten irradianswas studied to regulatewater quality during bay scallop larva rearing.The results showed the 24 h median effective concentration(EC50)of total ammonia nitrogen was 3.089 mg/L(NH3-N=0.194 mg/L)for hatching rate,with themaximum acceptable toxicant concentration(MATC)of0.86-1.80 mg/L(NH3-N=0.054-0.113 mg/L)atwater temperature of(21.5依22.5)益,pH 8.20-8.30,and a salinity of27-28.The LC50of to-tal ammonia nitrogen for 2-day-old pelagic larvaewas7.801 mg/L(NH3-N=0.342 mg/L)in 48 h,2.445mg/L (NH3-N=0.107 mg/L)in 96 h,and 1.294 mg/L(NH3-N=0.057 mg/L)in 144 h,with EC50of 2.023 mg/L (NH3-N=0.089 mg/L)in 144 h at pH 7.95-8.10,temperature 23-25益and a salinity of 27-28.The pelagic larvae had maximum allowable toxicant concentration(MATC)of 0.37-0.66 mg/L(NH3-N=0.016-0.029 mg/L)and themetamorphic larvae were observed at total ammonia nitrogen concentrations of 2.03 mg/L(NH3-N臆0.089 mg/L)or lower.Duringmetamorphosis stages(from eye-spot larva to juvenile),there was 192 h EC50of 1.460 mg/L(NH3-N=0.064mg/L),408 h EC50of1.927mg/L(NH3-N=0.085mg/L).It is suggested that total ammonia nitrogen concentration be controlled under 0.40 mg/L(NH3-N=0.018 mg/L)at pH 7.95-8.10, which provides some reference for bay scallop developmental ecology and water quality control in larva rearing.
Argopecten irradians;total ammonia nitrogen;larva;development;growth;survival
S968.31
A海湾扇贝Argopecten irradians隶属于瓣鳃纲、异柱目、扇贝科、扇贝属,又称大西洋内湾扇贝。该扇贝具有生长速度快、养殖周期短、营养价值高的特点,为中国近海贝类养殖的主要品种。人工育苗技术是海湾扇贝养殖的基础,随着海湾扇贝养殖业的发展,其人工育苗技术也得到了迅速发展和推广。然而由于水环境污染、养殖密度过大,以及对养殖水环境状况缺乏了解和调控等原因,海湾扇贝的育苗效果波动较大,常常遭受重大经济损失。
10.16535/j.cnki.dlhyxb.2017.03.003
2095-1388(2017)03-0268-07
2017-01-12
现代农业产业技术体系建设专项(CARS-48)
袁洪梅(1989—),女,硕士研究生。E-mail:hongmei_yuan@sina.com
杨凤(1962—),女,教授。E-mail:yangfeng@dlou.edu.cn
