基于一步法萃取婴幼儿奶粉中游离态叶黄素和β-胡萝卜素研究
2017-06-19曾星星刘雪梅
郭 园,曾星星,刘雪梅,沈 遥,陈 波
(湖南师范大学植化单体开发与利用湖南省重点实验室,中国 长沙 410081)
基于一步法萃取婴幼儿奶粉中游离态叶黄素和β-胡萝卜素研究
郭 园†,曾星星†,刘雪梅,沈 遥,陈 波
(湖南师范大学植化单体开发与利用湖南省重点实验室,中国 长沙 410081)
为建立简单、快速、准确的样品前处理方法以提高婴幼儿奶粉中叶黄素和β-胡萝卜素的提取效率,通过显微镜观察奶粉样品中叶黄素包埋剂的溶解特性,采用有机溶剂一步萃取的方式替代传统耗时的皂化法.样品加水破除包埋剂,后续经乙醇溶解剩余被脂类成分包裹的包埋剂并沉淀蛋白,再用甲基叔丁基醚在单相中一步萃取叶黄素和β-胡萝卜素,方法无需浓缩,适用于高效液相色谱直接分析.结果表明,游离态叶黄素和β-胡萝卜素的线性相关系数均为0.999 9,加标回收率为91%~94%,且所有RSD<5%.
叶黄素;β-胡萝卜素;婴幼儿奶粉;样品前处理;一步萃取
类胡萝卜素具有延缓衰老、调节免疫、抗突变、预防癌症等多种生理功能[1-2],其中,天然叶黄素是优良的抗氧化剂,具有预防老年性黄斑区病变、预防白内障等独特功能[3].β-胡萝卜素是维生素A的重要来源,具有抗氧化以及增强免疫力等作用[4-5].叶黄素和β-胡萝卜素已经作为食品添加剂和营养增补剂广泛用于食品加工.2012年3月颁布的《食品营养强化剂使用标准》批准了叶黄素(万寿菊来源)可用于婴儿配方食品、较大婴儿和幼儿配方食品中,其添加量分别为300~2 000 μg/kg,1 620~4 230 μg/kg[6].
叶黄素和β-胡萝卜素均为含有多个异戊二烯单位的四萜化合物,对光、热、氧敏感,极易发生结构异构化.因此,叶黄素和β-胡萝卜素一般以其包埋体的方式添加到实际样品中[5].叶黄素和β-胡萝卜素的提取工艺一般为有机溶剂提取法、酶反应提取法、超声波辅助提取法等.有机溶剂提取法通常选用乙醚、石油醚等毒性较大的有机试剂,而且需要反复萃取多次,试剂消耗量大,萃取时间较长[4].近年来,也有研究应用皂化方法对叶黄素和β-胡萝卜素进行提取并同时测定,样品需求量少,对叶黄素而言,测定结果包含酯化的叶黄素和游离态的叶黄素,准确度高[7-8],但皂化过程依旧复杂、耗时,且操作过程因操作人员的技术水平差异很容易产生误差.本文从破除包埋剂、一步萃取的角度出发,采用溶剂直接溶解包埋剂,释放叶黄素和β-胡萝卜素,然后用溶剂一步萃取游离态叶黄素和β-胡萝卜素的方式,省去了耗时的皂化过程,且样品无需浓缩,简化了样品的前处理过程,大大缩短了样品前处理时间,方法简单、快速、准确.为婴幼儿奶粉中叶黄素和β-胡萝卜素的提取测定提供新的研究视角.
1 实验部分
1.1 仪器与试剂
仪器:岛津LC-20A高效液相色谱仪(配二极管阵列检测器),UV-1780紫外可见分光光度计(日本岛津公司);澳浦光电UB100i生物显微镜;TG 16G台式离心机(湖南凯达公司);WH-2微型旋涡混合仪;KQ5200B型超声波发生器(昆山超声仪器有限公司);AL204电子天平(上海梅特勒-托利多公司)等.
试剂:叶黄素和β-胡萝卜素标准品均为西亚试剂(成都格雷西亚化学技术有限公司),叶黄素包埋原料(雅培公司提供).甲醇、甲基叔丁基醚(均为色谱纯);抗坏血酸、无水乙醇、2,6-二叔丁基对甲酚(BHT)、石油醚、乙醚、氢氧化钾、二氯甲烷、氯仿、乙酸丁酯、正丁醇、丙酮(均为分析纯),水为去离子水.
1.2 色谱分离条件
色谱柱:大连江申ProntoSIL C30 (250 mm×4.6 mm, 5 μm);柱温:18 ℃;进样体积:30 μL;检测波长451 nm;流动相:A为甲醇,B为甲基叔丁基醚;梯度洗脱程序:0~6 min, 10%~45%B; 6~10 min, 45%~90% B; 10~12 min, 90%~10%B; 12~16 min, 10%B;流速:1.0 mL/min;总运行时间:16 min.
1.3 标准溶液的配制与标定
(1)标准储备液配制 分别称取叶黄素、β-胡萝卜素标准品2 mg(精确到0.001 g),用无水乙醇(色谱纯)溶解,分别定容至50 mL.
(2)标准溶液浓度标定 分别吸取标准储备液叶黄素500 μL,β-胡萝卜素5 mL,用无水乙醇(色谱纯)定容至10 mL作为校正液.用分光光度计全波长扫描,确定其最大吸收波长;在各自最大吸收波长下分别测定吸光度5次,以公式C=A×10 000/E计算其实际浓度.
(3)标准溶液色谱纯度测定 将校正液按1.2条件进行高效液相色谱(HPLC)测定,平行测定3次,通过面积归一法(叶黄素7~15 min,β-胡萝卜素12~15 min),得到标准品中全反式叶黄素和β-胡萝卜素的色谱纯度.标定后的标准溶液的浓度乘以其色谱纯度,即得到标准储备液中全反式叶黄素和β-胡萝卜素的实际浓度.
1.4 样品前处理方法
称取均匀固体样品2 g(精确到0.001 g)于50 mL聚四氟乙烯离心管中,加5 mL水涡旋溶解.在样品溶液中加入5 mL含0.1%BHT乙醇溶液涡旋振荡3次,1 min/次.再向样品溶液中加入10 mL含0.1%BHT甲基叔丁基醚溶液,涡旋3次,1 min/次.4 500 r/min下离心3 min使分层.将上层有机相转入25 mL容量瓶,甲基叔丁基醚定容.用0.45 μm微孔滤膜过滤至2 mL棕色进样瓶中,待HPLC分析.
2 结果与讨论
2.1 样品前处理方法优化
由于叶黄素、β-胡萝卜素易受光、热等因素的影响,性质不稳定,一般采用微胶囊技术对其进行包埋处理后再添加到实际样品中,直接用有机溶剂提取较困难[5,8].叶黄素和β-胡萝卜素的常用包埋剂有明胶、阿拉伯胶、酪蛋白酸钠、麦芽糊精、蔗糖、辛烯基琥珀酸淀粉酯等[9-12],均为水溶性包埋剂,但奶粉基质可能存在脂类成分包裹包埋剂的情况,此时水便无法破除被脂类成分包裹的包埋剂.基于一步法萃取的考虑,本实验考察水及多种极性有机溶剂对包埋剂的溶解情况,对比去除包埋剂后多种溶剂的提取效果.
2.1.1 包埋剂溶解溶剂的选择和优化 实验以叶黄素的包埋原料为代表模型,分别采用了乙酸丁酯、正丁醇、乙醇、丙酮、水共5种溶剂对原料包埋剂进行溶解破除,在显微镜下观察其溶解情况.通过显微镜的观察,叶黄素包埋原料在显微镜下呈现大量包裹有黄色块状物质的球形气泡状和少量零散的黄色块状颗粒(图1a),加入不同的溶剂后,原料逐渐呈现出不同的情形,如图1.直接加入正丁醇或乙酸丁酯时,显微镜下的气泡状颗粒没有明显变化(b);加入乙醇或丙酮时,气泡状颗粒随溶剂游动、聚集且随溶剂挥发逐渐破裂,其间的黄色物质释放出来,一段时间后,气泡状颗粒明显减少,黄色块状颗粒物明显增加(c,d);加入水时,视野中瞬时间就只剩下较分散的黄色块状颗粒物(e).显微镜的观察结果表明,水对于包埋剂的溶解效果最佳,乙醇和丙酮次之,因此选择水作为叶黄素和β-胡萝卜素的包埋剂溶解剂.
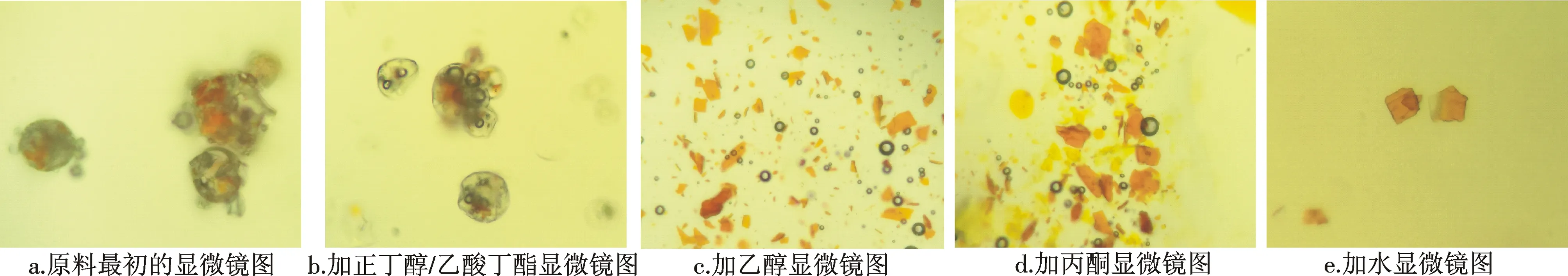
图1 不同溶剂对包埋剂的溶解情况的显微镜图Fig.1 Micrographs of embedded lutein in different solvents
2.1.2 萃取溶剂的选择和优化 在类胡萝卜素中,叶黄素属胡萝卜醇类,含有羟基,极性相对较强,而β-胡萝卜素属烃类,极性相对较弱,需要选择极性合适的溶剂同时实现二者的高提取率.基于奶粉基质中含有大量的蛋白和其他配方成分,考察了奶粉样品在水溶液中被分散并破除包埋剂后,直接用有机溶剂涡旋萃取并离心的情况,所用有机溶剂分别为二氯甲烷、乙醇、乙醚、甲基叔丁基醚、正丁醇、丙酮、氯仿、石油醚(图2).结果表明,奶粉加水后,直接加二氯甲烷/乙醚/甲基叔丁基醚/正丁醇/氯仿/石油醚形成乳状悬浊液,且离心后无明显变化(见图2 a,b,c,e,g,h),说明这些溶剂无法实现直接萃取;直接加乙醇或丙酮可使蛋白变性,离心后,蛋白层和溶剂层分层明显(见图2 d,f),但由图3 a,b可知,溶剂层中的叶黄素和β-胡萝卜素并未完全溶解.在此溶剂层的基础上,再选择的合适溶剂便可溶解该相中的叶黄素和β-胡萝卜素.
虽然乙醇和丙酮均可沉淀蛋白,但由于乙醇极性较大、毒性较低,且乙醇也能溶解部分被脂质所包裹的叶黄素包埋剂,使叶黄素完全释放出来,故在后续实验中选用乙醇以沉淀蛋白.

a.二氯甲烷;b.乙醚;c.石油醚;d.乙醇;e.正丁醇;f.丙酮;g.甲基叔丁基醚;h.氯仿图2 奶粉加水后多种有机溶剂直接萃取并离心现象对比图Fig.2 Comparison of milk water solution after various organic solvent extraction and centrifugation
以叶黄素包埋原料为例,进一步考察原料依次加入水和乙醇释放出叶黄素后,常用类胡萝卜素提取溶剂乙醇、二氯甲烷、甲基叔丁基醚对其的溶解提取效果.图3a表明依次加入水和乙醇后叶黄素以块状存在,并未完全溶解,在此基础上进一步加入萃取剂二氯甲烷(图3c)或者甲基叔丁基醚(图3d)后对比加入乙醇后(图3a)的显微镜结果表明,黄色块状颗粒逐渐溶解,溶液颜色明显变黄,说明合适的萃取溶剂可以将叶黄素有效地溶解提取出来.β-胡萝卜素的极性较叶黄素更弱,乙醇对其溶解和萃取效率将会更低,二氯甲烷毒性较大,不能直接进液相色谱仪分析,甲基叔丁基醚萃取液的液相色谱分析结果表明其对叶黄素和β-胡萝卜素的提取效果均较好;另外,加入甲基叔丁基醚离心后,有机相与水相分层,蛋白浮于两相分层处,便于操作,因此本文实验最终选择甲基叔丁基醚作为萃取溶剂.奶粉样品中叶黄素和β-胡萝卜素同时提取并分析的色谱图见图4.
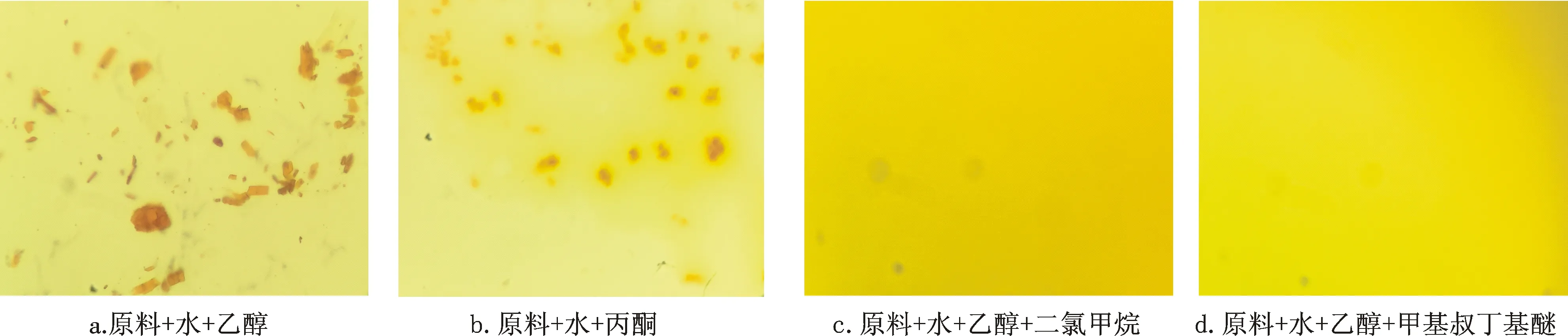
图3 多种萃取溶剂对叶黄素的提取显微镜图Fig.3 Micrographs of extraction of lutein by different solvents

图4 奶粉样品中叶黄素及β-胡萝卜素的同时分析色谱图 Fig.4 Chromatogram of simultaneous determination of lutein and β-carotene in sample
2.2 色谱分离条件优化
若要在尽量短的时间内对二者同时分析,则必须采用梯度洗脱.对叶黄素进行定量计算时,通常把13-顺式和13′-顺式的两个顺式叶黄素也共同纳入计算[13],因此梯度条件还须保证三个顺反式叶黄素的分离.实验以10%甲基叔丁基醚为起始比例,后逐步增加甲基叔丁基醚至45%先洗脱出叶黄素,再增加甲基叔丁基醚到90%洗脱出β-胡萝卜素,较好地实现了对叶黄素三个顺反异构体及β-胡萝卜素的分离(见图4).
2.3 标准曲线
分别准确吸取1.3中已标定的叶黄素和β-胡萝卜素标准储备液适量进行稀释,稀释后的浓度分别为0.038 44,0.048 05,0.096 11,0.192 2,0.480 5,0.961 1 mg/L和0.027 79,0.055 59,0.139 0,0.277 9,0.555 9,1.390 mg/L,按1.2条件进行测定.标准溶液标定结果及标准曲线线性见表1.

表1 标准溶液标定及标准曲线线性
2.4 加标回收率
在已知含量的奶粉样品中分别进行叶黄素和β-胡萝卜素的高、中、低3个浓度水平的加标,每组做3个平行,每个平行连续分析3次,平均加标回收率范围分别为91.80%~93.46%和91.94%~94.22%,全部RSD<5%(见表2).与文献方法[7]中的加标回收率80%~90%相比,本方法回收率良好.

表2 加标回收率结果
2.5 精密度与准确度
对比本方法与文献方法[7]中的皂化方法对市售奶粉中叶黄素和β-胡萝卜素进行测定,每个样品做6组平行样,每组平行样连续分析3次,测定结果见表3,本方法RSD<6%,精密度良好.方法还对不同厂家的不同配方奶粉进行了广泛的验证,结果表明本文提出的方法对于基础配方奶粉中叶黄素和β-胡萝卜素的测定有明显的简便、快速、准确的优势,但对于某些特殊工艺的配方奶粉(如样品3)中叶黄素和β-胡萝卜素的测定结果则稍稍偏低,这可能是由于在特殊配方的复杂工艺中少量添加的叶黄素和β-胡萝卜素以酯化形式存在而造成的.

表3 样品测定结果
3 结论
本文对婴幼儿配方奶粉的前处理方法进行研究,省去了耗时的皂化方法,从破除包埋剂、一步萃取的角度出发,用水溶解包埋剂,释放出叶黄素和β-胡萝卜素,乙醇沉淀蛋白,再采取甲基叔丁基醚直接提取的方式,建立了快速、准确测定样品中游离态叶黄素和β-胡萝卜素的方法.本方法与文献中的皂化方法对市售奶粉的检测结果对比表明,该方法尽管在某些生产商的特殊配方奶粉测定中稍显不足,但是对市场占有率最大的各生产商基础配方奶粉中叶黄素和β-胡萝卜素分析时则有明显的优势:步骤简单,速度快,结果准确度高,精密度好.
[1] 李永纪. 类胡萝卜素的生理功效[J]. 微量元素与健康研究, 2006,23(6):73-73.
[2] 王永华, 梁世中. 类胡萝卜素的结构和生理功能研究[J]. 现代食品科技, 2000,16(4):1-4.
[3] 朱海霞, 郑建仙. 叶黄素(Lutein)的结构、分布、物化性质及生理功能[J]. 中国食品添加剂, 2005(5):48-55.
[4] 朱秀灵, 车振明, 徐 伟, 等.β-胡萝卜素的生理功能及其提取技术的研究进展[J]. 现代食品科技, 2004,20(2):158-162.
[5] 王丽娟, 张 慧, 张立冬, 等.β-胡萝卜素的研究进展及应用[J]. 中国食品添加剂, 2013(S1):148-152.
[6] GB14880-2012, 食品营养强化剂使用标准[S].
[7] 郑菲菲, 陶保华, 赖世云, 等. 高压液相色谱法同时测定婴幼儿配方乳粉中的叶黄素和β-胡萝卜素[J]. 食品安全质量检测学报, 2014,5(1):227-234.
[8] 黄百芬, 郑 凯, 谭 莹, 等. 高效液相色谱法同时测定婴幼儿食品和乳品中的叶黄素、α-胡萝卜素和β-胡萝卜素[J]. 中国卫生检验杂志, 2012,22(9):2043-2045.
[9] QV X Y, ZENG Z P, JIANG J G. Preparation of lutein microencapsulation by complex coacervation method and its physicochemical properties and stability[J]. Food Hydrocoll, 2011,25(6):1596-1603.
[10] 李世伟, 石睿杨, 马春颖, 等. 复合凝聚β-胡萝卜素微胶囊制备工艺研究[J]. 食品与机械, 2012,28(6):209-213.
[11] LI D J, SONG J F, LIU C Q. Stereoisomers identification and storage stability of microencapsulated marigold lutein[J]. Int J Food Prop, 2015,18(1):178-185.
[12] 代志凯, 周 迪, 刘爱琴, 等. 辛烯基琥珀酸淀粉酯制备高含量β-胡萝卜素微胶囊[J]. 中国食品添加剂, 2013(3):180-185.
[13] 郑国建, 关 岩, 杨 方, 等. 高效液相色谱法检测婴幼儿奶粉中的叶黄素[J]. 中国乳品工业, 2016,44(1):51-53.
[14] MACHMUDAH S, GOTO M. Methods for extraction and analysis of carotenoids[C]//RAMAWAT K G, MRILLON J M. Natural Products: Phytochemistry, Botany and Metabolism of Alkaloids, Phenolics and Terpenes. Heidelberg:Springer Berlin Heidelberg, 2013:3367-3411.
(编辑 WJ)
One-Step Extraction of Free Lutein andβ-Carotene from Infant Formula
GUOYuan†,ZENGXing-xing†,LIUXue-mei,SHENYao*,CHENBo
(Key Laboratory of Phytochemical R&D of Hunan Province, Hunan Normal University, Changsha 410081, China)
We report, in this work, the establishment of a simple, rapid and accurate sample pretreatment method to improve the extraction efficiency of lutein andβ-carotene in infant milk powder. To replace the time-consuming saponification method, dynamic dissolution processes of different solvents for embedding materials of lutein and simultaneous extraction of lutein andβ-carotene by organic solvents were inspected using a microscope. Using water to dissolve the embedding material to free lutein andβ-carotene and ethanol to precipitate proteins, we show that the sample can be extracted by methyl tert-butyl ether in monophase. After that, the extraction solution could be analyzed by HPLC without concentration. The calibration curve of free lutein andβ-carotene exhibited good linearity, with bothr2equal to 0.999 9. Recoveries ranged from 91% to 94%, and relative standard deviations (RSDs) are less than 5%.
lutein;β-carotene; infant formula; sample pretreatment; one-step extraction
2016-07-10
国家自然科学基金项目(21575040)
10.7612/j.issn.1000-2537.2017.03.010
R155
A
1000-2537(2017)03-0053-05
†这两位作者对本论文的贡献值相同
*通讯作者,E-mail:lvy33@163.com,
