调节因子X5及其复合物的研究进展*
2017-06-19赵杨静谢兴旺王荟闫美娜邵启祥
赵杨静,谢兴旺,王荟,闫美娜,邵启祥
(1.江苏大学医学院,江苏镇江 212013;2.北京大学人民医院北京大学肝病研究所,丙型肝炎及肝病免疫治疗北京市重点实验室,北京 100044)
·综述·
调节因子X5及其复合物的研究进展*
赵杨静1,2,谢兴旺2,王荟1,闫美娜1,邵启祥1
(1.江苏大学医学院,江苏镇江 212013;2.北京大学人民医院北京大学肝病研究所,丙型肝炎及肝病免疫治疗北京市重点实验室,北京 100044)
调节因子X5(regulatory factor X5,RFX5)是在人体广泛表达的DNA结合蛋白,它通过结合RFXB和RFXAP形成RFX复合物,主要功能是转录调控主要组织相容性复合体MHCⅡ类基因。研究发现,RFX5还具有转录调控非MHC类靶基因的功能,尤其是与肿瘤相关的研究提示,RFX5可能在免疫系统和肿瘤进程中发挥重要的跨界分子作用。该文综述了RFX5及其组成RFX复合物的生物学特性,以及在裸淋巴细胞综合征、动脉粥样硬化和肿瘤等疾病中RFX5转录调控靶基因的研究进展。
调节因子X5;RFX复合物;转录调控;靶基因;肿瘤
调节因子X5(regulatory factor X5, RFX5)是Steimle等[1]在1995年首次从Ⅱ型C群裸淋巴综合症(bare lymphocyte syndrome type Ⅱ complementation group C,BLS)患者来源的细胞系(SJO)cDNA表达文库中分离得到,是RFX基因家族成员之一。RFX复合物最初是从MHCⅡ类分子阳性的B细胞核提取物中被识别的异源三聚体,由RFX5、含锚蛋白重复序列的RFX(RFX containing ankyrin repeats,RFXB,亦称RFXANK)和RFX相关蛋白(RFX-associated protein,RFXAP)3个亚基组成,分子量(Mr)分别为75、33和41,其中具有DNA结合和核转运能力的RFX5在三聚体中发挥最主要的作用。RFX蛋白以结合主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类基因启动子区高度保守的顺式作用元件X盒而得名,含76个超保守氨基酸序列的DNA结合域(DNA binding domain,DBD),是一类具有特殊功能和作用模式的DNA结合蛋白[2-3]。近年来的研究发现,RFX5还具有转录调控非MHC类靶基因的功能。本文旨在对RFX5及其参与形成RFX复合物的生物学特性,以及RFX5转录调控靶基因及相关疾病等方面的研究进展作一综述。
1 RFX5和RFX复合物的生物学特性
1.1 经典作用模式 RFX复合物可促进其他转录因子结合MHCⅡ类基因上游调节区的保守序列(conserved upstream sequences,CUS),并增强结合的特异性和亲和力,在MHCⅡ类基因转录过程发挥关键作用。有学者认为RFX5可结合预先装配的RFXB和RFXAP,形成RFX复合物结合S、X1盒;也有学者认为携有核定位信号(nuclear localization signals,NLS)的RFX5和RFXAP在胞浆先结合并转运至胞核,再与核定位能力弱的RFXB结合[3]。RFX复合物招募X2BP(X2 box binding proteins)、NF-Y(nuclear factor Y)形成MHC Ⅱ增强体(MHC Ⅱ enhanceosome),提供了一个供CⅡTA(class Ⅱ transactivator)结合的平台,进而由CⅡTA募集其他通用调节因子形成转录体启动转录和延伸,最终促进MHCⅡ类分子表达(图1)[4-6]。还有研究表明,RFX复合物以类似机制参与MHC Ⅰ类和MHC附属基因(如β2微球基因)的转录调控[7]。
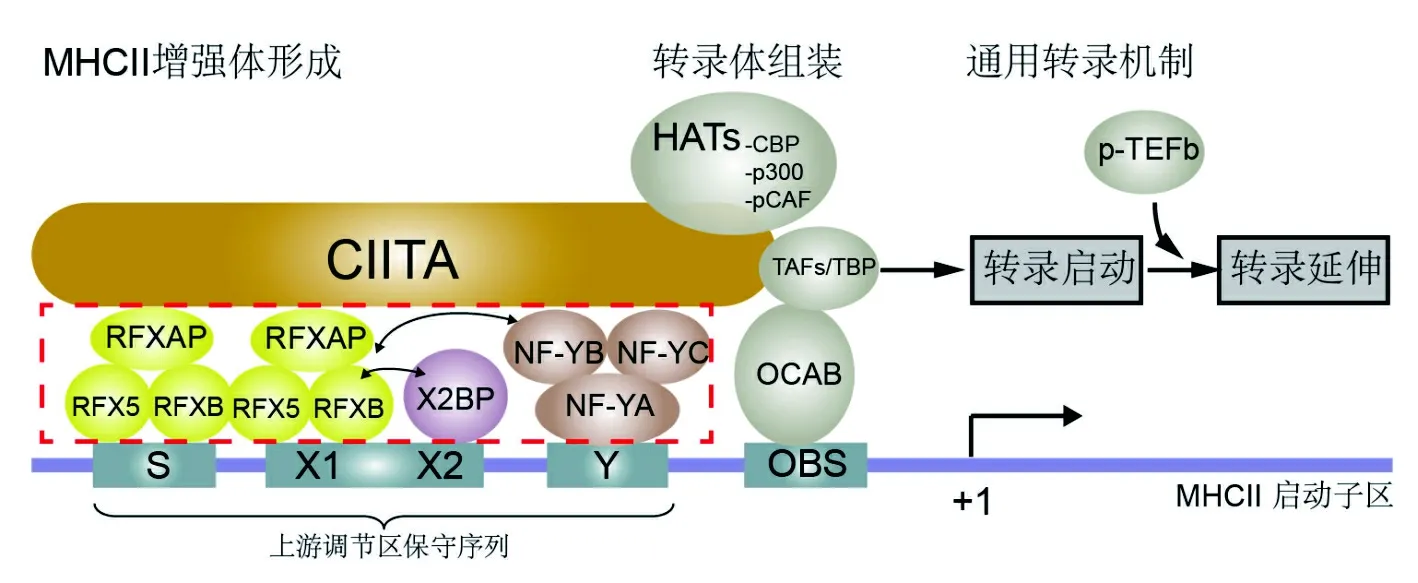
图1 MHCⅡ类基因的转录调控示意图
1.2 基本蛋白质结构与功能 RFX复合物的3个亚基蛋白结构各异且存在交互作用,是RFX复合物在MHCⅡ增强体中发挥与DNA结合、蛋白质间相互作用和反式激活功能的必要结构基础[8]。RFX5蛋白由616个氨基酸构成,分为5个功能区:寡聚化结构域(oligomerization domain,OD)、DNA结合域(DBD)、螺旋形结构域(helical domain,HD)、富含脯氨酸的区域(proline-rich region,P-rich)和反式激活区域(transactivation domain,AD)。见图2。所有功能域发挥各自功能,促进RFX复合物的募集及与其他MHCⅡ基因调节因子的相互作用。OD功能域能调节RFX复合物的二聚化并结合其他RFX复合物成员,利用化学筛选点突变方法,发现OD区含有1个亮氨酸富集二聚基序(62-LYLYLQL-68),其突变使得RFX5的DNA-蛋白质结合和反式激活功能丧失[9],L66A点突变会阻断了RFX5二聚体和DNA环(DNA loop)的形成[10]。DBD是RFX复合物最主要的DNA结合域,包括3个α螺旋(H)、β链(S)和连接线(L),连接顺序为H1-S1-H2-L1-H3-L2-S2-W1-S3,L3连接S2和S3形成疏水核侧翼W1,W1和H3分别与对称回文结构X1盒的主沟和小沟作用。DBD中高度保守的9个残基直接或由水介导接触DNA序列,从而实现DNA-蛋白质相互作用,与X1盒的5′端和中心序列结合的区域[11]。有研究推测在BLS患者来源的Ker细胞中DBD功能域的R149Q点突变会导致BLS第5个互补群[12]。HD、P-rich和AD功能域参与RFX5和MHCⅡ增强子其他组分的相互作用,协助MHCⅡ基因的转录[8,10]。AD功能域存在一种小型的DNA结合蛋白基序——AT-hook,其突变会明显抑制人HLA-DQ基因表达[13];此外,还有1个非典型双NLS,其可协助RFX5蛋白高效转运入核发挥作用[3]。RFXB蛋白是由260个氨基酸组成的蛋白质,N端含有与短寿命蛋白相关的PEST(proline/glutamic acid/serine/threonine)结构域同源的功能未知区域,但缺失PEST的保守末端序列,所以无短寿命蛋白的特性。RFXB蛋白最小功能区是C端含有的4个锚蛋白重复序列(ankyrin repeats),构成β-发夹环(β-hairpin loops)和内螺旋(inner helices)使其结合RFX5和RFXAP。PEST区和锚蛋白之间有一段区域(第69~123个氨基酸)能够交联到X1盒3′端[8]。见图2。RFXAP是由272个氨基酸组成的蛋白质,最小功能区是C端第184~266个氨基酸,包含富含谷氨酰胺功能域(Q-rich region),参与结合RFX5和RFXB,且RFXAP广泛结合于X1盒全长[8,14]。
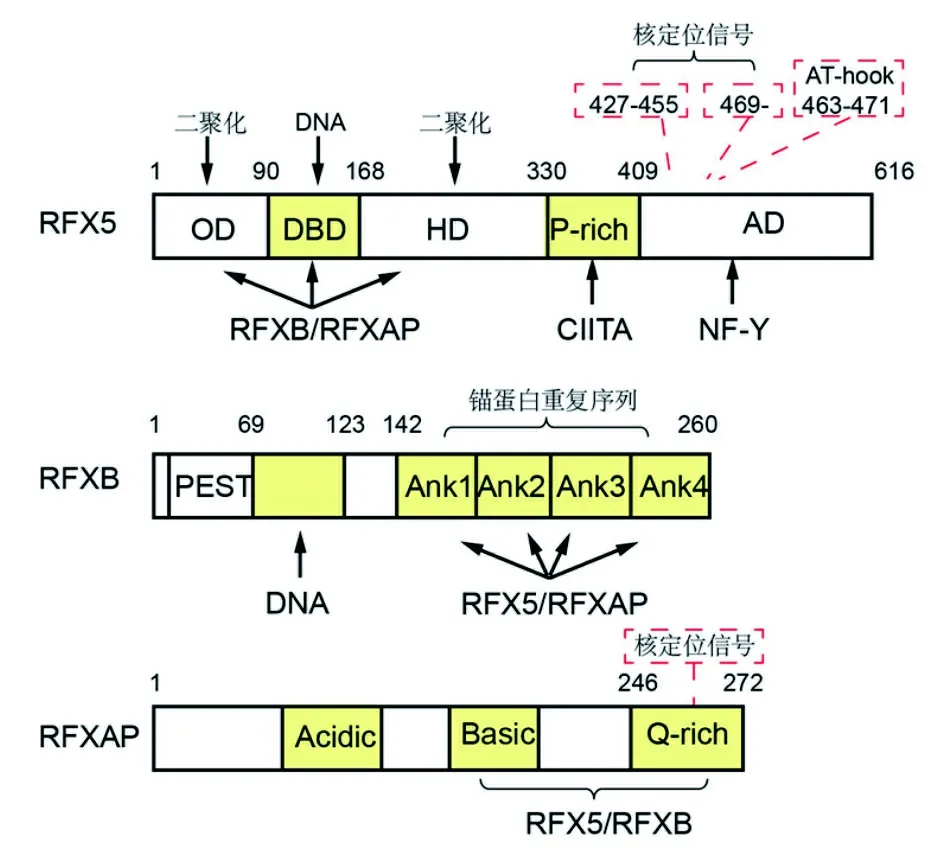
注:功能域名称在条框中标出,箭头和括号表示功能和相互作用。
图2 RFX复合物蛋白功能域示意图
1.3 复合物模型 通过分析RFX复合物低聚态和组分比例发现,RFXB和RFXAP是单体,RFX5通过OD功能域形成二聚体。RFX复合物化学计算比例为RFX5·RFXAP·RFXB(2∶1∶1),或通过RFX5的OD功能域再结合1个RFX5二聚体(4∶1∶1)。RFX复合物有3种DNA结合模型[10]。模型1:2个RFX复合物通过RFX5的功能域二聚化交互结合到S和X1盒;模型2:RFX复合物结合X1盒,RFX5结合S盒,因此S盒序列突变不影响RFX复合物结合MHCⅡ启动子区;模型3:也称为DNA环模型,MHCⅡ基因的转录调控可以受远端X1盒的调控,2个RFX复合物分别结合近端和远端的X1盒形成DNA环,DNA环能募集MHCⅡ基因的远端顺式作用元件,直接影响附近MHCⅡ基因染色质结构和表达[15]。见图3。
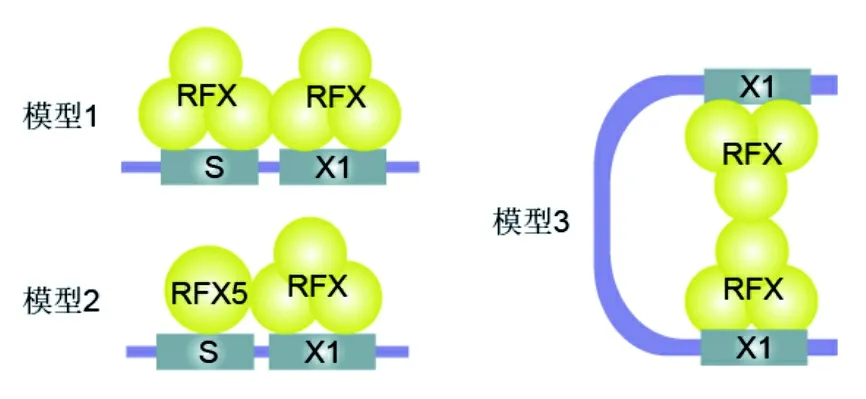
图3 RFX复合物DNA结合模型示意图
2 RFX5与疾病
2.1 RFX5与MHCⅡ类分子缺陷症 MHCⅡ类分子表达调节严格依赖于RFX复合物和CⅡTA,任一调控基因突变产生截短蛋白或无效蛋白,使MHCⅡ类分子表达缺陷和CD4+T细胞活化障碍,不能有效地产生免疫应答,导致MHCⅡ类分子缺陷症(也称BLS)[16]。BLS是一种罕见的原发性常染色体隐性免疫缺陷病,患者典型临床表现为严重的复发性感染,包括胃肠道和泌尿道功能异常,其主要诊断方法是检测各种类型的细胞表面MHCⅡ分子的表达。BLS是一种单基因病,即单个缺陷基因可导致所有临床表现。根据MHCⅡ调节基因突变体不同,BLS可分为A、B、C和D 4个互补群,对应的突变基因分别是CⅡTA、RFXB、RFX5和RFXAP。目前RFX5、RFXAP和RFXB基因已分别被鉴定出6个、3个和9个导致MHCⅡ类分子表达缺陷的突变位点,其中突变频率最高的是RFXB基因5号和6号外显子之间26个碱基缺失(752delG-25)。因此,针对RFX复合物和CⅡTA等遗传分子和淋巴细胞标志物的检测方法将有助于BLS疾病的检出和诊断。目前BLS患者首选治疗方案是同种异体造血干细胞移植,理论上将外源野生型RFX基因导入对应BLS患者造血干细胞可作为BLS基因治疗的策略[14,17-19]。
2.2 RFX5与动脉粥样硬化 MHCⅡ类分子只表达于特定抗原提呈细胞表面,而RFX5在人体各组织中广泛表达,甚至在MHCⅡ类分子阴性的细胞中也检测到RFX5表达[1,18],理论上一个转录因子可以同时调控多个靶基因[20],因此RFX5还有可能具有转录调控非MHC类靶基因的功能。
Ⅰ型胶原基因是第1个被发现的RFX5非MHC类靶基因,胶原基因转录起始位点有与MHC基因X盒的同源序列。人纤维细胞中RFX蛋白有2条通路抑制胶原基因表达:RFX5通过干扰素γ(interferon γ,IFN-γ)和RFX1经甲基化方式抑制Ⅰ型胶原基因转录和表达。炎症过程中,血管平滑肌细胞可分泌IFN-γ促进人纤维细胞中RFX复合物表达和核转运,参与形成RFX5/HDAC2/Sin3B/G9a复合物,通过类似调控MHCⅡ类基因的动力学,结合胶原基因COL1A2的转录起始位点,抑制Ⅰ型胶原基因转录,从而抑制瘢痕和纤维化,是动脉粥样硬化斑块失稳和破裂的关键环节。因此,靶向RFX5复合物是潜在的抗动脉粥样硬化的治疗方法[21-23]。然而,在平滑肌细胞中,组蛋白脱乙酰酶SIRT1能通过负向调控RFX5活性,拮抗RFX5对COL1A2的抑制作用[24]。
2.3 RFX5与肿瘤 研究显示,RFX5参与错配修复过程,纯化重组的RFX5能在体外实验中激活5′→3′错配剪切修复系统,敲减RFX5后细胞出现微卫星不稳定现象。其机制可能是RFX5作为转录因子调控错配修复因子,或RFX复合物(尤其是RFXB)可参与染色质重塑,有助于错配剪切[25]。
RFX5编码基因位于的染色体1q21区段,在多种癌前和癌变疾病中发生高频率染色体变异,肿瘤细胞此区段RFX5编码基因突变,会导致肿瘤细胞MHCⅡ类分子表达完全缺失,有助于肿瘤细胞逃避免疫监视[26]。在结直肠癌中,MHCⅡ调控基因发生编码微卫星突变,其中RFX5基因突变率最高,因此有学者提出RFX5、RFXB和RFXAP体细胞突变,可能引起高水平微卫星不稳定,最终导致MHCⅡ类分子在肿瘤细胞中的表达缺失,从而有助于肿瘤细胞的免疫逃逸[27-28]。本课题组研究发现RFX5在6种消化系统肿瘤(食管鳞状细胞癌、胃腺癌、结肠腺癌、直肠腺癌、肝细胞肝癌和胰腺腺癌)组织中mRNA和蛋白质水平均明显高于癌旁组织,且在胃腺癌和肝细胞肝癌中的上调最为明显。RFX5 mRNA水平在384例胃腺癌组织和371例肝细胞肝癌组织中均显著高于其癌旁组织,差异有统计学意义(P<0.01)。癌症组织芯片结果显示,RFX5蛋白在胃腺癌组织中2例中度表达和3例强阳性,在肝细胞肝癌中3例中度表达和2例强阳性,而在其配对癌旁组织中表达水平均较弱[29]。Zhou等[30]通过分析HBV和HCV相关肝细胞癌样本的表达谱芯片数据,发现RFX5在两种肝癌基因表达失调网络中均发挥重要调节作用,并推测RFX5转录调节功能可能与肝细胞癌变进程相关。最近,本课题组研究结果进一步证实,RFX5在肝细胞肝癌细胞和组织中过度表达,却不能上调MHCⅡ类基因表达,而是通过转录激活肿瘤相关基因TPP1(tripeptidyl peptidaseⅠ)过度表达,其表达水平与肝癌患者预后相关,从而参与促进HCC的发生、发展[31]。Sethi等[32]通过生物信息学分析ENCODE数据库中ChIP-Seq数据,预测在角化细胞中抑癌基因p63能结合在RFX5基因上游的远端调节子,两者相互作用形成转录反馈环并调节p63结合靶点。RFX5 mRNA和蛋白质倾向于表达在p63富集的人表皮细胞,进一步佐证RFX5和p63两者可能在细胞增殖和分化等多种生物进程中存在紧密联系[33]。
3 小结及展望
经典的研究认为RFX复合物通过3个亚基的精密协作,参与MHCⅡ类分子表达调控,发挥调节免疫应答的功能。近年来的研究发现,这种MHCⅡ类基因转录严格依赖的DNA结合蛋白,可能在非MHC类靶基因转录中也发挥重要作用,如在生理状态中具有调控胶原基因和参与DNA错配修复等功能;在肿瘤中RFX基因突变,尤其RFX5基因突变,可能通过改变MHCⅡ类分子表达,促进肿瘤细胞逃避免疫监视,或直接调控其他肿瘤相关基因参与癌变进程。因此,在RFX5及其组成RFX复合物现有的认识基础上,探索其在肿瘤等疾病中转录调控非MHC靶基因的作用和功能有可能成为今后研究的热点。
[1]Steimle V, Durand B, Barras E,etal. A novel DNA-binding regulatory factor is mutated in primary MHC class Ⅱ deficiency (bare lymphocyte syndrome)[J]. Genes Dev, 1995, 9(9):1021-1032.
[2]Aftab S, Semenec L, Chu JS,etal. Identification and characterization of novel human tissue-specific RFX transcription factors[J]. BMC Evol Biol, 2008, 8:226.
[3]Nagarajan UM, Long AB, Harreman MT,etal. A hierarchy of nuclear localization signals governs the import of the regulatory factor X complex subunits and MHC class Ⅱ expression[J]. J Immunol, 2004, 173(1):410-419.
[4]Beaulieu YB, Leon Machado JA, Ethier S,etal. Degradation, promoter recruitment and transactivation mediated by the extreme N-terminus of MHC Class Ⅱ transactivator CⅡTA isoform Ⅲ[J]. PLoS One, 2016, 11(2):e148753.
[5]Nekrep N, Fontes JD, Geyer M,etal. When the lymphocyte loses its clothes[J]. Immunity, 2003, 18(4):453-457.
[6]Devaiah BN, Singer DS. CIITA and its dual roles in MHC gene transcription[J]. Front Immunol, 2013, 20(4):476.
[7]Meissner TB, Liu YJ, Lee KH,etal. NLRC5 cooperates with the RFX transcription factor complex to induce MHC class I gene expression[J]. J Immunol, 2012, 188(10):4951-4958.
[8]Desandro AM, Nagarajan UM, Boss JM. Associations and interactions between bare lymphocyte syndrome factors[J]. Mol Cell Biol, 2000, 20(17):6587-6599.
[9]Laird KM, Briggs LL, Boss JM,etal. Solution structure of the heterotrimeric complex between the interaction domains of RFX5 and RFXAP from the RFX gene regulatory complex[J]. J Mol Biol, 2010, 403(1):40-51.
[10]Garvie CW, Stagno JR, Reid S,etal. Characterization of the RFX complex and the RFX5 (L66A) mutant: implications for the regulation of MHC class II gene expression[J]. Biochemistry, 2007, 46(6):1597-1611.
[11]Gajiwala KS, Chen H, Cornille F,etal. Structure of the winged-helix protein hRFX1 reveals a new mode of DNA binding[J]. Nature, 2000, 403(6772):916-921.
[12]Nekrep N, Jabrane-Ferrat N, Wolf HM,etal. Mutation in a winged-helix DNA-binding motif causes atypical bare lymphocyte syndrome[J]. Nat Immunol, 2002, 3(11):1075-1081.
[13]Stavride P, Arampatzi P, Papamatheakis J. Differential regulation of MHCⅡ genes by PRMT6, via an AT-hook motif of RFX5[J]. Mol Immunol, 2013, 56(4):390-398.
[14]Waldburger JM, Masternak K, Muhlethaler-Mottet A,etal. Lessons from the bare lymphocyte syndrome: molecular mechanisms regulating MHC class Ⅱ expression[J]. Immunol Rev, 2000, 178:148-165.
[15]Krawczyk M, Peyraud N, Rybtsova N,etal. Long distance control of MHC class II expression by multiple distal enhancers regulated by regulatory factor X complex and CⅡTA[J]. J Immunol, 2004, 173(10):6200-6210.
[16]Wong D, Lee W, Humburg P,etal. Genomic mapping of the MHC transactivator CⅡTA using an integrated ChIP-seq and genetical genomics approach[J]. Genome Biol, 2014, 15(10):494.
[17]Ting JP, Trowsdale J. Genetic control of MHC class Ⅱ expression[J]. Cell, 2002, 109(Suppl):S21-S33.
[18]Hanna S, Etzioni A. MHC class Ⅰ and Ⅱ deficiencies[J]. J Allergy Clin Immunol, 2014, 134(2):269-275.
[19]Ouederni M, Vincent QB, Frange P,etal. Major histocompatibility complex class Ⅱ expression deficiency caused by a RFXANK founder mutation: a survey of 35 patients[J]. Blood, 2011, 118(19):5108-5118.
[20]Macquarrie KL, Fong AP, Morse RH,etal. Genome-wide transcription factor binding: beyond direct target regulation[J]. Trends Genet, 2011, 27(4):141-148.
[21]Xu Y, Sengupta PK, Seto E,etal. Regulatory factor for X-box family proteins differentially interact with histone deacetylases to repress collagen alpha2(I) gene (COL1A2) expression[J]. J Biol Chem, 2006, 281(14):9260-9270.
[22]Xu Y, Wang L, Buttice G,etal. Interferon epression of collagen (COL1A2) transcription is mediated by the RFX5 complex[J]. J Biol Chem, 2003, 278(49):49134-49144.
[23]Weng X, Cheng X, Wu X,etal. Sin3B mediates collagen type I gene repression by interferon gamma in vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2014, 447(2):263-270.
[24]Xia J, Wu X, Yang Y,etal. SIRT1 deacetylates RFX5 and antagonizes repression of collagen type I (COL1A2) transcription in smooth muscle cells[J]. Biochem Biophys Res Commun, 2012, 428(2):264-270.
[25]Zhang Y, Yuan F, Wang D,etal. Identification of regulatory factor X as a novel mismatch repair stimulatory factor[J]. J Biol Chem, 2008, 283(19):12730-12735.
[26]Villard J, Reith W, Barras E,etal. Analysis of mutations and chromosomal localisation of the gene encoding RFX5, a novel transcription factor affected in major histocompatibility complex classⅡ deficiency[J]. Hum Mutat, 1997, 10(6):430-435.
[27]Michel S, Linnebacher M, Alcaniz J,etal. Lack of HLA class Ⅱ antigen expression in microsatellite unstable colorectal carcinomas is caused by mutations in HLA class Ⅱ regulatory genes[J]. Int J Cancer, 2010, 127(4):889-898.
[28]Surmann EM, Voigt AY, Michel S,etal. Association of high CD4-positive T cell infiltration with mutations in HLA class Ⅱ-regulatory genes in microsatellite-unstable colorectal cancer[J]. Cancer Immunol Immunother,2015, 64(3):357-366.
[29]赵杨静,谢兴旺,张恒辉,等.调节因子X5在消化系统肿瘤中高表达[J]. 江苏大学学报(医学版), 2016, 2(26):168-171.
[30]Zhou X, Zhu HQ, Lu J. Regulation of gene expression in HBV- and HCV-related hepatocellular carcinoma: integrated GWRS and GWGS analyses[J]. Int J Clin Exp Med, 2014, 7(11):4038-4050.
[31]Zhao Y, Xie X, Liao W,etal. The transcription factor RFX5 is a transcriptional activator of theTPP1 gene in hepatocellular carcinoma[J]. Oncol Rep, 2017, 37(1):289-296.
[32]Sethi I, Sinha S, Buck MJ. Role of chromatin and transcriptional co-regulators in mediating p63-genome interactions in keratinocytes[J]. BMC Genomics, 2014, 15:1042.
[33]Gulati N, Krueger JG, Suárez-Farias M,etal. Creation of differentiation-specific genomic maps of human epidermis through laser capture microdissection[J]. J Invest Dermatol, 2013, 133(11):2640-2642.
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.05.10
国家自然科学基金面上项目(81541151,81372221,81671541,81273202);江苏省临床医学科技专项(BL2013024)。
赵杨静,1990年生,女,博士研究生,研究方向:肿瘤相关基因和肿瘤免疫学。
邵启祥,教授,博士,E-mail:shao_qx@ujs.edu.cn。
Q344+.14
A
2017-02-16)
