miR-133b在前列腺癌中的表达及其对肿瘤细胞增殖的影响
2017-06-19彭鲁林聪
彭鲁,林聪
(1.南京医科大学附属脑科医院检验科,南京 210009;2.南京医科大学第一附属医院麻醉科,南京 210009)
·临床实验研究·
miR-133b在前列腺癌中的表达及其对肿瘤细胞增殖的影响
彭鲁1,林聪2
(1.南京医科大学附属脑科医院检验科,南京 210009;2.南京医科大学第一附属医院麻醉科,南京 210009)
目的 检测miR-133b在前列腺癌患者癌组织中的表达水平及其对前列腺癌细胞增殖的影响。方法 提取30例手术切除的前列腺组织癌和配对癌旁组织中的总RNA,并逆转录为cDNA,实时荧光定量PCR检测癌组织及癌旁组织中miR-133b的表达水平,并分析其与患者临床病理参数之间的相关性;用脂质载体将miR-133b模拟物转染入PC-3细胞中,检测PR结构域结合因子16(PRDM16)表达情况;CCK8实验检测转染miR-133b模拟物后PC-3细胞增殖变化情况。结果 前列腺癌组织中miR-133b的表达水平(16.85±0.939)×10-4低于癌旁组织(22.95±1.567)×10-4,差异有统计学意义(t=3.335,P<0.01)。PC-3细胞转染miR-133b模拟物后,模拟物转染组中PRDM16表达水平较对照组明显降低,差异有统计学意义(0.371±0.031 vs 1.000±0.022,t=12.53,P<0.01);转染miR-133b模拟物72 h后,模拟物转染组的PC-3细胞增殖能力低于阴性对照组,差异有统计学意义(t=6.811,P<0.01);而PRDM16抑制剂转染PC-3细胞72 h后的细胞增殖能力也低于阴性对照组(t=9.048,P<0.01)。结论 miR-133b在前列腺癌组织中的表达下调,其可能通过PRDM16控制前列腺肿瘤细胞增殖。
前列腺癌;微小RNA-133b;PR结构域结合因子16;增殖
miR-133b是miRNA(miR-133)家族中的一员,定位于6号染色体短臂,其在肌肉发育和多种肿瘤生长过程中具有重要作用[1]。目前对miR-133b研究主要集中在其抑制直结肠肿瘤细胞增殖,促进细胞凋亡及其对线粒体呼吸的作用[2-4]。PR结构域结合因子16(positive regulatory domain I-binding factor 16,PRDM16)是一种重要的转录因子,其存在于如骨髓异常增生综合征(myelodysplastic syndrome, MDS)等多种血液系统疾病患者体内[3]。研究表明,PRDM16在前列腺癌组织中高表达,且参与细胞线粒体呼吸作用过程,通过生物信息学预测(TargetScan)发现在前列腺癌细胞中存在miR-133b的作用位点,提示 miR-133b可能通过PRDM16控制肿瘤细胞发生、发展[4]。
为探究miR-133b在前列腺癌中的表达及其作用机制,寻找其下游基因,本研究对前列腺癌患者的癌组织及癌旁组织中miR-133b的表达水平进行分析,并在前列腺癌细胞系PC-3中观察转染miR-133b模拟物后PRDM16表达情况,旨在为其在前列腺癌诊断中的临床应用价值提供实验依据。
1 材料与方法
1.1 研究对象 收集2016年1-12月江苏省人民医院就诊的前列腺癌患者30例,年龄63.2±3.5岁,诊断标准为中华人民共和国卫生部2011年发布的《前列腺癌诊断标准》。均采集经前列腺根治手术切除的癌组织及配对癌旁组织标本。所有患者临床病理资料齐全,每例患者临床资料的整理和收集均在江苏省人民医院病案室完成。本研究经医院医学伦理学委员会批准,并经患者知情同意。
1.2 细胞系、试剂及仪器 人前列腺癌细胞系PC-3(编号为ATCC®CRL-1435TM)购自美国模式菌种收集中心(ATCC);H-DMEM培养基、胎牛血清(FBS)购自美国Gibco公司;RNA提取分离试剂盒(TranZolTMUP Plus RNA kit,北京全式金公司);逆转录试剂盒(PrimeScriptTMRT reagent Kit,日本TaKaRa公司);PCR扩增试剂盒(美国Roche公司);转染试剂LipofectamineTM3000(美国Invitrogen公司);CCK-8试剂(日本碧云天公司);miR-133b模拟物(上海吉凯基因公司);PRDM16抑制剂(上海吉玛制药公司);全自动酶联检测仪(美国Bio-Rad公司);LightCycler480荧光定量PCR仪(美国Roche公司)。
1.3 标本采集及RNA提取、逆转录 术中取蚕豆大小的前列腺癌组织及癌旁组织(癌旁组织距癌组织约2 cm,且经病理组织学检查无癌细胞)。迅速置于液氮中保存。RNA提取时,将各组织进行研磨,按照RNA提取分离试剂盒说明书提取总RNA。另取PC-3细胞约106个接种于60 mm培养皿中常规培养细胞,用TranZolTMUP Plus RNA kit试剂盒提取细胞总RNA。蛋白质核酸分析仪检测RNA的浓度及纯度,取吸光度(A260/280 nm)在1.8~2.0之间的样本用于后续实验,样本置-80 ℃保存;用逆转录试剂盒将RNA逆转录为cDNA,样本置-20 ℃保存。
1.4 细胞培养及细胞转染 取PC-3细胞106个,用含10%胎牛血清(FBS)的H-DMEM培养基培养,细胞置于37 ℃、5% CO2、饱和湿度的条件下培养。按LipofectamineTM3000说明书操作转染细胞。实验分为4组(miR-133b模拟物转染组及对照组、PRDM16抑制剂转染组及对照组),将miR-133b模拟物、PRDM16抑制剂及相应的阴性对照分别转染入PC-3细胞,miR-133b模拟物和PRDM16抑制剂转染终浓度均为100 nmol/L。
1.5 实时定量RT-PCR检测
1.5.1 实时定量RT-PCR检测组织中miR-133b的表达 miR-133b引物序列见文献[2]。以GAPDH为内参基因。根据GenBank中GAPDH基因的序列号(26330),用Primer Premier 5.0软件设计引物,并送上海生工公司合成。GAPDH上游引物序列:5′-TGTGGGCATCAATGGATTTGG-3′,下游引物序列:5′-ACACCATGTATTCCGGGTCAAT-3′,退火温度为60.9 ℃,产物片段大小为116 bp。qPCR总反应体系为20 μL,包括10 μmol/L上、下游引物各1 μL,10 μL TaqMan Gene Expression Master Mix(PrimeScriptTMRT reagent Kit自带),10×PCR buffer 1 μL,模板DNA 1 μL,无菌ddH2O补足体积至20 μL。反应参数: 95 ℃预变性15 min;95 ℃ 15 s、60 ℃ 30 s、60 ℃ 30 s,共40个循环;72 ℃ 5 min。于每个循环的延伸阶段各采集1次荧光信号,用LightCycle 480 SW1.5.1软件分析。组织中miR-133b相对表达量以2-△Ct法表示。公式:ΔCt=Ct癌组织/癌旁组织-CtGAPDH计算。所有实验均设3个复孔。重复3次。
1.5.2 实时定量RT-PCR检测细胞中miR-133b及PRDM16表达 取1.4中的转染各组细胞,按1.3方法获得各组细胞DNA。以GAPDH为内参基因。miR-133b及GAPDH引物序列见1.5.1。根据GenBank中PRDM16基因的序列号(63976),用Primer Premier 5.0软件设计引物,并送上海生工公司合成。PRDM16上游引物序列:5′-CGAGGCCCCTGTCTACATTC-3′,下游引物序列:5′-GCTCCCATCCGAAGTCTGTC-3′,退火温度为61.7℃,产物片段大小为185 bp。qPCR反应总体系及条件见1.5.1。各组细胞中miR-133b及PRDM16相对表达量以2-△△Ct法表示。公式:ΔΔCt=(CtmiR-133b模拟物转染组/PRDM16抑制剂转染组-CtGAPDH)-(CtmiR-133b模拟物对照组/PRDM16抑制剂对照组-CtGAPDH)。所有实验均设3个复孔。实验重复3次。
1.6 细胞增殖试验(CCK8) 取1.4中的转染各组细胞,使用H-DMEM培养基配制成单细胞悬液,按照每孔104个的细胞密度接种于96孔细胞培养板,分别于培养0、24、48、72 h时,每孔避光加CCK8试剂5 μL,37 ℃、5% CO2、饱和湿度的条件下继续培养30 min,在450 nm处检测吸光度(A450 nm)值,取其均值计算。各组设置5个复孔,实验重复3次。
2 结果
2.1 miR-133b在前列腺癌组织中的表达及与前列腺癌临床病理参数的关系 qRT-PCR检测结果显示miR-133b在前列腺癌组织中表达量为(16.85±0.939)×10-4,明显低于癌旁组织中的表达量(22.95±1.567)×10-4,差异有统计学意义(t=3.335,P=0.007)。此外,以中位数为界值将其分为miR-133b低表达组(≤中位数)和miR-133b高表达组(>中位数),miR-133b表达水平在两组间差异与年龄、是否吸烟、肿瘤分期、Gleason评分、有无远处转移均无统计学意义。见表1。
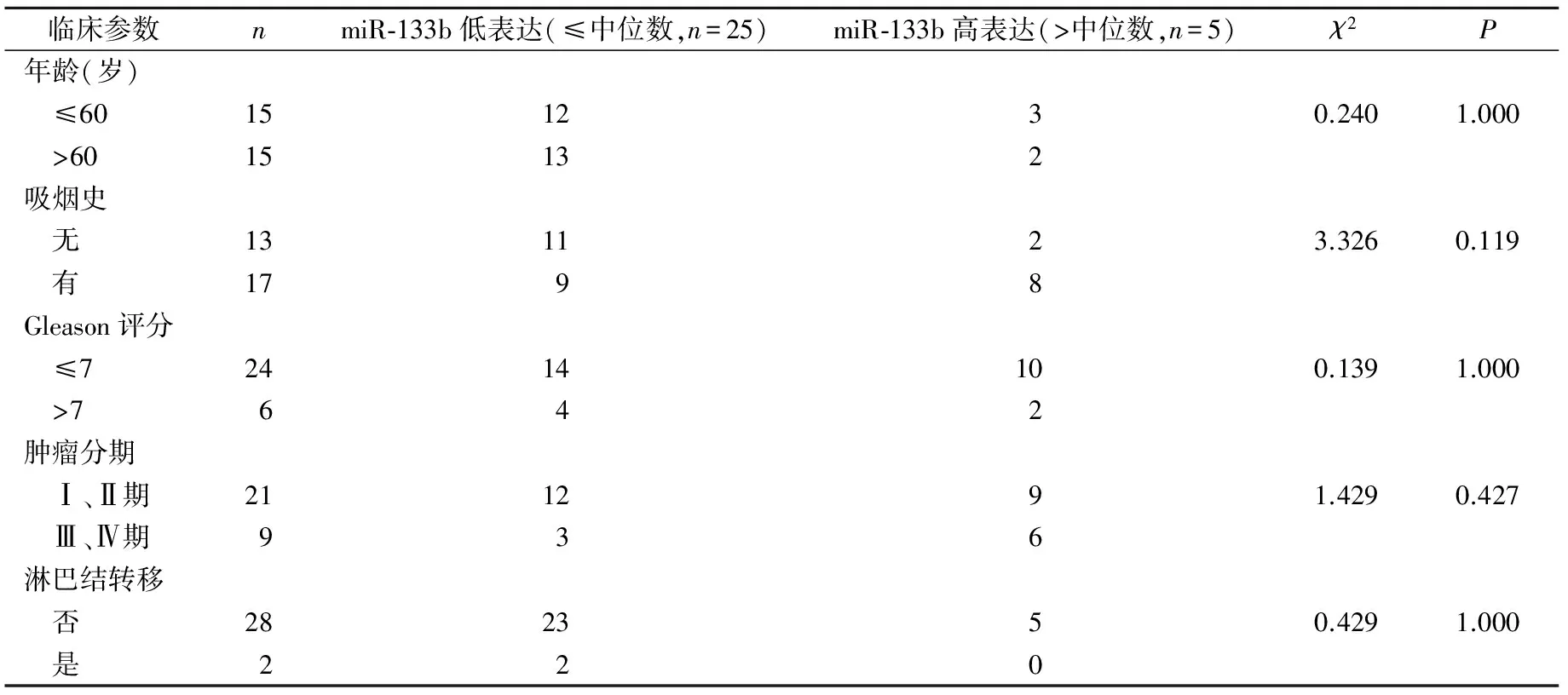
表1 组织中miR-133b的表达水平与前列腺癌患者临床病理参数的分析
2.2 实时定量RT-PCR法检测PC-3细胞中过表达miR-133b后PRDM16的表达 qRT-PCR结果表明,与miR-133b模拟物对照组(1.000±0.038)相比,miR-133b模拟物转染组的miR-133b表达水平(2.033±0.158)明显升高,差异有统计学意义(t=6.472,P=0.003);对二者进行PRDM16表达水平检测,结果发现与miR-133b模拟物对照组(1.000±0.022)相比,miR-133b模拟物转染组的表达水平(0.371±0.031)明显降低,差异有统计学意义(t=12.53,P=0.006),表明miR-133b可以抑制PRDM16表达。
2.3 CCK-8法检测结果
2.3.1 CCK-8法检测PC-3细胞中转染miR-133b模拟物时PC-3细胞增殖 结果表明,与miR-133b模拟物对照组相比,转染72 h后细胞增殖率下降(t=6.811,P=0.000 1),而转染24、48 h时的miR-133b的表达水平差异均无统计学意义(t=0.143,P=0.890;t=2.068,P=0.072),表明miR-133b可以抑制前列腺癌细胞增殖。见图1。
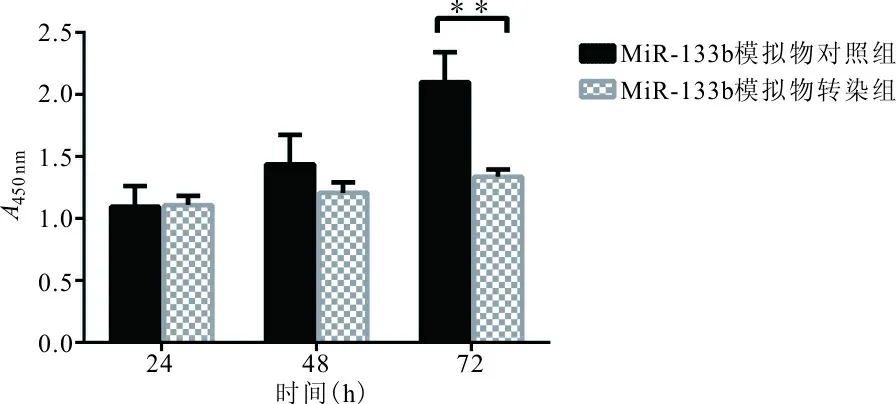
注: **,P<0.01。
图1 miR-133b对PC-3细胞增殖能力的影响
2.3.2 CCK-8法检测PC-3细胞中转染PRDM16抑制剂后细胞增殖 与PRDM16抑制对照组相比,转染48、72 h后细胞增殖率明显降低,差异有统计学意义(t=4.663,P=0.002;t=9.048,P=0.000 1),而转染24 h时的细胞增殖率差异无统计学意义(t=0.153 5,P=0.882),表明PRDM16可以促进前列腺癌细胞增殖。见图2。
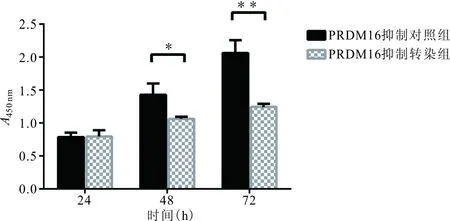
注: *,P<0.05;**,P<0.01。
图2 PRDM16对PC-3细胞增殖能力的影响
3 讨论
本研究通过检测前列腺癌患者组织中miR-133b表达水平,发现miR-133b在前列腺癌组织中的表达明显低于癌旁组织(P<0.01)。同时,miR-133b的表达量与患者的年龄、是否吸烟、肿瘤分级、是否转移均无明显关系(P>0.05)。为了研究miR-133b对前列腺癌细胞的影响,我们将miR-133b模拟物转染人前列腺腺癌细胞PC-3,同时设立阴性对照组,观察miR-133b表达水平的改变对肿瘤细胞增殖的影响,结果发现转染miR-133b模拟物后,PC-3细胞的增殖明显降低,提示miR-133b在前列腺癌增殖过程中可能起到重要作用。
miRNA本身不翻译产生蛋白质,其生物学功能主要通过调节下游mRNA表达而实现[5]。miR-133b在不同肿瘤中存在不同的下游靶基因:在非小细胞肺癌组织和细胞中,miR-133b可以通过抑制MMP9蛋白表达而抑制细胞增殖、迁移、侵袭[6];在肝细胞肿瘤中,miR-133b可以通过CTGF调控细胞增殖以及细胞代谢[7]。在前列腺癌中,我们发现过表达miR-133b可以抑制PRDM16 mRNA生成,说明miR-133b可以通过抑制PRDM16而降低肿瘤细胞增殖速率,起到抑癌基因作用。miR-133b与PRDM16之间相互作用机制目前尚不清楚,有研究结果提示两者之间可能存在相互联系:miR-133b参与神经细胞分化成熟过程;另有研究发现PRDM16参与神经细胞分化过程并具有重要作用[8]。以上研究结果说明miR-133b与PRDM16具有相关性,验证了本试验结果。
研究表明,将miRNA的阻断剂或诱导剂转入细
胞可抑制肿瘤发展,起到靶向治疗的效果[9]。本研究发现,miR-133b在前列腺癌发生、发展过程中具有抑癌基因样功能,转染miR-133b模拟物可抑制前列腺癌肿瘤细胞增殖,这使得miR-133b有成为前列腺癌新的治疗靶点的可能。本研究结果提示,miR-133b在前列腺癌组织中表达水平降低,且具有抑制前列腺癌细胞PC-3增殖的作用。但有关miR-133b对前列腺癌细胞其他生物学功能的影响及其对下游靶基因PRDM16具体作用机制尚需大量临床试验加以验证。
[1]Liu Y, Liang Y, Zhang JF,etal. MicroRNA-133 mediates cardiac diseases: Mechanisms and clinical implications[J]. Exp Cell Res,2017,4827(17):30159-30163.
[2]Wu H, Wu R, Chen M,etal. Comprehensive analysis of differentially expressed profiles of lncRNAs and construction of miR-133b mediated ceRNA network in colorectal cancer[J]. Oncotarget,2017,3(10):18632-18843.
[3]Ishibashi J, Seale P. Functions of Prdm16 in thermogenic fat cells[J]. Temperature(Austin),2015,2(1):65-72.
[4]Zhu S, Xu Y, Song M,etal. PRDM16 is associated with evasion of apoptosis by prostatic cancer cells according to RNA interference screening[J]. Mol Med Rep,2016,14(4):3357-3361.
[5]龚雪,莫冬萍,杨大恒,等. miRNA-181c对人肺腺癌细胞系SPC-A1增殖和侵袭的影响[J]. 临床检验杂志,2015,33(12):900-903.
[6]Zhen Y, Liu J, Huang Y,etal. miR-133b inhibits cell growth, migration, and invasion by targeting MMP9 in non-small cell lung cancer[J]. Oncol Res,2016,29(10):3727-3740.
[7]Sugiyama T, Taniguchi K, Matsuhashi N,etal. miR-133b inhibits growth of human gastric cancer cells by silencing pyruvate kinase muscle-splicer polypyrimidine tract-binding protein 1[J]. Cancer Sci,2016,107(12):1767-1775.
[8]García-Pérez D, López-Bellido R, Hidalgo JM,etal. Morphine regulates Argonaute 2 and TH expression and activity but not miR-133b in midbrain dopaminergic neurons[J]. Addict Biol,2015,20(1):104-119.
[9]杨子江,张婷,高恒,MircoRNAs调节垂体腺瘤细胞周期的研究进展[J].临床神经外科杂志,2016,13(6):478-480.
(本文编辑:许晓蒙)
Expression of miR-133b in prostate cancer and its effect on the proliferation of tumor cells
PENGLu1,LINCong2
(1.DepartmentofLaboratoryMedicine,BrainHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing210009,Jiangsu; 2.DepartmentofAnesthesiology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210009,Jiangsu,China)
Objective To investigate the expression level of miR-133b in cancer tissues of patients with prostate cancer and its effect on the proliferation of prostate cancer cells. Methods The total RNAs in resected prostate cancer tissues and adjacent tissues from 30 patients with prostate cancer were extracted and reversely transcripted into cDNA, and then the expression levels of miR-133b were detected by real-time quantitative PCR. The correlations between the expression levels of miR-133b and the patients′ clinicopathological features were analyzed. The expression of positive regulatory domain I-binding factor 16(PRDM16) and proliferation of PC-3 cells transfected with miR-133b mimics by LipofectamineTM3000 were determined by real-time quantitative PCR and the CCK8 method, respectively. Results The expression levels of miR-133b in prostate cancer tissues [(16.85±0.94)×10-4] was significantly lower than that in adjacent tissues [(22.95±1.567)×10-4,t=3.335,P< 0.01]. The expression levels of PRDM16 in PC-3 cells transfected with miR-133b mimics were significantly lower than that in the control group (0.371±0.031 vs 1.000±0.022,t=12.53,P<0.01). The proliferation ability of PC3 cells transfected with miR-133b mimics for 72 hours was significantly lower than that in the control group (t=6.811,P<0.01). Similarly, the proliferation ability of PC-3 cells transfected with PRDM16 inhibitor for 72 hours was also significantly lower than that in the control group (t=9.048,P<0.01). Conclusion The expression levels of miR-133b in prostate cancer tissues are significantly down-regulated, which regulate the proliferation of prostate cancer cells possibly through PRDM16.
prostate cancer; microRNA-133b; positive regulatory domain I-binding factor 16; proliferation
10.13602/j.cnki.jcls.2017.05.08
彭鲁,1982 年生,女,主管技师,硕士,从事生物化学与分子生物学研究,E-mail:remenber2008520@sina.com。
R734.2
A
2017-01-14)
