温度和盐度对壳黑长牡蛎幼虫生长和存活的影响*
2017-06-19孔令锋于瑞海
许 岚, 李 琪, 孔令锋, 于瑞海
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
研究简报
温度和盐度对壳黑长牡蛎幼虫生长和存活的影响*
许 岚, 李 琪**, 孔令锋, 于瑞海
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
为了充实长牡蛎(Crassostreagigas)人工苗种规模化繁育的基础生物学资料,本文研究了不同温度和盐度对长牡蛎壳黑品系幼虫生长和存活的影响。温度实验设置了4个梯度(20、25、29和33℃),研究表明,温度的升高能促进幼虫生长,但同时存活率显著降低;低温条件下幼虫存活率较高但生长缓慢。温度25℃组和29℃组生长和存活均无显著差异(P> 0.05),综合存活和生长两个指标,壳黑长牡蛎幼虫的最适人工培育温度为25~29℃。盐度实验设置了5个梯度(16、21、26、31、36),研究表明,随着盐度的增加,幼虫的生长速率和存活率均先上升再下降,低盐和高盐条件均不利于幼虫的生长和存活。盐度21组、26组、31组为最适生长和存活盐度,且组间差异不显著(P>0.05),综合存活和生长两个指标,壳黑长牡蛎幼虫的最适人工培育盐度为21~31。研究结果表明,在壳黑长牡蛎大规模人工育苗中,水温控制在25~29℃之间,盐度控制在21~31之间较为适宜。
长牡蛎;壳黑新品系;幼虫;温度;盐度;生长;存活
长牡蛎(Crassostreagigas)又称太平洋牡蛎,自然分布于西北太平洋海域,由于其生长速度快、养殖成本低,并能适应多种不同的海域环境,已被多个国家作为养殖对象引进,成为了一种重要的世界性养殖贝类[1]。作为一种大规模人工养殖的经济贝类,长牡蛎的遗传育种研究受到高度重视,国外学者报道了长牡蛎的高产[2]、抗病和抗逆[3]等性状的遗传改良,国内学者对长牡蛎的生长性状进行了人工选育[4],并培育出“海大1号”新品种。
贝类的壳色是一种直观的表型性状,并在一定程度上呈现出多态性[5]。贝类的壳色选择育种已在马氏珠母贝(Pinctadamartensii)[6]、菲律宾蛤仔(Ruditapesphilippinarum)[7]、海湾扇贝(Argopectenirradiant)[8]等物种中取得进展。近年来,长牡蛎的壳色作为一种可遗传的性状也引起了越来越多的关注[9]。壳色多态性主要表现为颜色类型变异和着色程度的差异,长牡蛎左壳着色程度具有很高的遗传力[10],可以进行有效的人工选育。开展培育具有特定壳色的长牡蛎品种,有着重要的经济价值和社会价值。自2010年,我们开展了壳黑长牡蛎新品系的继代选育,成功培育出性状遗传稳定的壳黑品系[11]。
温度和盐度是海洋生物最为重要的环境因子[12]。巨蛎属(Crassostrea)牡蛎被认为是广温、广盐性的种类[13],但作为双壳类生活史第一个阶段的浮游幼虫对环境的变化极为敏感,随着附着变态,稚贝对环境条件的耐受性会增加[14]。温度和盐度对贝类幼虫的存活、生长、发育、附着、变态的影响非常显著[15]。宁军号等[16]发现偏顶蛤(Modiolusmodiolus)幼虫在20℃条件下的生长速度明显快于15℃实验组,且当温度超过25℃时幼虫活力明显下降,生长发育受到强烈抑制,死亡率、畸形率升高。Madrones-Ladja等[17]研究了盐度对Placunaplacenta生长的影响,当盐度高于或低于最适盐度都会减缓幼虫的生长速度,从而导致更长的浮游生活时间。因此,优化幼虫生长发育的温度和盐度条件是贝类苗种规模化培育的必由之路。
在长牡蛎,已有相关研究探讨了温度和盐度对幼虫生长与存活[18]、受精率和孵化率[19]、免疫活性[20]、摄食、发育与附着[21]等方面的影响。国内学者比较了温度和盐度对长牡蛎和巨蛎属其他牡蛎幼虫及稚贝生长、存活的影响[19,22]。目前尚未见有关环境因子对壳黑长牡蛎新品系影响的报道,因此,本文针对壳黑长牡蛎选育品系,系统地比较了不同温度和盐度条件对整个幼虫培育时期幼虫生长及存活的影响,旨在为壳黑长牡蛎优良品系的推广和规模化人工苗种繁育提供基础资料。
1 材料和方法
1.1 实验材料
实验亲贝采用2015年构建的第六代壳黑长牡蛎选育群体。从乳山养殖海区运至莱州市海益苗业有限公司进行室内暂养。人工促熟后挑选性腺发育成熟的雌性个体30个、雄性个体10个,采用解剖法收集精卵,并按精卵(30~50)∶1的比例进行人工授精。在持续微充气的条件下孵化,水温控制在23~24℃,孵化密度控制在20~30个/mL,受精后约23 h发育至D形幼虫。
1.2 实验设计
用300目筛绢挑选上层活力较好的D形幼虫至80 L聚乙烯塑料桶中进行培育,各实验组初始密度均设置为5个/mL。盐度实验设置5个梯度(16、21、26、31和36),每个梯度均设3个重复组,温度保持在24.2~28.6 ℃。自然海水的盐度为31,低盐度海水通过向自然海水中添加充分曝气的自来水配制而成,经淀粉碘化钾检验,水中完全没有余氯成分方可使用。高盐度海水通过向自然海水中添加海盐并充分曝气制成。盐度由折射盐度计测定。各组按不超过每4 h 1个单位盐度的升降速率达到各自的实验盐度。温度实验设置4个梯度(20、25、29和33 ℃),每个梯度均设3个重复组,盐度为31。不同温度通过使用加热棒加热和循环水冷式冷水机降温来调节,控制温度波动幅度不超过±0.5 ℃。各组按不超过每4 h 1 ℃的升降温速率达到设定的实验温度。
1.3 日常管理
实验过程中每天换水一次,换水量1/3,随着幼虫长大,增大换水量,到面盘幼虫后期,日换水量1/2。所用海水经过砂滤池处理后用300目筛绢网过滤。饵料以等边金藻(Isochrysisgalbana)为主,后期辅助投喂扁藻(Platymonassp.)和小球藻(Chlorellavulgaris),每天4次,投饵量根据幼虫的摄食情况和水中残饵情况确定。各实验组投饵、换水、充气等操作一致。
1.4 指标测定
在孵化后第2、5、8、11、14、17和20天从每组随机取样30个幼虫进行测量。采用五点取样法取样,即从每个实验组内的5个不同部位取样,每个部位取样2 mL,共取样10 mL幼虫,用卢戈氏液杀死固定,在显微镜下用目微尺测量其壳高(精确到1μm)。同时测定幼虫密度,每次测定后及时对密度进行均等校正,使各实验组保持一致,以消减密度效应的影响。根据初始密度、每次调整密度和测定的密度推算出幼虫存活率。
我们的社会是群居社会,我们的生活、工作中,几乎没有事情不与他人相关。你在街上乱丢废弃物,可能造成清洁工的生命危险;你随便处置玻璃碎片,就可能扎伤清洁工的手……养成关怀他人的素质,需要家庭的教养,也需要自身的觉悟。也就是说,你做任何事情,都要想到这件事是整个社会生活中的一个环节,你的上一环是怎样传递给你的,你的下一环将怎样传递给他人?如果你的上一环存在缺陷,你应该采取相应的补救措施。无论如何,不能将缺陷、危险和可能的隐患,继续向下传递。只有这样,他人是安全的,社会是安全的,也就才能保障我们自己的安全。
1.5 数据统计
实验数据采用SPSS 19.0软件进行单因子方差分析(One-Way ANOVA),结合Tukey多重比较分析各温度、盐度处理组间的差异,显著性水平设为P<0.05。
2 结果
2.1 温度对壳黑长牡蛎幼虫生长和存活的影响
2.1.1 不同温度对壳黑长牡蛎幼虫生长的影响 在整个实验周期内,温度20 ℃组的壳高显著低于其余各组(P<0.05),到第20天仅(201.1 ± 43.4) μm(见图1)。温度33℃组的壳高在孵化后的第5天起显著高于其余各组(P<0.05),到第20天达(326.1±38.1)μm。温度25℃组和29℃组的壳高除第11天外差异不显著(P>0.05)。
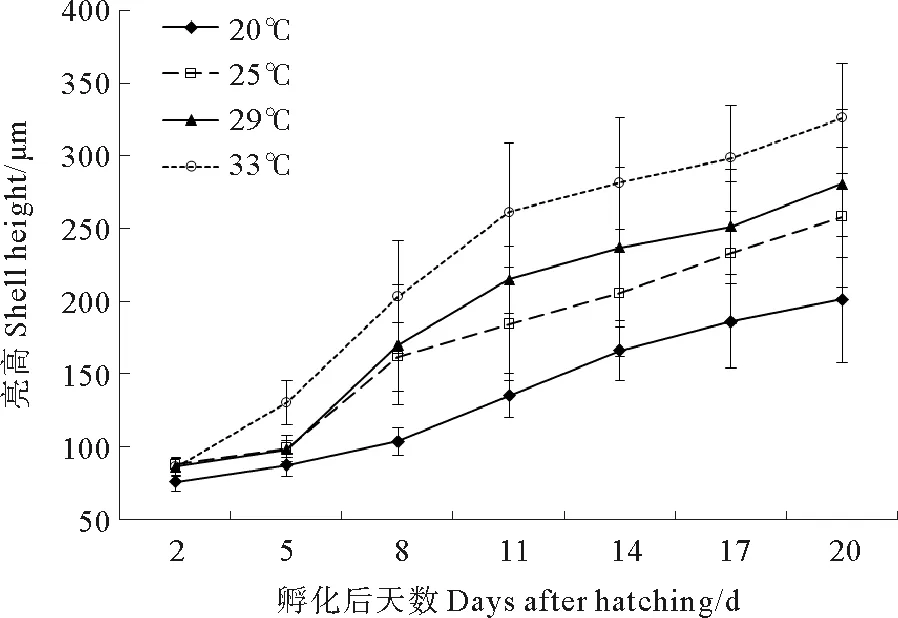
图1 不同温度下幼虫的壳高生长情况
整体上看来,壳高的日增长量随着温度的升高而增加(见图2)。温度33 ℃组的壳高日增长量最大,达到(13.3 ± 1.2) μm/d,与温度29 ℃组差异不显著(P> 0.05),与其余2组差异显著(P<0.05)。温度20 ℃组的壳高日增长量最小,仅为(7.0 ± 1.3) μm/d,与温度25 ℃组差异不显著(P>0.05),与其余两组差异显著(P<0.05)。温度25 ℃组和29 ℃组的壳高日增长量差异不显著(P>0.05)。
2.1.2 不同温度对壳黑长牡蛎幼虫存活的影响 孵化后第2天,所有温度组间存活率差异不显著(P> 0.05)(见图3)。自第5天起,各组之间存活率情况为20 ℃组> 25 ℃组> 29 ℃组> 33 ℃组。自第8天起,温度20 ℃组和33 ℃组分别与各组之间差异显著(P< 0.05),温度25 ℃组和29 ℃组之间差异不显著(P> 0.05)。到第20天,温度20 ℃组、25 ℃组、29 ℃组、33 ℃组的存活率分别为(51.9±3.6)%、(40.4±2.1)%、(34.4±4.5)%、(16.4±4.4)%。

(图中字母完全不同表示差异显著,P<0.05,下同。Completely different letters indicate significant difference (P<0.05), the same as below.)
图2 不同温度下幼虫的壳高平均日增长量
Fig. 2 The daily mean shell height growth of slarvae at different temperatures

图3 不同温度下幼虫的存活率
2.2 盐度对壳黑长牡蛎幼虫生长和存活的影响

图4 不同盐度下幼虫的壳高生长情况
整体上看,壳高的日增长量随着盐度的升高先增加后减少(见图5)。盐度26组的壳高日增长量最大,达(12.2±0.8)μm/d,与盐度21组和盐度31组差异不显著(P>0.05),与其余2组差异显著(P<0.05)。盐度16组的壳高日增长量最小,为(6.2±1.0)μm/d,与盐度36组差异不显著(P>0.05),与其他各组差异显著(P<0.05)。盐度21、31和36组的幼虫壳高日增长量差异不显著(P>0.05)。

图5 不同盐度下幼虫的壳高平均日增长量
2.2.2 不同盐度对壳黑长牡蛎幼虫存活的影响 第2天,各盐度组间幼虫存活率差异不显著(P>0.05)(见图6)。自第2天起,盐度16组存活率明显低于其他各组,到第20天存活率仅为(19.8±4.5)%。第2天起,盐度31组存活率明显高于其他各组,在第20天存活率(45.6±2.1)%与盐度21组和26组差异均不显著(P>0.05)。盐度21组存活率波动较大,第5~11天存活率高于盐度26组和36组,自第14天起,存活率高于盐度36组但低于盐度26组。
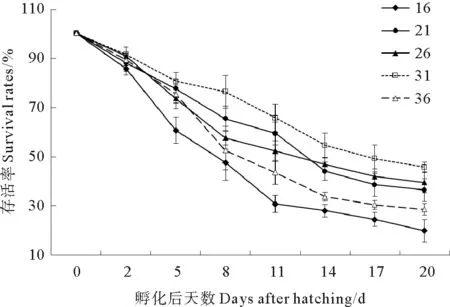
图6 不同盐度下幼虫的存活率
3 讨论
温度和盐度是影响海洋动物生长发育的关键因素,已有研究结果表明,当二者中的一个接近动物的耐受极限时,二者才显示出明显的联合效应,当二者中的一个因子控制在安全范围内时,通过单因子实验能够反应温度和盐度对海洋动物的影响[23]。
3.1 温度对贝类浮游幼虫生长和存活的影响
贝类是变温动物,较低的新陈代谢水平和不完善的温度调节机能是其体温不恒定的主要原因[24]。不适或剧烈的温度变化会影响贝类的新陈代谢、摄食消化、生理状态和免疫防御能力,从而对存活、生长和发育产生消极影响。在适宜范围内,随着水温的升高,幼虫纤毛运动加强,摄食更加活跃[25],从而生长更为迅速,因此升温能加快育苗进程。但当温度升高到一定程度,会加速水中致病微生物的滋生,增加耗氧,同时减弱幼虫摄食活动,导致生长速度和存活率降低[26]。Luzadriana等[27]报道了温度从22 ℃升高到28 ℃,扇贝Argopectennucleu和Nodipectennodosus的幼虫有更大的生长速率,但同时存活率降低。这与本研究的结果一致,随着温度从20 ℃升高到33 ℃,壳黑长牡蛎幼虫的生长速率逐渐增加,但存活率却不断下降,当温度达到33 ℃时,孵化后第20天幼虫的存活率仅为16.4%。Ricovilla等[21]报道了长牡蛎幼虫在32 ℃时有最大的生长速率,这与本研究的结果相近,可能的原因是长牡蛎为广温性物种,对温度耐受性很高,33 ℃未触及其温度耐受上限,因此生长率并未出现下降的情况。此外,温度胁迫能降低贝类血细胞和酶的活性,减弱机体免疫防御能力,对呼吸摄食、生长发育及存活产生不利影响[20]。本实验条件下,适宜壳黑长牡蛎幼虫生长的温度为25~33 ℃,但水温33 ℃时幼虫存活率过低;适宜壳黑长牡蛎幼虫存活的温度为20~29 ℃(存活率> 30%),但水温20 ℃时幼虫生长速率过慢。因此,均衡生长和存活两个指标,壳黑长牡蛎幼虫生长和存活的最适温度为25~29 ℃。
3.2 盐度对贝类浮游幼虫生长和存活的影响
盐度对海洋贝类的胞内等渗调节、新陈代谢、消化吸收效率、免疫能力等都会产生影响,从而控制个体的生长、发育、数量消长和分布等。一些研究表明,渗透压调节在贝类对盐度的适应过程中起着关键作用,盐度不适导致幼虫死亡的主要原因是海水渗透压的改变超出了自身调节能力所致[28]。本研究表明,幼虫的生长速率和存活率均随着盐度的增加先增加再减少,高盐(36)和低盐(16)条件下幼虫生长缓慢且存活率较低。一些关于双壳贝类的研究也得到了类似的结果。叶乐等[29]对长肋日月贝(Amusiumpleuronectes)幼虫的研究发现,盐度低于20或高于40,D形幼虫3天内全部死亡。王丹丽等[30]发现,随着盐度的增加,青蛤(Cyclinasinensis)幼虫的生长率和存活率都是先升高再降低。此外,血淋巴细胞作为双壳贝类的主要免疫细胞,对盐度的变化非常的敏感,Gagnaire等[20]报道盐度的急剧降低将导致长牡蛎血淋巴细胞的大量死亡,致使其免疫能力丧失。因此在人工育苗过程中,应将盐度控制在适宜范围内。本研究中,壳黑长牡蛎幼虫适合在盐度为21~31的范围内生长和存活,盐度为26时生长速率最快,盐度为31时存活率最高。这一结果与Helm等[31]、Nell等[18]、刘海涛等[32]基本一致,但His等[33]的研究表明长牡蛎幼虫在盐度为30时有最大生长速度,造成这种差异的可能原因之一是亲贝性腺发育时所在海区盐度条件的不同[34]。
3.3 壳色对贝类生长与存活的影响
已有研究表明贝类不同壳色品系间幼虫的生长、存活存在差异[35]。丛日浩等[36]发现长牡蛎白壳色、黑壳色、金壳色和紫壳色4种壳色家系在幼虫期的生长、存活存在差异。类似的结果在菲律宾蛤仔(Ruditapesphilippinarum)[7]、虾夷扇贝(Patinopectenyessoensis)[37、马氏珠母贝(Pinctadamartensii)[38]中均有报道。Fiqueroa等[39]发现,智利牡蛎(Tiostreachilensis)由于贝壳颜色的深浅,具有不同的吸热和散热功能,导致在高低温季节生长速度的差异。但郑怀平等[40]对海湾扇贝(Argopectenirradians)不同壳色家系进行研究后,发现各家系贝壳的颜色在变态后才出现,幼虫的贝壳均是透明或半透明状态,无明显色彩。因此,在不同壳色繁殖的家系子代幼虫间不存在由贝壳颜色引起的生长差异。此外,许飞等[8]还提出,适温条件下“中科红”海湾扇贝与养殖群体间生长差异不大,只有当温度对幼虫存在胁迫时,“中科红”海湾扇贝的基因型才表现出其生长优势。本文只探讨了长牡蛎壳黑新品系在不同温度、盐度条件下幼虫的生长、存活状况,因此,还需进一步比较温度、盐度对不同壳色品系及普通养殖群体之间幼虫生长存活的影响,以阐明不同壳色幼虫在不同温盐条件下的生长存活状况及耐受性是否存在差异,为长牡蛎不同壳色新品系的推广提供必要的基础资料。
4 结语
本文研究了不同盐度和温度对壳黑长牡蛎新品系幼虫生长与存活的影响,结合实际人工繁育过程中对温度和盐度的可控性,在壳黑长牡蛎新品系的幼虫培育过程中水温控制在25~29 ℃之间,盐度控制在21~31之间较适宜。
[1] Miossec L, Le Deuff R M, Goulletquer P. Alien Species Alert:Crassostreagigas(Pacific oyster) [R]. Copenhagen: Denmark, 2009.
[2] Langdon C, Evans F, Jacobson D, et al. Yields of cultured Pacific oystersCrassostreagigasThunberg improved after one generation of selection [J]. Aquaculture, 2003, 220(1): 227-244.
[3] Dégremont L, Bédier E, Boudry P. Summer mortality of hatchery-produced Pacific oyster spat (Crassostreagigas). II. Response to selection for survival and its influence on growth and yield [J]. Aquaculture, 2010, 299(1): 21-29.
[4] Li Q, Wang Q, Liu S K, et al. Selection response and realized heritability for growth in three stocks of the Pacific oysterCrassostreagigas[J]. Fisheries Science, 2011, 77(4): 643-648.
[5] 张跃环, 闫喜武, 张澎,等. 贝类壳色多态的研究概况及展望 [J]. 水产科学, 2008, 27(12): 680-683. Zheng Yuehuan, Yan Xi wu, ZhangPeng, et al. Research advances and prospects on shell color polymorphism of mollusks [J]. Fisheries Science, 2008, 27 (12): 680-683.
[6] 朱晓闻, 刘志刚, 王辉,等. 马氏珠母贝四种壳色选育系F5的生长及遗传多样性分析 [J]. 海洋与湖沼, 2012, 43(1): 160-165. Zhu Xiaowen, Liu Zhigang, Wang Hui, et al. Growth and geneti diversity for four shell color lines (F5) of the pearl oysterPincatadamartensii[J]. Oceanologia Et Limnologia Sinica, 2012, 43(1): 160-165.
[7] 闫喜武, 张跃环, 霍忠明,等. 不同壳色菲律宾蛤仔品系F2的表型性状 [J]. 水产学报, 2010, 34(6): 701-709. Yan Xiwu, Zhang Yuehuan, HuoZhongming, et al. Studies on phenotypic traits of different shell color strains F2 of manila clam (Ruditapesphilippinarum) [J]. Journal of fisheries of China, 2010, 34(6): 701-709.
[8] 许飞, 郑怀平, 张海滨, 等. 海湾扇贝“中科红”品种与普通养殖群体不同温度下早期性状的比较 [J]. 水产学报, 2008, 32(6): 876-883. Xu Fei, Zheng Huaiping, Zhang Haibin, et al. Comparison on the larval traits between strain “Zhongkehong” and common cultured population of bay scallopArgopectenirradiansunder different temperature [J]. Journal of Fisheries of China, 2008, 32(6): 876-883.
[9] Ge J L, Li Q, Yu H, et al. Mendelian inheritance of golden shell color in the Pacific oysterCrassostreagigas[J]. Aquaculture, 2015, 441: 21-24.
[10] Evans S, Camara M D, Langdon C J. Heritability of shell pigmentation in the Pacific oyster,Crassostreagigas[J]. Aquaculture, 2009, 286(3): 211-216.
[11] 王许波, 李琪, 孔令锋, 等. 长牡蛎壳黑和壳白选育群体生长性状的选择效应 [J]. 中国水产科学, 2016, 23(5): 1099-1107. Wang Xubo, Li Qi, Kong Lingfeng, et al. Evaluation of mass selective breeding lines of black-shell and white-shell Pacific oyster (Crassostreagigas) for fast growth [J]. Journal of Fishery Sciences of China, 2016, 23(5): 1099-1107.
[12] Kinne O. The effects of temperature and salinity on marine and brackish water animals: II. Salinity and temperature-salinity combinations [J]. Oceanography Marine Biology Annual Review, 1964, 2: 281-339.
[13] Li X, Qi Z. Studies on the comparative anatomy, systematic classification and evolution of Chinese oysters [J]. Studia Marina Sinica, 1994, 35: 143-173
[14] His E, Beiras R, Seaman M N L. The assessment of marine pollution-bioassays with bivalve embryos and larvae [J]. Advances in Marine Biology, 1999 (37): 1-178.
[15] O′Connor W A, Lawler N F. Salinity and temperature tolerance of embryos and juveniles of the pearl oyster,PinctadaimbricataRöding[J]. Aquaculture, 2004, 229(1): 493-506.
[16] 宁军号, 庞云龙, 宋坚,等. 偏顶蛤胚胎和幼虫发育及温度对其浮游幼虫生长和发育的影响 [J]. 中国水产科学, 2015, 22(2): 196-203. NingJunhao, Pang Yunlong, Song Jian, et al. Development of embryo and larva ofModiolusmodiolusand effects of temperature on growth and development of the pelagic larva [J]. Journal of Fishery Sciences of China, 2015, 22(2): 196-203.
[17] Madrones-Ladja J A. Salinity effect on the embryonic development, larval growth and survival at metamorphosis ofPlacunaplacentaLinnaeus (1758) [J]. Aquaculture, 2002, 214(1): 411-418.
[18] Nell J A, Holliday J E. Effects of salinity on the growth and survival of Sydney rock oyster (Saccostreacommercialis) and Pacific oyster (Crassostreagigas) larvae and spat [J]. Aquaculture, 1988, 68(1): 39-44.
[19] 张跃环, 王昭萍, 闫喜武,等. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状 [J]. 生态学报, 2012, 32(4): 1105-1114. Zhang Yuehuan, Wang Zhaoping, Yan Xiwu, et al. Phenotypic traits of both larvae and juvenileCrasstreahongkongensisandC.gigas[J] Acta Ecologica Sinica, 2012, 32(4): 1105-1114.
[20] Gagnaire B, Frouin H, Moreau K, et al. Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostreagigas(Thunberg) [J]. Fish & Shellfish Immunology, 2006, 20(4): 536-547.
[21] Ricovilla B, Pouvreau S, Robert R. Influence of food density and temperature on ingestion, growth and settlement of Pacific oyster larvae,Crassostreagigas[J]. Aquaculture, 2009, 287(3): 395-401.
[22] 姚托, 王昭萍, 闫喜武,等. 盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响 [J]. 生态学报, 2015, 35(5): 1581-1586. Yao Tuo, WangZhaoping, Yan Xiwu, et al. Effect of salinity on growth and survival ofCrassostreagigas,C.ariakensisand juvenile hybrids [J] Acta Ecologica Sinica, 2015, 35(5): 1581-1586.
[23] Tettelbach S T, Rhodes E W. Combined effects of temperature and salinity on embryos and larvae of the northern bay scallopArgopectenirradians[J]. Marine Biology, 1981, 63(3): 249-256.
[24] 王如才, 王昭萍. 海水贝类养殖学 [M]. 青岛: 中国海洋大学出版社, 2008. Wang Rucai, Wang Zhaoping. Science of marine shellfish culture [M]. Qingdao: China Ocean University Press, 2008.
[25] 包永波, 尤仲杰. 海洋滤食性贝类摄食率影响因子研究现状 [J]. 海洋水产研究, 2006, 27(1): 76-80. BaoYongbo, You Zhongjie. The present researching status of ingestion rate’s influence factors of marine suspension-feeding shellfish [J]. Marine Fisheries Research, 2006, 27(1): 76-80.
[26] Gruffydd L D, Beaumont A R. A method for rearingPectenmaximuslarvae in the laboratory [J]. Marine Biology, 1972, 15(4): 350-355.
[27] Luzadriana V, Judith B. Experimental larval culture of the caribbean scallopsArgopectennucleusandNodipectennodosus[J]. Aquaculture Research, 2008, 39(6): 603-618.
[28] 刘志刚, 刘建勇, 王辉,等. 墨西哥湾扇贝稚贝盐度适应性的研究 [J]. 广东海洋大学学报, 2006, 26(6): 12-16. Liu Zhigang, Liu Jianyong, Wang Hui,etal. Study on adaptability of Juveniles ofArgopectenirradiansconcentricusSay to salinity [J]. Journal of Zhanjiang Ocean University, 2006, 26(6): 12-16.
[29] 叶乐, 赵旺, 王雨,等. 盐度与pH对长肋日月贝幼虫存活及生长的影响 [J]. 南方农业学报, 2015, 46(9): 1698-703. Ye Le, Zhao Wang, Wang yu,etal. Effects of salinity and pH on survival and growth ofAmusiumpleuronecteslarvae [J]. Journal of Southern Agriculture, 2015, 46(9): 1689-1703.
[30] 王丹丽, 徐善良, 尤仲杰,等. 温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响 [J]. 水生生物学报, 2005, 29(5): 495-501. Wang Danli, Xu Shanliang, You Zhongjie, et al. The effects of temperature and salinity on the incubation ofCyclinasinensisand survival, growth and metamorphosis ofC.sinensislarvae and juveniles [J]. Acta Hydrobiologica Sinica, 2005, 29(5): 495-501.
[31] Helm M M, Millican P F. Experiments in the hatchery rearing of Pacific oyster larvae (CrassostreagigasThunberg) [J]. Aquaculture, 1977, 11(1): 1-12.
[32] 刘海涛, 董占武, 徐志明. 盐度对大连湾牡蛎胚胎发育及幼虫生长的影响 [J]. 水产学报, 1992, 16(1): 32-39. Liu Haitao, Dong Zhanwu, Xu Zhiming. The effects of salinity on embryonic development and growth of veliger of oysterOstreatalienwhanensis[J]. Journal of Fisheries of China, 1992, 16(1): 32-39.
[33] His E, Robert R, Dinet A. Combined effects of temperature and salinity on fed and starved larvae of the Mediterranean musselMytilusgalloprovincialisand the Japanese oysterCrassostreagigas[J]. Marine Biology, 1989, 100(4): 455-463.
[34] Loosanoff V L. Behavior of oysters in water of low salinities [J]. Proceedings of the National Shellfisheries Association, 1953, 43: 135-151.
[35] Zheng H P, Zhang G F, Liu X. Comparison of growth and survival of larvae among different shell color stocks of bay scallopArgopectenirradians(lamarck 1819) [J]. Chinese Journal of Oceanology and Limnology, 2005, 23(2): 183-188.
[36] 丛日浩, 李琪, 葛建龙,等. 长牡蛎4种壳色家系子代的表型性状比较 [J]. 中国水产科学, 2014, 21(3): 494-502. Cong Rihao, Li Qi, Ge Jianlong, et al. Comparion of Phentoypic traits of four shell color families of the Pacific oyster (Crassostreagigas) [J]. Journal of Fishery Sciences of China, 2014, 21(3): 494-502.
[37] 程鹏, 杨爱国, 周丽青, 等. 不同壳色虾夷扇贝家系F1幼虫生长及遗传结构的比较分析[J]. 中国水产科学, 2010, 17(5): 960-968. Cheng Peng, Yang Aiguo, Zhou Liqing, et al. Comparison of growth development and genetic diversity of F1larvae among different shell color lines of Janpanese scallop,Patinopectenyessonsis[J]. Journal of Fishery Sciences of China, 2010, 17(5): 960-968.
[38] Deng Y W, Fu S, Lu Y Z, et al. Fertilization, Hatching, Survival, and Growth of Third-Generation Colored Pearl Oyster (Pinctadamartensii) Stocks. Journal of Applied [J]. Aquaculture, 2013, 25(2): 113-120.
[39] Fiqueroa E, Brand E, Winkler F. Shell color polymorphism and growth in the Chilean oysterTiostreachilensis[J]. Journal of Shellfish Research, 1992, 11(1): 194.
[40] 郑怀平, 张国范, 刘晓,等. 不同贝壳颜色海湾扇贝(Argopectenirradians)家系的建立及生长发育研究 [J]. 海洋与湖沼, 2003, 34(6): 632-639. Zheng Huaiping, Zhang Guofan, Liu Xiao, et al. Establishment of different shell color lines of bay scallopArgopectenirradiansirradiansLamarck (1819) and their development [J]. Oceanologia Et Limnologia Sinica, 2003, 34(6): 632-639.
责任编辑 朱宝象
Effects of Temperature and Salinity on Growth and Survival of Larvae of Black-Shell Pacific Oyster (Crassostreagigas)
XU Lan, LI Qi, KONG Ling-Feng, YU Rui-Hai
(The Key Laboratory of Mariculture (Ocean University of China), Ministry of Education, Qingdao 266003, China)
This study examined the effects of temperature and salinity on the survival and growth of the larvae of black-shell Pacific oyster (Crassostreagigas). The larvae were held in artificial seawater at four different temperatures (20, 25, 29, and 33℃) and four salinities (16, 21, 26, 31, and 36) to determine the optimum hatchery and nursery conditions for mass production of seeds. The growth ofC.gigaslarvae increased with the increase of temperature, but there was a simultaneous decrease in survival rate. The maximal growth occurred at the highest temperature (33℃); however such growth associated with the lowest survival rate. The highest survival rate occurred at the lowest temperature (20℃) at which the slowest growth rate was observed. The optimum growth and survival temperature ranged from 25 to 29℃. The results of salinity treatments indicated that the larvae ofC.gigasare tolerant to a wide range of salinities (21 to 36), but both the growth and survival were consistently inhibited by relative low (16) and high (36) salinities. Optimal condition for survival occurred at salinity 31, and the most rapid growth rate occurred at salinity 26. The growth and survival rates at salinities 21, 26 and 31 are insignificant different (P> 0.05). A salinity range from 21 to 31 is considered optimal for survival and growth ofC.gigas. Thus, it is suggested that the black-shellC.gigaslarvae be reared at their respective optimal temperatures (25~29℃) and salinities (21~31) so as to improved yields.
Crassostreagigas; black-shell strain; larva; temperature; salinity; growth; survival
泰山学者种业计划专家项目;山东省重点研发计划项目(2016ZDJS06A06)资助 Supported by Taishan Scholar Seed Program; Shandong Key Research and Development Project (2016ZDJS06A06)
2016-12-19;
2017-03-13
许岚(1992-),男,硕士生。E-mail: 17863962190@163.com
** 通讯作者:E-mail: qili66@ouc.edu.cn
S968.3
A
1672-5174(2017)08-044-07
10.16441/j.cnki.hdxb.20160418
许岚,李琪,孔令锋,等.温度和盐度对壳黑长牡蛎幼虫生长和存活的影响[J].中国海洋大学学报(自然科学版), 2017, 47(8): 44-50.
XU Lan, LI Qi, KONG Ling-Feng, et al.Effects of temperature and salinity on growth and survival of larvae of black-Shell pacific oyster (Crassostreagigas) [J].Periodical of Ocean University of China, 2017, 47(8): 44-50.
