超高效液相色谱-串联质谱法同时测定不同饲料中30种真菌毒素
2017-06-15范志辰郭文博赵志辉
范志辰, 韩 铮, 郭文博, 赵志辉*
(1. 上海海洋大学食品学院, 上海 201306; 2. 上海市农业科学院农产品质量标准与检测技术研究所, 上海 201403)
研究论文
超高效液相色谱-串联质谱法同时测定不同饲料中30种真菌毒素
范志辰1, 韩 铮2, 郭文博2, 赵志辉2*
(1. 上海海洋大学食品学院, 上海 201306; 2. 上海市农业科学院农产品质量标准与检测技术研究所, 上海 201403)
采用QuEChERS前处理技术,建立了超高效液相色谱-串联质谱(UHPLC-MS/MS)检测不同饲料样品(预混料、浓缩料和配合料)中30种真菌毒素含量的分析方法。饲料样品经5 mL水和5 mL含1%(v/v)甲酸的乙腈溶液提取后,取上清液氮吹至近干,残渣经1 mL 5 mmol/L醋酸铵水溶液-乙腈(80∶20, v/v)复溶后,上机测定。采用基质匹配标准曲线结合同位素内标法进行定量分析。在低、中、高3个添加水平下,30种真菌毒素的平均加标回收率为72.0%~118.4%(n=5), 30种真菌毒素在各自的线性范围内线性关系良好,相关系数(r2)≥0.99,检出限(LOD,S/N=3)和定量限(LOQ,S/N=10)分别为0.7~20 μg/L和2~50 μg/L。该法简单、快速、实用性强,适用于预混料、浓缩料和配合料中30种真菌毒素的定量分析。
超高效液相色谱-串联质谱;QuEChERS;真菌毒素;饲料
真菌毒素(mycotoxins)是特定真菌在一定条件下产生的有毒次级代谢产物[1],广泛存在于不同的饲料中,从而造成粮食污染,导致巨大经济损失的同时也严重危害了动物甚至人体的健康[2]。目前已发现近400种真菌毒素,其中约30种对人类危害较大,包括黄曲霉毒素、赭曲霉毒素A、玉米赤霉烯酮、A型单端孢霉烯族类毒素、B型单端孢霉烯族类毒素、伏马毒素、腾毒素等[3]。部分真菌毒素如黄曲霉毒素B1、脱氧雪腐镰刀菌烯醇、赭曲霉毒素A等超过一定摄入量后会引起人的肝肾功能下降、癌变或诱发免疫抑制性疾病[4]。世界卫生组织已将真菌毒素纳入食品安全体系重点监测对象[5],我国也规定了饲料中黄曲霉毒素B1等重要真菌毒素的限量标准[6-8]。
目前,饲料中真菌毒素检测方法主要分为快速筛选法和确证法两大类。快速筛选法主要采用酶联免疫吸附法(ELISA)[9],此法可以在较短的时间内完成大批量样品的分析,具有简便、快速、成本低等优点,但存在检出结果伴有假阳性、不能准确定量的缺点。真菌毒素的确证方法包括薄层色谱法(TLC)、高效液相色谱法(HPLC)和气相色谱法(GC)等[10-12]。目前这些方法只适用于一种或一类真菌毒素的定性和定量分析,但实际上一般都是多种真菌毒素的联合污染[13]。高效液相色谱-串联质谱法(HPLC-MS/MS)结合了色谱分离度好和质谱灵敏度高的特点,近年来被广泛应用于不同样品中真菌毒素的定性、定量分析[14],如应永飞等[15]建立了多功能净化柱结合LC-MS/MS检测饲料中14种真菌毒素的方法。然而,由于不同种类真菌毒素化学结构、色谱行为、光学特性的相似性,一般的分离方法无法在短时间内将多种真菌毒素同时分离,目前报道的检测方法仍然无法同时涵盖饲料中所有常见的真菌毒素。超高效液相色谱法(UHPLC)因具有更高的分析速度和灵敏度[16],越来越多地应用于多种真菌毒素的残留分析,为目标化合物的快速定性与定量提供了技术保障。
本文利用QuEChERS前处理技术[17,18],建立了UHPLC-MS/MS同时测定预混合饲料、浓缩饲料、配合饲料中常见的30种真菌毒素的分析方法,并采用同位素内标法[19]对其进行定量。本方法简单快速,准确度高,可同时检测不同饲料中的真菌毒素,大大缩短了分析时间,减少了不必要的资源成本。
1 实验部分
1.1 仪器、试剂与材料
Waters/XEVO TQ-S超高效液相色谱-串联质谱仪(美国Waters公司); XYC-12A型氮吹仪(上海析友分析仪器有限公司); Milli-Q超纯水仪(美国Millipore公司); Multifuge 1 L-R离心机(德国Thermo公司); AL104分析天平(美国梅特勒-托利多仪器有限公司); SK8210LHC超声波清洗机(上海科导超声仪器有限公司)。
甲醇、乙腈、甲酸、醋酸铵(色谱纯,德国Merck公司);无水硫酸镁、氯化钠(上海凌峰化学试剂有限公司);真菌毒素标准品(100 mg/L)和5种同位素内标(13C17-黄曲霉毒素B1(50 μg/L)、13C24-T-2毒素(1 mg/L)、13C15-脱氧雪腐镰刀菌烯醇(1 mg/L)、13C20-赭曲霉毒素A(1 mg/L)和13C18-玉米赤霉酮(1 mg/L)纯度均大于98%(美国Sigma公司);实验用38份不同饲料样品包括预混料(14份)、浓缩料(11份)和配合料(13份),均取自上海市生物科技有限公司和饲料生产公司的委托样品(如申嘉生物科技有限公司、上海谷歌丰饲料有限公司、金朝生物科技有限公司等)。
1.2 标准溶液的配制
分别移取30种真菌毒素标准品(100 mg/L),用乙腈配制质量浓度为1 mg/L的混合标准工作液,于-20 ℃保存。
移取适量5种同位素内标标准品,用乙腈将13C17-黄曲霉毒素B1、13C24-T-2毒素、13C15-脱氧雪腐镰刀菌烯醇、13C20-赭曲霉毒素A和13C18-玉米赤霉酮配制成质量浓度分别为10、50、100、200和100 μg/L的混合内标标准工作液,于-20 ℃保存。
1.3 样品前处理
试样:抽取500 g饲料样品,用四分法缩减取样200 g,粉碎后过0.45 mm样品筛,混匀,装入密闭容器中,常温避光保存,备用。
精密称取2 g(精确到0.01 g)试样于50 mL离心管中,加入200 μL同位素内标混合标准工作液,于室温下静置1 h后,加入5 mL水,浸泡5 min后,超声提取40 min,然后加入5 mL含1%(v/v)甲酸的乙腈溶液,涡旋混匀30 s后,超声提取40 min,加入2.0 g无水硫酸镁和0.5 g氯化钠,立即剧烈振摇30 s,超声10 min,以8 000 r/min离心5 min,移取3 mL上清液,于40 ℃下氮气吹干,用1 mL 5 mmol/L醋酸铵水溶液-乙腈(80∶20, v/v)溶解残渣,涡旋30 s,经0.22 μm滤膜过滤后,上机测定。
1.4 分析条件
色谱柱:Agilent Poroshell 120 EC-C18柱(100 mm×3.0 mm, 2.7 μm);柱温:40 ℃;流速:0.4mL/min;进样量:3 μL;流动相:A为甲醇,B为5 mmol/L醋酸铵水溶液;梯度洗脱条件:0~0.5 min, 10%A; 0.5~6.0 min, 10%A~90%A; 6.0~6.5 min, 90%A; 6.5~6.7 min, 90%A~10%A; 6.7~8.0 min, 10%A。
离子源:电喷雾离子(ESI)源;正离子、负离子模式同时扫描;离子源温度:150 ℃;脱溶剂温度:500 ℃(高纯氮气);脱溶剂气流:1 000 L/h;锥孔气流:7.0 L/h(高纯氮气);碰撞气:高纯氩气;多反应监测(MRM)模式;数据分析:MassLynxv 4.1和Targetlynx软件。其他质谱参数见表1。

表 1 30种真菌毒素及5种同位素内标的保留时间(tR)、母离子、子离子和碰撞能量(CE)
* Quantitative ion.
2 结果与讨论
2.1 前处理方法的选择
QuEChERS技术和N-丙基乙二胺(PSA)吸附剂常被应用于多种化学性质不同的真菌毒素的净化处理中。但PSA吸附剂会通过离子交换作用吸附FB1和FB2,导致其回收率低于20%。因此本实验选择QuEChERS技术作为样品的前处理方法,并进一步优化了提取时间、提取溶剂等条件。
2.2 流动相的选择
本实验比较了①甲醇-0.1%(v/v)甲酸水溶液、②甲醇-0.1%(v/v)乙酸水溶液和③甲醇-5 mmol/L醋酸铵水溶液3种流动相的洗脱效果。结果表明,当选择流动相①和②时,真菌毒素在ESI+模式下的色谱峰对称、尖锐,但在ESI-模式下,B型单端孢霉烯族类毒素(如3-ADON和D3G等)的色谱峰形较差,响应强度较低;当选择流动相③时,在正、负离子模式下,30种真菌毒素的色谱峰形和响应强度均较好,且保留时间稳定。因此本实验最终选择甲醇-5 mmol/L醋酸铵水溶液作为流动相。30种真菌毒素(200 μg/L)和5种同位素内标在基质溶液中的总离子流色谱图见图1。
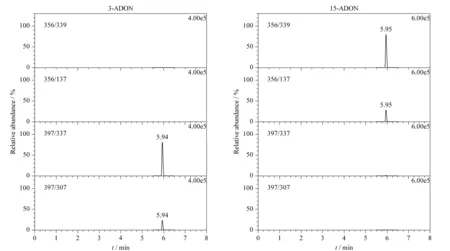
图 2 3-ADON和15-ADON标准品(50 μg/L)在各自离子通道下的MRM色谱图Fig. 2 MRM chromatograms of the 3-ADON and 15-ADON standard sample (50 μg/L) under the corresponding ion channels
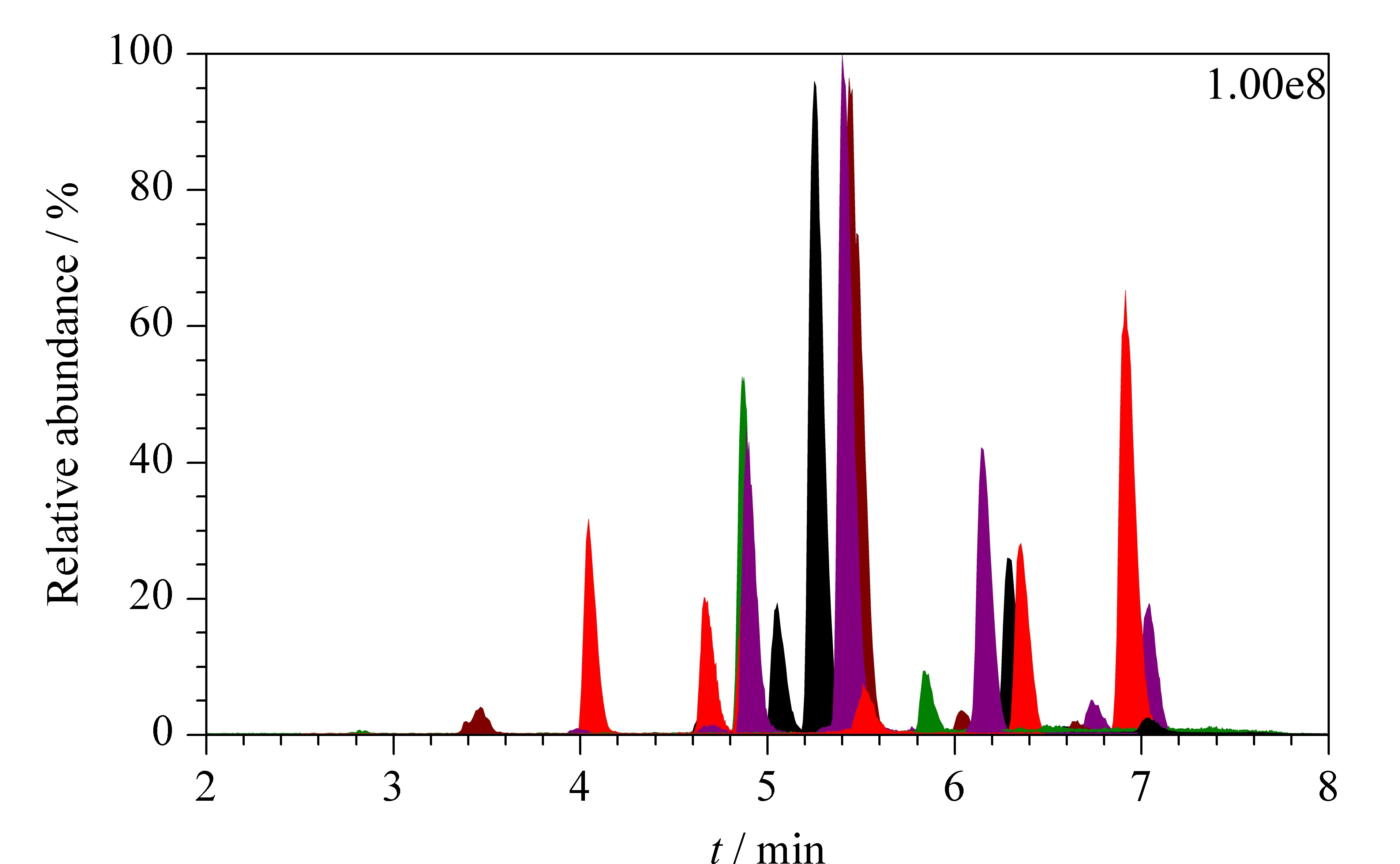
图 1 30种真菌毒素(200 μg/L)和5种同位素内标的总离子流色谱图Fig. 1 Total ion chromatogram of the 30 mycotoxins (200 μg/L) and five internal standards13C17-AFB1: 2 μg/L; 13C24-T-2: 10 μg/L; 13C15-DON: 20 μg/L; 13C20-OTA: 40 μg/L; 13C18-ZEN: 20 μg/L.
2.3 质谱条件的优化
通过对每种真菌毒素的标准品进行分析,分别在ESI+及ESI-模式下通过全扫描确定每种真菌毒素的母离子,并通过优化碰撞能量,选择相对丰度最高的离子作为定量离子,相对丰度次之的离子作为定性离子。在ESI+条件下,真菌毒素的母离子主要为[M+H]+和[M+NH4]+,在ESI-条件下,真菌毒素的母离子主要为[M-H]-和[M+CH3COO]-。由于3-ADON和15-ADON具有相同的分子式和相对分子质量,所以正离子模式下两种化合物有着相同的母离子和子离子,意味着在此情形下二者不能准确定量。通过比较正、负离子模式下不同的母离子、子离子及碰撞电压等质谱条件,最终确定15-ADON采用ESI+扫描模式,3-ADON采用ESI-扫描模式。为进一步确认两种化合物的离子通道不会相互干扰而影响定量,分别对两种化合物的标准品进行仪器分析,结果显示,3-ADON和15-ADON在各自的离子通道下几乎不存在相互干扰(见图2)。
2.4 基质效应的评估及内标物的确定
本文分别对预混料、浓缩料和配合料样品中的30种真菌毒素的基质效应进行了评价,结果显示,预混料、浓缩料和配合料基质中,真菌毒素的基质效应分别为1.1%~72.2%、1.2%~80.8%和0.1%~81.5%(见表S1,详见http://www.chrom-China.com/UserFiles/File/1702010-SI.pdf)。30种真菌毒素的基质效应较大,为基质抑制效应,可导致检测方法的回收率偏低,降低了方法的准确度,因此必须通过基质加标的方法进行校正。然而基质加标后,采用外标法计算得到的回收率(41.3%~127.9%)仍具有较大差别(具体结果见表S2,详见http://www.chrom-China.com/UserFiles/File/1702010-SI.pdf),并不能满足检测需求,因此必须采用内标法进行定量。将5种同位素内标的回收率与表S2中30种真菌毒素的绝对回收率进行比较,其回收率值相近的作为相应真菌毒素的内标,如13C17-AFB1的回收率与AFB1、AFB2、AFG1、AFG2、AFM1、AFM2和SMC的绝对回收率接近,用以校正该组目标物前处理过程的损失及基质效应,具体分组情况见表1。
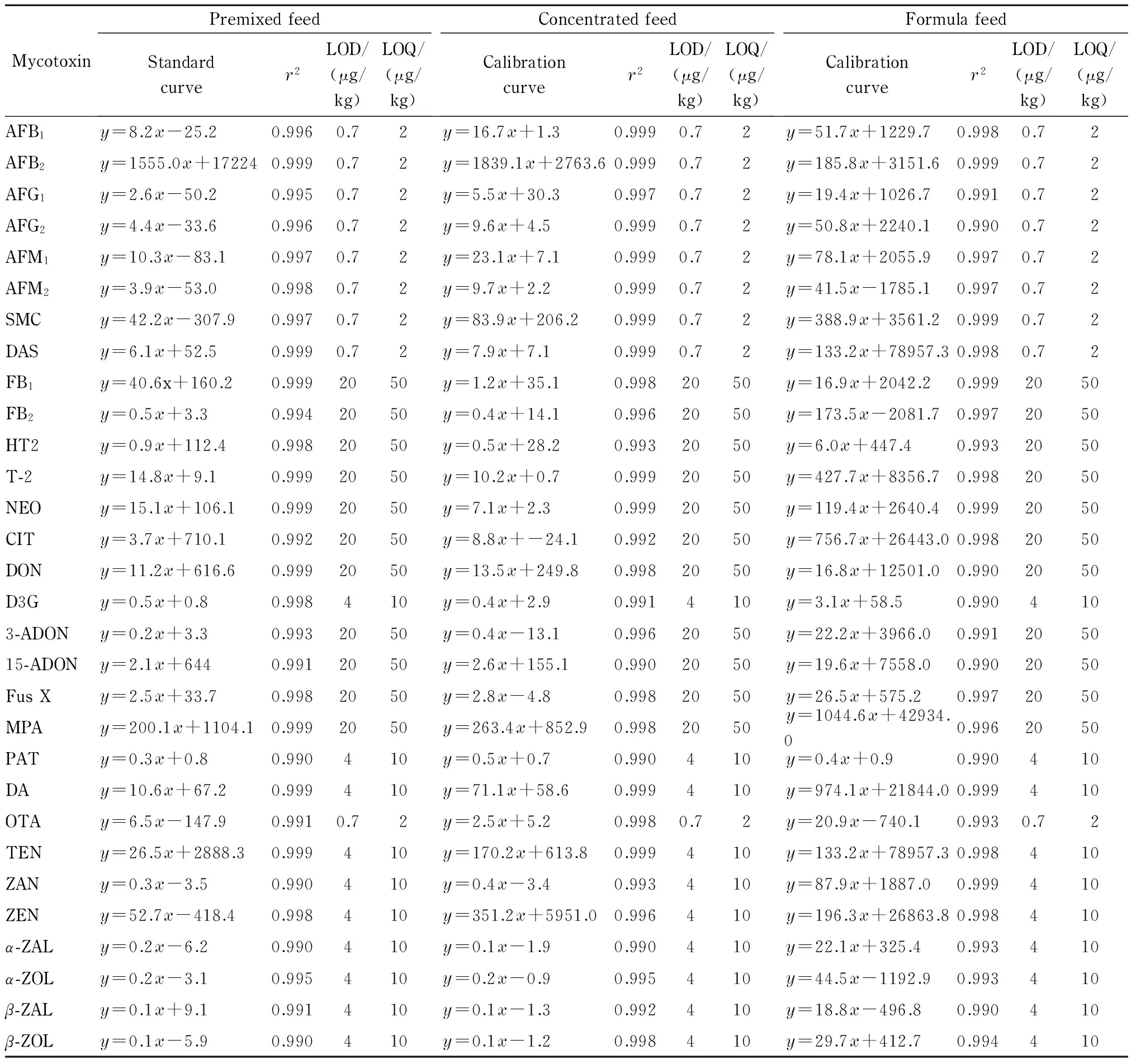
表 2 不同饲料中30种真菌毒素的标准曲线、相关系数、检出限和定量限
y: peak area ratio of the compound to the internal standard;x: mass concentration, μg/L.
2.5 方法学考察
2.5.1 线性关系、检出限和定量限
以目标真菌毒素含量少的样品作为空白样品,将适量的30种真菌毒素混合标准工作液和120 μL混合内标工作液混合,配制不同线性范围的系列空白基质标准溶液(质量浓度为①2~200 μg/L的AFB1、AFB2、AFG1、AFG2、AFM1、AFM2、SMC、OTA和DAS溶液;②10~500 μg/L的D3G和PAT溶液;③10~500 μg/L的DA、TEN、ZEN、ZAN、α-ZAL、α-ZOL、β-ZAL和β-ZOL溶液;④50~1 000 μg/L的15-ADON、3-ADON、CIT、DON、FB1、FB2、Fus X、HT2、MPA、NEO和T-2溶液),建立了30种真菌毒素的标准曲线,结果见表2。30种真菌毒素在线性范围内线性关系良好,相关系数(r2)均≥0.99。以定性通道的3倍信噪比(S/N)确定化合物的检出限(LOD)、定量通道的10倍信噪比确定化合物的定量限(LOQ),检出限和定量限分别为0.7~20 μg/L和2~50 μg/L,满足国家标准的相关要求[6-8]。
2.5.2 回收率和精密度
取空白饲料样品,将30种真菌毒素按低、中、高3个水平进行加标回收率试验,结果见表3。30种真菌毒素在低、中、高添加水平下的回收率为72.0%~118.4%(n=5)。分别在一天内和连续的5天进行稳定性试验,30种真菌毒素的日内和日间精密度见表S3(详见http://www.chrom-China.com/UserFiles/File/1702010-SI.pdf)。结果表明,30种真菌毒素的日内和日间精密度为2.0%~11.9%和5.0%~17.8%(n=5)。
2.6 实际样品分析
采用建立的UHPLC-MS/MS方法对38份饲料样品进行分析,其中一份阳性样品的MRM色谱见图3。38份饲料中均含有真菌毒素,含量为60.3~2 989.6 μg/kg(见表S4,详见http://www.chrom-China.com/UserFiles/File/1702010-SI.pdf)。其中,有31份饲料被DON污染,含量为59.3~576.8 μg/kg;有21份饲料被15-ADON污染,含量为62.3~984.3 μg/kg;有7份饲料被D3G污染,含量为27.8~127.1 μg/kg;另外,在不同的饲料中还发现了FB1、FB2、ZEN、β-ZOL、PAT和AFB1等真菌毒素。

表 3 不同饲料中30种真菌毒素的加标回收率(n=5)
Low, medium and high levels: AFB1, AFG2, AFM1, AFM2, DAS, OTA and SMC were 2, 5 and 50 μg/kg, respectively; D3G, DA, PAT, TEN, ZEN, ZAN,α-ZOL,β-ZOL,α-ZAL andβ-ZAL were 10, 50 and 100 μg/kg, respectively; 3-ADON, 15-ADON, CIT, DON, FB1, FB2, Fus X, HT2, MPA, NEO and T-2 were 50, 200 and 500 μg/kg, respectively.

图 3 (a)5种真菌毒素在标准品溶液(50 μg/L)和(b)典型阳性饲料样品中的MRM色谱图Fig. 3 MRM chromatograms of the five mycotoxins in (a) a standard solution (50 μg/L) and (b) a typical positive feed sample
3 结论
本研究基于QuEChERS前处理技术,建立了UHPLC-MS/MS同时检测不同饲料样品中30种真菌毒素的方法。本方法具有操作简单、快速、准确、实用性强等优点,分析结果满足国家标准的要求,适用于预混料、浓缩料和配合料中30种真菌毒素的定量分析,也可为其他基质中多种真菌毒素含量的同时检测提供技术支持。
[1] Cao X Q, Wu S C, Yue Y, et al. J Chromatogr B, 2013, 942/943: 113
[2] Li F Q, Yu C C, Shao B, et al. Chinese Journal of Preventive Medicine, 2011, 45(1): 57
李凤琴, 于钏钏, 邵兵, 等. 中华预防医学杂志, 2011, 45(1): 57
[3] Binder E M, Tan L M, Chin L J, et al. Anim Feed Sci Technol, 2007, 137: 265
[4] Li P, Lai W H, Jin J. Academic Periodical of Farm Products Processing, 2005(3): 12
李鹏, 赖卫华, 金晶. 农产品加工学刊, 2005(3): 12
[5] World Health Organization (WHO). WHO Global Strategy for Food Safety: Safer Food for Better Health. Switzerland: WHO, 2002
[6] GB 2761-2011
[7] GB 13078. 2-2006
[8] GB 13078. 3-2007
[9] Li Y S, Luo X S, Yang S P, et al. J Agric Food Chem, 2014, 62: 1492
[10] Shephard G S. Chem Soc Rev, 2008, 37: 2468
[11] Wang J S, Zhou Y, Wang Q M. Food Chem, 2008, 107: 970
[12] Almeida I, Martins H M, Santos S, et al. Mycotox Res, 2011, 27: 177
[13] Monbaliu S, van Poucke C, Detavernier C, et al. J Agric Food Chem, 2010, 58(1): 66
[14] Zhao Z Y, Rao Q X, Song S Q, et al. J Chromatogr B, 2014, 963: 75
[15] Ying Y F, Zhu C Y, Wei M J, et al. Chinese Journal of Analytical Chemistry, 2010, 38(12): 1759
应永飞, 朱聪英, 韦敏珏, 等. 分析化学, 2010, 38(12): 1759
[16] Dong M F, Si W S, Jiang K Q, et al. J Chromatogr A, 2015, 1423: 177
[17] Anastassiades M, Lehotay S J, Stajnbaher D, et al. J AOAC Int, 2003, 86(2): 412
[18] Gong X M, Ma R H, Wang H T, et al. Chinese Journal of Chromatography, 2017, 35(2): 185
宫小明, 马荣桧, 王洪涛, 等. 色谱, 2017, 35(2): 185
[19] He J L, Peng T, Xie J, et al. Chinese Journal of Chromatography, 2016, 34(7): 708
何建丽, 彭涛, 谢洁, 等. 色谱, 2016, 34(7): 708
Shanghai Agriculture Applied Technology Development Program of China (No. G20140302).
Simultaneous determination of 30 mycotoxins in different feed products by ultra high performance liquid chromatography-tandem mass spectrometry
FAN Zhichen1, HAN Zheng2, GUO Wenbo2, ZHAO Zhihui2*
(1.CollegeofFoodScience&Technology,ShanghaiOceanUniversity,Shanghai201306,China; 2.InstituteforAgro-FoodStandardsandTestingTechnology,ShanghaiAcademyofAgriculturalSciences,Shanghai201403,China)
A method for the simultaneous determination of 30 mycotoxins in different feed products was developed using a QuEChERS pretreatment procedure coupled with ultra high performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS). The samples were extracted with 5 mL water and 5 mL acetonitrile containing 1% (v/v) formic acid. An aliquot of the supernatant was dried by nitrogen gas, re-dissolved by 1mL water containing 5 mmol/L ammonium acetate-acetonitrile (80∶20, v/v), and analyzed by UHPLC-MS/MS. Matrix-matched calibration curves and internal standards were used for accurate quantification. Satisfactory recoveries at low, medium and high spiked levels were ranged from 72.0% to 118.4% (n=5). Good linear relationships were obtained, the correlation coefficients (r2) were greater than 0.99. The limits of detection (LODs,S/N=3) and the limits of quantification (LOQs,S/N=10) ranged from 0.7 μg/L to 20 μg/L and from 2 μg/L to 50 μg/L, respectively. The proposed method is simple, rapid and valuable, which can be a powerful tool for quantitative analysis of the 30 mycotoxins in premixed feed, concentrated feed and formula feed products.
ultra high performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS); QuEChERS; mycotoxins; feed
10.3724/SP.J.1123.2017.02010
2017-02-12
沪农科攻字(2014)第3-2号(G20140302).
O658
A
1000-8713(2017)06-0627-07
* 通讯联系人.Tel:(021)52235463,E-mail:zhao9912@hotmail.com.
