芝麻栽培种与野生种(Sesamum indicatum)杂种F1的获得及特性鉴定
2017-06-15杨敏敏刘红艳周婷瞿洪浩杨远霄魏鑫左阳赵应忠
杨敏敏,刘红艳,周婷,瞿洪浩,杨远霄,魏鑫,左阳,赵应忠
(中国农业科学院油料作物研究所/农业部油料作物生物学与遗传育种重点实验室,武汉 430062)
芝麻栽培种与野生种(Sesamum indicatum)杂种F1的获得及特性鉴定
杨敏敏,刘红艳,周婷,瞿洪浩,杨远霄,魏鑫,左阳,赵应忠
(中国农业科学院油料作物研究所/农业部油料作物生物学与遗传育种重点实验室,武汉 430062)
【目的】通过远缘杂交获得芝麻栽培种与野生种的杂交后代,改良芝麻栽培种对茎点枯病的抗性。【方法】对野芝3号(S. indicatum)(P3)和芝麻栽培种中芝14(P1)、中芝14同源四倍体(P2)进行正反种间杂交,通过幼胚培养技术获得杂种F1植株。首先利用SSR分子标记、细胞学、形态学方法进行后代真实性鉴定,筛选出真杂种。后对种间杂交的3个亲本(野芝3号、中芝14及其同源四倍体)以及杂种后代F1株系进行茎点枯病人工接种鉴定。【结果】种间正反交组合后代的幼胚成苗率有明显差异,在接种的773个幼胚中,有155个幼胚发育成苗,平均幼胚成苗率为20.05%。种间正交组合(P3×P1、P3×P2分别为32.75%和21.11%),高于反交组合(P1×P3、P2×P3分别为 8.84%和 13.41%)。说明亲本的基因型在很大程度上影响远缘杂交的成苗率。P3×P1、P1×P3组合 F1植株染色体数目为42条;P3×P2、P2×P3组合F1染色体数目为55条,正反交杂种F1株系大部分花粉粒形态独特,形状规则但多无内含物,为高度不育类型;部分F1株系有少量的可育花粉,为部分不育型。选用多态性较好的HS142引物在亲本中芝14中能清晰的扩增出2条特异性条带(约460和500 bp),在野芝3号则扩增出1条特异性条带(约380 bp)。然后对12个后代进行鉴定,其中有10个杂种F1植株同时具有3条父、母本特异条带,另2株仅出现母本或父本带为假杂种。以高抗种质野芝3号为母本的种间杂交P3×P1、P3×P2后代染病的病斑长度分别为9.35和6.65 cm,反交组合后代的病斑长度分别为9.90和8.90 cm;所有杂交组合的后代对茎点枯病抗性均高于其栽培种亲本(P114.30 cm和P211.46 cm),但低于野生种亲本(P34.80 cm)。【结论】通过种间杂交结合幼胚培养可以筛选出茎点枯病抗性明显高于芝麻栽培亲本的新种质。
芝麻;野生种;种间杂交;分子标记;茎点枯病抗性
0 引言
【研究意义】芝麻(Sesamum indicum L.)是中国重要的优质油料作物,分布广,但主要集中在江淮、黄淮地区,雨热同季,易受到多种真菌、细菌病害的侵染,其中最严重的病害是茎点枯病(Macrophomina phaseolina Ashby)[1]。茎点枯病的病原菌主要通过种子、土壤及病残体越冬传播,能以菌核或分生孢子形式存活 10个月以上,侵染玉米、大豆、芝麻等 100多个属的500多种作物[2-3],一般造成减产10%—20%,严重时达到 80%以上[4]。因此,迫切需要选育高抗病或高耐病的芝麻品种。但是,现有芝麻栽培品种均来自于同一个种(S. indicum),遗传基础相对狭窄[5-6]。现有的芝麻种质资源里缺少免疫类型,而高抗类型也很少,导致芝麻茎点枯病的遗传改良无法取得突破性进展[4, 7-8]。研究发现,芝麻属中部分野生种具有高抗病抗逆等优良特性[9-10],因此,发掘、利用芝麻野生种的抗茎点枯病优良基因,丰富芝麻栽培种的基因库,是芝麻茎点枯病遗传改良的重要途径[3]。【前人研究进展】近30年来,国内外的专家学者先后开展了大量的芝麻远缘杂交研究,以期利用野生芝麻的优良性状。已有研究表明,芝麻种间杂交存在一定的杂交不亲和性或杂种发育障碍,利用常规杂交方法很难获得杂种后代[11-12]。借助胚胎培养拯救技术是获得种间杂交后代的有效方法,已在野生种S. schinzianum、S. radiatum、S. alatum等与栽培种的杂交上取得成功[9, 12-15]。在杂交种真实性的鉴定上,除形态学观察外,也普遍使用细胞学、分子标记等方法[9,13-15]。RAJESWARI等[13]以S. alatum和栽培种杂交,获得抗变叶病材料。【本研究切入点】尽管前人在一些芝麻野生种与栽培种的杂交上取得成功,但关于野芝3号(S. indicatum)茎点枯病的抗性转移研究未见报道。【拟解决的关键问题】本研究通过对野芝3号与栽培种中芝14、中芝14同源四倍体进行种间杂交,借助幼胚培养技术及细胞学、分子标记、茎点枯病人工接种鉴定技术,获得高抗茎点枯病新种质,为芝麻茎点枯病抗病育种提供基础遗传材料。
1 材料与方法
1.1 试验材料
供试材料亲本为P1:中芝14(2n=26)、P2:中芝14同源四倍体(2n=52)、P3:野芝3号(2n=58 S. indicatum)。
茎点枯病抗性鉴定的对照材料:芝麻育种课题组经过多年在湖北武汉病害鉴定圃鉴定出的稳定新株系,包括抗病对照BJ2236、中抗对照BJ2018和感病对照BJ2002。
菌种:由河南省农业科学院植物保护研究所刘红彦研究员提供。
1.2 种间杂交以及F1植株的获得
种间杂交试验于 2014年夏在中国农业科学院油料作物研究所武昌基地进行。于开花前一天下午摘掉母本的花冠和雄蕊,第二天上午用父本花粉授粉。取杂交授粉后16 d的幼蒴,进行表面消毒,切开幼蒴,剥取幼胚,接种到幼胚诱导培养基上(MS+30 g·L-1蔗糖+8 g·L-1琼脂粉+0.5 g·L-1GA3+1 g·L-16-BA,pH=5.8)。14 d后转入分化培养基(MS+30 g·L-1蔗糖+8 g·L-1琼脂粉+0.3 g·L-1IBA,pH=5.8)继续培养,20 d后在生根培养基(MS +30 g·L-1蔗糖+8 g·L-1琼脂粉+0.5 g·L-1NAA,pH=5.8)上壮苗生根,直至发育成幼苗,控制温度28—30℃、光周期8—16 h·d-1、光照强度1 500—2 000 lx。将杂种F1植株在室内自然光下开瓶炼苗2—3 d,洗净附着在其表面的培养基,将其移栽到装有营养土(泥炭﹕珍珠岩﹕蛭石=1﹕1﹕1)的穴盘中,在27—30℃、60%—70%相对湿度条件下培养5 d后带土移栽大田。幼胚萌发并形成健壮小苗时统计幼胚成苗率。

1.3 细胞学观察
以植株花期的子房为材料,进行细胞有丝分裂观察。子房的大小为2 mm左右,在解剖镜下除去花药,常温下用0.002 mol·L-18-羟基喹啉混合液避光处理4 h,加入新鲜卡诺固定液(冰乙酸﹕无水乙醇=1﹕3)在 4℃冰箱中固定 18—24 h。清水冲洗后,转入 1 mol·L-1HCl 60℃恒温解离8 min,用蒸馏水漂洗,卡宝品红染色,蒸馏水压片,敲片,镜检时取30个分裂相良好的细胞观察染色体的形态,统计染色体数目,用OLYMPUS显微镜(BX-51)拍照。
1.4 DNA提取、检测和SSR分析
选取健康无病害供试材料的幼嫩叶片50 mg,参照 PATERSON等[16]改良的 CTAB法提取基因组DNA,-20℃保存备用。随机从已合成的EST-SSR引物中挑选265对引物[17]进行双亲之间的多态性筛选。通过选用与双亲有特异性标记的引物对杂种 F1进行分子鉴定。PCR扩增反应体系和扩增程序参考WU等[17]。扩增产物在 6%聚丙烯酰胺凝胶中电泳,银染,检测,同时具有父母本特异性带的即为真杂种。
1.5 形态学观察
2015年夏分别在现蕾期、花期和成熟期调查后代植株及亲本形态性状,主要包括植株生长习性、株型、茎秆颜色、花冠长唇缘颜色、每叶腋花数、花粉粒育性、蒴果形状、单株蒴果数、种皮颜色、全生育期等。
1.6 茎点枯病抗性鉴定
2016年对抗病、中抗、感病等3个稳定的对照材料、种间杂交的3个亲本(野芝3号、中芝14及其同源四倍体)以及杂种后代F1株系进行茎点枯病菌的接种抗性鉴定。参考王建方[18]的接菌方法,在盛花期进行,每个材料接种5株,重复3次,挂牌记录。选取灭菌后的棉花,在菌丝液中浸泡待用,取灭菌后的镊子在芝麻茎杆中下部戳一个3 mm左右的小孔,用棉花蘸取菌液对小孔周围进行均匀涂抹,高度为2 cm。对照:只涂抹无菌水。在7 d后进行植株发病情况调查记录,参照江诗洋等[19]的方法测量发病植株的病斑长度,结果取平均值。在SPSS软件上进行差异显著性方差分析,用Origin软件绘图。
2 结果
2.1 种间杂交
野芝3号(P3)与栽培种(P1和P2)共配制4个正、反杂交组合,授粉511朵花,获得277个蒴果。在田间自然条件下,虽然能获得蒴果但是蒴果成熟后多数瘪而小,内无籽或仅有一两粒种子,多数无发芽能力。而采用胚胎拯救技术对授粉后16 d的幼胚进行组织培养,在接种的773个幼胚中,有155个幼胚发育成苗,平均幼胚成苗率为20.05%(表1)。发现正反交组合的幼胚成苗率存在明显差异,以野芝3号为母本组合(P3×P1、P3×P2)的幼胚成苗率均高于其反交组合(P1×P3、P2×P3),其中,P3×P1组合成苗率高达32.75%。以野芝3号为父本的反交组合的幼胚成苗率均低于平均值,其中较高的P2×P3组合成苗率为13.41%。结果表明,亲本的基因型在很大程度上影响远缘杂交的成苗率。
2.2 种间杂种F1的细胞学和分子标记鉴定
对野芝3号与中芝14、中芝14同源四倍体以及种间杂交后代的子房有丝分裂中期染色体数目进行统计,结果表明,P3×P1、P1×P3组合F1植株染色体数目为42(图1-A4)。P3×P2、P2×P3组合F1染色体数目为55(图1-A5)。正反交杂种F1株系大部分花粉粒形态独特,形状规则但多无内含物,为高度不育类型;部分F1株系有少量的可育花粉,为部分不育型(图1-B4—图1-B5)。调查发现F1植株在田间有自交结实现象,F1植株自交所得籽粒颜色分离,体积较大,部分饱满,有一定的萌发率。
从265对SSR引物[17]进行的双亲多态性筛选中,检测出12对标记在亲本间具有多态性。选用其中部分多态性较好的SSR标记对种间正反交F1株系进行分子鉴定。图 2中所用的引物为 HS142(F:5′-ATT GTCGTTGTCGTTGTCGT-3′,R:5′-AACTCCATCAA CCTATGCCC-3′)。
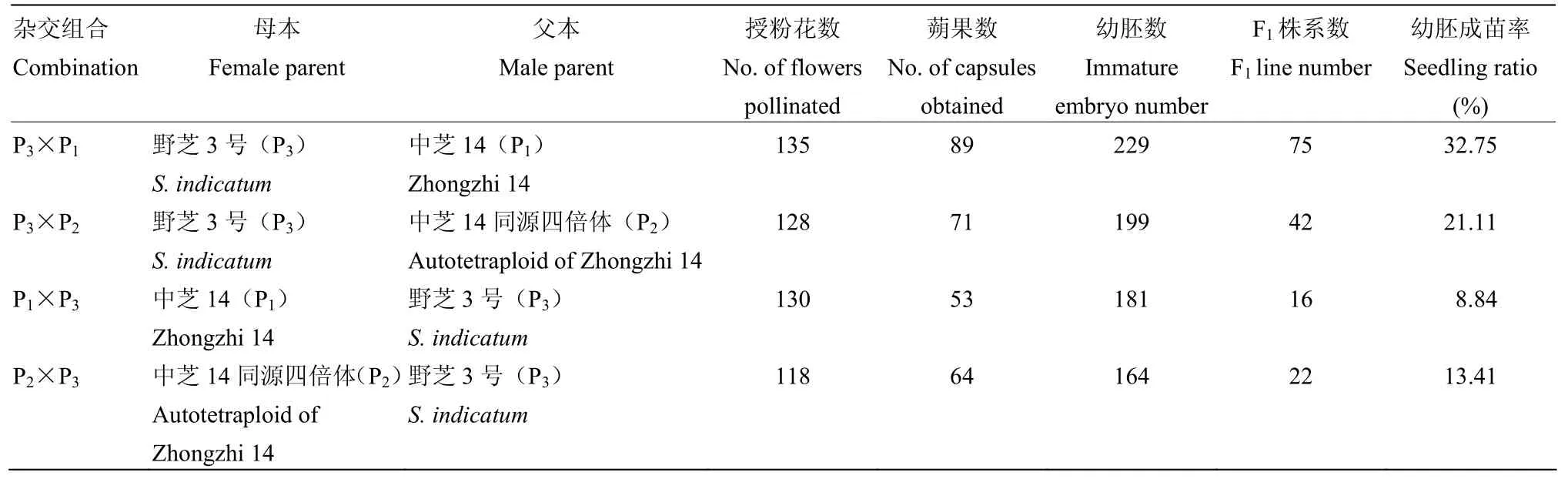
表1 野芝3号与2个栽培种种间杂交后代成苗率比较Table 1 Comparison of the seedling ratios among the reciprocal crosses between No.3 wild sesame and the two cultivated accessions
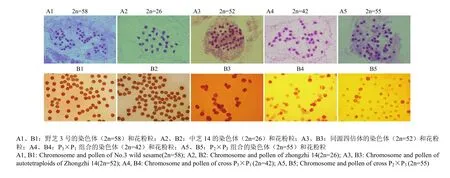
图1 亲本及种间杂交后代的染色体和花粉粒比较Fig. 1 Chromosome and pollen comparison between parents and interspecific hybrids
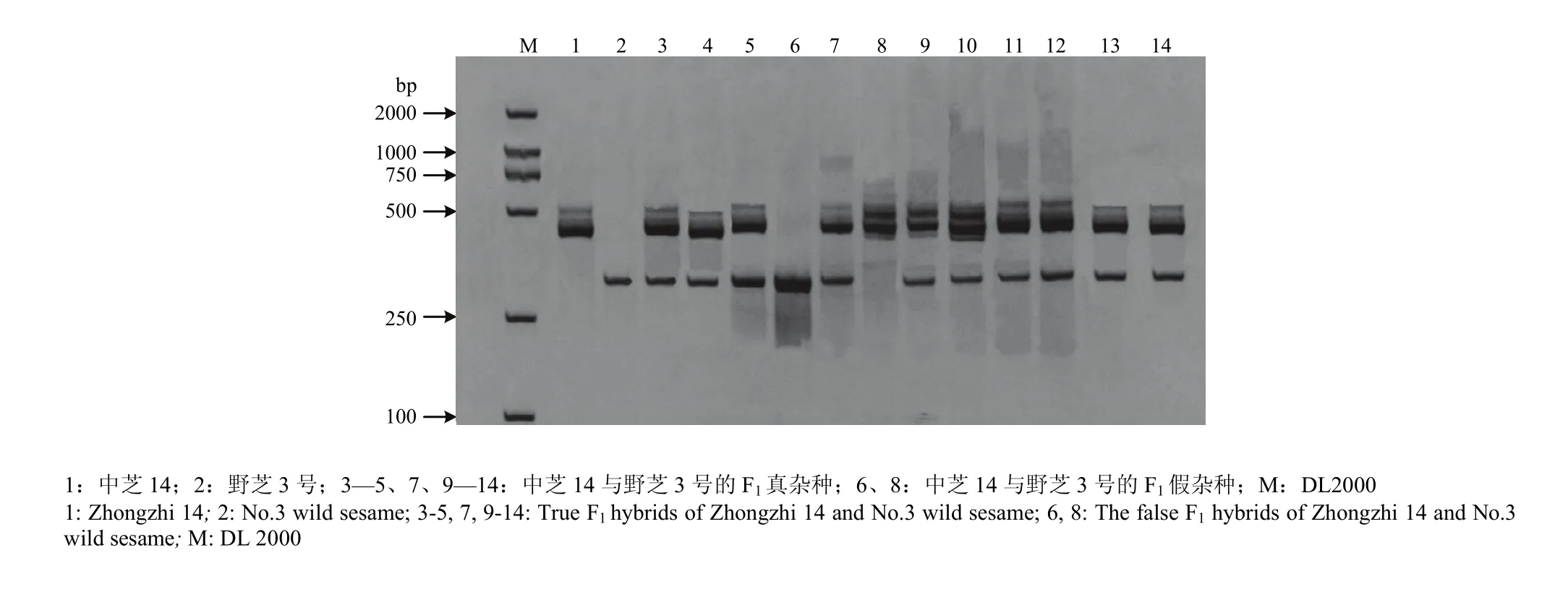
图2 种间杂种F1的SSR标记扩增图谱(HS142)Fig. 2 Detection of F1interspecific hybrids by SSR marker (HS142)
如图2所示,HS142引物在亲本中芝14中能清晰地扩增出2条特异性条带(约460 bp、500 bp),在野芝3号则扩增出1条特异性条带(约380 bp)。12个后代中,有10个杂种F1植株同时具有3条父、母本特异条带,另2株仅出现母本或父本带。结合其他引物PCR结果,判定该10株为真杂种,另外2株为假杂种。田间观察发现,假杂种表型性状与父本或母本无差异,证实了PCR结果。
2.3 杂种F1形态学特征
随机选取20个正反杂交组合的F1植株,分别在现蕾期、花期和成熟期观察其形态特征(表 2),正反交杂种F1的蒴果形状、叶片基部边缘锯齿状、每叶腋花数为单花等都趋向于亲本野芝3号;花冠长唇缘颜色浅紫、茎秆颜色浅紫等则介于双亲之间(图3)。不同正反杂交组合的杂种F1植株生长习性、株型、全生育期、种皮颜色等性状均存在差异,如以野芝3号为母本的组合P3×P1、P3×P2杂种F1植株形态上表现为匍匐型、分枝,种皮颜色均为黑色,与野生种亲本相似;反交组合P1×P3的杂种F1种皮颜色为白色,与栽培种亲本相似;植株形态则大部分为半直立,株型也多为单秆或少分枝,性状居于两亲本之间(表2)。
2.4 亲本及杂种F1茎点枯病抗性鉴定
芝麻茎秆在伤口处涂抹菌液后,伤口附近会形成棕黑色病斑并逐渐扩大,接菌3 d后感病材料BJ2002开始出现侵染症状,病斑迅速扩大;抗病材料BJ2236病斑扩大比较缓慢,而野芝3号(P3)以及其种间杂交后代伤口的棕黑色病斑无明显变化;接菌7 d后,不同对照材料的病斑长度差异非常明显,因此,作为品种抗性评价的依据。由图 4可见,抗病对照材料BJ2236的病斑长度为11.41 cm;中抗对照材料BJ2018的病斑长度为15.03 cm;感病对照材料BJ2002的病斑长度为19.52 cm,3个对照材料的染病结果与之前多年的人工病圃鉴定结果表现基本一致,说明此试验准确性较好,用于芝麻茎点枯病抗性鉴定是合适的。
本研究结果显示,抗病、中抗、感病对照材料、3个亲本以及杂种 F1对茎点枯病菌的抗性存在显著差异。亲本野芝3号(P3)的抗性与抗病对照材料BJ2236有显著差异,抗性最强;中芝14(P1)与中抗对照材料BJ2018无显著差异;同源四倍体(P2)与抗病对照材料BJ2236无显著差异。中芝14(P1)的病斑长度显著高于同源四倍体(P2)的病斑长度(14.30 cm>11.46 cm),说明同源四倍体的抗性要显著强于中芝14。后代中,P3×P2的杂种F1病斑最短为6.65,显著低于其他杂交组合后代和抗病对照材料的病斑长度;其他杂交组合F1的病斑长度为8.90—9.90 cm,显著低于抗病对照材料BJ2236。野芝3号与同源四倍体的后代在茎点枯抗性上均强于与中芝14杂交的后代。同样的亲本,以野芝3号为母本的正交组合在后代茎点枯抗性上均强于其反交组合。所有正反杂交的杂种 F1抗病性均超过其栽培种亲本。
3 讨论
芝麻野生种中具有很多栽培种缺乏的优异性状,尤其是抗病抗逆性,通过远缘杂交的方式将其优异基因转移到栽培种中,是创造种间遗传变异、丰富种质资源、改良芝麻抗性最有效的途径[5,14, 20-21]。由于芝麻种间杂交存在严重的生殖隔离、杂种胚败育等问题[14, 22],对种间杂种后代性状改良及利用研究的报道不多。本研究结果显示,在自然状态下野芝3号(S. indicatum)与栽培种杂交存在受精后的幼胚发育障碍,杂种幼胚发生败育。利用幼胚培养拯救技术显著提高获得种间杂交后代成功率,这也是开展远缘杂交普遍采用的方法[23-24]。
在幼胚培养条件下,种间杂交组合正反交杂种胚的发育程度也存在很大的差异。染色体多的野生种作母本与栽培品种杂交其杂种胚更容易成苗。此外,研究还发现,将染色体少的栽培种预先加倍,使得染色体数目接近野生种的染色体数目,也可以提高F1幼胚成苗率,这与张海洋等[15]的研究报道一致。由SSR分子鉴定结果可知,种间杂种F1都有野芝3号的特异性带型,说明后代存在野芝3号的遗传物质,为芝麻远缘杂交后代鉴定提供了依据。
本文所用亲本野芝3号(S. indicatum,2n=58)植株匍匐,分布于印度,S. prostratum是野生种,分布于印度、非洲,植株匍匐,不易受病虫害影响,抗旱性也强,系栽培种(n=13)×S. prostratum(n=16)后代加倍获得的双二倍体[25]。已有研究表明,多倍体可通过表观遗传变异产生新的表现型,且能够将这种改变通过有性生殖传递给后代,从而提高基因表达的多样性,且多倍体物种比其二倍体祖先更能适应环境的变化[26]。本研究中芝 14同源四倍体对茎点枯病的抗性要强于中芝14,且与野芝3号杂交的后代植株在茎点枯病抗性上也要强于其他杂交组合。
本研究通过野芝3号分别与中芝14、中芝14同源四倍体正反杂交,利用幼胚培养技术获得了真杂种F1株系,通过人工接菌,鉴定出了高抗茎点枯病的杂种F1株系,正反杂种F1的茎点枯病抗性均介于两亲本之间且高于其栽培种亲本,说明芝麻茎点枯病抗性可能由多基因控制,野芝3号是抗性提高的重要供体。研究发现杂交后代的抗性水平受到双亲抗性的影响,选择抗性较好的双亲在培育抗茎点枯病中起着重要的作用。
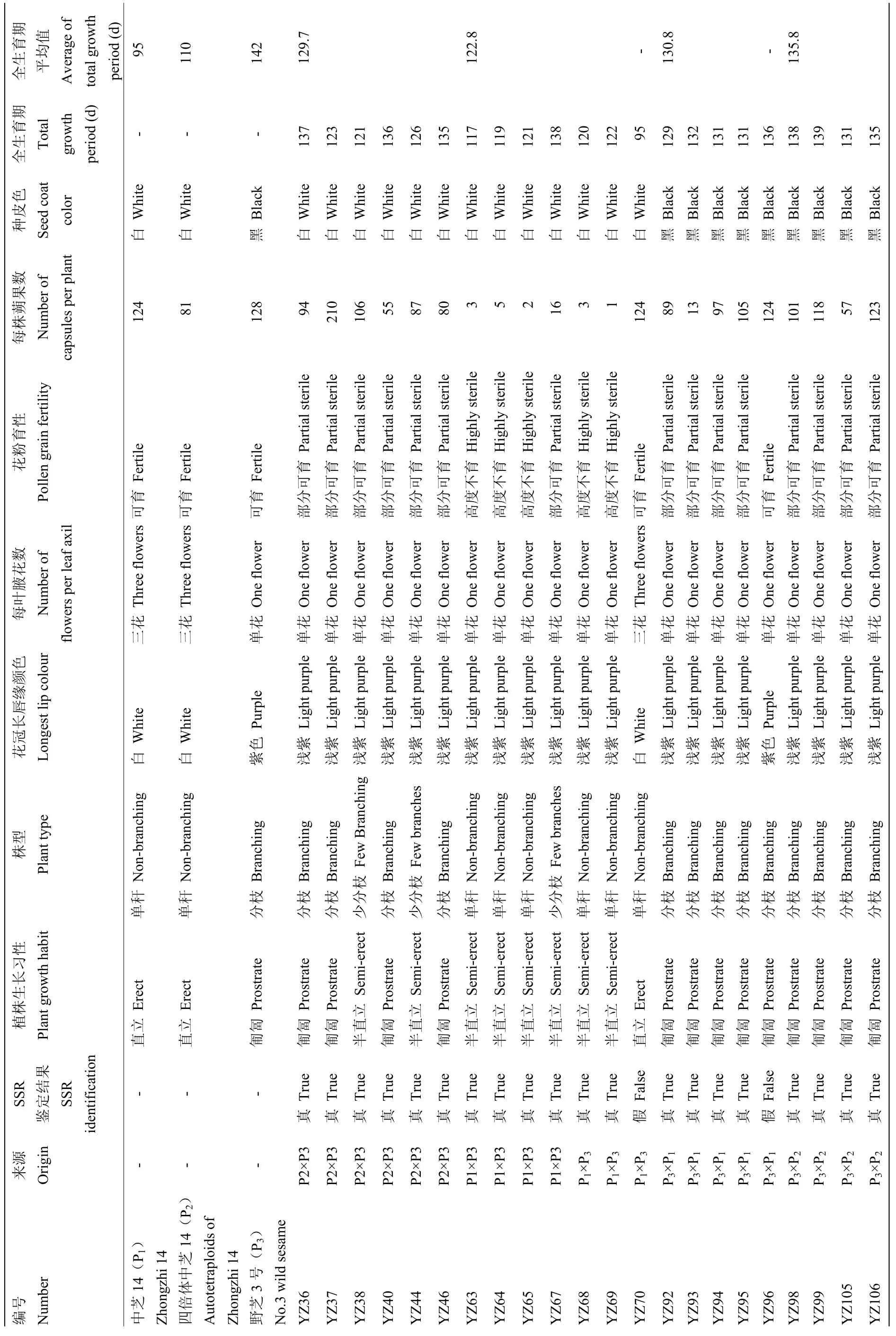
表2 种间杂种后代及亲本特征比较Table 2 Morphological comparison between the parents and hybrids

图3 种间杂交F1与亲本的生物学性状比较Fig. 3 Morphological comparison between the F1interspecific hybrids and the parents
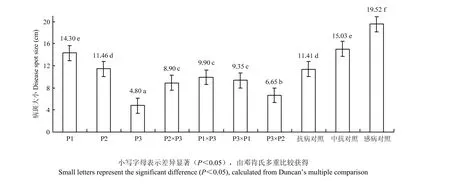
图4 基于3个对照、3个亲本、4个杂交后代的茎点枯病病情指数Fig. 4 Disease index of charcoal rot on 3 control materials, 3 parents and 4 hybrids
4 结论
通过幼胚培养技术成功获得芝麻栽培种与野生种的种间杂交F1株系,并通过形态学、细胞学和分子标记等方法得到证实。杂种F1的茎点枯病抗性介于双亲之间,但明显强于其栽培种亲本。
[1] 孙建, 乐美旺, 饶月亮, 颜廷献, 颜小文, 周红英. 江西芝麻产业现状、限制因素、发展潜力与对策分析. 江西农业学报, 2010, 22(9): 10-15. SUN J, LE M W, RAO Y L, YAN T X, YAN X W, ZHOU H Y. Current situation, limiting factors, developmental potential and counter measures of sesame industry in Jiangxi. Acta Agriculturae Jiangxi, 2010, 22(9): 10-15. (in Chinese)
[2] SURIACHANDRASELVAN M, SEETHARAMAN K. Survial of Macrophomina phaseolina, the causal agent of charcoal rot of Sunflower in soil, seed and plant debris. Journal of Mycology and Plant Pathology, 2000, 30(3): 402-405.
[3] SONGA W, HILLOCKS R J. Survival of Macrophomina phaseolina in bean seed and crop residue. International Journal of Pest Management, 1998, 44(2): 109-114.
[4] 李丽丽, 王圣玉, 方小平, 黄早花, 汪山涛, 李民良, 崔苗青. 我国芝麻种质资源抗茎点枯病鉴定. 中国油料, 1991(1): 3-6. LI L L, WANG S Y, FANG X P, HUANG Z H, WANG S T, LI M L, CUI M Q. Identification of sesame germplasm resources resistance to charcoal rot in China. Oil Crops in China, 1991(1): 3-6. (in Chinese)
[5] 岳文娣, 魏利斌, 张体德, 李春, 苗红梅, 张海洋. 芝麻种质资源SSR标记遗传多样性与群体结构分析. 作物学报, 2012, 38(12): 2286-2296. YUE W D, WEI L B, ZHANG T D, LI C, MIAO H M, ZHANG H Y. Genetic diversity and population structure of germplasm resources in sesame (Sesamum indicum L.) by SSR markers. Acta Agronomica Sinica, 2012, 38(12): 2286-2296. (in Chinese)
[6] ASHRI A. Sesame (Sesamum indicum L.)//SINGH R J. Genetics Resources, Chromosome Engineering, and Crop Improvement. Boca Raton: CRC Press, USA, 2007, 4: 231-290.
[7] 冯祥运, 张秀荣, 刘越英. 芝麻优良种质资源的深化鉴定与综合评价. 中国油料, 1996, 18(3): 63-66. FENG X Y, ZHANG X R, LIU Y Y. Deepen identification and comprehensive evaluation of elite sesame germplasm resources. Oil Crops in China, 1996, 18(3): 63-66. (in Chinese)
[8] 崔苗青, 李义芝, 高新国, 韩玉枝. 芝麻种质资源抗茎点枯病鉴定与评价. 作物品种资源, 1999(2): 36-37. CUI M Q, LI Y Z, GAO X G, HAN Y Z. Identification and evaluation of sesame germplasm resources resistance to charcoal rot. Crop Germplasm Resources, 1999(2): 36-37. (in Chinese)
[9] KULKARNI V V. Studies on interspecific hybridization with particular reference to development of male sterility in sesame (Sesamum indicum L.)[D]. Dharwad: University of Agricultural Sciences, India, 2006.
[10] NIMMAKAYALA P, PERUMAL R, MULPURI S, REDDY U K. Sesamum // KOLE C. Wild Corp Relatives: Genomic and Breeding Resources Oilseeds. Berlin Heidelberg: Springer-Verlag Press, 2011:261-273.
[11] 刘红艳, 赵应忠. 芝麻野生种与栽培种种间杂交亲和性研究. 中国农学通报, 2011, 27(9): 156-159. LIU H Y, ZHAO Y Z. Studies on the hybridization compatibility between cultivated sesame and its wild species. Chinese Agricultural Science Bulletin, 2011, 27(9): 156-159. (in Chinese)
[12] 石淑稳. 芝麻野生种与栽培种的交配能力. 中国油料, 1993(2): 18-21. SHI S W. The crossability between wild and cultivated species in sesame. Oil Crops in China, 1993(2): 18-21. (in Chinese)
[13] RAJESWARI S, THIRUVENGADAM V, RAMASWAMY N M. Production of Interspecific hybrids between Sesamum alatum Thonn and Sesamum indicum L. through ovule culture and screening for phyllody disease resistance. South African Journal of Botany, 2010, 76(2): 252-258.
[14] PRABAKARAN A J. Cytoplasmic male sterility in sesame from the species cross // MARTÍNEZ J F. Sesamum malabaricum × S. indicum: I. Substitution Backcrosses. Sesame and Safflower Newsletter. Córdoba: IAS Press, Spain, 1998: 1-6.
[15] 张海洋, 苗红梅, 张体德, 魏利斌, 李春, 王慧丽, 段迎辉, 琚铭.芝麻栽培种与野生种(Sesamum schinzianum Asch、Sesamum radiatum Schum & Thonn)种间杂交后代的生物学特性. 中国农业科学, 2013, 46(19): 3965-3977. ZHANG H Y, MIAO H M, ZHANG T D, WEI L B, LI C, WANG H L, DUAN Y H, JU M. Biological characters of interspecific hybrid progenies between Sesamum indicum L. and wild relatives (Sesamum schinzianum Asch, Sesamum radiatum Schum & Thonn). Scientia Agricultura Sinica, 2013, 46(19): 3965-3977. (in Chinese)
[16] PATERSON A H, BRUBAKER C, WENDEL J F. A rapid method for extraction of cotton (Gossypium spp.) genomic DNA suitable for RFLP or PCR analysis. Plant Molecular Biology Reporter, 1999, 11(2): 122-127.
[17] WU K, YANG M, LIU H, TAO Y, MEI J, ZHAO Y. Genetic analysis and molecular characterization of Chinese sesame (Sesamum indicum L.) cultivars using Insertion-Deletion (InDel) and simple sequence repeat (SSR) markers. BMC Genetics, 2014, 15: 35.
[18] 王建方. 芝麻种质资源茎点枯病抗性及药剂防治研究[D]. 郑州:郑州大学, 2013. WANG J F. identification of resistance to charcoal rot of the sesame germplasm and chemical control of the disease [D]. Zhengzhou : Zhengzhou University, 2013. (in Chinese)
[19] 江诗洋, 黎冬华, 张艳欣, 王林海, 高媛, 张秀荣. 芝麻种质对不同茎点枯病致病菌株的抗性鉴定. 华北农学报, 2015, 30: 251-256. JIANG S Y, LI D H, ZHANG Y X, WANG L H, GAO Y, ZHANG X R. Resistance identification for sesame germplasm to different pathogen strains of Macrophomina phaseolina. 2015, 30: 251-256. (in Chinese)
[20] JOSHI A B. Sesamum. Hyderabad: Examiner Press, 1961.
[21] KULKARNI V, SRIDEVI O. In vivo studies on pollen germination, tube growth and micropylar penetration in interspecific crosses of sesame (Sesamum indicum L.). International Journal of Plant Sciences, 2009, 4(1): 250-254.
[22] 瞿桢, 吴新镛, 夏伏建. 芝麻远缘杂种胚胎的营救和植株再生. 中国油料, 1994, 16(1): 33-35. QU Z, WU X Y, XIA F J. Embryo rescue and plant regeneration of interspecific hybridization between S. indicum and a wild species S. schinzianum. Chinese Oil Crops, 1994, 16(1): 33-35. (in Chinese)
[23] DASHARATH K, SRIDEVI O, SALIMATH P M, RAMESH T. Production of interspecific hybrids in sesame through embryo rescue. Indian Journal of Crop Science, 2007, 2: 193-196.
[24] Rajeswari S, Ramaswamy N M. Pollen tube growth and embryology of ovule abortion in Sesamum alatum and S. indicum crosses. Journal of Genetics and Breeding, 2004, 58: 113-118.
[25] 方嘉禾, 常汝镇. 中国作物及其野生近缘植物(经济作物卷). 北京:中国农业出版社, 2010: 186-187. FANG J H, CHANG R Z. Crops and Genetic Resources of Wild Relatives in China(Economic Crop Roll). Beijing: China Agriculture Press, 2010: 186-187. (in Chinese)
[26] LIU B, WENDEL J F. Epigenetic phenomena and the evolution of plant allopolyploids. Molecular Phylogenetics and Evolution, 2003, 29(3): 365-379.
(责任编辑 李莉)
Production and Identification of F1Interspecific Hybrid Between Sesamum indicum and Wild Relative S. Indicatum
YANG MinMin, LIU HongYan, ZHOU Ting, QU HongHao, YANG YuanXiao, WEI Xin, ZUO Yang, ZHAO YingZhong
(Oil Crops Research Institute of Chinese Academy of Agricultural Sciences/Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture, Wuhan 430062)
【Objective】 The progenies of Sesamum indicum and wild species were obtained by interspecific hybridization in order to improve charcoal rot disease (Macrophomina phaseolina) resistance of sesame cultivars. 【Method】 No.3 wild sesame (S. indicatum) (P3), Zhongzhi 14 (P1) and autotetraploid of Zhongzhi 14 (P2) were used as reciprocal cross parents, the F1plants of interspecific hybrids were obtained using the immature embryo culture technique. First, the authenticity of F1progenies were confirmed by using phenotypic, cytological and SSR marker methods in order to screen out the true hybrids . Then the three parents of the interspecific hybrids (No.3 wild sesame, Zhongzhi 14 and autotetraploid of Zhongzhi 14 )and hybrids of F1lines resistance toMacrophomina phaseolina was identified by artificial inoculations. 【Result】The seedling ratios of immature embryos between reciprocal combinations existed significant difference. The 773 immature embryos were inoculated of which 155 embryos developed into seedlings and the average seedling rate was 20.05%. The seedling ratios of combinations (P3×P132.75%, P3×P221.11%) were higher than those of reciprocal combinations (P1×P38.84%, P2×P313.41%). This indicates that the genotype of the parent affects the seedling rate of distant hybridization to a large extent. The number of chromosomes in the F1plants of (P3× P1, P1× P3) was 42 and in the F1plants of (P3× P2, P2× P3) was 55. The majority of the pollen grains of the F1hybrids were regular but no inclusions, all of which were highly sterile. HS142 primer with a better polymorphism could be clearly amplified two specific types in Zhongzhi14 (about 460 bp and 500 bp) and the one in No.3 wild sesame(about 380 bp) .Then, it could be used to identify twelve hybrid progenies and their parents. There are ten of F1progenies with three male and female-specific markers of the parents, the other two plants only appeared in the female parent or male parent type which was the fake hybrids. The infected lesion length of progenies from interspecific hybridization P3×P1, P3×P2, using No.3 wild sesame with high charcoal rot resistance as female parent, was 9.35 cm and 6.65 cm, respectively, while 9.90 cm and 8.90 cm from reciprocal combinations. The resistance to Macrophomina phaseolina of progenies from all combinations was higher than their cultivated parents (P114.30 cm and P211.46 cm), but weaker than wild relative (P34.80 cm). 【Conclusion】 New germplasms with high charcoal rot resistance can be created through interspecific hybridization combined with immature embryo culture, which provides important materials for genetic improvement of sesame with charcoal rot resistance.
sesame; wild species; interspecific hybridization; molecular marker; charcoal rot resistance
2016-12-16;接受日期:2017-02-17
国家现代农业产业技术体系建设专项(CARS-15)、中国农业科学院科技创新工程(CAAS-ASTIP-2013-OCRI)
联系方式:杨敏敏,E-mail:hbyangmm@163.com。通信作者赵应忠,E-mail:zhaoyz63@163.com
