拓扑替康联合化疗治疗宫颈癌的疗效与安全性的系统评价
2017-06-15黄世明罗燕薇李彦峰林志春
黄世明,罗燕薇,李彦峰,林志春
(1.武警后勤学院附属医院 核医学科,天津 300162;2.天津市心血管重塑与靶器官损伤重点实验室,天津 300162;3.锦州医科大学武警后勤学院附属医院研究生培养基地,辽宁 锦州 121000)
临床经验交流
拓扑替康联合化疗治疗宫颈癌的疗效与安全性的系统评价
黄世明1,2,罗燕薇2,3,李彦峰1,林志春1
(1.武警后勤学院附属医院 核医学科,天津 300162;2.天津市心血管重塑与靶器官损伤重点实验室,天津 300162;3.锦州医科大学武警后勤学院附属医院研究生培养基地,辽宁 锦州 121000)
目的 系统评价拓扑替康联合化疗辅助治疗晚期宫颈癌的疗效性与安全性,为临床治疗提供参考和依据。方法 网络检索CNKI中国期刊全文数据库、万方全文数据库、中文科技期刊数据库、Embase、 PubMed、Cochrane图书馆,检索时间至2016年11月,对相关文献进行筛选,纳入符合标准的文献并提取资料进行质量评估,使用RevMan 5.3进行Meta分析和描述统计分析。结果 共纳入4项随机对照研究,共766名患者。Meta分析显示,拓扑替康联合化疗治疗组与以顺铂为基础的标准化疗对照组相比,在总生存时间(Overall Survival,OS)(HR=0.96,95%CI=0.70~1.33,P=0.83)、疾病无进展时间(Progress Free Survival,PFS)(HR=0.88,95%CI=0.55~1.40,P=0.58)、总缓解率(OR=0.92,95%CI=0.36~2.34)、完全缓解率(OR=1.75,95%CI=0.92~3.31)、部分缓解率(OR=0.76,95%CI=0.32~1.79)方面两组差异无统计学意义,而不良反应在贫血(OR=3.51,95%CI=1.31~9.40)和血小板减少(OR=8.42,95%CI=4.54~15.61)方面其发生率高于对照组,其他不良反应两组差异无统计学意义。结论 拓扑替康联合化疗的治疗疗效与标准化疗法相当,可用于晚期宫颈癌的化疗。
宫颈癌;拓扑替康;顺铂;Meta分析
宫颈癌是仅次于乳腺癌的女性第二大恶性肿瘤,I-II期宫颈癌的治疗失败率为15%~30%,而III期宫颈癌治疗失败率增加到40%~60%,复发宫颈癌患者的5年生存率只有10%[1]。因此,每年仍有超过2.6万的女性死于宫颈癌,预计未来40年将大约有1 900万女性死于宫颈癌[2]。其中,有85%的宫颈癌是发生在发展中国家,因此宫颈癌也成为这些国家癌症死因的首位[3]。
对于宫颈癌早期患者手术治疗效果较好,但晚期宫颈癌一般不适合手术切除或进行放射治疗,而系统的化疗能有效降低肿瘤复发率和转移率并提高患者的生存率[4]。15%~61%的患者在初期治疗后的2年内发展为晚期宫颈癌[5]。目前,以铂类为基础的化疗是晚期宫颈癌患者的标准治疗方案[6],由于顺铂是铂类抗肿瘤药物最有效的,因此常规作为联合化疗的主要药物之一[7]。但这种治疗的预后仍较差,同时二线治疗的选择也非常有限,因此迫使寻找新的化疗药物。拓扑替康属于第三代喜树碱衍生物的半合成药物,具有强抗癌性,已经广泛用于妇科肿瘤的化学治疗[8]。美国食品和药物管理局(Food and Drug Administration,FDA)已批准顺铂、拓扑替康用于晚期宫颈癌。但与顺铂为基础的标准治疗方案相比,拓扑替康联合化疗治疗宫颈癌的疗效不一致[9],因此本研究将对拓扑替康联合化疗辅助治疗晚期宫颈癌的疗效与安全性进行系统评价,为临床宫颈癌化疗用药及研究提供依据。
1 资料与方法
1.1 检索策略 网络全面检索CNKI中国期刊全文数据库、万方全文数据库、中文科技期刊数据库,以及Embase、 PubMed、Cochrane图书馆,检索时间均为建库起至2016年11月,采用Endnote X 7纳入国内外参考文献。中文检索词为:拓扑替康,和美新,喜典,金喜素,化疗,药物治疗,宫颈癌,宫颈肿瘤;英文检索词为:topotecan, 9-Dimethylaminomethyl-10-hydroxycamptothecin,chemotherapy,drug therapy,pharmacotherapy,cervical cancer,cervical neoplasm, cervix cancer,cervix neoplasm。
1.2 纳入和排除标准
1.2.1 研究类型 纳入国内外发表的所有拓扑替康联合化疗治疗宫颈癌的临床随机对照研究,无论是否采用分配隐藏和盲法,语种限于中文和英文。
1.2.2 研究对象 经病理组织学检查确诊为宫颈癌的患者,其年龄、种族和国籍不限。排除肝肾功能衰竭、严重的心血管疾病以及良性肿瘤的患者。排除非宫颈癌方面的研究和非临床随机对照试验研究。
1.2.3 干预措施和分组 试验组患者采用拓扑替康联合化疗,对照组患者采用顺铂为基础的标准化疗(顺铂或顺铂联合化疗)方案。
1.2.4 结局指标 主要结局指标包括:3年疾病无进展时间(Progress Free Survival,PFS),总生存时间(Overall Survival,OS),治疗有效率以及不良反应率。按照世界卫生组织抗肿瘤药物疗效评价标准[10]分为完全缓解(complete remission,CR),部分缓解(partial remission,PR),稳定(stable disease,SD)和进展(progress disease,PD),总有效率(overall response rate, ORR)为CR+PR。安全性指标为不良反应率,具体包括中性粒细胞减少、贫血、血小板减少、出血、神经病变、疼痛、肺功能与肾功能损伤等不良反应发生情况。
1.3 文献筛选与方法质量学 由2名评价者分别独立的检索中英文相关文献,通过下载并阅读相关全文,依据纳入标准筛选文献并对文献的研究设计、患者纳入、治疗干预措施及其治疗结果进行评价,同时相互交叉进行核对,若存在分歧则通过请有关专家讨论解决。每项研究提取的数据主要包括:第一作者、发表时间、试验设计、患者纳入、研究时间、干预措施、结局指标、不良反应等。
1.4 文献质量评价 由2名评价者对所纳入的研究进行质量评价[11]:①随机分配方法是否正确;②是否采用盲法;③结果数据是否完整;④分配方法是否隐藏;⑤有无退出或失访,退出或失访人数,原因是否描述清楚。
1.5 统计学方法 利用RevMan 5.3软件(Cochrane 协作网提供)对纳入的研究进行Meta分析,对于二分类变量使用比值比(odds ratio,OR)或相对危险度(relative risk,RR);对于数值变量使用加权均数差(weighted mean difference,WMD)或标准均数差(standardised mean difference,SMD),所有合并统计量均计算其95%可信区间(95%CI),P<0.05表示具有统计学意义。通过I2检验进行异质性检验,若P>0.10,I2≤50%,则认为多个同类研究具有同质性,使用固定效应模型(fixed effect model)计算合并统计量;若P≤0.10,I2>50%,认为多个同类研究间具有异质性,使用随机效应模型(random effect model)计算合并统计量。
2 结果
2.1 文献检索结果 按照上述文献检索策略初步检索到中英文文献496篇,其中CNKI数据库49篇,万方数据库8篇,中文科技期刊数据库5篇,PubMed 85篇,Embase 327篇,Cochrane图书馆22篇。利用Endnote软件与人工查重,剔除重复文献91篇;通过阅读标题与摘要剔除综述142篇,会议摘要48篇,动物实验6篇,病例报道26篇及其他
非相关文献127篇;通过下载全文并阅读,剔除拓扑替康联合化疗非随机对照研究10篇,非拓普替康联合化疗研究42篇,最终共纳入4篇文献,均为英文文献。系统评价文献的筛选与纳入流程见图1,纳入文献的一般情况见表1。

图1 评价文献的筛选与纳入流程
表1 纳入文献的一般情况

纳入研究发表时间例数(n)试验组对照组研究设计例数(n)试验组对照组Frumovitz等[12]20161321RCT拓扑替康、紫杉醇、贝伐单抗顺铂、紫杉醇Long等[13]2005147146RCT拓扑替康、顺铂顺铂Monk等[14]2009111103RCT拓扑替康、顺铂顺铂、紫杉醇Tewari等[15]2014111114RCT拓扑替康、紫杉醇顺铂、紫杉醇
RCT—随机对照研究(Randomized Controlled Trial)。
2.2 纳入研究的偏移风险评估 根据Cochrane协作网偏倚风险评价标准,纳入的研究存在不同水平的偏倚。其中4个研究[12-15]均进行了随机分组但未描述方法;随机化隐藏1个研究[15]描述采用,3个未具体描述;4个研究均未描述盲法。所有研究无选择性报告偏倚,其他偏倚来源不清楚。
2.3 Meta分析结果
2.3.1 OS与PFS 4项[12-15]随机对照临床研究比较了试验组(拓扑替康联合化疗)和对照组(以顺铂为基础的标准化疗)的3年总生存时间(Overall Survival,OS)与疾病无进展时间(Progress Free Survival,PFS),并都报道了相应的HR结果。Meta分析结果显示,OS与PFS的异质性检验结果分别为:χ2=10.25,P=0.02,I2=71%和χ2=24.76,P<0.10,I2=88%。表明4项研究结果之间具有异质性,因此,合并效应量HR采用随机效应模型,合并效应值分别为HR=0.96,95%CI=0.70~1.33,P=0.83和HR=0.88,95%CI=0.55~1.40,P=0.58。结果表明两组的OS与PFS的差异均无统计学意义,结果见图2~3。

图3 疾病无进展时间(Progress Free Survival,PFS)的Meta分析森林图
2.3.2 疗效评价
2.3.2.1 总缓解率 3项研究[13-15]都报道了总缓解率,合计样本量为732例宫颈癌患者。异质性检验结果:χ2=14.84,P=0.000 6,I2=87%,表明3项研究结果之间具有异质性,因此,合并效应量OR采用随机效应模型。合并统计量的结果为:OR=0.92,其95%CI=0.36~2.34,结果表明两组差异没有有统计学意义,具体结果见图4。
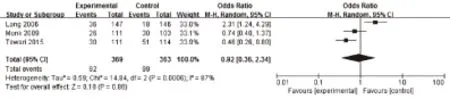
图4 两组患者总缓解率的Meta分析森林图
2.3.2.2 完全缓解率 3项研究[13-15]报道了完全缓解率,异质性检验结果:χ2=3.44,P=0.18,I2=42%,表明3项研究结果之间具有同质性,因此,合并效应量OR采用固定效应模型。合并统计量的结果为:OR=1.75,其95%CI=0.92~3.31,结果表明两组差异没有统计学意义,具体结果见图5。

图5 两组患者完全缓解率的Meta分析森林图
2.3.2.3 部分缓解率 3项研究[13-15]报道部分缓解率,异质性检验结果:χ2=10.30,P=0.006,I2=81%,表明3项研究结果之间具有异质性,因此,合并效应量OR采用随机效应模型。合并统计量的结果为:OR=0.76,其95%CI=0.32~1.79,结果表明两组差异没有统计学意义,具体结果见图6。

图6 两组患者部分缓解率的Meta分析森林图
2.3.3 药物不良反应评价 共有2项[13-14]研究报道了化疗的不良反应,纳入研究报道的药物不良反应主要包括中性粒细胞减少、贫血、血小板减少、出血、神经病变、疼痛、肺功能与肾功能损伤等,分别进行Meta分析后其结果如表2。结果表明,中性粒细胞减少因异质性太大且难以降低故只做描述性统计分析,拓扑替康联合化疗组与对照组的发生率之比为1.09;两组在贫血(OR=3.51,其95%CI=1.31~9.40)、血小板减少(OR=8.42,其95%CI=4.54~15.61)方面有统计学差异,实验组高于对照组,而出血(OR=2.22,其95%CI=0.76~6.51)、神经病变(OR=0.67,其95%CI=0.35~1.66)、疼痛(OR=1.27,其95%CI=0.72~2.26)、肺功能损伤(OR=0.79,其95%CI=0.34~1.87)与肾功能损伤(OR=1.43,其95%CI=0.74~2.75)等方面差异无统计学意义。
表2 两组患者不良反应发生率的Meta分析森林图

不良反应纳入研究实验组效应数总人数对照组效应数总人数异质性检验(I2)Meta分析模型选择OR(95%CI)P贫血2922583324979%随机3.51(1.31~9.40)0.01血小板减少2822581324938%固定8.42(4.54~15.61)<0.01出血21125852490%固定2.22(0.76~6.51)0.15神经病变2122581524934%固定0.67(0.35~1.66)0.49疼痛2312582524941%固定1.27(0.72~2.26)0.41肺功能2102581224929%固定0.79(0.34~1.87)0.60肾功能224258172490%固定1.43(0.74~2.75)0.28
3 讨论
近30年来,越来越多的研究集中于晚期宫颈癌化疗药物的研究,尽管宫颈癌化疗药物的研究取得了较大进展,但晚期宫颈癌患者治疗失败率仍较高,严重影响患者生存质量,其平均生存期也只有7~12个月[16]。
拓扑替康属于广谱抗肿瘤药物,可用于多种肿瘤的治疗,包括卵巢癌、子宫内膜癌、非小细胞肺癌以及脑转移瘤等[17],其抗肿瘤主要机制是在DNA复制过程中结合到拓扑异构酶I,从而抑制DNA的复制引起不可逆的损伤作用[8],同时可以通过抑制缺氧诱导因子(hypoxia-inducible factor-1,HIF-1)的翻译,HIF-1主要调节缺氧条件下基因的转录,从而影响血管生存、肿瘤代谢、肿瘤转移等[18]。顺铂是一种铂的金属络合物,属于细胞周期非特异性的毒性药物,可抑制肿瘤细胞的DNA复制与损伤的修复,从而导致肿瘤细胞的致死性损伤,其对晚期宫颈癌的化疗效果已得到公认。
本研究对纳入的文献进行分析,系统评价拓扑替康联合化疗治疗晚期宫颈癌的治疗疗效与安全性,对于指导临床用药具有一定的指导意义。系统评价结果显示,拓扑替康联合化疗治疗晚期宫颈癌在OS、、PFS、总缓解率、完全缓解率、部分缓解率方面,与以顺铂为基础的标准化疗方案相比,两组差异无统计学意义,表明拓扑替康联合化疗与标准化疗方案在提高患者生存期与治疗疗效方面效果相当。而在不良反应方面,拓扑替康在临床上最常见的不良反应是血液毒性,包括中性粒细胞减少、贫血和血小板减少,但骨髓抑制效应不会产生蓄积性,同时具有可预见性,必要时通过延迟治疗时间或降低药物剂量可降低不良反应发生率[19]。而在利用拓扑替康进行晚期宫颈癌化疗的同时可使用粒细胞集落支持因子,能有效降低中性粒细胞减少的发生率,同时有利于增加化疗药物的剂量从而最大发挥拓扑替康的治疗效果[20]。因此,拓扑替康联合化疗的化疗方案对晚期宫颈癌患者是有效的,其安全性是可被接受和预防的,故拓扑替康联合化疗可作为晚期宫颈癌的标准化疗方案之一。因目前的研究数量有限,因此未进行相应的漏斗图分析。
综上所述,拓扑替康联合化疗有望作为治疗宫颈癌的一种有效、安全的化疗方案。但本研究在纳入文献的数量和质量方面仍存在一定的局限性,纳入的文献没有研究单独使用拓扑替康的治疗有效性,也未进行发表偏倚评价,因此不能从联合化疗中判断拓扑替康单独的治疗疗效,而拓扑替康联合化疗治疗宫颈癌的临床应用尚需要高质量的临床研究对本系统评价的结果进行验证。
[1] Hong J H,Tsai C S,Lai C H,et al.Recurrent squamous cell carcinoma of cervix after definitive radiotherapy[J].Int J Radiat Oncol Biol Phys,2004,60(1):249-257.
[2] Tsu V,Jeronimo J.Saving the World's Women from Cervical Cancer[J].N Engl J Med,2016,374(26):2509-2511.
[3] 周晖,卢淮武,彭永排,等.《2015年NCCN宫颈癌临床实践指南》解读[J].中国实用妇科与产科杂志,2015,30(3):185-191.
[4] 刘霄,周航,陈敏,等.单纯放疗与放疗联合化疗治疗中晚期宫颈癌疗效观察[J].遵义医学院学报,2012,35(5):420-422.
[5] Wright J D,Viviano D,Powell M A,et al.Bevacizumab combination therapy in heavily pretreated,recurrent cervical cancer[J].Gynecol Oncol,2006,103(2):489-493.
[6] Schefter T E,Winter K,Kwon J S,et al.A phase II study of bevacizumab in combination with definitive radiotherapy and cisplatin chemotherapy in untreated patients with locally advanced cervical carcinoma:preliminary results of RTOG 0417[J].Int J Radiat Oncol Biol Phys,2012,83(4):1179-1184.
[7] Takano M,Kikuchi Y,Kita T,et al.Complete remission of metastatic and relapsed uterine cervical cancers using weekly administration of bevacizumab and paclitaxel/carboplatin[J].Onkologie,2009,32(10):595-597.
[8] Musa F,Blank S,Muggia F.A pharmacokinetic evaluation of topotecan as a cervical cancer therapy[J].Expert Opin Drug Metab Toxicol,2013,9(2):215-224.
[9] 李伟枫,王刚.拓扑替康在宫颈癌治疗中的应用[J].实用妇产科杂志,2015,31(7):505-507.
[10] Therasse P,Arbuck S G,Eisenhauer E A,et al.New guidelines to evaluate the response to treatment in solid tumors.European organization for research and treatment of cancer,national cancer institute of the united states,national cancer institute of canada[J].J Natl Cancer Inst,2000,92(3):205-216.
[11] 刘建平.非随机研究的系统评价方法(一)[J].中国循证医学,2001,1(4):239-243.
[12] Frumovitz M,Munsell M F,Burzawa J K,et al.Combination therapy with topotecan,paclitaxel,and bevacizumab improves progression-free survival in recurrent small cell neuroendocrine carcinoma of the cervix[J].Gynecol Oncol,2017,144(1):46-50.
[13] Long H J,Bundy B N,Grendys E C,et al.Randomized phase III trial of cisplatin with or without topotecan in carcinoma of the uterine cervix:a gynecologic oncology group study[J].J Clin Oncol,2005,23(21):4626-4633.
[14] Monk B J,Sill M W,McMeekin D S,et al.Phase III trial of four cisplatin-containing doublet combinations in stage IVB,recurrent,or persistent cervical carcinoma:a Gynecologic Oncology GrouPstudy[J].J Clin Oncol,2009,27(28):4649-4655.
[15] Tewari K S,Sill M W,Long H J,et al.Improved survival with bevacizumab in advanced cervical cancer[J].N Engl J Med,2014,370(8):734-743.
[16] Minion L E, Tewari K S.The safety and efficacy of bevacizumab in the treatment of patients with recurrent or metastatic cervical cancer[J].Expert Rev Anticancer Ther,2017,17(3):191-198.
[17] Burris H A,Infante J R,Jewell R C,et al.A phase I study of weekly topotecan in combination with pemetrexed in patients with advanced malignancies[J].Oncologist,2010,15(9):954-960.
[18] Melillo G.Targeting hypoxia cell signaling for cancer therapy[J].Cancer Metastasis Rev,2007,26(2):341-352.
[19] Mould D R,Holford N H,Schellens J H,et al.Population pharmacokinetic and adverse event analysis of topotecan in patients with solid tumors[J].Clin Pharmacol Ther,2002,71(5):334-348.
[20] Shimada M,Sato S,Oishi T,et al.Feasibility study on combination chemotherapy using nogitecan hydrochloride (topotecan) and cisplatin for patients with metastatic,persistent,or recurrent uterine cervical cancer[J].Int J Clin Oncol,2016,21(5):969-974.
[收稿2017-01-03;修回2017-03-10]
(编辑:王福军)
The efficacy and safety of topotecan combined with chemotherapy in the treatment of cervix cancer:a Meta-analysis
HuangShiming1,2,LuoYanwei2,3,LiYanfeng1,2,LinZhichun1
(1.Department of Nuclear Medicine,Affiliated Hospital of Logistics University of Chinese People's Armed Police Forces,Tianjin 300162,China; 2.Tianjin Key Laboratory of Cardiovascular Remodeling and Target Organ Injury Institute of Cardiovascular Disease and Heart Center,Tianjin 300162,China;3.Postgraduate Training Basement in the Affiliated Hospital of Logistics University of Chinese People's Armed Police Forces,Jinzhou Medical University,Jinzhou Liaoning 121000,China)
Objective To systematically evaluate the efficacy and safety of topotecan combined with chemotherapy as adjunctive therapy for cervical cancer,and further provide reference and basis for clinical treatment.Methods Computer retrieval of CNKI,WanFang Database,CSJD,PubMed,Embase and Cochrane Library from inception to November,2016.The eligible articles were included and the data were extracted for quality assessment.Meta-analysis and statistical analysis were performed by Rev Man 5.3 statistics software after extracting data and evaluating quality.Results A total of 766 patients from four RCTs were included for final analysis.Meta-analysis showed that there were no significant difference in overall survival time (HR=0.96,95%CI=0.70~1.33,P=0.83),progression-free time (HR=0.88,95%CI=0.55~1.40,P=0.58),overall response rate (OR=0.92,95%CI=0.36~2.34),complete remission rate (OR=1.75,95%CI=0.92~3.31),and partial remission rate (OR=0.76,95%CI=0.32~1.79) between topotecan combined chemotherapy for the treatment group and cisplatin-based standard chemotherapy for the control group.But the incidences of adverse reactions in anemia (OR=3.51, 95%CI=1.31~9.40) and thrombocytopenia (OR=8.42,95%CI=4.54~15.61) were higher than those in the control group.There were no significant differences in other adverse reactions between the two groups.Conclusion The efficacy of topotecan combined with cisplatin was equal with that of standard therapy.Topotecan combined with chemotherapy could be used in the chemotherapy of advanced cervical cancer.
cervical cancer; topotecan; cisplatin; Meta-analysis
天津市自然科学基金资助项目(NO:13JCYBJC22000)。
林志春,男,博士,副主任医师,研究方向:肿瘤的化疗与影像学的早期诊断, E-mail:zhichunlin@163.com。
R737.33
B
1000-2715(2017)02-0190-06
