杠板归化学成分的研究
2017-06-15潘胤池徐德林张茂生徐应淑付少彬肖世基
潘胤池,胡 秀,徐德林,李 林,张茂生,徐应淑,付少彬,肖世基
(1.遵义医学院 细胞生物学教研室,贵州 遵义 563099;2.遵义医学院 药物化学教研室,贵州 遵义 563099)
基础医学研究
杠板归化学成分的研究
潘胤池1,胡 秀2,徐德林1,李 林1,张茂生2,徐应淑2,付少彬2,肖世基2
(1.遵义医学院 细胞生物学教研室,贵州 遵义 563099;2.遵义医学院 药物化学教研室,贵州 遵义 563099)
目的 研究杠板归PolygonumperfoliatumL.的化学成分。方法 采用各种柱色谱包括硅胶、凝胶及制备液相等色谱分离方法进行分离纯化,经核磁共振技术进行化合物结构鉴定。结果 从杠板归甲醇提取物中分离得到11个化合物,分别鉴定为长寿花糖苷(1)、4,5-二氢布卢门醇A(2)、槲皮素-3-O-β-D-吡喃葡萄糖苷(3)、槲皮素-3-O-β-D-葡萄糖醛酸-6″-甲酯(4)、槲皮素-3-O-β-D-葡萄糖醛酸苷(5)、槲皮素(6)、3,4-dihydro-5-hydroxy-7-methoxy-4-(4′-methoxyphenyl)coumarin(7)、地芰普内酯(8)、vanicoside B(9)、vanicoside A(10)、氢化胡椒苷(11)。结论 化合物1、2和8为首次从该属植物中分离得到。
杠板归;蓼属;槲皮素糖苷;化学成分
杠板归为蓼科(Polygonaceae)蓼属植物杠板归(PolygonumperfoliatumL.)的干燥全草,又名河白草、龙先草、贯叶蓼等,系多年生蔓性草本,生于沟边、路旁、山谷湿地,全国各地均有分布,资源相当丰富[1]。《中药大词典》记载杠板归具有利水消肿、清热、活血、解毒等功效,用于治疗水肿、疟疾、痢疾、湿疹、疱疹、疥癣及毒蛇咬伤等症[2]。已有杠板归化学成分的相关研究表明,其主要含黄酮苷、蒽苷、强心苷、酚类、氨基酸、有机酸、鞣质和糖类[3-5]。为了进一步研究其活性部位,阐明黔产杠板归的化学成分,为贵州道地药材的利用奠定物质基础,为杠板归合理用药提供科学依据,本文拟对采自贵州省遵义市的杠板归进行化学成分研究。
1 材料与方法
1.1 仪器与材料 Agilent DD2 400-MR NMR 型核磁共振仪,TMS为内标(美国Agilent公司);Sepacore中压制备系统(瑞士BÜCHI公司);LC3000型高效液相色谱仪(中国北京创新通恒公司);C18,5 μm,10 mm × 250 mm半制备HPLC柱(日本YMC公司);反相C18填料(ODS,日本富士硅化学株式会社);薄层色谱硅胶GF 254和柱色谱硅胶(300~400目,中国青岛海洋化工公司);Sephadex LH-20凝胶(德国Merck公司)。
杠板归于2016年5月采自遵义市新蒲镇,由遵义医学院生药学教研室杨建文教授鉴定为杠板归(PolygonumperfoliatumL.),样品标本(No.20160510)保存在遵义医学院药学院。
1.2 提取分离 杠板归全草干重2.35 kg粉碎后用甲醇室温浸泡提取3次,每次7 d,减压浓缩提取液得甲醇提物约210 g,将其分散于水中,依次用乙酸乙酯、正丁醇萃取。减压浓缩萃取物得乙酸乙酯部位浸膏约121 g,正丁醇部位浸膏约76 g。取正丁醇部位浸膏76 g,经中压硅胶柱色谱(90 mm×460 mm)乙酸乙酯-甲醇梯度洗脱(5∶1、3∶1、2∶1、1∶1)分离为4个部分(Fr.1~4),Fr.1经ODS柱色谱(36 mm×460 mm,甲醇∶水,75∶25→100∶0,V/V),粗分得3个部位 (Fr.1.1~3)。Fr.1.1用Sephadex LH-20柱层析纯化,甲醇洗脱,再经半制备HPLC纯化(C18,甲醇∶水,35∶65,V/V,3 mL/min)得化合物1(11 mg,tR=15.4 min);Fr.1.2经半制备HPLC纯化(C18,甲醇∶水,75∶25,V/V,2.8 mL/min)得化合物8(10 mg,tR=15.0 min);Fr.1.3经ODS柱色谱(36 mm×460 mm,甲醇∶水,30∶70→80∶20,V/V)分离为5个部分(Fr.1.3.1~5),Fr.1.3.2经半制备HPLC分离(C18,甲醇∶水,55∶45,V/V,2.8 mL/min)得到化合物7(16 mg,tR=8.1 min),Fr.1.3.3经半制备HPLC分离(C18,甲醇∶水,58∶42,V/V,2.5 mL/min)得到化合物3(10 mg,tR=15.1 min),Fr.1.3.4经半制备HPLC分离(C18,甲醇∶水,55∶45,V/V,2.5 mL/min)得到化合物4(10 mg,tR=15.8 min)。乙酸乙酯部位浸膏121 g,过MIC凝胶柱(甲醇∶水,90∶10,V/V)除去叶绿素,得样品35 g。该样品经中压硅胶柱色谱(90 mm×460 mm)石油醚-乙酸乙酯梯度洗脱(12∶1、6∶1、3∶1、1∶1、1∶2),粗分得5个部位(Fr.5~9)。Fr.6经ODS柱色谱(36 mm×460 mm,甲醇∶水,30∶70→80∶20,V/V)分离为3个部分(Fr.6.1~3),Fr.6.2经半制备HPLC分离(C18,甲醇∶水,76∶24,V/V,3 mL/min) 得到化合物11(10 mg,tR=9.5 min);Fr.8用Sephadex LH-20柱层析纯化,甲醇洗脱为6个部位(Fr.8.1~6),Fr.8.3经半制备HPLC纯化(C18,乙腈∶水,60∶40,V/V,3 mL/min)得到化合物5(6 mg,tR=10.7 min),Fr.8.5经半制备HPLC纯化(C18,甲醇∶水,65∶35,V/V,5 mL/min)得到化合物6(11 mg,tR=11.7 min);Fr.9用ODS柱色谱(36 mm×460 mm,甲醇∶水,30∶70→80∶20,V/V)分离为3个部分(Fr.8.1~3),Fr.9.1经半制备HPLC分离(C18,甲醇∶水,65∶35,V/V,5 mL/min)得到化合物2(9 mg,tR=10.0 min),Fr.9.2经半制备HPLC分离(C18,甲醇∶水,73∶27,V/V,3 mL/min)得到化合物9(10 mg,tR=15.9 min),Fr.9.3经半制备HPLC分离(C18,甲醇∶水,77∶23,V/V,3 mL/min)得到化合物10(10 mg,tR=14.7 min)。
1.3 结构鉴定 分离得到化合物的结构通过1H NMR和13C NMR数据分析及和文献数据对比得到鉴定。
2 结果
我们对采自贵州省遵义市的杠板归进行了研究,从其甲醇提取物中分离得到11个化合物(见图1),分别鉴定为:长寿花糖苷(1)、4,5-二氢布卢门醇A(2)、槲皮素-3-O-β-D-吡喃葡萄糖苷(3)、槲皮素-3-O-β-D-葡萄糖醛酸-6″-甲酯(4)、槲皮素-3-O-β-D-葡萄糖醛酸苷(5)、槲皮素(6)、3,4-dihydro-5-hydroxy-7-methoxy-4-(4′-methoxyphenyl)coumarin(7)、地芰普内酯(8)、vanicoside B(9)、vanicoside A(10)、氢化胡椒苷(11)。
2.1 化合物1 黄色油状物,1H-NMR(400 MHz,CD3OD)δ:5.98(1H,d,J= 15.5 Hz,H-7),5.87(1H,s,H-4),5.73(1H,dd,J= 15.5,6.6 Hz,H-8),4.54(1H,m,H-9),4.27(1H,d,J= 7.5 Hz,H-1′),3.85,3.63(各1H,br.d,J= 11.5 Hz,H-6′),3.12~3.32(4H,m,H- 2′,3′,4′,5′),2.61,2.17(各1H,d,J= 16.9 Hz,H-2),1.94(3H,s,H-11),1.29(3H,d,J= 4.4 Hz,H-10),1.04(3H,s,H-12),1.02(3H,s,H-13);13C-NMR(100 MHz,CD3OD)δ:201.4(C-30),167.2(C-5),133.9(C-7),133.8(C-8),127.2(C-4),80.1(C-6),74.7(C-9),50.9(C-2),42.6(C-1),24.9(C-13),23.6(C-12),22.4(C-10),19.7(C-11),101.4(C-1′),78.5(C-5′),78.3(C-3′),75.1(C-2′),71.8(C-4′),62.9(C-6′)。以上数据与文献[6-7]报道一致,确定化合物1为长寿花糖甙。
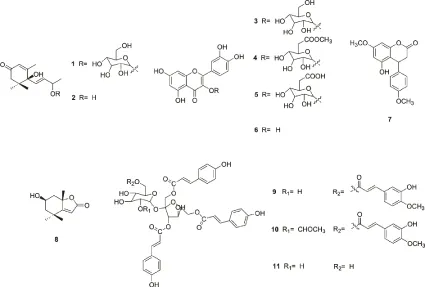
图1 从杠板归中分离得到的化合物结构图
2.2 化合物2 无色油状物,1H-NMR(400 MHz,CDCl3)δ:5.89(1H,s,H-4),5.84(1H,s,H-8),5.77(1H,d,J= 15.7 Hz,H-7),4.40(1H,m,H-9),2.44(1H,d,J= 17.1 Hz,H-2b),2.19(1H,d,J= 13.7 Hz,H-2a),1.89(3H,s,H-11),1.29(3H,d,J= 6.1 Hz,H-10),1.06(3H,s,H-11),0.99(3H,s,H-12);13C-NMR(100 MHz,CDCl3)δ:198.3(C-3),163.2(C-5),135.7(C-7),129.0(C-8),126.8(C-4),79.0(C-6),68.0(C-9),49.7(C-2),41.2(C-1),24.0(C-12),23.7(C-10),22.9(C-11),19.0(C-13)。以上数据与文献[8]基本一致,确定化合物2为4,5-二氢布卢门醇A。
2.3 化合物3 棕黄色粉末,1H-NMR(400 MHz,CD3OD)δ:7.67(1H,br.s,H-2′),7.54(1H,d,J=7.6,2.3 Hz,H-6′),6.82(1H,d,J= 7.6 Hz,H-5′),6.33(1H,br.s,H-8),6.14(1H,br.s,H-6),5.21(1H,d,J= 6.3 Hz,H-1″);13C-NMR(100 MHz,CD3OD)δ:179.6(C-4),166.2(C-7),163.1(C-5),159.1(C-9),158.5(C-2),150.0(C-4′),146.0(C-3′),135.7(C-3),123.3(C-6′),123.2(C-1′),117.7(C-5′),116.1(C-2′),105.8(C-10),104.5(C-1″),100.0(C-6),94.9(C-8),78.5(C-3″),78.2(C-4″),75.9(C-5″),71.3(C-4″),62.7(C-6″)。以上数据与文献[9]报道一致,确定化合物3为槲皮素-3-O-β-D-葡萄糖苷。
2.4 化合物4 棕色粉末,1H-NM R(400 MHz,CD3OD)δ:7.58(2H,m,H-2′,6′),6.83(1H,d,J= 8.1 Hz,H-5′),6.35(1H,br.s,H-8),6.17(1H,br.s,H-6),5.22(1H,d,J= 6.2 Hz,H-1″),3.65(3H,s,OCH3);13C-NMR(100 MHz,CD3OD)δ:179.3(C-4),170.8(C-6″),166.1(C-7),163.0(C-5),159.5(C-9),158.5(C-2),150.0(C-4′),146.0(C-3′),135.6(C-3),132.5(C-6′),123.6(C-1′),117.4(C-5′),116.0(C-2′),105.7(C-10),104.9(C-1″),100.1(C-6),94.9(C-8),77.4(C-5″),77.2(C-4″),75.4(C-3″),72.8(C-2″),53.0(OCH3)。以上数据与文献[10]报道一致,确定化合物4为槲皮素-3-O-β-D-葡萄糖醛酸-6″-甲酯。
2.5 化合物5 淡黄色粉末,1H-NMR(400 MHz,DMSO-d6)δ:12.57(1H,s,OH-5),10.91(1H,br.s,OH-7),9.79(1H,br.s,OH-3′),9.26(1H,br.s,OH-4′),7.61(1H,br.d,J= 8.1 Hz,H-6′),7.53(1H,br.s,H-2′),6.84(1H,d,J= 8.1 Hz,H-5′),6.41(1H,br.s,H-8),6.21(1H,br.s,H-6),5.51(1H,d,J= 6.4 Hz,H-1″);13C-NMR(100 MHz,DMSO-d6)δ:156.2(C-1),133.1(C-2),177.2(C-3),103.9(C-4),161.2(C-5),98.8(C-6),164.3(C-7),93.7(C-8),156.3(C-9),121.8(C-1′),116.1(C-2′),145.0(C-3′),148.7(C-4′),115.3(C-5′),120.9(C-6′),101.1(C-1″),73.8(C-2″),76.1(C-3″),71.4(C-4″),75.9(C-5″),169.8(C-6″)。以上数据与文献[11]报道一致,确定化合物5为槲皮素-3-O-β-D-吡喃葡萄糖醛酸苷。
2.6 化合物6 黄色粉末,1H-NMR(400 MHz,DMSO-d6)δ:12.47(1H,s,5-OH),7.66(1H,s,H-2′),7.52(1H,br.s,H-6′),6.87(1H,br.s,H-5′),6.39(1H,br.s,H-8),6.16(1H,br.s,H-6);13C-NMR(100 MHz,DMSO-d6)δ:148.1(C-2),136.1(C-3),176.2(C-4),161.1(C-5),98.6(C-6),164.5(C-7),93.8(C-8),156.6(C-9),103.3(C-10),120.4(C-1′),115.4(C-2′),145.5(C-3′),147.2(C-4′),116.0(C-5′),122.4(C-6′)。以上数据与文献[12]报道一致,确定化合物6为槲皮素。
2.7 化合物7 深棕色粉末,1H-NMR(400 MHz,CD3OD)δ:2.92(1H,m,H-3),3.13(1H,dd,J= 15.7,6.6 Hz,H-3),3.77,3.73(各3H,s,2×OCH3),4.57(1H,d,J= 5.0 Hz,H-4),6.24(1H,br.s,H-8),6.32(1H,br.s,H-6),6.83(2H,d,J= 8.0 Hz,H-3′,5′),7.07(2H,d,J= 8.0 Hz,H-2′,6′),8.86(1H,s,OH);13C-NMR(100 MHz,CD3OD)δ:34.6(C-4),38.1(C-3),94.5(C-8),98.7(C-6),106.4(C-4a),114.9(C-3′,5′),128.8(C-2′,6′),135.1(C-1′),154.7(C-8a),156.2(C-5),159.6(C-4′),161.4(C-7),168.1(C-2)。以上数据与文献[13]报道一致,确定化合物7为3,4-dihydro-5-hydroxy-7-methoxy-4-(4′-methoxyphenyl)coumarin。
2.8 化合物8 无色针晶(氯仿),1H-NMR(400 MHz,CDCl3)δ:5.66(1H,s,H-7),4.30(1H,s,H-3),2.44,1.73(各1H,br.d,J= 13.8 Hz,H-4),1.96,1.50(各1H,br.d,J= 14.3 Hz,H-2),1.75(3H,s,H-9),1.44(3H,s,H-11),1.24(3H,s,H-10);13C-NMR(100 MHz,CDCl3)δ:36.2(C-1),47.5(C-2),66.9(C-3),45.8(C-4),87.1(C-5),182.9(C-6),113.0(C-7),172.3(C-8),30.9(C-9),26.7(C-10),27.2(C-11)。以上数据与文献[14]报道一致,确定化合物8为地芰普内酯。
2.9 化合物9 黄色粉末,1H-NMR(400 MHz,CD3OD)δ:7.71,7.64,7.60,7.56(各1H,d,J= 16.0 Hz,H-7″,7″′,7′′′′,7′′′′′),6.47,6.43,6.33,6.24(各1H,d,J= 16.0 Hz,H-8″,8″′,8′′′′,8′′′′′),6.70-6.81(6H,m,H-3″′,3′′′′,3′′′′′和H-5″′,5′′′′,5′′′′′),7.47,7.39,7.31(各2H,d,J= 8.2 Hz,H-2″′,2′′′′,2′′′′′和H-6″′,6′′′′,6′′′′′);13C-NMR(100 MHz,CD3OD)δ:66.4(C-1),103.5(C-2),79.2(C-3),75.0(C-4),81.0(C-5),65.4(C-6),93.0(C-1′),72.3(C-2′),75.1(C-3′),72.3(C-4′),72.5(C-5′),65.9(C-6′),127.1(C-1′′),111.9(C-2′′),149.3(C-3′′),150.6(C-4′′),116.9(C-5′′),124.7(C-6′′),146.9(C-7′′),115.4(C-8′′),169.4(C-9′′),56.5(OCH3),127.1×3(C-1′′′,1′′′′,1′′′′′),131.3×2,131.4×2,131.7× 2(C-2′′′,2′′′′,2′′′′′ 和 C-6′′′,6′′′′,6′′′′′),116.9×6(C-3′′′,3′′′′,3′′′′′和C-5″′,5′′′′,5′′′′′),161.3,161.4,161.5(C-4′′′,4′′′′,4′′′′),147.3×2,148.0(C-7′′′,7′′′′,7′′′′′),114.4,114.8,114.9(C-8′′′,8′′′′,8′′′′′),168.6×3(C-9′′′,9′′′′,9′′′′′)。以上数据与文献[15]报道一致,确定化合物9为vanicoside B。
2.10 化合物10 无色粉末,1H-NMR(400 MHz,CD3OD)δ:7.72,7.63,7.61,7.58(各1H,d,J= 15.9 Hz,H-7″,7″′,7′′′′,7′′′′′),6.47,6.46,6.34,6.27(各1H,d,J= 15.9 Hz,H-8″,8″′,8′′′′,8′′′′′),6.72-6.81(7H,m,H-3′′′,3′′′′,3′′′′′,H-5″′,5′′′′,5′′′′′和H-5″),7.49,7.41,7.35(各2H,d,J= 8.5 Hz,H-2″′,2′′′′,2′′′′′和H-6″′,6′′′′,6′′′′′),7.20(1H,d,J= 1.6 Hz,H-2″),7.02(1H,dd,J= 8.2,1.6 Hz,H-6″),5.71(1H,d,J= 3.7 Hz,H-1′),5.57(1H,d,J= 8.3 Hz,H-3),3.84(3H,s,OCH3),2.09(3H,s,CH3);13C-NMR(100 MHz,CD3OD)δ:66.5(C-1),103.7(C-2),79.5(C-3),74.4(C-4),81.1(C-5),65.5(C-6),90.7(C-1′),74.4(C-2′),72.4(C-3′),72.2(C-4′),72.5(C-5′),65.5(C-6′),127.8(C-1′′),111.7(C-2′′),149.4(C-3′′),150.8(C-4′′),116.5(C-5′′),124.7(C-6′′),147.3(C-7′′),115.4(C-8′′),169.3(C-9′′),56.6(OCH3),127.1×2,127.2(C-1′′′,1′′′′,1′′′′′),131.4×2,131.5×2,131.7×2(C-2″′,2′′′′,2′′′′′和C-6″′,6′′′′,6′′′′′),117.0×6(C-3″′,3′′′′,3′′′′′和C-5″′,5′′′′,5′′′′′),161.4,161.5,161.8(C-4′′′,4′′′′,4′′′′),147.0,147.3,148.2(C-7′′′,7′′′′,7′′′′′),114.3,114.7,114.9(C-8′′′,8′′′′,8′′′′′),168.5×2,169.0(C-9′′′,9′′′′,9′′′′′),21.2(COCH3),172.6(COCH3)。以上数据与文献[15]报道一致,确定化合物10 为vanicoside A。
2.11 化合物11 无色晶体,1H-NMR(400 MHz,CD3OD)δ: 4.33(2H,s,H-1),5.60(1H,d,J= 8.5 Hz,H-3),4.50(1H,d,J= 8.5 Hz,H-4),4.20(1H,m,H-5),4.55(2H,t,J= 5.7 Hz ,H-6),5.50(1H,d,J= 3.5 Hz,H-1′),3.42(1H,dd,J= 9.3,5.7 Hz,H-2′),3.31(1H,br.s,H-3′),3.40(1H,s,H-4′),3.95(1H,dd,J= 21.7,10.2 Hz,H-5′),3.82(2H,dd,J= 12.1,4.3 Hz,H-6′),6.37(1H,d,J= 3.1 Hz,H-8),6.75(1H,d,J= 8.4 Hz,H-14),6.80(1H,d,J= 8.2 Hz,H-14),7.42(1H,d,J= 8.4 Hz,H-11),7.47(1H,d,J= 8.2 Hz,H-15),7.66(1H,d,J= 15.9 Hz,H-15);13C-NMR(100 MHz,CD3OD),δ:66.1(C-1),103.7(C-2),73.1(C-3),75.1(C-4),74.2(C-5),66.2(C-6),93.7(C-1′),74.5(C-2′),79.1(C-3′),71.6(C-4′),81.2(C-5′),62.7(C-6′),168.6,168.6,169.2(C-7,7′,7′′),114.5,114.8,114.9(C-8,8′,8′′),147.2,147.3,148.0(C-9,9′,9′′),127.2,127.2,127.2(C-10,10′,10′′),131.5,131.5,131.7(C-11,11′,11′′),117.0,117.0,117.0(C-12,12′,12′′),161.5,161.5,161.7(C-13,13′,13′′),117.0,117.0,117.0(C-14,14′,14′′),161.5,161.5,161.7(C-15,15′,15′′)。以上数据与文献[16]报道一致,确定化合物11为氢化胡椒苷。
3 讨论
杠板归作为一味传统的中草药,因其独特的性质,针对其化学成分、药理作用以及临床应用的研究越来越广泛。关于杠板归化学成分的研究已有较多报道,据报道黄酮类化合物是其中一类重要的天然有机化合物。在继续对杠板归进行化学研究的过程中,从贵州遵义产的杠板归中分离得到11个化合物,其中有5个为黄酮类衍生物,包括槲皮素-3-O-β-D-吡喃葡萄糖苷、槲皮素-3-O-β-D-葡萄糖醛酸-6″-甲酯、3,4-dihydro-5-hydroxy-7-methoxy-4-(4′-methoxyphenyl)coumarin、槲皮素-3-O-β-D-葡萄糖醛酸苷和槲皮素,进一步佐证黄酮类衍生物是杠板归的主要成分。现代药理学研究证明:槲皮素-3-O-β-D-葡萄糖醛酸苷可保护肝细胞抵抗脂肪酸氧化所引起的氧化应激损伤,降低游离脂肪酸诱导HepG2细胞脂质蓄积和甘油三酯的含量[17];槲皮素对环孢素A导致的慢性肾损害有一定的保护作用,可降低尿蛋白排泄、下调肾组织TGF-β1的表达,延缓肾小管间质纤维化进程[18]。这对杠板归药物的作用效应、作用机制及临床应用等提供了参考价值。
本研究还从贵州省遵义市产的杠板归中首次分离得到3个化合物,包括长寿花糖苷、地芰普内酯、4,5-二氢布卢门醇A,这3个化合物也是从杠板归所属的蓼属植物中首次分离得到。这对深入研究阐明杠板归的化学成分,发掘杠板归新的生物活性成分,拓展杠板归的药用价值提供了科学依据。贵州省遵义市产的杠板归富含黄酮类、萜类、倍半萜苷类、酯类、糖苷类等化合物,具有深入研究的价值空间和利用价值,本研究为杠板归药材的深度开发打下了物质基础,对于更大程度地利用该药材有着重要科学意义。
[1] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:685-688.
[2] 江苏新医学院.中药大辞典(上册)[M].上海:上海科学技术出版社,2000:869-871.
[3] 汪琼,陈立,田瑛,等.杠板归化学成分的研究[J].军事医学,2009,33(3):254-256.
[4] 成焕波,刘新桥,陈科力.杠板归乙酸乙酯部位化学成分研究[J].中药材,2012,35(7):1088-1090.
[5] Zhu G H,Wang D Y,Meng J C.New compounds fromPolygonumperfoliatumL.[J].Indian Journal of Heterocyclic Chemistry,2000,10(1):41-44.
[6] 赵青,李创军,杨敬芝,等.黄皮叶的化学成分研究[J].中国中药杂志,2010,35(8):997-1000.
[7] Mohamed K M,Mohamed M H,Ohtani K,et al.Megastigmane glycosides from seeds ofTrifoliumalexandrinum[J].Phytochemistry,1999,50(5):859-862.
[8] González A G,Guillermo J A,Ravelo A G,et al.4,5-Dihydroblumenol A,a new nor-isoprenoid fromPerrottetiamultiflora[J].Journal of Natural Products,2004,57(3):400-402.
[9] 赵超,陈华国,龚小见,等.杠板归的化学成分研究(Ⅱ)[J].中草药,2010,41(3):365-367.
[10] 李红芳,马青云,刘玉清,等.杠板归的化学成分(英文)[J].应用与环境生物学报,2009,15(5):615-620.
[11] 付辉政,罗永明,张东明.番石榴叶化学成分研究[J].中国中药杂志,2009,34(5):577-579.
[12] 徐寅鹏,石金敏,郭明明,等.黄秋葵乙酸乙酯部位化学成分的研究[J].天然产物研究与开发,2013,25(1):56-59.
[13] Sun X,Sneden A T.Neoflavonoids fromPolygonumperfoliatum[J].Planta Medica,1999,65(7):671-673.
[14] He Z,Zhang A,Ding L,et al.Chemical composition of the green algaCodiumdivaricatumHolmes[J].Fitoterapia,2010,81(8):1125-1128.
[15] Kiem P V,Nhiem N X,Cuong N X,et al.New phenylpropanoid esters of sucrose fromPolygonumhydropiperand their antioxidant activity[J].Archives of Pharmacal Research,2008,31(11):1477-1482.
[16] 王俊锋,钟惠民,程永现.矮杨梅根的化学成分研究[J].中草药,2009,40(11):1696-1700.
[17] 王路路,张志超,吴诉诉,等.槲皮素-3-O-β-D-葡萄糖醛酸苷对游离脂肪酸诱导HepG2细胞脂肪变性的作用[J].中国药科大学学报,2015,46(5):587-593.
[18] 谭州科,唐智,罗茜,等.槲皮素对大鼠慢性环孢素肾病的保护作用[J].遵义医学院学报,2012,35(5):396-399.
[收稿2017-02-16;修回2017-03-13]
(编辑:王静)
Study on chemical constituents ofPolygonumperfoliatumL.
PanYinchi1,HuXiu2,XuDelin1,LiLin1,ZhangMaosheng2,XuYingshu2,FuShaobin2,XiaoShiji2
(1.Department of Cell Biology,Zunyi Medical University,Zunyi Guizhou 563099,China;2.Department of Pharmaceutical Chemistry,Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To investigate the chemical constituents ofPolygonumperfoliatumL.Methods The constituents were isolated and purified by silica gel column chromatographic and preparative HPLC technologies.The structures of the isolated compounds were elucidated by NMR spectrum.Results Eleven compounds were isolated and identified as corchoionoside C (1),4,5-dihydroblumenol A (2),quercetin-3-O-β-D-glucoside (3),quercetin-3-O-β-D-glucuronide-6′′- methyl ester (4),quercetin-3-O-β-D-glucuronopyranoside (5),quercetin (6),3,4-dihydro-5- hydroxy-7-methoxy-4-(4′-methoxyphenyl) coumarin (7),loliolide (8),vanicoside B (9),vanicoside A (10),hydropiperoside (11).Conclusion Compound 1,2 and 8 are obtained from this genus for the first time.
PolygonumperfoliatumL.;Polygonaceae;quercetin glycoside;chemical constituent
国家自然科学基金资助项目(NO:31560102);贵州省教育厅自然科学研究资助项目(NO:黔教合KY字[2015]362);贵州省科技厅中药现代化资助项目(NO:黔科合ZY字[2012]3014);遵义医学院药物化学学科建设经费资助项目;遵义医学院博士启动基金资助项目(NO:F-698)。
肖世基, 男, 博士, 教授, 研究方向:天然药物化学,E-mail:sjxiao@zmc.edu.cn。
R284.1
A
1000-2715(2017)02-0124-05
