羊肉与鸭肉的分子生物学鉴别技术
2017-06-14孙海新孙丕春刘伟张慧
孙海新+孙丕春+刘伟+张慧


摘 要:本研究建立羊肉与鸭肉的分子生物学鉴别方法,以羊肉和鸭肉线粒体细胞色素b基因(cytb)为特征靶基因,设计1 条通用上游引物F和2 条特异性下游引物:R羊、R鸭,并按照一定浓度比例组成混合引物,进行一次聚合酶链式反应(polymerase chain reaction,PCR)扩增即可获得目的DNA片段,根据琼脂糖凝胶电泳的DNA条带大小来判断羊肉中是否掺杂鸭肉。结果表明:当被检样本在367 bp和480 bp处分别出现特异性条带时,说明该样本的羊肉中掺杂了鸭肉;当被检样本在367 bp处出现特异性条带,而在480 bp处未出现特异性条带时,则说明该样本的羊肉中没有掺杂鸭肉。该方法准确、可靠、简单快捷,可用于食品中肉类种属的筛选和肉类掺假的检测和监管。
关键词:羊肉;鸭肉;分子生物学;鉴别
Abstract: This study has established a molecular biological method for the identification of mutton adulterated with duck meat. Based on the target genes, namely the mitochondrial cytochrome b gene (cytb) sequences of mutton and duck, we designed one universal forward primer (F) and two specific reverse primers (Rmutton and Rduck) and mixed them in a certain proportion. The target DNA fragments were obtained by one cycle of polymerase chain reaction (PCR) amplification. By the sizes of the DNA bands in the agarose gel, we judged whether the mutton was adulterated with duck. Results indicated that duck adulteration in the tested samples could be confirmed by the appearance of specific bands at both 367 and 480 bp. On the other hand, the appearance of specific bands at 367 bp but not at 480 bp could not confirm mutton adulteration with duck. The proposed method in this study was accurate, reliable, simple, quick and useful for meat species screening and the detection and supervision of adulterated meat.
Key words: mutton; duck; molecular biology; identification
DOI:10.7506/rlyj1001-8123-201705009
中圖分类号:TS251.7 文献标志码:A 文章编号:1001-8123(2017)05-0046-05
羊肉性温,中医认为进食羊肉可以补虚益气,促进人体血液循环,提高抵抗力,因此羊肉成为冬季滋补及抗寒的重要食物来源[1]。近年来,随着生活水平的不断提高,羊肉及其制品的消费量不断上升,涮羊肉、烤羊肉等都深受消费者的喜爱[2]。然而部分商贩为了获取不法利益,利用食品质量检测手段的不足,用价格相对低廉的肉类冒充羊肉或者将其掺入羊肉中进行贩卖,尤其是羊肉卷和羊肉串等加工后的羊肉制品,消费者难以从形态纹理和肉质口感上对其进行识别,这种掺假造假的行为严重干扰市场秩序,影响消费者的身体健康和合法权益[3-5],因此加强对该类食品的品质鉴别十分必要。
早期的肉源鉴别技术主要依靠光谱、色谱及酶联免疫吸附测定等技术[6-10],但因操作复杂、耗时耗力且对样品要求高而不能满足对肉制品进行准确、快速鉴别的需求。随着基因工程的普及推广,以聚合酶链式反应(polymerase chain reaction,PCR)检测为代表的分子生物学检测手段已成为各类食品掺假检测的标准化方法[11-12],也是转基因食品判别技术研究的热点方向。
根据线粒体基因组DNA序列差异设计物种特异性引物在常规PCR方法中已见报道[13-14],但多数方法一次只能扩增一个目的片段,如果单独检测每一个项目,则存在费时费力、步骤繁琐和消耗试剂量大等弊端。因此,亟需建立一套准确度高、重复性好且特异性强的分子生物学检测方法,为规范市场秩序、保障食品安全提供技术支撑。
1 材料与方法
1.1 材料与试剂
新鲜羊肉、鸭肉、鸡肉和牛肉样品均购买于农贸市场。
动物组织全基因组提取试剂盒 北京全式金公司;Taq DNA聚合酶、PCR缓冲液、琼脂糖 生工生物工程(上海)股份有限公司;dNTP、核糖核酸酶A、DS2000 DNA Marker、1 kb DNA Ladder Marker、蛋白酶K溶液、胶回收试剂盒 日本TaKaRa公司;其他试剂均为分析纯。
1.2 仪器与设备
Thermal Cycler PCR仪 美国Hybaid公司;Dyy-11凝胶电泳仪及电泳槽 中国六一机械厂;AlphaImager HP凝胶成像系统 美国Alpha Inotech公司;Microfuge 22R高速冷冻离心机 美国Beckman公司。
1.3 方法
1.3.1 DNA提取
1.3.1.1 纯肉样DNA提取
称取羊肉、鸭肉、鸡肉和牛肉各20 mg左右,分别置于研钵中用液氮研磨至粉末,使用DNA提取试剂盒提取各肉样总DNA。并对提取得到的DNA进行纯化,除去残存蛋白质和RNA,使用紫外分光光度仪和凝胶电泳测试DNA的浓度及纯度,并将DNA稀释至质量浓度为20 ng/μL备用。
1.3.1.2 羊肉、鸭肉混合样品的制备及DNA提取
分别称取99 g羊肉和1 g鸭肉,将两者绞碎并混合,再用电动组织匀浆器进行研磨、匀浆,制成掺杂鸭肉的混合肉样,取20 mg混合肉样按1.3.1.1节的方法提取其DNA并进行检测,将DNA稀释至质量浓度为20 ng/μL备用。
1.3.2 引物设计
在GenBank中检索得到羊(accession EM130780.1)和鸭的线粒体基因序列(accession KC466567.1)。通过LaserGene中的MegAlign工具在基因库中分析和比对羊、鸭的线粒体基因保守序列,确定针对不同物种线粒体细胞色素b基因(cytb)中的特定片段,分别设计2 种物种的相同上游引物F和具有各自物种特异性的下游引物(羊引物R羊、鸭引物R鸭),引物信息详见表1。
1.3.3 引物特异性验证
分别用羊肉、鸭肉、鸡肉和牛肉的全基因组作为PCR扩增模板,加入羊肉特异性引物(F/R羊)得到PCR扩增產物,取5 μL产物进行凝胶电泳检测,验证羊肉引物的特异性。鸭肉引物(F/R鸭)的特异性验证同羊肉引物。
1.3.4 羊肉、鸭肉成分的鉴定
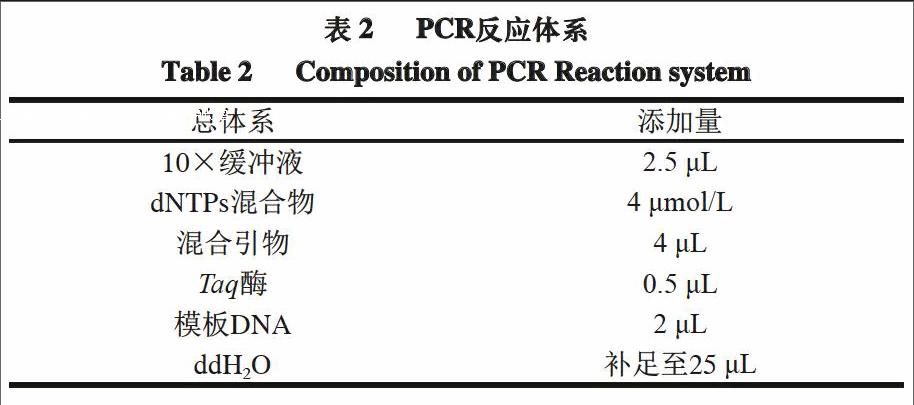
将羊肉特异性引物和鸭肉特异性引物混合,使用提取的羊肉、鸭肉及其混合肉样的DNA作为模板进行PCR扩增,多次优化实验以确定引物配比,其最佳反应体系见表2。
最佳PCR反应条件为:94 ℃、5 min;94 ℃、30 s;50 ℃、30 s;72 ℃、30 s;32 个循环;最后72 ℃延伸8 min。取5 μL产物进行凝胶电泳检测。
1.3.5 羊肉真伪鉴别
随机抽取在售羊肉5 批,按照1.3.1.1节的方法提取肉样DNA,并按照1.3.4节进行PCR检测和凝胶电泳,鉴定此5 批肉样中是否含有鸭肉成分。将市售羊肉PCR检测扩增出的条带进行切胶回收,分别送至青岛擎科生物技术有限公司进行测序,并将测序结果与GenBank数据库中羊和鸭的线粒体Cytb基因序列进行比对。
2 结果与分析
2.1 肉样DNA质量及纯度检测
采用1.3.1节中的方法提取的羊肉、鸭肉、鸡肉、牛肉及混合样的DNA凝胶电泳结果见图1。
由图1可知,所有样品的条带清晰,无明显拖带且电泳孔亮度不明显,说明提取的总DNA无降解、无蛋白质残留。用紫外分光光度仪测得DNA样品的OD260 nm/OD280 nm均在1.8~2.0之间,符合进行PCR的要求。
2.2 引物特异性检测
基于PCR手段对样品进行鉴别时,首先必须确定合成的引物是否具有特异性,以确保用此引物进行的PCR反应能得到特异性目的片段,进而确定其能否满足检测需要。按1.3.3节的方法分别使用羊肉引物(F/R羊)、鸭肉引物(F/R鸭)对4 种肉样进行PCR扩增,结果见图2~3。
由图2~3可知,仅在羊肉样品中检测到单一目的条带,而在其他肉类中未检测到条带,说明本实验设计的羊肉引物(F/R羊)具有特异性;使用鸭肉引物进行PCR反应,同样仅在鸭肉中检测到明显的目的条带,说明设计的鸭肉引物(F/R鸭)特异性良好。
2.3 羊肉中鸭肉成分的鉴定
按1.3.4节配制PCR扩增体系并进行PCR扩增,羊肉、鸭肉及其混合肉样的电泳结果如图4所示。
由图4可知,经过调整引物比例和优化反应参数,在相同的反应体系下,单一模板及混合模板的PCR产物条带均清晰、单一,并与引物设计中的预期条带大小一致,且混合模板的电泳条带差别明显,说明本研究用于羊肉中鸭肉掺假鉴别的PCR检测方法可以达到预期效果,2 种肉类均可实现特异、高效的PCR扩增与鉴别。
2.4 市售羊肉的PCR检测
根据上述检测方法,随机抽取5 份市场流通中的羊肉进行检测。由图5可知,第1批羊肉在480 bp和367 bp处出现2 条特异性条带a1和a2,表明该批羊肉中掺杂有鸭肉;第2、5批羊肉只在367 bp处出现羊的特异性目标条带b和e,表明该2 批羊肉中未掺杂鸭肉;而第3、4批羊肉则只在490 bp处出现鸭的特异性目标条带c和d,说明该2 批羊肉为假冒产品。阴性对照样品未出现条带。
将条带a1、a2、b、c、d、e的测序结果与GenBank数据库中羊和鸭的线粒体Cytb基因序列进行比对,结果如图6~7所示。
由图6~7可知,a2、b和e序列确实位于羊线粒体Cytb基因序列上,a1、c和d序列确实位于鸭线粒体Cytb基因序列上。
3 讨 论
市场调研结果表明,流通领域中的羊肉有不同程度的掺伪造假现象,其中尤以掺杂鸭肉现象最为突出[15],羊肉的质量安全逐渐受到消费者和市场监管部门的重视。因此,建立一种准确度高、重复性好的检测方法,对于相关部门加强对市场的监管十分必要。本研究采用的PCR鉴定方法较其他方法具有更高的灵敏性、特异性和便捷性,因此其在肉类品种鉴定分析上起到重要作用[16-18]。
研究表明,在物种进化过程中,线粒体DNA的进化速度要快于细胞核内的DNA[19],因此线粒体DNA具备更明显的种间多态性和种内多态性,能够更精准地将有较近亲缘关系的物种区分开来[20-21]。另一方面,细胞中线粒体DNA的含量是核DNA的1 000 倍以上,线粒体内DNA具有更加稳定的环状结构,跟细胞核内DNA相比,线粒体DNA的提取比较简单,并可以应用于PCR反应中[22]。
因此在国内外的研究中,用于肉类来源鉴定的序列主要位于线粒体上,其中最常用的序列为12S rDNA、16S rDNA、Cytb和D-loop等[23-26]。
本研究通过对羊、鸭的线粒体Cytb进行分析比对,根据分析结果在序列保守区设计羊、鸭通用的上游兼并引物,并分别在两者的序列特异区设计特异性下游引物,采用一次PCR反应的方法鉴别羊肉中是否掺杂鸭肉,经反复实验证明,该方法可实现在一个反应体系中体现出2 个不同物种的特异性,且引物序列具备灵敏性和稳定性;所建立的PCR检测方法样品用量少,可在几小时内准确、快速地得出结果,具有较强的实用性。
随着生物技术(基因芯片、蛋白质芯片等)的飞速发展和其他新兴技术的不断涌现,在后续的工作中,需要进一步加强基因检测等多种检测技术的结合使用,扩大应用领域[27-28]。例如:基于基因的多态性,在PCR的基础上发展指纹图谱技术和DNA条形码技术,不仅可以鉴定物种还可以追踪溯源[29-30];在生产及检测过程中引入大数据技术,构建数据库,共享物种的特征数据及模型;在现有的检测技术基础上,研发更加低成本、高通量、准确可靠的检测方法,提高掺假检测鉴别的能力,完善肉类掺假检测技术体系,为我国肉类食品的质量安全做好保障,这些工作需要在今后的研发中作进一步的探索。
参考文献:
[1] 郑灿龙. 羊肉的营养价值及其品质的影响因素[J]. 肉类研究, 2003, 17(1): 47-48.
[2] 丁存振, 肖海峰. 我國羊肉供需现状及趋势分析[J]. 农业经济与管理, 2016, 37(3): 86-96.
[3] 张慧霞, 宗卉, 吴建平, 等. 应用SYBR GreenⅠ实时荧光PCR溶解曲线检测鹌鹑源性成分[J]. 中国畜牧杂志, 2010, 46(17): 70-72.
[4] HUBALKOVAL Z, KRALIK P, TREMLOVA B, et al. Methods of gadoid fish species identification in food and their economic impact in the Czech republic: a review[J]. Veterinarni Medicina, 2007, 52(7): 273-292.
[5] 张驰, 邱皓璞, 张筠, 等. 荧光定量PCR检测肉制品中鸭源性成分[J]. 食品科学, 2013, 34(18): 154-157.
[6] 马永征, 马冬, 白娣斯, 等. 免疫学检测肉类制品掺假研究进展[J]. 肉类研究, 2012, 26(9): 26-29.
[7] MAGDSIENA M, EDWARD P. Species identification of meat by electrophoretic methods[J]. Acta Scientiarum Polonorum Technologia Alimentaria, 2007, 6(1): 5-16.
[8] XU Y J, JIN M L, WANG L J, et al. Differential proteome analysis of porcine skeletal muscles between Meishan and Large White[J]. Journal of Animal Science, 2009, 87(8): 2519-2527. DOI:10.2527/jas.2008-1708.
[9] SENTANDREU M ?, SENTANDREU E. Authenticity of meat products: tools against fraud[J]. Food Research International, 2014, 60(6): 19-29. DOI:10.1016/j.foodres.2014.03.030.
[10] MONTOWSKA M, POSPIECH E. Species-specific expression of various proteins in meat tissue: proteomic analysis of raw and cooked meat and meat products made from beef, pork and selected poultry species[J]. Food Chemistry, 2013, 136(3/4): 1461-1469. DOI:10.1016/j.foodchem.2012.09.072.
[11] AIDA A A, CHEMAN Y B, WONG C M, et al. Analysis of raw meats and fats of pigs using polymerase chain reaction for Halal authentication[J]. Meat Science, 2005, 69(1): 47-52. DOI:10.1016/j.meatsci.2004.06.020.
[12] SHARMA A, KMMAR S, SHARMA N, et al. Prospects in bioscience: addressing the issues[M]. India: Springer, 2013: 49-54. DOI:10.1007/978-81-322-0810-5.
[13] 李通, 尹艳, 王海, 等. 聚合酶链式反应快速鉴别5 种常见肉类别[J]. 食品科学, 2013, 34(8): 249-252.
[14] HOPWOOD A J, FAIRBROTHER K S, LOCKLEY A K, et al. An actin gene-related polymerase chain reaction (PCR) test for identification of chicken in meat mixtures[J]. Meat Science, 1999, 53(4): 227-231.
[15] 王彤, 刘显军. 混合羊肉卷的鉴别与管理[J]. 黑龙江畜牧兽医, 2013, 33(16): 69-70. DOI:10.13881/j.cnki.hljxmsy.2013.16.033.
[16] ABBAS D, PAYAM G D, EBRAHIM R. Molecular assay to fraud identification of meat products[J]. Journal of Food Science and Technology, 2014, 51(1): 148-152. DOI:10.1007/s13197-011-0456-3.
[17] 李潇, 曲焱焱, 张丕乔, 等. 聚合酶链式反应-限制性片段长度多态性和芯片生物分析技术用于渤海地区鱼种鉴定[J]. 色谱, 2011, 29(7): 673-676.
[18] 范丽丽, 李培, 傅春玲, 等. 实时荧光聚合酶链式反应法检测食品中猪源性成分[J]. 食品科学, 2013, 34(8): 224-227.
[19] HEBERT P D N, RATNASINGHAM S, WAARD J R D. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proceedings of the Royal Society B: Biological Sciences, 2003, 270(Suppl1): 96-99. DOI:10.1098/rsbl.2003.0025.
[20] DAVID S, SCOTT E M. DNA barcoding a useful tool for taxonomists[J]. Nature, 2005, 435: 17. DOI:10.1038/435017b.
[21] SACCONE C, de GIORGI C, GISSI C, et al. Evolutionary genomics in Metazoa: the mitochondrial DNA as a model system[J]. Gene, 1999, 238(1): 195-209. DOI:10.1016/S0378-1119(99)00270-X.
[22] CHANDRIKA M, ZAINONMOHD N, MAIMUNAH M, et al. Meat species identification and Halal authentication analysis using mitochondrial DNA[J]. Meat Science, 2009, 83(1): 57-61. DOI:10.1016/j.meatsci.2009.03.015.
[23] MIGUEL V, MEIKE T, ARIE M, et al. Comparative performance of the 16S rRNA gene in DNA barcoding of amphibians[J]. Frontiers in Zoology, 2005, 2(1): 1-12. DOI:10.1186/1742-9994-2-5.
[24] RAMADAN H A I. Sequence of specific mitochondrial 16S rRNA gene fragment from Egyptian buffalo is used as a pattern for discrimination between river buffaloes, cattle, sheep and goats[J]. Molecular Biology Reports, 2011, 38(6): 3929-3934. DOI:10.1007/s11033-010-0509-0.
[25] HSIEH H M, CHIANG H L, TSAI L C, et al. Cytochrome b gene for species identification of the conservation animals[J]. Forensic Science International, 2001, 122(1): 7-18. DOI:10.1016/S0379-0738(01)00403-0.
[26] 王康環, 金红, 蒋利, 等. 藏系绵羊、新疆细毛羊及阿勒泰羊mtDNA D-loop基因序列分析及系统进化研究[J]. 中国畜牧兽医, 2014, 41(1): 160-166.
[27] 欧阳小艳, 莫帮辉, 余华丽. DNA条形码识别-DNA条形码与DNA芯片识别蚊媒准确性的比较[J]. 中国国境卫生检疫杂志, 2007, 30(6): 349-352.
[28] ESCHER N, KAATZ M, MELLE C, et al. Posttranslational modifications of transthyretin are serum markers in patients with mycosis fungoides[J]. Neoplasia, 2007, 9(3): 254-259. DOI:10.1593/neo.06805.
[29] 吴潇, 张小波, 朱连龙, 等. 肉产品分子溯源标记的研究进展[J]. 食品科学, 2010, 31(7): 308-311.
[30] 田晨曦, 周巍, 王爽, 等. 基于DNA条形码技术常见肉类掺假鉴别技术的研究[J]. 现代食品科技, 2016, 32(8): 295-301. DOI:10.13982/j.mfst.1673-9078.2016.8.045.
