环境UV—B辐射增强对叶用杜仲林叶片光合作用与活性物质含量的影响
2017-06-11付金颖杨超李德文唐中华郭晓瑞祖元刚
付金颖 杨超 李德文 唐中华 郭晓瑞 祖元刚

摘要[目的]探討環境紫外(UV-B)辐射对叶用杜仲叶片光合作用和活性物质含量及膜脂过氧化的影响,为叶用杜仲林的生态培育提供理论依据。[方法]在不同紫外(UV-B)辐射强度处理[CK:+0;T1:+1.40 kJ/(m2·d);T2:+2.81 kJ/(m2·d)]下,以5年生杜仲为研究对象,采用单因素方差分析与相关分析方法研究净光合速率、光合色素、次生代谢产物及自由基含量差异及相关性。[结果]UV-B辐射强度增加显著降低杜仲叶片光合参数净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)和叶绿素a/b,显著提高了叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量,T1处理的叶绿素含量最高[(1.15±0.049)mg/g],T2处理的类胡萝卜含量最高[(0.036 0±0.001 6) mg/g];UV-B辐射强度增加显著降低杜仲叶片部分次生代谢产物桃叶珊瑚苷、京尼平苷酸、京尼平苷和绿原酸含量,且最大变化值之间分别相差20.74、61.23、16.16和13.63倍,同时也显著提高了部分次生代谢产物京尼平、黄酮、总酚和单宁含量,且T1处理的京尼平、黄酮、总酚和单宁含量分别是CK处理的1.21、1.11、1.34和1.37倍,总酚与单宁含量以T2处理最高,分别为(1.290 0±0.023 0)和(17.30±1.44)μg/g;UV-B辐射增强显著增加了MDA、H2O2和O2·-含量,且T1处理的MDA含量与O2·-含量较CK处理组分别高39.46%、70.48%;T2处理的H2O2含量较CK处理组高43.51%。[结论]UV-B辐射显著影响杜仲叶片光合参数及绿原酸、桃叶珊瑚苷、京尼平苷和京尼平苷酸等主要活性物质含量,因此可以通过调节环境UV-B辐射强度以提高叶用杜仲林的经济效益。
关键词杜仲;UV-B辐射;净光合速率;茶多酚;绿原酸
中图分类号S567;Q945.11文献标识码
A文章编号0517-6611(2017)26-0006-05
Effects of Elevated UVB Radiation on Photosynthesis and Contents of Active Substance of Eucommia ulmoides Plantation
FU Jinying,YANG Chao,LI Dewen* et al(Northeast Forestry University,Harbin,Heilongjiang 150040)
Abstract[Objective] The aim was to study the effects of environmental ultraviolet (UVB) radiation on the photosynthesis,active substance content and membrane lipid peroxidation of leaves of Eucommia ulmoides and provide theoretical basis for the ecological cultivation of Eucommia ulmoides.[Method] Taking five years old Eucommia ulmoides leaves under different ultraviolet radiation treatments [CK:+0; T1:+1.40 kJ/(m2·d); T2:+2.81 kJ/(m2·d)] as materials,with the single factor analysis of variance and correlation analysis method were used to study the variation content of photosynthetic parameters,photosynthetic pigment,aucubin,chlorogenic acid,genipin,geniposide,geniposide acid,flavonoids,total phenol,tannin and MDA,H2O2,O2·-.[Result] Elevated UVB radiation significantly reduced the photosynthetic rate (Pn),stomatal conductance (Gs),intercellular CO2 concentration (Ci),transpiration rate (Tr) and chlorophyll a/b,and increased the content of chlorophyll a,chlorophyll b,carotenoid and total chlorophyll significantly; the content of total chlorophyll in T1 treatment was the highest [(1.15±0.049) mg/g];the content of carotenoid in T2 treatment was the highest [(0.036 0±0.001 6) mg/g]; UVB radiation significantly reduced the partial metabolites such as aucubin,geniposide acid,geniposide and chlorogenic acid content in the leaves of Eucommia ulmoides,and the maximum change was 20.74 times,61.23 times,16.16 times and 13.63 times,respectively,and other secondary metabolites,genipin,flavonoids,total phenolics and tannin content were significantly increased.The contents of total phenol and tannin in T1 treatment were 1.21 times,1.11 times,1.34 times and 1.37 times higher than that of CK treatment,respectively,and the contents of total phenol and tannin were (1.290 0±0.023 0) and (17.30±1.44) μg/g respectively in T2 treatment.UVB radiation significantly increased the contents of MDA,H2O2 and O2·-,the content of MDA and O2·- in T2 treatment was 39.46% and 70.48% higher than that in CK treatment group.The content of H2O2 in T2 treatment was 43.51% higher than CK treatment group.[Conclusion] UVB radiation significantly affects the photosynthetic parameters of Eucommia ulmoides leaves and the main active substances such as chlorogenic acid,aucubin,geniposide and geniposide,so the UVB radiation intensity can be used to improve the economic benefit of Eucommia ulmoides.
Key wordsEucommia ulmoides Oliv;UVB radiation;Net photosynthetic rate;Tea polyphenol;Chlorogenic acid
大气层中平流层臭氧减薄受到国际社会的普遍关注,UV-B辐射部分被臭氧吸收,波长越短,臭氧对其吸收量越大,因而臭氧层的减薄主要引起地表 UV-B辐射增强。UV-B辐射的增强势必影响植物的生长发育,Rozema等[1]也认为 UV-B辐射诱导产生的次生代谢物如黄酮、单宁和木质素等的变化对生态系统营养循环的调节才是其最重要的影响。许多植物次生代谢产物可作为重要的医药和化工原料,植物次生代谢过程与环境关系的研究有利于提高资源植物生物工程的效率和质量,也有助于传统中药植物的目标化种植[2]。植物次生代谢物中有效成分含量的多寡往往是决定中药材质量的关键所在,为提高药材质量,利用环境因子对药用植物的生长进行干扰从而调控其代谢途径,已成为目前植物学研究的热点。
植物暴露于UV-B辐射后,主要被叶片表皮吸收,表皮层通过积累具有吸收紫外线功能的化合物适应环境变化[3]。当前研究紫外辐射对次生代谢产物的变化主要集中在类黄酮次生物质方面。Fischbach等[4]发现UV-B辐射诱导Piceaabies 树叶表皮组织中的类黄酮和羟基肉桂酸积累,类黄酮的积累降低了UV-B辐射对表皮层的透过率[5]。 UV-B 辐射诱导植物类黄酮累积的分子生物学机理是它能刺激类黄酮生物合成途径中关键酶基因的转录和表达,Park等[6]发现苯丙素合成基因途径中相关酶(PAL、CHS、CHI和DFR)活性表达在S-UV-B处理下与黄酮含量的变化同步升高,说明相关合成途径上的酶对黄酮在S-UV-B下起到关键作用;Beggs等[7]发现类黄酮合成途径的苯丙氨酸裂解酶和查尔酮合成酶以及其他分支点的酶在UV-B辐射下活性加强,引起植物体内类黄酮及酚醛类化合物 (丹宁、木质素等 )的增加[8]。
杜仲(Eucommia ulmoides Oliv)是我国名贵的滋补药材,一直以来杜仲主要以杜仲皮入药,但现代研究证明,杜仲叶的药用有效成分与杜仲皮基本相同、药用功能基本一致[9-10],除此之外杜仲叶片也可加工成一种茶疗珍品——杜仲茶。目前,对杜仲的研究主要集中在资源、栽培、化学成分及药理活性和临床应用等方面[11],而对环境因子变化下杜仲生理生化特征及次生代谢过程研究还很薄弱。为此,笔者以我国传统名贵中药材杜仲为研究对象,在不同UV-B辐射增强条件下,通过对杜仲叶片光合作用、叶片活性成分含量及膜脂过氧化程度的研究,初步探讨了UV-B辐射对杜仲叶片光合作用及次生代谢过程的影响,以期为叶用杜仲林的生态培育提供理论依据。
1材料与方法
1.1材料40W UV-B辐射灯管为北京电光源研究所产品;LI-6400型便携式光合仪为美国LI-COR公司产品;高通量组织研磨器为浙江宁波新艺超声设备有限公司产品。标准品桃叶珊瑚苷、京尼平苷酸、京尼平、京尼平苷和绿原酸均购于Sigma公司,纯度≥98%。
1.2试验设计
试验于2016年9月18—21日在东北林业大学森林植物生态学教育部重点实验室实验园内进行,选取30株长势一致的5年生杜仲(平茬后当年萌发的植株)分为3个处理,每個处理10株,在自然光照基础上,根据试验要求,增加0 (CK)、1.40 kJ/(m2·d)(T1)、2.81 kJ/(m2·d)(T2)3个不同辐射强度的UV-B辐射处理,UV-B(280~320 nm)辐射处理通过悬在植株上方的UV-B辐射灯管产生,每日处理时间为09∶00—17∶00。处理期间采用茶用杜仲林管理方法进行常规管理,保证水分、养分供应。处理3 d后选取植株顶端已完全展开的生长状况及叶龄和叶位一致的叶片,测定各项生理指标,每个处理均随机取样,3次重复。
1.3试验方法
1.3.1光合参数与光合色素的测定。
在实验室处理周期内,在晴天上午选取已完全展开的生长状况良好、叶位一致的叶片,采用LI-6400型便携式光合仪,测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等光合参数,每个处理5次重复,取平均值。
光合色素含量参考Jiang等[12]的方法测定,稍作修改:称取0.2 g杜仲叶片鲜样,加入预冷的80%丙酮研磨成匀浆,5 000 r/min离心10 min,取上清液于紫外分光光度计665、649、480 nm波长处测定吸光值。
1.3.2次生代谢产物含量测定。
杜仲叶片桃叶珊瑚苷、绿原酸、京尼平苷酸、京尼平苷及京尼平的提取参考Dong等[13]的方法:称取0.5 g鲜样,加入20 mL 60%甲醇(色谱纯)于高通量组织研磨器(70 Hz)中保持 10 min,超声提取25 min,8 000 r/min离心15 min,取上清残渣用上述方法重提1次,合并上清液弃去残渣,上清液在40 ℃下浓缩,用色谱纯甲醇少量多次洗涤离心管,合并浓缩液,用甲醇定容至50 mL后过0.45 μm 微孔滤膜,将样品保存在-20 ℃冰箱供色谱分析。
采用高效液相色谱仪(HPLC)同时测定5种主要活性物质(桃叶珊瑚苷、京尼平苷酸、京尼平、京尼平苷和绿原酸)。色谱仪Qtrap5500(AB公司),色谱柱C18(2.1 mm×100.0 mm,1.6 μm);流动相:溶剂 A(62%水)与溶剂 B(38%甲醇),流速:0.25 mL/min,柱温:25 ℃,进样量:5 μL。
黄酮、总酚、单宁样品提取参考魏晓雪等[14]的方法:称取0.5 g新鲜叶片,加10 mL酸性甲醇溶液(甲醇∶水∶盐酸=79∶20∶1),室温下研磨,于55 ℃水浴提取30 min,3 000 r/min离心10 min,取上清液定容至10 mL,待测。黄酮含量测定采用尉芹等[15]的方法,于分光光度計510 nm波长处检测吸光值;总酚的检测采用Chaovanalikit等[16]的方法,于分光光度计765 nm波长处检测吸光值;单宁含量测定采用王杰兴等[17]的方法,于分光光度计442 nm波长处检测吸光值。
1.3.3MDA、H2O2及O2·-含量测定方法。
MDA的测定采用硫代巴比妥酸(TBA)比色法[18];H2O2含量参考Patterson等[19]的测定方法,H2O2与硫酸钛(或氯化钛)生成过氧化物-钛复合物黄色沉淀,可被H2SO4 溶解后,在415 nm 波长处比色测定,在一定范围内,其颜色深浅与H2O2浓度呈线性关系;O2·-含量参考Jiang等[12]的方法测定。
1.4数据分析
应用SPSS 19.0和Excel 2010 软件进行数据分析,并采用单因素方差分析检验各处理组间差异显著性和所有指标相关性,表中数值为平均值±标准误。
2结果与分析
2.1光合参数与光合色素含量的变化
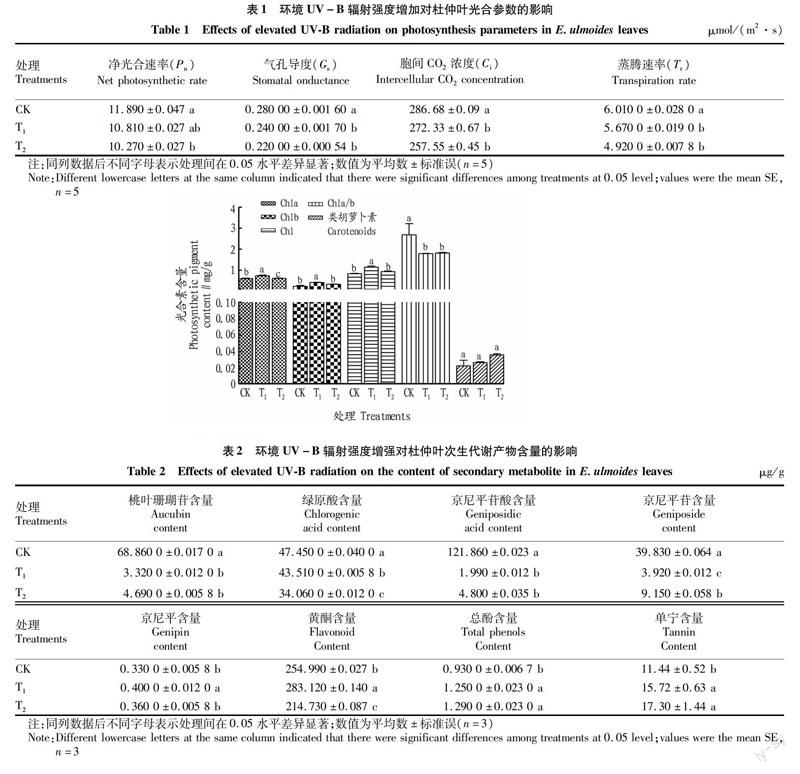
结果表明,增加环境UV-B辐射强度对杜仲叶片光合参数和光合色素含量均有显著影响(表1和图1)。与CK相比,提高UV-B辐射强度显著降低杜仲叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),但T1与T2处理间差异不显著。T2處理较CK处理的Pn、 Gs、Ci和Tr分别降低了13.62%、21.43%、11.31%和18.14%。低强度UV-B辐射显著增加叶片光合色素含量,叶绿素a、叶绿素b以及总叶绿素在T1处理含量最高,分别达(0.740±0.030)、(0.410±0.019)和(1.150±0.049)mg/g,而各处理间类胡萝卜素含量无显著差异,增强UV-B辐射强度降低了叶绿素a/b比值,但差异并不显著。
2.2次生代谢产物含量的变化
由表2可知,在增加UV-B辐射强度胁迫下,杜仲叶片重要次生代谢产物绿原酸含量随UV-B辐射强度的增加而显著降低;UV-B辐射增强显著降低了桃叶珊瑚苷、京尼平苷酸和京尼平苷含量,T1处理的含量分别为(3.320 0±0.012 0)、(1.990±0.012)、(3.920±0.012) μg/g;低强度UV-B处理显著增加了京尼平与黄酮含量,且T1较CK分别升高了21.2%和11.03%;总酚与单宁含量在T2处理时最高,分别达(1.290 0±0.023 0)和(17.30±1.44) μg/g。
安徽农业科学2017年
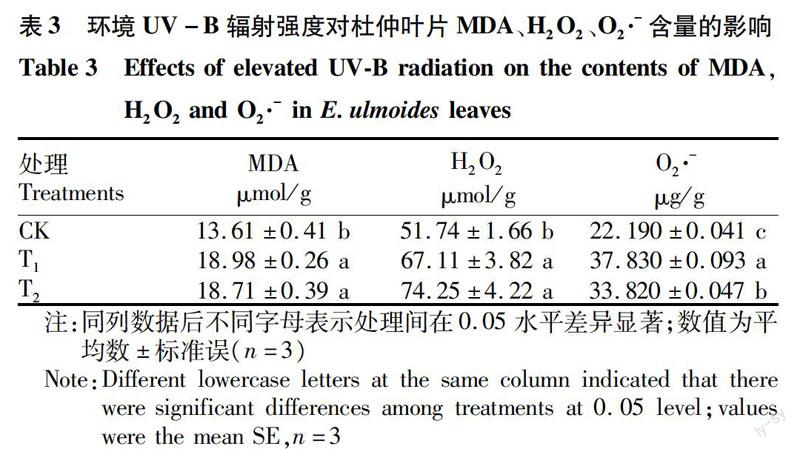
2.3MDA、H2O2和O2·-含量的变化
由表3可知,与CK相比,T1与T2显著增强MDA含量,T1与T2差异不显著;H2O2含量在UV-B辐射增强下表现为:T2>T1>CK,与CK相比,T1与T2显著提高杜仲叶片H2O2含量,但T2与T1处理间无显著差异;O2·-含量在UV-B辐射增强下表现为:T1>T2>CK,且各处理间差异显著;MDA与O2·-含量T1处理较CK升高了39.46%和70.48%,H2O2含量中T2处理较CK升高了43.51%。
2.4UV-B辐射下杜仲叶生理与代谢物质之间的相关性
相关分析结果表明,在UV-B辐射增强条件下,杜仲叶片生理指标间存在相关性(表4),京尼平、总酚、单宁含量与叶绿素b(Chlb)、MDA、O2·-含量存在显著正相关关系;桃叶珊瑚苷、京尼平苷酸,京尼平苷与叶绿素b(Chlb)、叶绿素(Chl)、MDA、H2O2、 O2·-含量存在显著负相关关系,与叶绿素a/b(Chla/b)存在显著正相关关系;绿原酸和类胡萝卜素、MDA、H2O2存在显著负相关关系;黄酮含量与叶绿素a(Chla)存在显著正相关关系(r=0.71)。
3结论与讨论
UV-B辐射对植物伤害机理一直是有关UV-B辐射研究的重点。该研究结果表明,UV-B辐射对叶用杜仲光合作用的影响主要表现为光合速率降低及光合色素含量的改变,高强度UV-B輻射造成光合速率下降的原因是由于气孔阻力增大,增加气孔对外界环境特别是大气湿度的敏感性,同时CO2 的传导率降低,引起胞间CO2浓度下降,从而影响CO2的同化效率[20],最终导致杜仲叶片净光合速率的下降。低强度UV-B处理下叶绿素含量增加,这有利于杜仲植株吸收和利用过多的光能以缓解UV-B辐射对植物造成的伤害[21],但植物自身调节能力有限,随着UV-B辐射强度的加大,导致杜仲叶片叶绿素含量在T2处理下降低,植物受到明显伤害。植物体内叶绿素多以叶绿素a/b-蛋白复合体的形式存在,虽然低水平UV-B辐射增强处理下叶绿素a与叶绿素b的含量升高了,但增加UV-B辐射强度降低了叶绿素a/b比值,表明UV-B 辐射对光合色素的光破坏是本质的[22]。糖和氨基酸等植物光合作用产物的组成及总量的积累对杜仲茶叶品质形成具有决定作用[23],UV-B辐射降低杜仲叶片光合作用效率势必影响其茶用的功能与品质,最直观的影响即为杜仲茶的色泽。
次生代谢产物的产生是植物在长期进化中对生态环境适应的结果,故不同植物在不同生长环境下体内产生的次生代谢产物不尽相同[24]。许多研究发现,通过调节UV-B辐射剂量能够提高植物某些具有重要药用价值和经济效益的次生代谢产物含量[25],例如,研究发现提高环境UV-B辐射强度可显著提高南方红豆杉针叶紫杉醇含量[26]。该研究中的次生代谢产物桃叶珊瑚苷、京尼平、京尼平苷和京尼平苷酸均属于环烯醚萜类,当前环烯醚萜生物合成关键酶的研究主要集中在甲羟戊酸途径(MVA)[27]和2-甲基赤藓糖-4-磷酸途径(MEP)[28]上系列关键酶及催化环烯醚萜骨架形成的萜类合酶等。该研究结果表明,UV-B辐射增强条件下杜仲叶片桃叶珊瑚苷、京尼平苷和京尼平苷酸含量较对照降低,仅京尼平含量升高,这与该研究之前的假定(UV-B辐射增强将促进主要活性物质含量提高)不同,随后该研究在环境UV-B辐射控制条件下对3年生杜仲叶片中次生代谢产物含量进行测定,得出相同的结果。究其原因,导致桃叶珊瑚苷、京尼平苷和京尼平苷酸含量降低原因可能是UV-B辐射引起了MVA途径和MEP途径中某一关键酶的改变,有相关研究发现盐胁迫下玉米萜类合成途径中的萜烯合酶基因2(TPS2)、萜烯合酶基因3(TPS3)、牻牛儿基牻牛儿基焦磷酸合成酶基因4(GGPS4)在不同材料中表达量随胁迫时间延长均先上调再下调[29];京尼平含量升高可能是由于UV-B辐射增加了β-葡萄糖苷酶水解京尼平苷的能力[30]。有关环烯醚萜类代谢产物在非生物胁迫中的研究较少,故产生上述结果的原因有待进一步研究。
绿原酸与黄酮属于苯丙素类物质,紫外辐射条件下,苯丙烷类化合物代谢和黄酮合成途径中多种酶,包括 PAL、CHS、4CL、CHI、黄酮-3-羟化酶(F3H)、二氢黄酮-4-还原酶(DFR)等的基因表达上调或者酶活性增强[31]。该研究表明,UV-B辐射升高增加了黄酮含量,降低了绿原酸含量,现有研究已证实增强UV-B辐射强度使得黄酮合成途径上的相关基因被激活[32],如PAL(丙氨酸裂解酶)、CAD(肉桂醇脱氢酶)、4CL(4-香豆酸辅酶A连接酶)、CHI(黄酮查尔酮异构酶)和DFR(二氢黄酮醇还原酶)等[33],进而增加了黄酮含量。绿原酸含量下降可能是与由于UV-B辐射抑制了合成绿原酸通路上HQT的合成[34]。增加UV-B辐射强度总酚含量较对照升高,总酚物质可以保护感光目标免受氧化应激反应,故增加自身含量来降低UV-B辐射对植株的氧化伤害作用;酚类化合物的积累也可能与此类化合物可使植物免受因 UV 辐射带来的 DNA 损伤或光抑制有关[35]。黄酮、总酚、单宁又均属于紫外吸收物质,UV-B辐射增加激活了植物自身的防御系统,以提升紫外吸收物质来进行抵御或降低植株的受害情况[36],杜仲叶片中上述活性物质组成及含量的改变将直接影响叶用杜仲林的经济价值。
植物叶绿体与线粒体是产生活性氧的主要细胞器[37],前者进行光合作用时经过一系列反应后电子传递能力增强时会产生大量的活性氧;后者进行呼吸作用时通过呼吸链为细胞提供能量,此过程中植物组织中耗费的氧约有1%产生了活性氧[38],可见活性氧产生概率之广。该研究表明,MDA、H2O2和O2·-在受到UV-B辐射增强条件下均有增加的现象,这与撒玉霞等[39]、沈嘉等[40]的研究结果一致。UV-B辐射刺激了贮存活性氧的细胞器如叶绿体、线粒体,使得细胞器内发生电子传递过程中活性氧的积累,经过一系列反应产生H2O2和O2·-,而活性氧的积累大大加剧了膜脂过氧化作用,使其产物MDA含量也随之增加。细胞膜被认为是UV-B辐射的主要靶位点之一,UV-B照射可导致膜结构的损伤,膜脂氧化速度提高,导致活性氧自由基的产生[41],最终导致膜脂过氧化产物MDA的积累增加[42]。
总体来说,增加UV-B辐射强度对杜仲叶片光合作用、活性物质组成及含量的改变、活性氧自由基变化的影响将直接影响着杜仲叶的品质及其经济价值,如色泽、药用保健功效等。环境因子变化对药用植物品质及保健功能的影响是值得关注的,在当前全球变化的背景下,采用环境调控及生长因子调控等组合措施对杜仲植物资源进行定向培育,进一步提高其品质具有重要意义。
参考文献
[1]
ROZEMA J,VAN D S J,BJRN L O,et al.UV-B as an environmental factor in plant life:Stress and regulation[J].Trends in ecology and evolution,1997,12(1):22-28.
[2] SHELTON A L.Variable chemical defences in plants and their effects on herbivore behaviour[J].Evolutionary ecology research,2000,2(2):231-249.
[3] 彭祺,周青.植物次生代谢响应UV-B辐射胁迫的生态学意义[J].中国生態农业学报,2009,17(3):610-615.
[4] FISCHBACH R J,KOSSMANN B,PANTEN H,et al.Seasonal accumulation of ultravioletB screening pigments in needles of Norway spruce (Picea abies(L.) Karst.)[J].Plant cell and environment,1999,22(1):27-37.
[5] ROBBERECHT R,CALDWELL M M.Protective mechanisms and acclimation to solar ultravioletB radiation in Oenothera stricta[J].Plant cell and environment,1982,6(6):477-485.
[6] PARK J S,CHOUNG M G,KIM J B,et al.Genes upregulated during red coloration in UVB irradiated lettuce leaves[J].Plant Cell Rep,2007,26:507-516.
[7] BEGGS C J,WELLMANN E,GRISEBACH H,et al.Photocontrol of flavonoid biosynthesis[M]//KENDRICK R E,KRONENBERG G H M.Photomorphogenesis in Plants.Berlin:Springer Netherlands,1994:467-499.
[8] BRAUN J,TEVINI M.Regulation of UVprotective pigment synthesis in the eipermal layer of rye seedlings (Secale cereale L.cv.Kusteo)[J].Photochemistry and photobiology,1993,57(57):318-323.
[9] 李家实,阎玉凝.杜仲皮與叶化学成分初步研究[J].中药通报,1986,11(8):41-42.
[10] 龚桂珍,宫本红,张学俊,等.杜仲叶和杜仲皮中化学成分的比较[J].西南大学学报(自然科学版),2010,32(7):167-172.
[11] 杨峻山,张聿梅,姜声虎.杜仲研究的现状与展望[J].自然资源学报,1997,12(1):60-67.
[12] JIANG M Y,ZHANG J H.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings[J].Plant and cell physiology,2001,42(11):1265-1273.
[13] DONG J N,MA X H,WEI Q,et al.Effects of growing location on the contents of secondary metabolites in the leaves of four selected superior clones of Eucommia ulmoides[J].Industrial crops and products,2011,34(3):1607-1614.
[14] 魏晓雪,于景华,李德文,等.UV-B輻射增强对红松幼苗针叶脂质过氧化及抗氧化系统的影响[J].林业科学,2011,47(5):54-59.
[15] 尉芹,王冬梅,马希汉,等.杜仲叶总黄酮含量测定方法研究[J].西北农林科技大学学报(自然科学版),2001,29(5):119-123.
[16] CHAOVANALIKIT A,WROLSTAD R E.Total anthocyanins and total phenolics of fresh and processed cherries and their antioxidant properties[J].Journal of food science,2010,69(69):67-72.
[17] 王杰兴,王全杰,杜山山,等.分光光度法测定板栗刺壳、核桃青皮及葡萄皮中的单宁含量[J].西部皮革,2013,35(6):20-23.
[18] 高俊凤.植物生理学实验指导[J].北京:高等教育出版社,2006.
[19] PATTERSON B D,MACRAE E A,FERGUSON I B.Estimation of hydrogen peroxide in plant extracts using titanium (IV)[J].Analytical biochemistry,1984,139(2):487-492.
[20] ALLEN D J,NOGUS S,BAKER N R.Ozone depletion and increased UVB radiation:Is there a real threat to photosynthesis?[J].Journal of experimental botany,1998,49(328):1135-1136.
[21] 王进,张静,樊新燕,等.干旱区UV-B辐射增强对棉花生理、品质和产量的影响[J].棉花学报,2010,22(2):125-131.
[22] 师生波,尚艳霞,朱鹏锦,等.增补UV-B辐射对高山植物美丽风毛菊光合作用和光合色素的影响[J].草地学报,2010,18(5):607-614.
[23] 单武雄,肖润林,王久荣,等.遮光对丘陵茶园白露毛尖茶產量和品质的影响[J].农业现代化研究,2010,31(3):368-372.
[24] 李彦,周晓东,楼浙辉,等.植物次生代谢产物及影响其积累的因素研究综述[J].江西林业科技,2012,(3):54-60.
[25] 吴洋,房敏峰,岳明,等.UV-B辐射对药用植物次生代谢的影响研究进展[J].中国中药杂志,2012,37(15):2247-2251.
[26] 李德文,刘英,李美兰,等.NO对UV-B辐射下南方红豆杉幼苗生理特性的影响[J].东北林业大学学报,2015,43(7):27-30.
[27] NEWMAN J D,CHAPPELL J.Isoprenoid biosynthesis in plants:Carbon partitioning within the cytoplasmic pathway[J].Critical reviews in biochemistry and molecular biology,1999,34(2):95-106.
[28] LICHTENTHALER H K.The 1deoxydxylulose5phosphate pathway of isoprenoid biosynthesis in plants[J].Annu Rev Plant Physiol Plant Mol Biol,1999,50(50):47-65.
[29] 史利平,季静,王罡,等.盐胁迫条件下玉米萜类合成相关基因的表达分析[J].中国生物工程杂志,2016,36(8):31-37.
[30] 周汉琛,雷攀登,丁勇.茶树β-葡萄糖苷酶研究进展[J].茶叶科学,2016,36(2):111-118.
[31] INDRAJITH A,RAVINDRAN K C.Antioxidant potential of indian medicinal plant Phyllanthus amarus L.under supplementary UVB radiation[J].Recent research in science and technology,2009(1):1-2.
[32] TAKSHAK S,AGRAWAL S B.Defence strategies adopted by the medicinal plant Coleus forskohlii against supplemental ultravioletB radiation:Augmentation of secondary metabolites and antioxidants[J].Plant physiology and biochemistry,2015,97(6):124-138.
[33] TAKSHAK S,AGRAWAL S B.Secondary metabolites and phenylpropanoid pathway enzymes as influenced under supplemental ultravioletB radiation in Withania somnifera Dunal,an indigenous medicinal plant[J].Journal of photochemistry and photobiology B:Biology,2014,140:332-343.
[34] BARTLEY G E,AVENABUSTILLOS R J,DU W X,et al.Transcriptional regulation of chlorogenic acid biosynthesis in carrot root slices exposed to UVB light[J].Plant gene,2016,7:1-10.
[35] TSORMPATSIDIS E,HENBEST R G C,DAVIS F J,et al.UV irradiance as a major influence on growth,development and secondary products of commercial importance in Lollo Rosso lettuce 'Revolution' grown under polyethylene films[J].Environmental and experimental botany,2008,63(1/2/3):232-239.
[36] 姚銀安,祖艷群,李元.紫外线B辐射与植物体内酚类次生代谢的关系[J].植物生理学报,2003,39(2):179-184.
[37] 施征,史胜青,姚洪军,等.植物线粒体中活性氧的产生及其抗氧化系统[J].北京林业大学学报,2009,31(1):150-154.
[38] PUNTARULO S,SA″NCHEZ R A,BOVERIS A.Hydrogen peroxide metabolism in soybean embryonic axes at the onset of germination[J].Plant physiology,1988,86(2):626-630.
[39] 撒玉霞,于海峰,杨蕾.UV-B辐射对发菜细胞活性氧及抗氧化酶活性的影响[J].现代食品科技,2013,29(2):247-250.
[40] 沈嘉,郭东锋,姜超强,等.UV-B辐射和干旱胁迫对烟草逆境生理指标的影响[J].热带作物学报,2015,36(2):329-333.
[41] MURPHY T M.Membranes as targets of ultraviolet radiation[J].Physiologia plantarum,1983,58(3):381-388.
[42] 杨景宏,陈拓,王勋陵.增强UV-B辐射对小麦叶片内源ABA和游离脯氨酸的影响[J].生态学报,2000,20(1):39-42.
安徽农业科学,Journal of Anhui Agri. Sci.2017,45(26):11-14
