基于细菌/真菌相互作用的红树林内生真菌活性菌株筛选*
2017-06-10张柳红李嫣然李云龙宁嘉盈周耀航熊智瑶李佳欣王玉如黄志坚刘岚
张柳红,李嫣然,李云龙,宁嘉盈,周耀航,熊智瑶,李佳欣,王玉如,黄志坚,刘岚
(中山大学海洋科学学院,广东 广州 510006)
基于细菌/真菌相互作用的红树林内生真菌活性菌株筛选*
张柳红,李嫣然,李云龙,宁嘉盈,周耀航,熊智瑶,李佳欣,王玉如,黄志坚,刘岚
(中山大学海洋科学学院,广东 广州 510006)
为筛选出具有抑菌活性且次级代谢产物丰富的红树林内生真菌,以水产养殖中分离得到的2株病原细菌(VibrioparahaemolyticusB1和AcinetobacterjohnsoniiB2)对2014年从珠海淇澳-担杆岛省级自然保护区采集得到的616株红树林内生真菌进行代谢产物抗菌活性和丰富度筛选。利用共培养技术,寻找在共培养后菌落形态特征出现明显变化或形成抑菌圈的内生真菌。通过对纯培养和共培养真菌的粗提物进行抑菌活性检测和HPLC指纹图谱分析,筛选出在共培养条件下可诱导产生新代谢产物且抑菌效果显著提高的菌株,为发现抗菌化合物提供新来源。
红树林内生真菌;抑菌活性;HPLC指纹图谱;次级代谢产物
红树林是生长于热带、亚热带海岸和河口潮间带的木本植物群落,是四大海洋高生产力生态系统之一,也是陆地到海洋过渡型生态系统。由于边缘效应,红树林生态环境具有强还原性、强酸性、高含盐量和营养丰富等特点[1],为一大群适应了高盐度和定期潮汐冲刷等生存环境的微生物提供了必要的栖息之地,红树林内生真菌就是红树林微生物资源中的主要类群。红树林丰富的微生物环境,使微生物间存在激烈的生存竞争,促使微生物产生丰富的次级代谢产物,为寻找新抗菌活性物质提供了源泉[2]。本课题组已从红树林内生真菌分离得到许多结构新颖或活性良好的次级代谢产物[3-4]。在过去的红树林内生真菌次级代谢产物研究中,大部分是采用纯培养的方式大规模发酵真菌,进而分离其次级代谢产物,但在纯培养条件下,有些真菌的基因处于沉默的状态,产生次级代谢产物的途径不表达或者表达被抑制[5],这就减少了发现活性天然产物的机会。共培养基于微生物间的相互作用,可激活沉默的生源合成基因簇[6],是产生新活性代谢产物的重要途径[7-9]。
耐药细菌性疾病是水产养殖中最为常见而且危害最大的一类疾病,由于抗生素的过量使用,使水产病原菌的种类和数量显著增加,养殖生物耐药病原菌病害的发生也越来越频繁,微生物病害防治的难度越来越大[10]。近年来全国范围内水产养殖毁灭性病害的频繁发生表明,当病害发生时,施虐的病原微生物很可能已具有了抗药性[11],抗生素药物疗法已不再有效。为寻求新型抗生素,需要探索新的抗菌机制或寻找新的抗菌活性物质。本研究旨在通过真菌与水产致病菌共培养,抑菌活性检测和HPLC指纹图谱分析等手段,筛选出在与水产致病菌共培养时能够被诱导产生新的活性物质且抑菌效果较纯培养时显著提高的红树林内生真菌,作为进一步次级代谢产物研究的目标菌株,寻找真菌由于与水产致病菌的生存竞争而产生针对水产致病菌作用的特殊代谢产物,为发现新型抗菌活性物质打下基础。
1 实验部分
1.1 仪器与试剂
仪器:SW-CJ-1FD型超净工作台(上海博迅实业有限公司医疗设备厂);YXQ-LS-100SII型立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);RE-2010型旋转蒸发仪(巩义市予华仪器有限责任公司);Multiskan®GO全波长酶标仪(Thermo Fisher Scientific公司);Waters高校液相色谱仪(沃特世科技(上海)有限公司)。
试剂:甲醇、乙酸乙酯、二氯甲烷(AR,天津市富宇精细化工有限公司);DMSO(CP,广州化学试剂厂);实验所用水均为蒸馏水;PDA培养基(马铃薯浸出粉300 g/L、葡萄糖 20 g/L、琼脂15 g/L,广东环凯微生物科技有限公司);LB肉汤培养基(胰蛋白胨10 g/L、酵母膏粉 5 g/L、氯化钠10 g/L、pH为6.9~7.1,青岛高科园海博生物技术有限公司)。
1.2 实验材料
实验用真菌为本课题组2014 年分离自中国珠海淇澳红树林保护区的红树植物,种属未鉴定。实验用的2株病原细菌为2014年分离自广东冠利海洋生物有限责任公司茂名试验站养殖海水,经分子生物学鉴定为VibrioparahaemolyticusB1(以下简称:B1)和AcinetobacterjohnsoniiB2(以下简称:B2),GenBank 登录号分别为KY077678和KY077679。所有菌种均保存在广州中山大学海洋科学学院海洋生物天然产物研究所。
1.3 实验方法
1.3.1 菌株活化 细菌活化:在超净工作台内,按为1∶10比例将细菌原液接种于LB肉汤培养基中,并于37 ℃恒温摇床震荡培养(150 r/min)18~24 h。
真菌活化:在超净工作台内,用接种针或接种环从冻存管中挑取真菌菌丝,按照三点转接法接种于PDA平板培养基中,并于28 ℃静置培养3~5 d,拍照记录菌株的生长形态。
1.3.2 真菌和细菌纯培养、共培养 真菌纯培养:在超净工作台内,用接种针挑取活化后的真菌菌落外缘菌丝于PDA平板培养基上,28 ℃静置培养3~5 d,观察并拍照记录菌落形态。
细菌纯培养:在超净工作台内,用移液枪取100 μL活化后的细菌液于PDA平板培养基,用涂布棒涂布均匀,37 ℃静置培养3~5 d,观察并拍照记录菌落形态。
真菌/细菌共培养:在超净工作台内,用移液器取100 μL活化后的细菌液于PDA平板培养基,并用涂布棒均匀涂布到平板的各个角落,然后用接种针挑取活化后的真菌菌落外缘菌丝按照三点转接法接种于上述涂布有细菌液的PDA平板中,28 ℃静置培养3~5 d,观察并拍照记录纯培养和共培养的真菌菌落形态有无改变,有无抑菌圈或色素产生,寻找相互作用强烈,形态变化明显的菌株。
1.3.3 次级代谢产物提取 对筛选出的菌株,其纯培养和共培养完成后,将整个含菌培养基放入茶袋中,用甲醇/乙酸乙酯/二氯甲烷(体积比为3∶2∶1)浸泡2~3 d(浸泡没过茶袋),超声萃取菌株的代谢产物并收集浸泡液,将浸泡液用旋转蒸发仪旋干后,用乙酸乙酯萃取2~3次。取上层乙酸乙酯有机相,并用旋蒸仪浓缩蒸干,甲醇复溶后转移至青霉素瓶中,放置于通风橱内挥干得到粗提物,待HPLC指纹图谱分析及抗菌活性检测。
1.3.4 HPLC指纹图谱分析 将粗提物用甲醇溶解并用微孔滤膜(0.22 μm)过滤,配制成3 mg/mL的样品,利用Waters 1525-2998 HPLC进行指纹图谱分析。流动相采用乙腈/水体系(A:15%乙腈+85%水;B:15%水+85%乙腈);梯度洗脱(0~22 min,100%A-100%B;22~27 min,100%B;27~35 min,100%B-100%A);流速1 mL/min;柱温30 ℃;进样量30 μL;检测波长范围为190~700 nm;色谱柱规格为Zorbax SB-C18 (9.4 mm×250 mm, 5 μm)。
1.3.5 抗菌活性检测 采用96孔板法[12]检测纯培养和共培养粗提物分别对B1和B2的抑菌活性。活化B1和B2后,按1∶10比例接种于LB肉汤培养基中,37 ℃恒温摇床震荡培养(150 r/min)12 h,再将菌种悬浮液以1∶100比例接种至LB肉汤培养基,37 ℃恒温摇床震荡培养(150 r/min)3 h,在600 nm波长下读取吸光值A,调整A值至0.5,再用新鲜LB肉汤培养基以1∶100比例稀释,此时菌液浓度约为5×105CFU/mL,适用于药敏实验。将粗提物样品用体积比为1∶4的DMSO水溶液配制成1 mg/mL的母液,分别取50 μL母液转移至96孔板中,再加入150 μL上述细菌悬浮液,37 ℃恒温摇床震荡培养(150 r/min)18 h后在600 nm波长下读取A值。50 μL体积比为1∶4的DMSO水溶液加上150 μL细菌悬浮液的体系作为阴性对照。每个样品设两个平行,A值取平均值。根据公式计算抑菌率:
抑菌率
2 结果分析与讨论
2.1 共培养对真菌菌落形态的影响
为了寻找对水产病原菌有强烈作用的菌株,本研究选取616株红树林内生真菌分别进行纯培养及与水产病原菌B1和B2共培养,根据纯培养和共培养的菌落形态变化和抑菌圈有无及大小等的观察结果,筛选出162株(占总体菌株数量的26.3%)共培养时有显著相互作用的内生真菌作为后续研究的候选菌株。以QA-740为例观察真菌共培养前后的菌落形态差异,从图1可知,QA-740在纯培养时产青绿色孢子,孢子分布较均匀,菌落颜色呈咖啡色;在与B1共培养时,生长较缓慢,菌落直径较小,产淡黄色孢子,菌落颜色呈砖红色;在与B2共培养时,产暗绿色和白色孢子,且菌落边缘被白色孢子包围,菌落颜色呈砖红色,说明真菌/细菌共培养会影响QA-740的生长状态,使其产生不同颜色的孢子,导致菌落颜色和形态发生变化。以QA-741为例观察真菌共培养前后抑菌圈的有无及大小,图2显示,QA-741纯培养时菌落内部凸起,产暗绿色和白色孢子,菌落边缘规则且被白色孢子包围;在与B1共培养时菌落内部凸起且产白色孢子,而菌落边缘产砖红色孢子,无白色孢子包围;在与B2共培养时菌落内部凸起且产白色孢子,菌落边缘产砖红色孢子且被白色孢子包围,并形成直径为17~24mm的抑菌圈,说明QA-741对B2具有抑制作用。
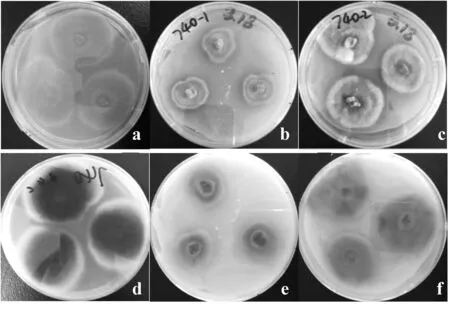
图1 QA-740纯培养和共培养的菌落变化图Fig.1 Colony change maps of QA-740 after pure culture and co-culturea/d:QA-740纯培养正/背面观;b/e:QA-740与B1共培养正/背面观;c/f:QA-740与B2共培养正/背面观
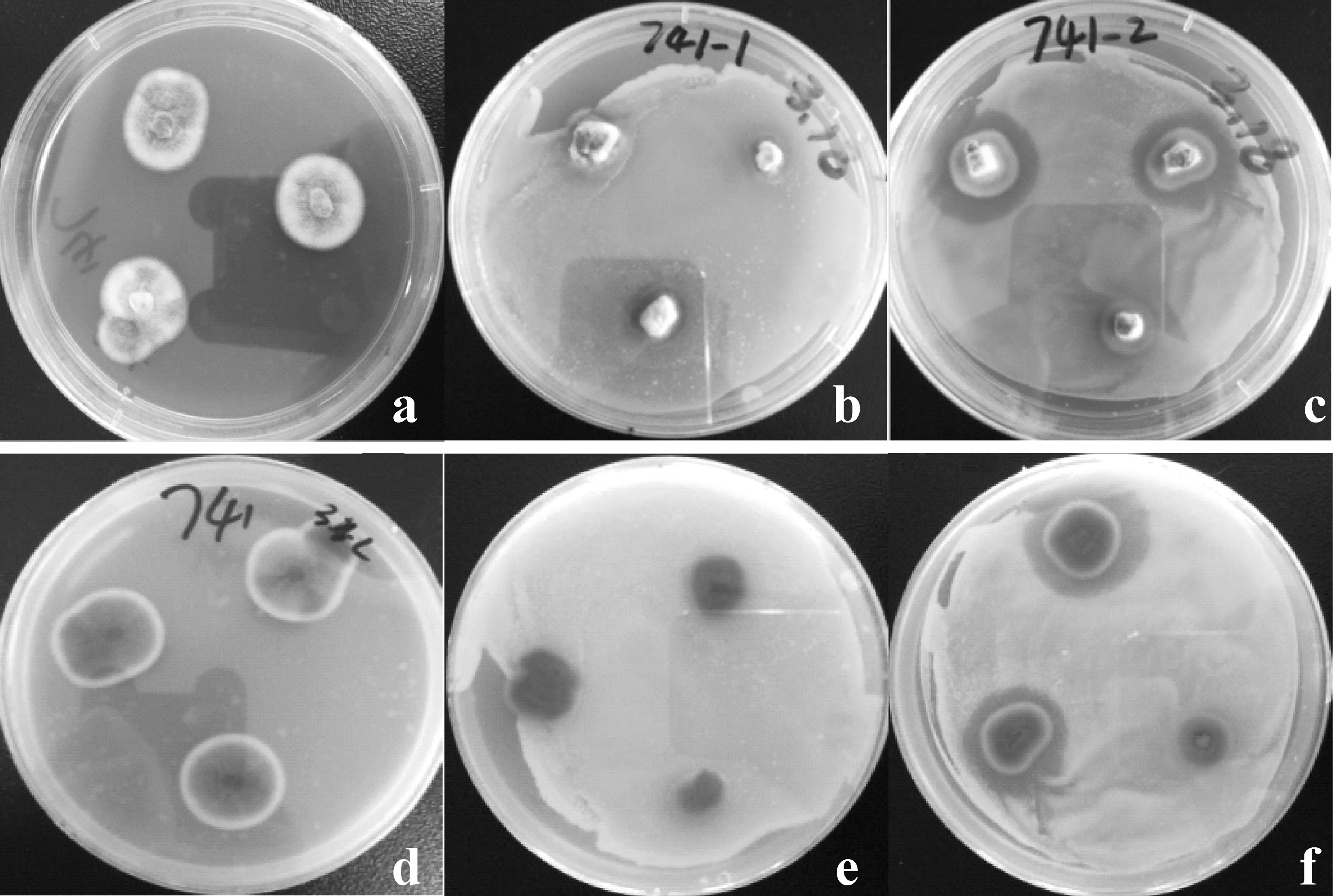
图2 QA-741纯培养和共培养的菌落抑菌圈变化图Fig.2 Changes of bacterial inhibition zone of QA-741 after pure culture and co-culturea/d:QA-741纯培养正/背面观;b/e:QA-741与B1共培养正/背面观;c/f:QA-741与B2共培养正/背面观
2.2 抑菌活性筛选结果与分析
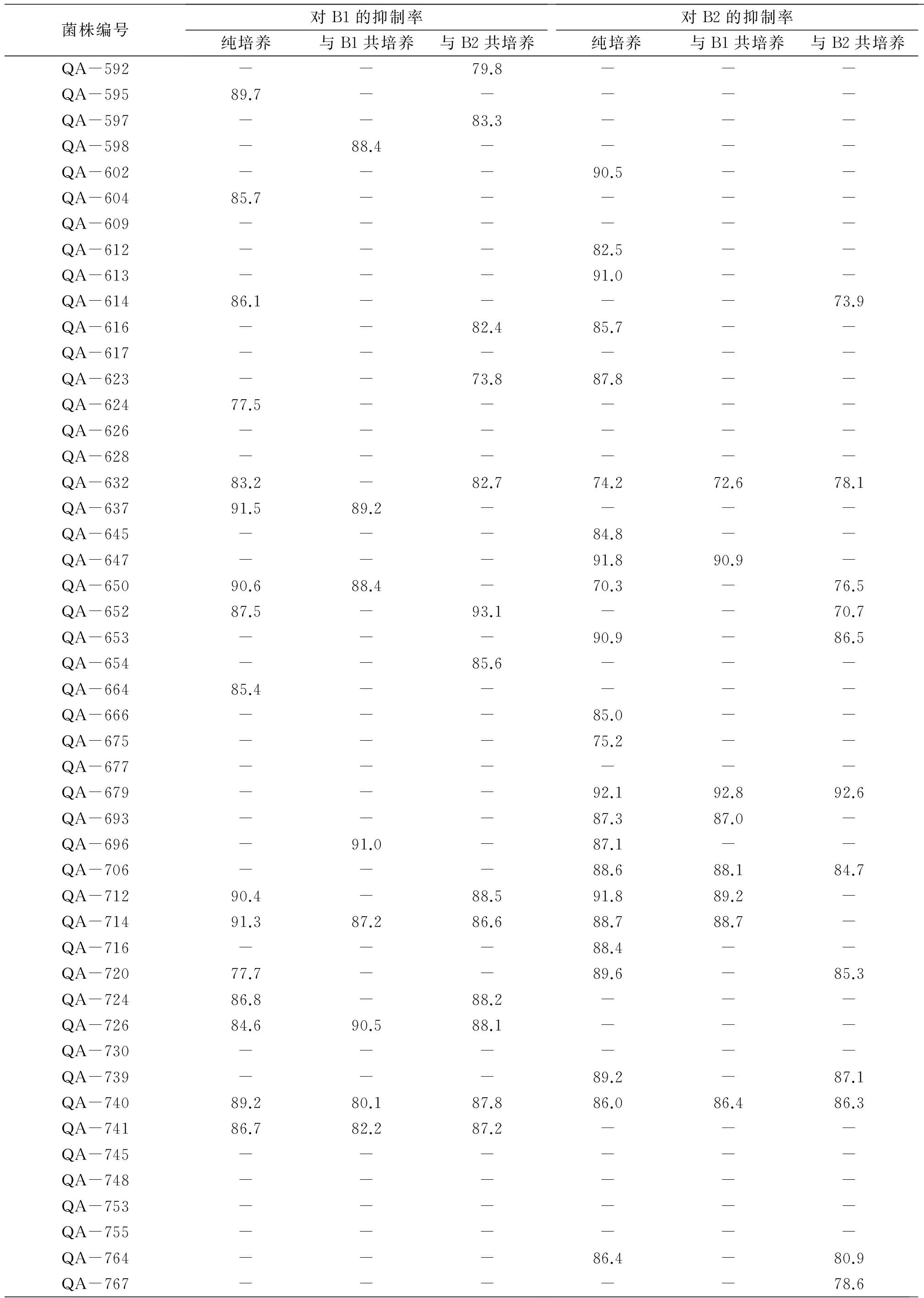
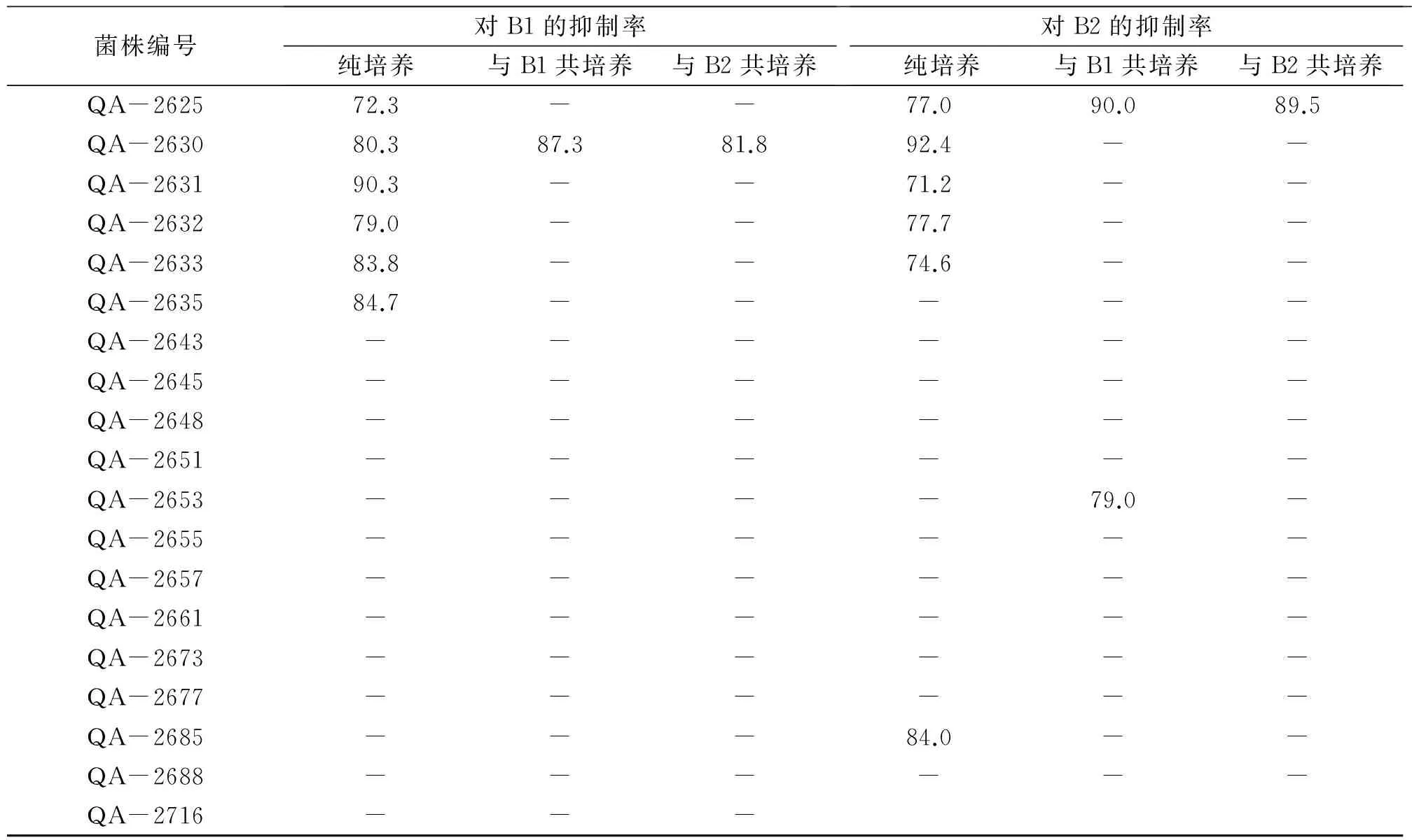
对162株内生真菌的纯培养和共培养进行次级代谢产物的提取,共获得486份粗提物(每株真菌3份粗提物,即纯培养,与B1共培养,与B2共培养各一份)。对上述粗提物样品进行抑菌活性检测,以抑菌率≥70%为有抑菌活性,结果见表1。由表1可知,对B1有抑制作用的粗提物样品有75份,对B2有抑菌活性的粗提物样品有130份,其中,有54份粗提物样品同时对B1和B2有抑制活性,因此,共有151份粗提物样品有抑菌活性。此外,根据表1,在对B1有抑制作用的75份粗提物样品中,纯培养样品有40份(占53.3%),与B1共培养的样品有14份(占18.7%),与B2共培养的样品有21份(占28.0%);在对B2有抑制作用的130份粗提物样品中,纯培养样品有67份(占51.5%),与B1共培养的样品有27份(占20.8%),与B2共培养的样品有36份(占27.7%)。因此,从样品所占比例上看,纯培养样品所占比例较大,且共培养的粗提物样品对B1和B2的抑制作用具有随机性,不存在特异性。
通过对B1有抑菌活性的粗提物样品的分析,共筛选出19株候选菌株,这些真菌为纯培养、与B1共培养和与B2共培养3份粗提物样品同时有抑菌作用,或者纯培养样品无抑菌活性但共培养样品显示出抑菌活性。候选真菌的编号和对应的培养条件见表2。同样地,对B2有抑制作用的粗提物样品进行统计分析,挑选出27株候选内生真菌,其编号及培养条件见表2。在上述对B2有抑制作用的27株候选内生真菌中,有8株在对B1有抑制作用的19株候选菌株中,因此共筛选出38株候选菌株。由表2可知,在这38株候选菌株中,有23株内生真菌在纯培养时无抑菌活性,共培养后显示出对B1或B2的抑菌活性,表明抑菌活性物质为在共培养条件下胁迫产生的,是本研究的重点研究对象,将结合HPLC指纹图谱分析结果进一步筛选。
2.3HPLC指纹图谱筛选结果与分析
根据抑菌活性检测结果,筛选出纯培养粗提物无抑菌效果但共培养粗提物表现出抑菌活性的内生真菌共23株,编号分别为:QA-49、QA-108、QA-115、QA-123、QA-137、QA-153、QA-591、QA-592、QA-597、QA-598、QA-616、QA-623、QA-653、QA-654、QA-696、QA-768、QA-2006、QA-2575、QA-2579、QA-2583、QA-2608、QA-2614和QA-2655。上述内生真菌的粗提物经HPLC分析,得到其指纹图谱,观察比较上述样品在检测波长为254nm时的HPLC色谱图,发现有4株内生真菌的次级代谢产物较为丰富(图3),这些菌株的编号分别为QA-124、QA-598、QA-623和QA-712。
其中,QA-124(图3a)纯培养和共培养样品对B1和B2均有抑制作用,其色谱峰出峰位置基本相同,但共培养样品在11.5min的色谱峰强度比纯培养样品的高。同样地,QA-712(图3b)纯培养和共培养样品对B2均有抑制活性,其色谱峰出峰位置也基本相同,但共培养样品在9, 11, 21和26min的色谱峰强度均明显高于纯培养样品,说明真菌/细菌共培养会改变一些真菌次级代谢产物的产量。QA-598(图3c)与B1共培养的样品对B1有抑制活性,其纯培养和与B2共培养的样品均无抑制作用,而从这些样品的HPLC指纹图谱中可看出,598-1的色谱峰数目明显大于纯培养和598-2的样品,说明598-1的化合物丰富度较高,其粗提物样品检测到的抗菌活性可能来源于QA-598与B1共培养后刺激产生的化合物,表明真菌/细菌共培养可激活某些沉默基因,进而促进真菌产生类型多样的次级代谢产物。QA-623(图3d)纯培养和共培养样品的色谱峰均很丰富,且出峰位置基本一致,但623-2在15.8min的峰强度明显高于纯培养和623-1样品,结合活性检测结果中只有623-2样品对B1有抑制作用,说明次级代谢产物的浓度会影响抑菌活性的结果,具体情况有待进一步的考究和验证。
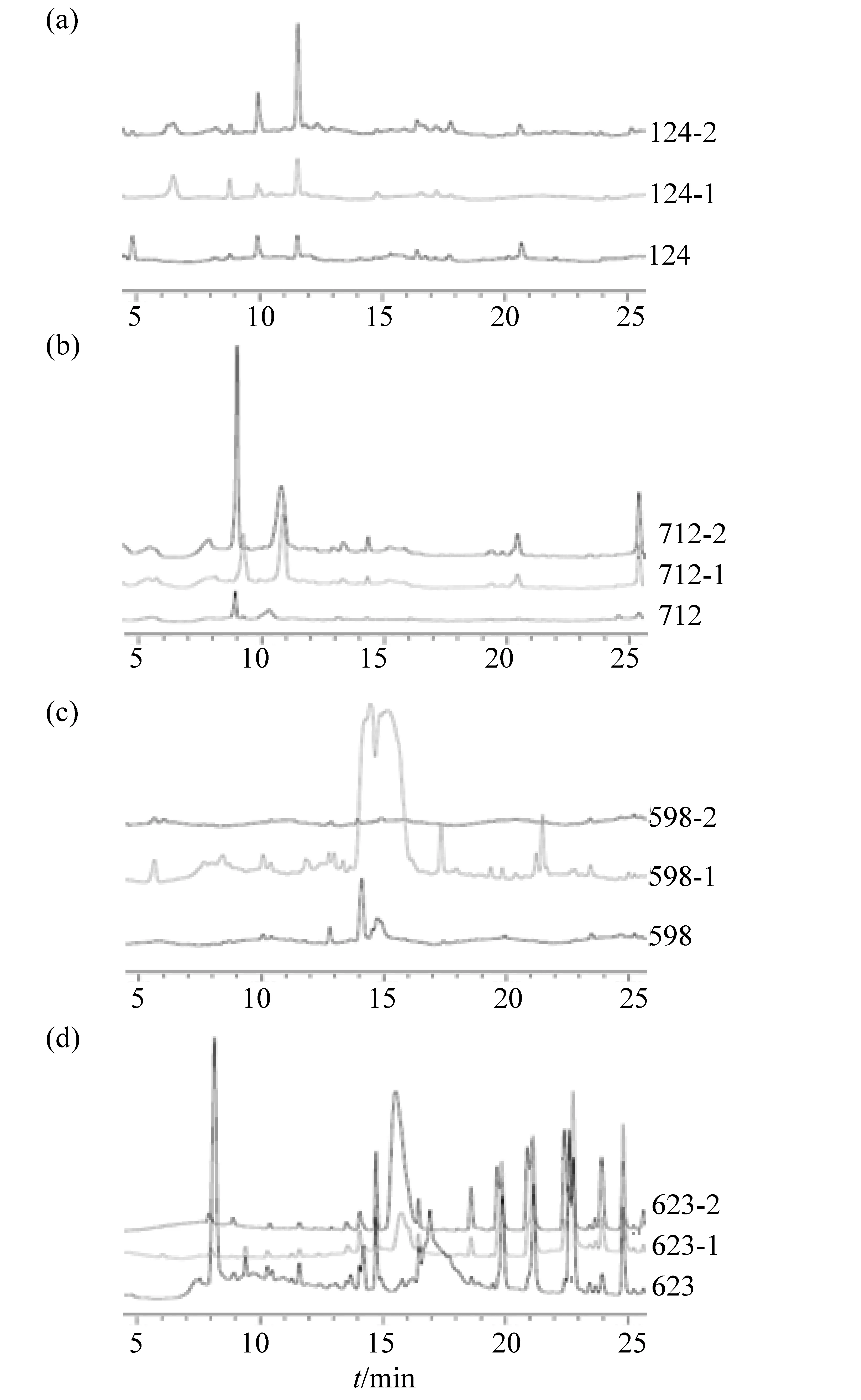
图3 粗提物样品(3 mg/mL)在检测波长为254 nm时的HPLC指纹图谱Fig.3 HPLC fingerprint chromatograms of the crude extracts(3 mg/mL)under the wavelength of 254 nm
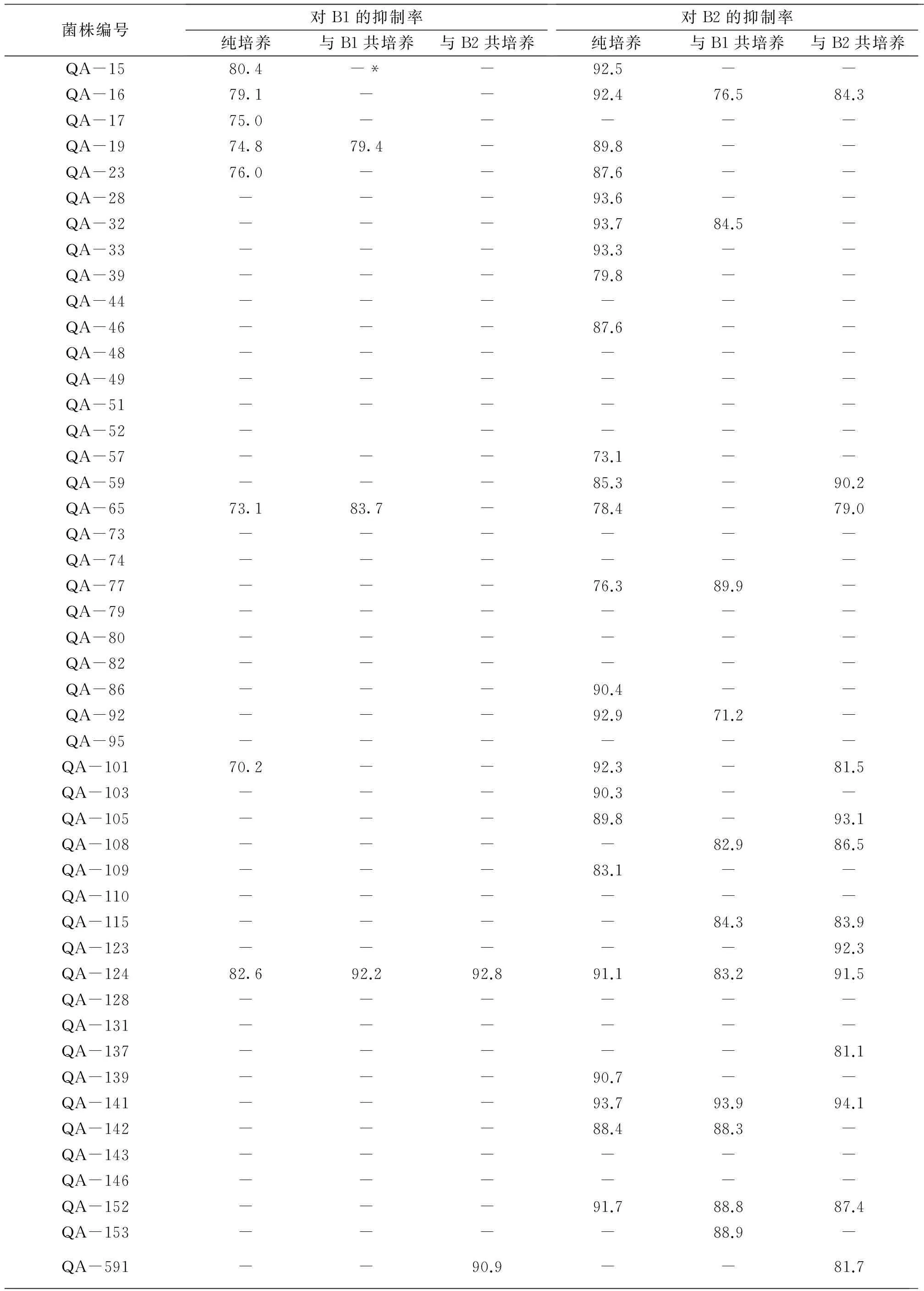
续表1 %

续表1 %
续表1 %
1)“-” 表示抑菌率<70%

表2 候选菌株的编号及培养条件1)Table 2 Numbers and culture conditions of the candidate fungi
1)pure:内生真菌纯培养样品;co-1:内生真菌与B1共培养样品;co-2:内生真菌与B2共培养样品;pure&co-1:内生真菌纯培养和与B1共培养样品;pure&co-2:内生真菌纯培养和与B2共培养样品;co-1&co-2:内生真菌与B1或B2共培养样品;pure&co-1&co-2:内生真菌纯培养和与B1或B2共培养样品
3 结 论
目前真菌代谢产物的研究通常采用纯培养的模式,而自然界的真菌和细菌是共同存在的,为争夺生存空间,互相之间通过化学物质进行斗争,相互间的作用有可能诱导各类活性化合物的产生。本研究的实验结果表明,真菌/细菌共培养可以改变真菌的菌落形态、颜色等特征,可以促进或者抑制真菌的生长,进而提高或者降低真菌次级代谢产物的多样性,也可以提高或者降低真菌次级代谢产物的产量,进而影响其抑菌活性。此外,从比例上看,真菌/细菌共培养前后样品对细菌B1和B2的抑制作用不具有特异性,即有些与B1共培养的粗提物样品对B2有抑制活性,而与B2共培养的粗提物样品可能对B1有抑制作用。因此,真菌/细菌共培养技术在真菌次级代谢产物的相关研究领域有很大的应用前景,在后续工作中有待深入研究。
根据共培养前后真菌菌落形态变化的观察结果,从616株红树林内生真菌中筛选出162株内生菌株,再根据抑菌活性检测结果从中筛选出38株候选菌株,并通过对目标菌株的HPLC指纹图谱的分析筛选出4株次级代谢产物较丰富的目标真菌,编号分别为:QA-124、QA-598、QA-623和QA-712,其中QA-623的HPLC色谱图出峰数目较多,说明其次级代谢产物较为丰富,拟对其进行大规模培养并进一步分离其次级代谢产物,从中寻找针对水产病原菌的新型抑菌活性化合物。
[1] 高剑,李赤,王燕,等. 红树林内生真菌多样性及其应用潜能 [J]. 菌物研究, 2013, 11(3): 212-216.GAOJ,LIC,WANGY,etal.Diversityandapplicationpotentialofendophyticfungiassociatedwithmangroves[J].JournalofFungalResearch, 2013, 11(3): 212-216.
[2]ONNM,LIMP,AAZANIM,etal.Initialscreeningofmangroveendophyticfungiforantimicrobialcompoundsandheavymetalbiosorptionpotential[J].SainsMalaysiana, 2016, 45(7): 1063-1071.
[3] 宋双, 薛艳钰, 陆勇军, 等. 南海红树林内生真菌Fusariumsolani387# 次级代谢产物研究 [J]. 中山大学学报(自然科学版), 2015, 54(5): 67-71. SONG S, XUE Y Y, LU Y J, et al. The secondary metabolites of the mangrove endophytic fungusFusariumsolani387# [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2015, 54(5):67-71.
[4] MA Y H, LI J, HUANG M X, et al. Six new polyketide decalin compounds from mangrove endophytic fungusPenicilliumaurantiogriseum328# [J]. Marine Drugs, 2015, 13(10): 6306-6318.
[5] PETTIT R K. Mixed fermentation for natural product drug discovery [J]. Applied Microbiology and Biotechnology, 2009, 83: 19-25.
[6] RUTLEDGE P J, CHALIS G L. Discovery of microbial natural products by activation of silent biosynthetic gene clusters [J]. Nature Reviews Microbiology, 2015, 13(8): 509-523.
[7] PATHAK R, KUMAR R, GAUTAM H K. Cross-species induction and enhancement of antimicrobial properties in response to gamma irradiation inExiguobacteriumsp. HKG 126 [J]. Indian Journal of Microbiology, 2013, 53 (2): 130-136.
[8] ADNANI N, VAZQUEZ-RIVERA E, ADIBHATLA S N, et al. Investigation of interspecies interactions within marine micromonosporaceae using an improved co-culture approach [J]. Marine Drugs, 2015, 13: 6082-6098.
[9] DUSANE D H, MATKAR P, VENUGOPALAN V P, et al. Cross-species induction of antimicrobial compounds, biosurfactants and quorum-sensing inhibitors in tropical marine epibiotic bacteria by pathogens and biofouling microorganisms [J]. Current Microbiology, 2011, 62 (3): 974-980.
[10] 黄志坚,陈勇贵,翁少萍,等. 多种细菌与凡纳滨对虾肝胰腺坏死症(HPNS)爆发有关 [J]. 中山大学学报(自然科学版), 2016, 55(1): 1-11. HUANG Z J, CHEN Y G, WENG S P, et al. Multiple bacteria species were involved in hepatopancreas necrosis syndrome ( HPNS) ofLitopenaeusvannamei[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(1): 1-11.
[11] FLEGEL T W. Historic emergence, impact and current status of shrimp pathogens in Asia [J]. Journal of Invertebrate Pathology, 2012, 110(2): 166-173.
[12] SELIN C, STIETZ M S, BLANCHARD J E, et al. A pipeline for screening small molecules with growth inhibitory activity againstBurkholderiacenocepacia[J]. PLoS One, 2015, 10(6): e0128587.
Screening of antibacterial strains from mangrove endophytic fungi based on bacterial/fungal interactions
ZHANGLiuhong,LIYanran,LIYunlong,NINGJiaying,ZHOUYaohang,XIONGZhiyao,LIJiaxin,WANGYuru,HUANGZhijian,LIULan
(School of Marine Sciences, Sun Yat-sen University, Guangzhou 510006, China)
In order to screen out mangrove endophytic fungal strains with antibacterial activity and abundant secondary metabolites, two strains of aquatic pathogenic bacteria named asVibrioparahaemolyticusB1 andAcinetobacterjohnsoniiB2 were co-cultured with 616 strains of mangrove endophytic fungi, which were collected from Guangdong Zhuahai Qiao-Dangan island nature reserve in 2014, respectively. And then some of the endophytic fungi with obvious changes in the morphology of the colonies or produce inhibition zones after co-culture were investigated. The crude extracts of pure cultures and co-cultures were analyzed by HPLC fingerprints to find out some fungal strains that could induce new secondary metabolites and increase antibacterial effect in co-culture conditions. In addition, their antibacterial activity againstV.parahaemolyticusB1 andA.johnsoniiB2 were evaluated. It is a new strategy for these strains to produce novel antibacterial compounds.
mangrove endophytic fungi; antibacterial activity; HPLC fingerprint; secondary metabolites
2016-11-18 基金项目: 国家自然科学基金(21272286);海洋公益性行业科研专项经费(201305017);海洋生物天然产物化合物库基金(GD2012-D02-001);中山大学2015年大学生创新训练和创业训练计划项目(教务[2015]105号)
张柳红(1991年生),女;研究方向:天然产物化学;E-mail:zhanglhn@mail2.sysu.edu.cn
黄志坚(1970年生),男;研究方向:海洋微生物;E-mail:lsshzhj@mail.sysu.edu.cn; 刘岚(1971年生),女;研究方向:天然产物化学;E-mail:cesllan@mail.sysu.edu.cn
10.13471/j.cnki.acta.snus.2017.02.016
Q93-3
A
0529-6579(2017)02-0093-09
