黄腐酸高产菌株的培养条件优化研究
2017-06-09邱宏端
谢 航,邱宏端,林 娟,赵 莹
(福州大学生物科学与工程学院,福建 福州 350116)
黄腐酸高产菌株的培养条件优化研究
谢 航,邱宏端,林 娟,赵 莹
(福州大学生物科学与工程学院,福建 福州 350116)
对发酵蔗渣产黄腐酸(FA)的高产菌株-枯草芽孢杆菌的培养基配方及培养条件进行优化研究. 获得的优化培养基配方为: 可溶性淀粉、 蛋白胨、 磷酸氢二钾和硫酸镁的添加量分别为12.50、 12.50、 0.25、 0.50 g·L-1;优化的培养条件为: pH 7.0、 温度37 ℃、 装液量20 mL/250 mL、 转速 130 r·min-1、 接种量5%(体积分数). 在该优化的培养基及培养条件下,枯草芽孢杆菌培养12 h后的细胞生物量达2.280×109cfu·mL-1,较优化前提高了77.9倍. 采用优化前后的条件培养菌种进行发酵产黄腐酸实验,结果优化后的发酵产品中FA含量为26.36%(质量分数),细胞生物量为1.09×109cfu·g-1,比优化前分别提高了13.9%和2.3倍.
黄腐酸; 枯草芽孢杆菌; 培养条件优化
0 引言
腐植酸(humic acid,HA)广泛存在于土壤、 褐煤、 泥炭、 湖泊、 河流、 海洋和沼泽中[1],是有机物质在微生物参与下经过复杂的化学、 生物分解等一系列反应后的一类富含多种官能团的天然大分子有机弱酸. 而黄腐酸(fulvic acid,FA)是HA中分子质量最小、 溶解度最高、 生物活性最强且吸收效果最佳的部分,含有羟基、 氨基等基团,具有一定的阳离子交换、 络合、 螯合以及吸附能力[2],广泛应用于农林牧、 医药卫生、 环保、 石油、 化工、 建材等领域[3-5].
目前,黄腐酸的生产一方面可以从泥炭和风化煤中提取,另一方面也可以利用生物技术的方法以农林下脚料如作物秸秆、 木屑、 蔗渣等为原料生产,即生物腐植酸(biotechnology humicacid,BHA). BHA开拓了将废弃物转化为极有价值的新资源和农业资源综合利用的新路[6]. 现有的生物腐植酸发酵主要为人工堆建发酵法,其中有许多物料与环境中的微生物参与代谢,存在腐植酸产量较低、 产品质量不稳定等不足[7-8]. 为了更好地筛选到发酵蔗渣高产FA的菌株,实验室前期以漳州市诏安绿洲生化有限公司自主研制的生物腐植酸样品为基础,分离筛选出了能有效提升FA含量的黄腐酸高产菌株-枯草芽孢杆菌[9]. 本研究对发酵蔗渣高产FA的枯草芽孢杆菌进行培养基配方与培养条件的优化,旨在提高其细胞生物量,从而为后续枯草芽孢杆菌更好地应用于发酵蔗渣生产黄腐酸奠定良好基础.
1 材料与方法
1.1 菌种
枯草芽孢杆菌(Bacillussubtilis)为实验室选育保藏菌种.
1.2 培养基
1) 牛肉膏蛋白胨培养基[10].
2) 工厂发酵培养基. 蔗渣: 麸皮为1∶1,并添加少量淀粉等成分. 配料时将所有原料加水混合均匀,物料水分控制以手捏混合料能成块,指尖有水渗出但不滴落为宜.
1.3 主要仪器设备
生化培养箱(SHP-250型, 上海精宏实验设备有限公司) ; 超净工作台(SW-CJ-2FD型,上海博迅实业有限公司医疗设备厂); 手提式高压蒸汽灭菌锅(YXQ-LS18SI型,上海博迅实业有限公司医疗设备厂); 可见分光光度计(V-1200型,上海美谱达仪器有限公司); 气浴式恒温摇床(THZ-82型,常州国华电器有限公司) ; pH计(PHS-3C型,上海精密科学仪器有限公司)
1.4 实验方法
1.4.1 枯草芽孢杆菌生长曲线测定
配制牛肉膏蛋白胨液体培养基,分装于试管(5 mL)和三角瓶(100 mL/250 mL)中(装液量下同). 先将枯草芽孢杆菌斜面菌种接种于试管液体培养基中,37 ℃下静置培养24 h,后以5%(体积分数,以下同)接种量接种到三角瓶培养基中,置于37 ℃、 200 r·min-1下培养,分别采用分光光度法(OD600nm)和平板菌落计数法跟踪测定细胞生物量的变化情况(单位为cfu·mL-1: 菌落数/mL),获得枯草芽孢杆菌的生长曲线,从而为后续优化菌种试验掌握其培养时间奠定依据.
1.4.2 培养基成分的优化
1.4.2.1 碳源对菌种细胞生物量的影响
以液体牛肉膏蛋白胨培养基为基础,选择葡萄糖等9种碳源,分别配制成含10 g·L-1单一碳源的培养基,后将菌液按照5%接种量接入并置于37 ℃、 200 r·min-1下培养12 h(培养条件下同). 试验以OD600增长量(即菌种培养后OD600值与菌种初始OD600值之差)为指标[11],确定最佳碳源种类. 后用优化的碳源种类,探讨不同添加量(2.5~17.5 g·L-1)对菌种生长的影响,从而确定最佳的碳源添加量.
1.4.2.2 氮源对菌种细胞生物量的影响
在碳源优化的基础上,分别以10 g·L-1的蛋白胨、 硝酸铵、 硫酸铵、 尿素、 氯化铵作为氮源配制培养基,以OD600增长量为指标,确定最佳氮源种类. 后用优化的的氮源种类,探讨不同添加量(2.5~17.5 g·L-1)对菌种生长的影响,从而确定最佳的氮源添加量.
1.4.2.3 无机盐对菌种细胞生物量的影响
在碳源和氮源优化的基础上,选择钼酸钠等10种无机盐,分别配制成含5 g·L-1的无机盐培养基,以OD600增长量为指标,确定最佳无机盐种类. 后采用L27(313)正交试验设计法[12],探讨不同种类的无机盐配比及其交互作用对菌体细胞生长量的影响,从而确定作用比较明显的无机盐的添加量.
1.4.3 培养条件的优化
1.4.3.1 培养基初始pH值对菌种细胞生物量的影响
以优化的培养基配方为基础,调节培养基初始pH值范围 4.0~10.0,再将菌液以5%接种量接种到培养基中,置于37 ℃、 200 r·min-1下培养12 h,以OD600增长量为指标,确定培养基的最佳初始pH值.
1.4.3.2 温度对菌种细胞生物量的影响
以优化的培养基配方为基础,将枯草芽孢杆菌以5%接种量接种到培养基中,分别置于30、 37、 45、 50 ℃,200 r·min-1下培养. 实验过程每3 h取样跟踪测定其OD600的变化,从而确定最佳培养温度.
1.4.3.3 溶氧对菌种细胞生物量的影响
1) 转速. 将枯草芽孢杆菌以5%接种量接种到已优化培养基成分的液体培养基中,置于37 ℃,分别在50~300 r·min-1的转速下培养12 h,以OD600增长量为指标确定最佳转速.
2) 装液量. 分别设定培养基的初始装液量为20~140 mL/250 mL,将枯草芽孢杆菌以5%接种量接种至不同装液量的锥形瓶中,置于37 ℃、 200 r·min-1下培养12 h,以OD600增长量为指标确定最佳装液量.
1.4.3.4 培养条件正交试验
采用正交试验设计法考察温度、 转速、 装液量、 培养基初始pH值对菌种生长的影响. 按照L27(313)正交试验表设定相应培养条件后,将枯草芽孢杆菌以5%接种量接种培养12 h,试验以OD600增长量为指标确定最佳培养条件.
1.4.3.5 接种量对菌种细胞生物量的影响
在培养基成分和培养条件优化的基础上,将活化好的菌液分别以1%~20%(体积分数)的接种量接种至液体培养基中,跟踪测定OD600的变化情况,探讨不同接种量对菌种细胞生物量的影响. 后在培养基和培养条件不变的情况下,采用优化的接种量接种,利用平板菌落计数法确定枯草芽孢杆菌在最佳培养条件下的细胞生物量.
1.5 高细胞生物量菌种应用发酵产黄腐酸实验
分别将优化前后培养的两批枯草芽孢杆菌接种于工厂发酵培养基中,发酵物料每袋装料量30 kg,各4袋堆置于发酵池的上层进行发酵. 同时以工厂原始发酵模式为对照,测定发酵结束后实验组和对照组FA含量,以及细菌细胞生物量的差异.
2 结果与分析
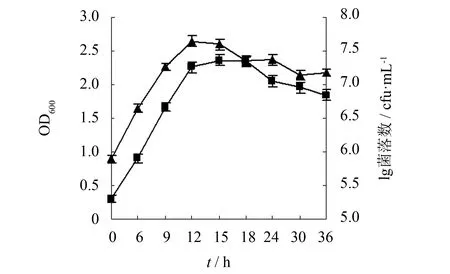
图1 枯草芽孢杆菌的生长曲线Fig.1 Growth curve of Bacillus subtilis
2.1 枯草芽孢杆菌生长曲线的测定
为了解枯草芽孢杆菌在牛肉膏蛋白胨培养基中的生长状况,实验过程每隔3 h利用分光光度法和平板菌落计数法跟踪测定细胞生物量的变化情况,并绘制菌种生长曲线(见图1). 由生长曲线可知,菌种培养12 h后进入稳定期,此时细胞生物量OD600为2.26,平板菌落计数达2.927×107cfu·mL-1. 实验表明,后续考察菌种的细胞生物量以培养12 h为较适合时期.
2.2 培养基的优化
2.2.1 碳源对菌种细胞生物量的影响
碳源不仅能为生物的生长提供必要的碳元素和能量,而且是微生物合成代谢产物所必需的重要组成部分. 以牛肉膏蛋白胨培养基作为对照配方,选择9种不同碳源进行筛选,结果见图2. 由图2可见,菌种以可溶性淀粉和牛肉膏作为碳源时,细胞OD600增长量最大(分别为0.565和0.586). 虽然牛肉膏作为碳源时细胞生长量略高于可溶性淀粉,但考虑后续工厂化培养菌体节约培养基成本且实现培养基煮沸的应用培养模式,因此最终确定采用可溶性淀粉作为菌种培养的最优碳源. 为此,试验进一步对可溶性淀粉的添加量进行优化,结果见图3. 由图3可见,随着可溶性淀粉添加量的增加,细胞生物量也不断提高,当可溶性淀粉添加量为12.5 g·L-1时,OD600增长量达到最高(为0.713); 而后继续增加可溶性淀粉的添加量,OD600增长量却出现缓慢下降. 实验表明,可溶性淀粉的最适添加量为12.5 g·L-1.
注: 以下图中小写字母表示P0.05,大写字母表示P0.01.
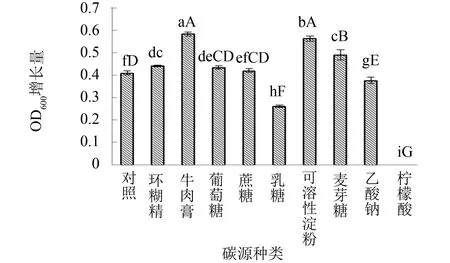
图2 不同碳源对枯草芽孢杆菌生长的影响Fig.2 Effect of different carbon sources on Bacillus subtilis注: 图2~3以菌悬液稀释5倍后的OD600增长量为纵坐标
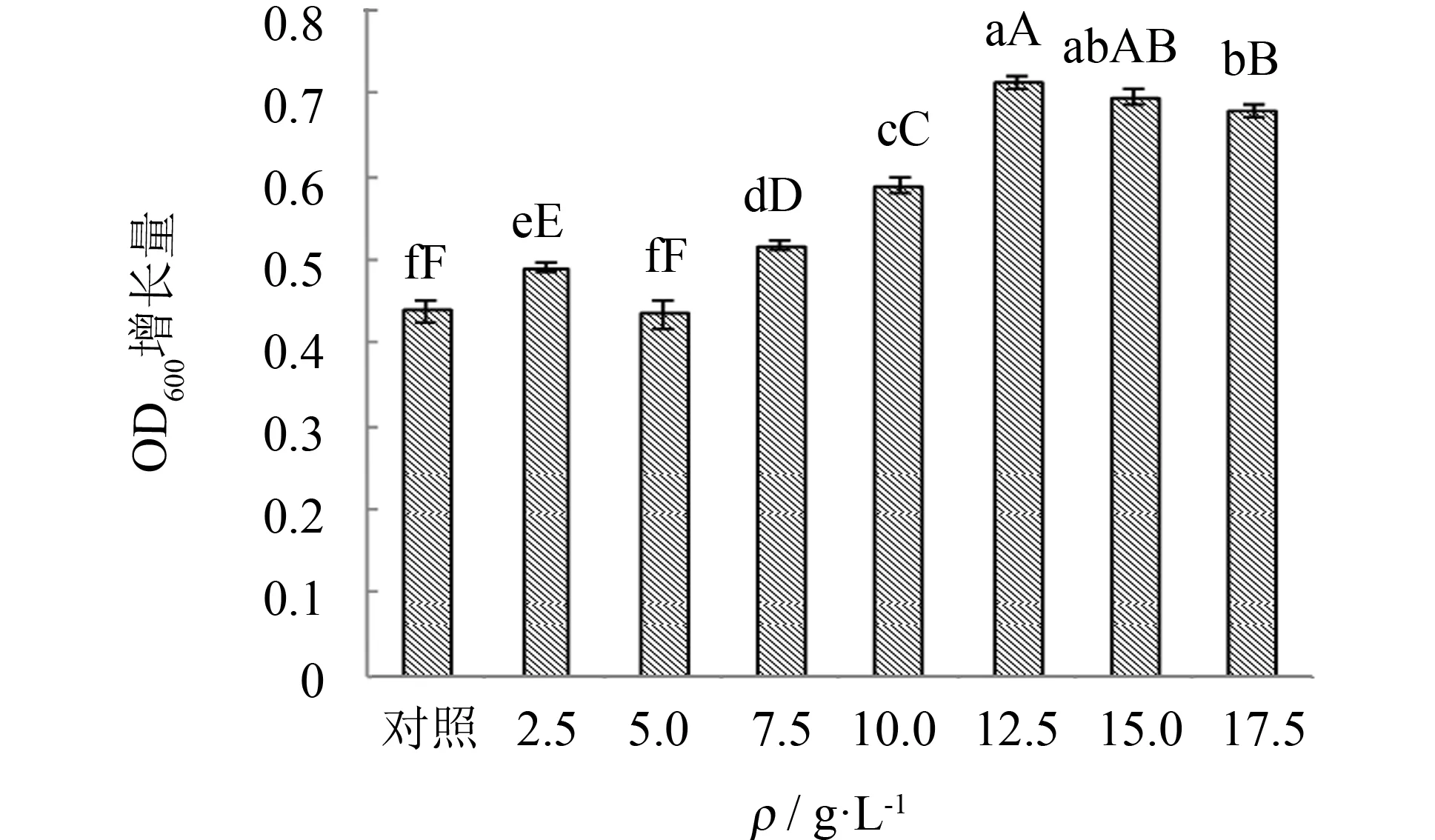
图3 可溶性淀粉添加量对枯草芽孢杆菌生长的影响Fig.3 Effect of addition of soluble starch on Bacillus subtilis
2.2.2 氮源对菌种细胞生物量的影响
氮源是微生物生长的重要元素,可构成细胞质内的蛋白质、 含氮物质以及代谢产物等. 在牛肉膏蛋白胨培养基中,牛肉膏与蛋白胨是有机氮源,营养成分丰富,但成本较高. 为此,实验考察4种无机氮源对菌种生长的适应情况,结果见图4. 由图4可见,添加无机氮作为培养基氮源时菌种基本不生长,而对照组以蛋白胨作为氮源时,菌种的OD600增长量最大,表明菌种的最佳氮源种类是蛋白胨. 实验继续对蛋白胨的添加量进行优化,结果见图5. 由图5可见,随着蛋白胨添加量的增加,其OD600增长量不断提高,当添加量为12.5 g·L-1时,OD600增长量显著,当添加量为15.0 g·L-1时,OD600增长量减缓,之后随着蛋白胨添加量的继续增加,OD600增长量出现缓慢下降. 实验表明,培养基中蛋白胨适合的添加量为12.5~15.0 g·L-1,但考虑成本因素,最后选择添加量12.5 g·L-1为宜.
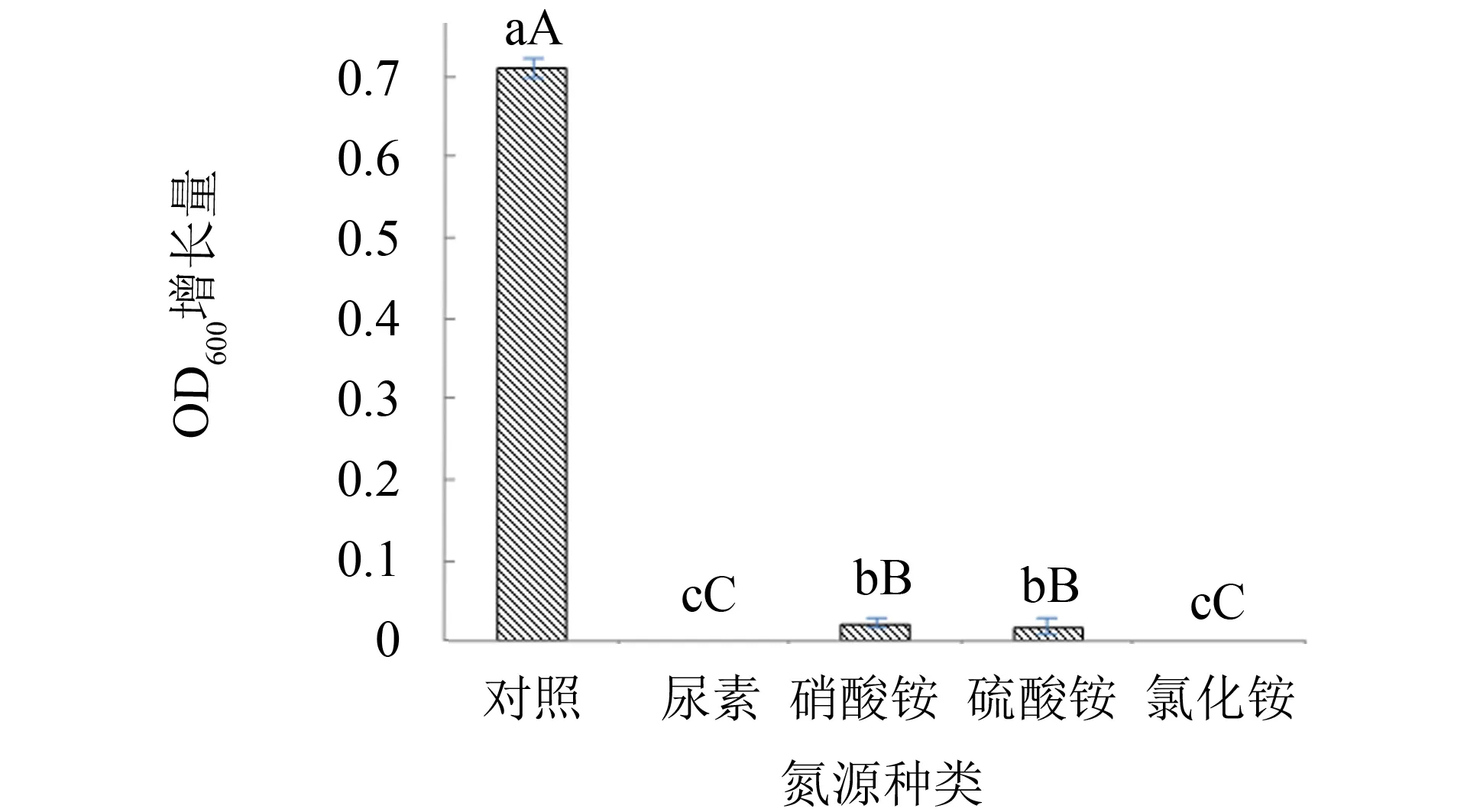
图4 不同氮源对枯草芽孢杆菌生长的影响Fig.4 Effect of different nitrogen sources on Bacillus subtilis注: 图4~5以菌悬液稀释5倍后的OD600增长量为纵坐标
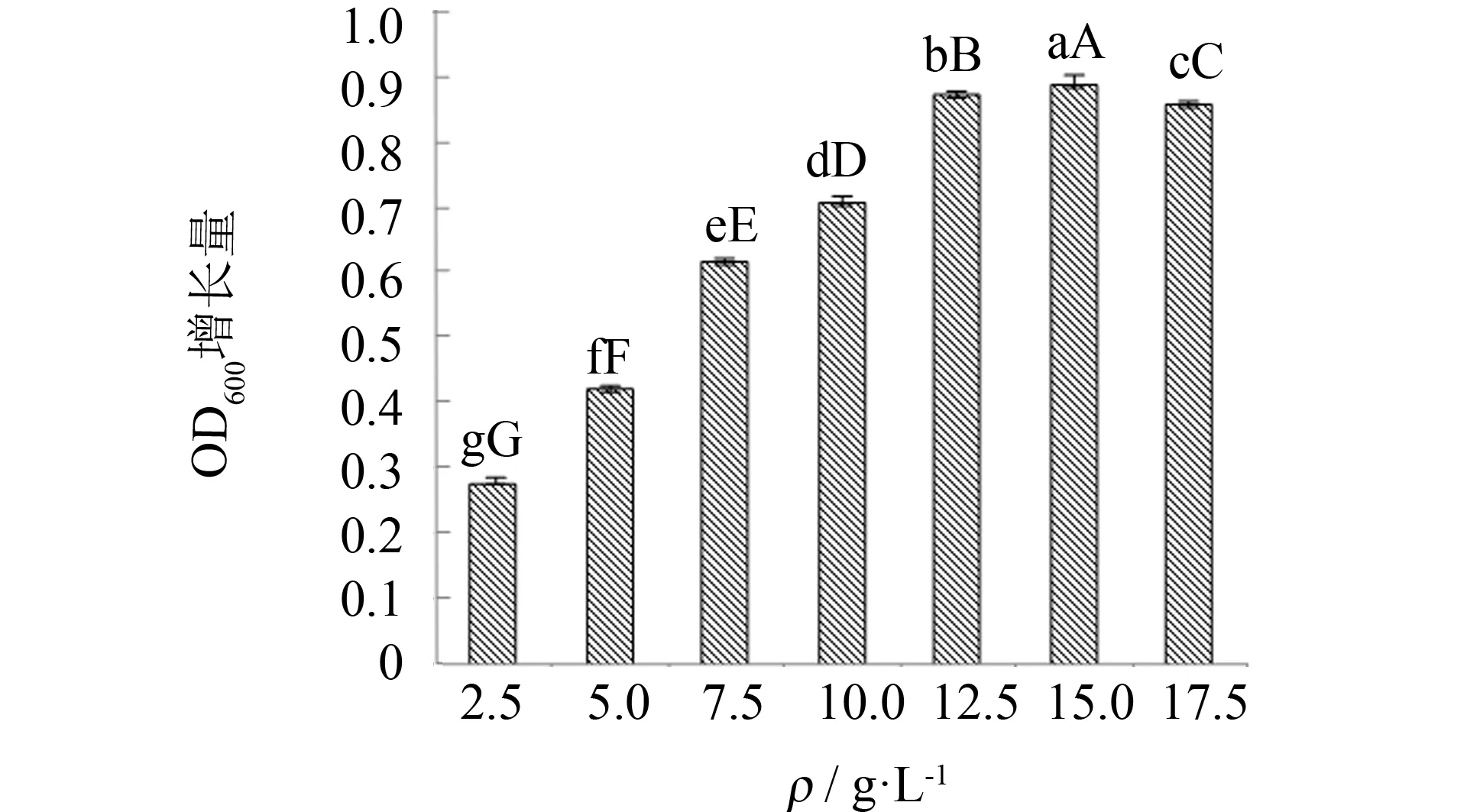
图5 蛋白胨添加量对枯草芽孢杆菌生长的影响Fig.5 Effect of addition of peptone on Bacillus subtilis
2.2.3 无机盐对菌种细胞生物量的影响
2.2.3.1 无机盐种类
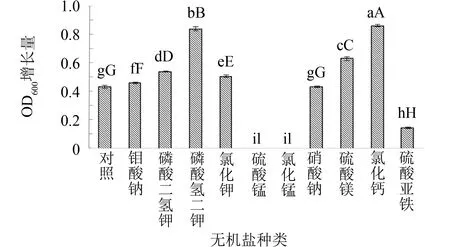
图6 不同无机盐种类对枯草芽孢杆菌生长的影响Fig.6 Effect of different inorganic salts on Bacillus subtilis注: 本图以菌悬液稀释10倍后的OD600增长量为纵坐标
在牛肉膏蛋白胨培养基中,明确的无机盐成分只有氯化钠一种. 而无机盐作为微生物生长所不可缺少的营养物质,对构成细胞的组成成分、 维持酶的活性、 调节细胞渗透压等方面具有重要作用. 实验继续探讨多种无机盐对菌种生长的影响, 结果见图6. 由图6可见,当培养基中分别添加氯化钙、 磷酸氢二钾、 硫酸镁作为无机盐时,菌种OD600增长量较大,分别为0.865、 0.842、 0.634,说明这些无机盐的添加对菌种生长较有利. 因此,后续继续考察氯化钙、 磷酸氢二钾和硫酸镁的最佳添加量,以及它们之间的交互作用.
2.2.3.2 无机盐添加量
实验以氯化钠、 磷酸氢二钾、 氯化钙、 硫酸镁为考察因素,设计正交试验L27(313)进行无机盐及配比优化试验,并考虑磷酸氢二钾与其余3因素的交互作用. 正交试验因素水平表分别选择氯化钠(因素A)的3水平为(0%、 0.25%、 0.50%); 磷酸氢二钾(因素B)的3水平为(0%、 0.025%、 0.050%); 氯化钙(因素C)的3水平为(0%、 0.05%、 0.10%); 硫酸镁(因素D)的3水平为(0%、 0.05%、 0.10%). 由试验的方差分析结果(见表1)可以看出,影响枯草芽孢杆菌生长的主次顺序为D>B> B×D>A>C> B×C> A×B. 其中,磷酸氢二钾(B)和硫酸镁(D)对于菌体生长具有显著性影响,而氯化钠(A)和氯化钙(C)对于菌体生长不具有显著性影响,且在其他无机盐存在下添加氯化钠菌体生长欠佳,而氯化钙对于菌体生长影响最小. 通过试验数据可以看出,最优条件组合为A1B2C1D2,即当磷酸氢二钾、 硫酸镁的添加量分别为0.25、 0.50g·L-1时菌体生长最好,说明二者对于菌体生长具有促进作用.
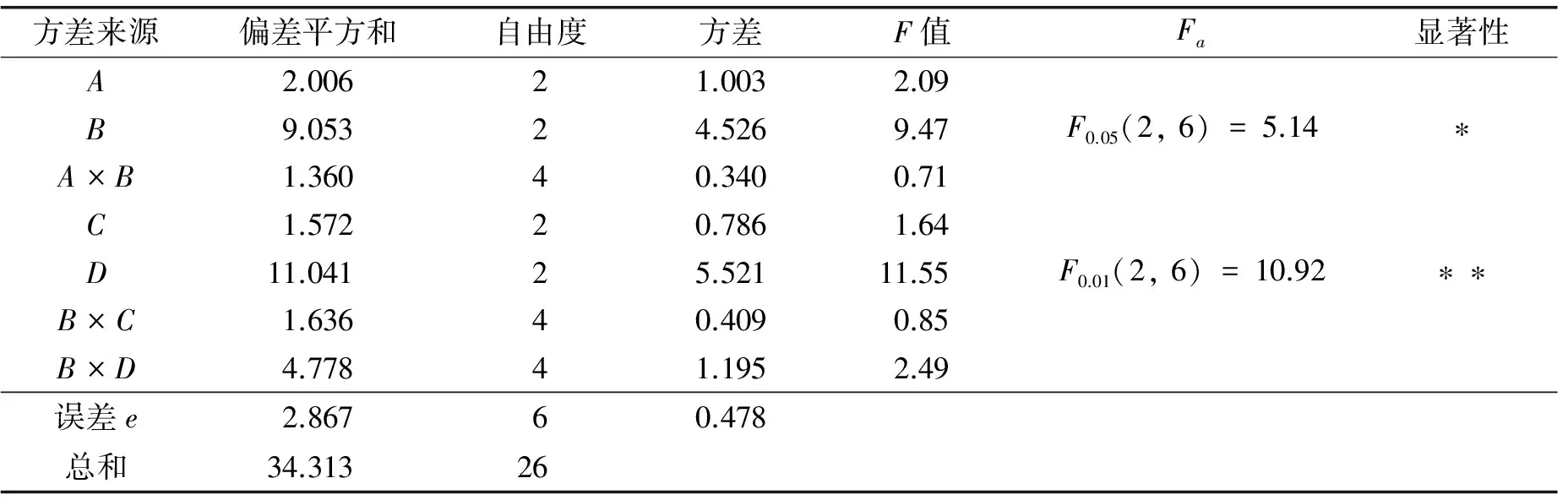
表1 无机盐添加量正交实验综合方差分析
2.3 培养条件的优化
2.3.1 培养基初始pH值对菌种细胞生物量的影响
培养基pH值对菌体生长与代谢具有重要影响[13-14],实验考察不同pH值对菌种生长的影响,结果见图7. 由图7可见,当pH值维持在5.0~8.0之间时,菌体均生长旺盛; 其中培养基在初始pH值7.0时,菌种生长最好,OD600增长量最大(为0.752); 而过酸、 过碱均不利于菌种的生长. 因此,确定菌种生长的培养基初始pH值为7.0.
2.3.2 温度对菌种细胞生物量的影响
温度是影响微生物生长速率的极其重要因素. 实验考察不同温度对菌种生长的影响,结果见图8. 由图8可见,在一定温度范围内,随着温度的升高,培养液中的菌浓度逐渐增加,其中,温度为45 ℃时,菌种的细胞浓度达到最大值(为0.663). 而温度高于45 ℃时,菌种生长速率却出现下降. 因此,可以确定菌种的最适生长温度为45 ℃.
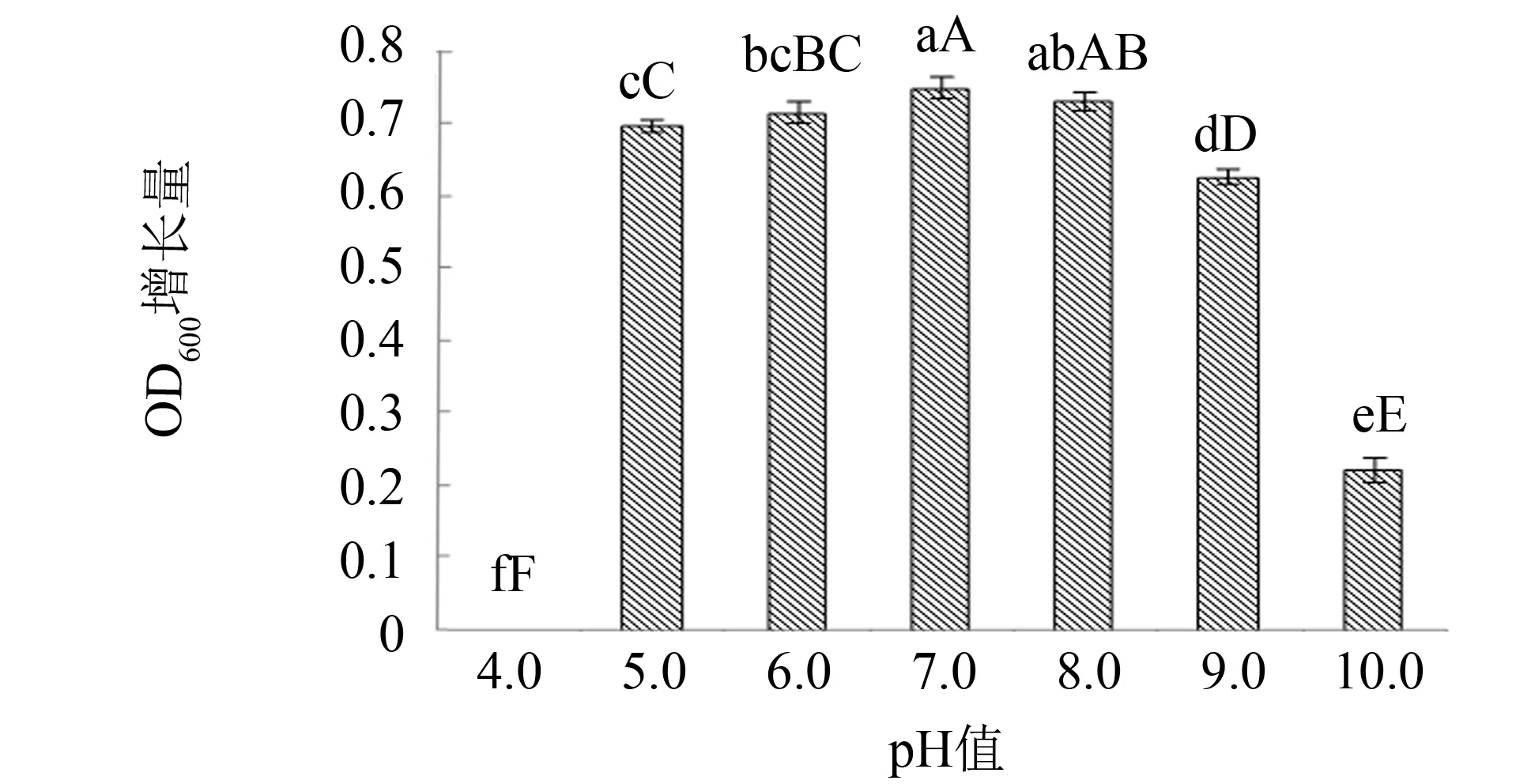
图7 培养基初始pH对枯草芽孢杆菌生长的影响Fig.7 Effect of initial pH of medium on Bacillus subtilis注: 本图以菌悬液稀释10倍后的OD600增长量为纵坐标
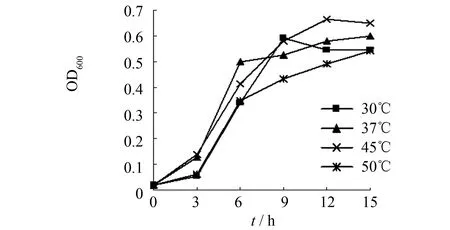
图8 培养温度对枯草芽孢杆菌生长的影响Fig.8 Effect of culture temperature on Bacillus subtilis注: 本图以菌悬液稀释10倍后的OD600为纵坐标
2.3.3 溶氧对菌种细胞生物量的影响
2.3.3.1 转速
溶氧对于细胞生长和产物的积累有较大的影响,而细菌培养时的摇床转速和锥形瓶的装液量均是影响溶氧的重要参数,因此考查转速和装液量对细胞生长的影响,结果见图9. 由图9可见,转速较低时,菌体OD600增长量很低,而后随着转速的增加,菌体OD600增长量急剧上升,当转速上升至170 r·min-1时OD600增长量最大(为0.772),而当转速继续提高时,菌体OD600增长量便不再增加,而是维持在与170 r·min-1转速下相当的水平. 这说明170 r·min-1为菌种培养的最佳转速.
2.3.3.2 培养基装液量
培养基装液量也是考察好氧微生物对氧气需求情况的另一个指标,如培养基装液量少,说明培养通气量大,反之说明菌种通气量小. 实验考察三角瓶的不同装液量对菌种培养的影响,结果见图10. 由图10可见,随着装液量的增加,菌种的OD600增长量逐渐下降,但当装液量≥80 mL/250 mL时,菌种的OD600增长量差异不大. 而初始装液量为20ml/250mL,菌种的OD600增长量最大(为0.907),因此,选择20 mL/250 mL作为菌种培养的初始装液量.
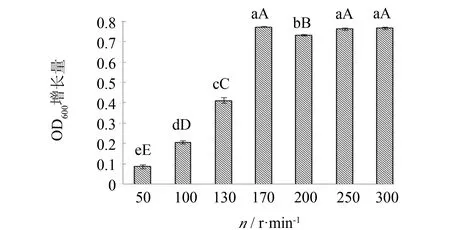
图9 转速对枯草芽孢杆菌生长的影响Fig.9 Effect of rotational speed on Bacillus subtilis注: 图9~10以菌悬液稀释10倍后的OD600增长量为纵坐标
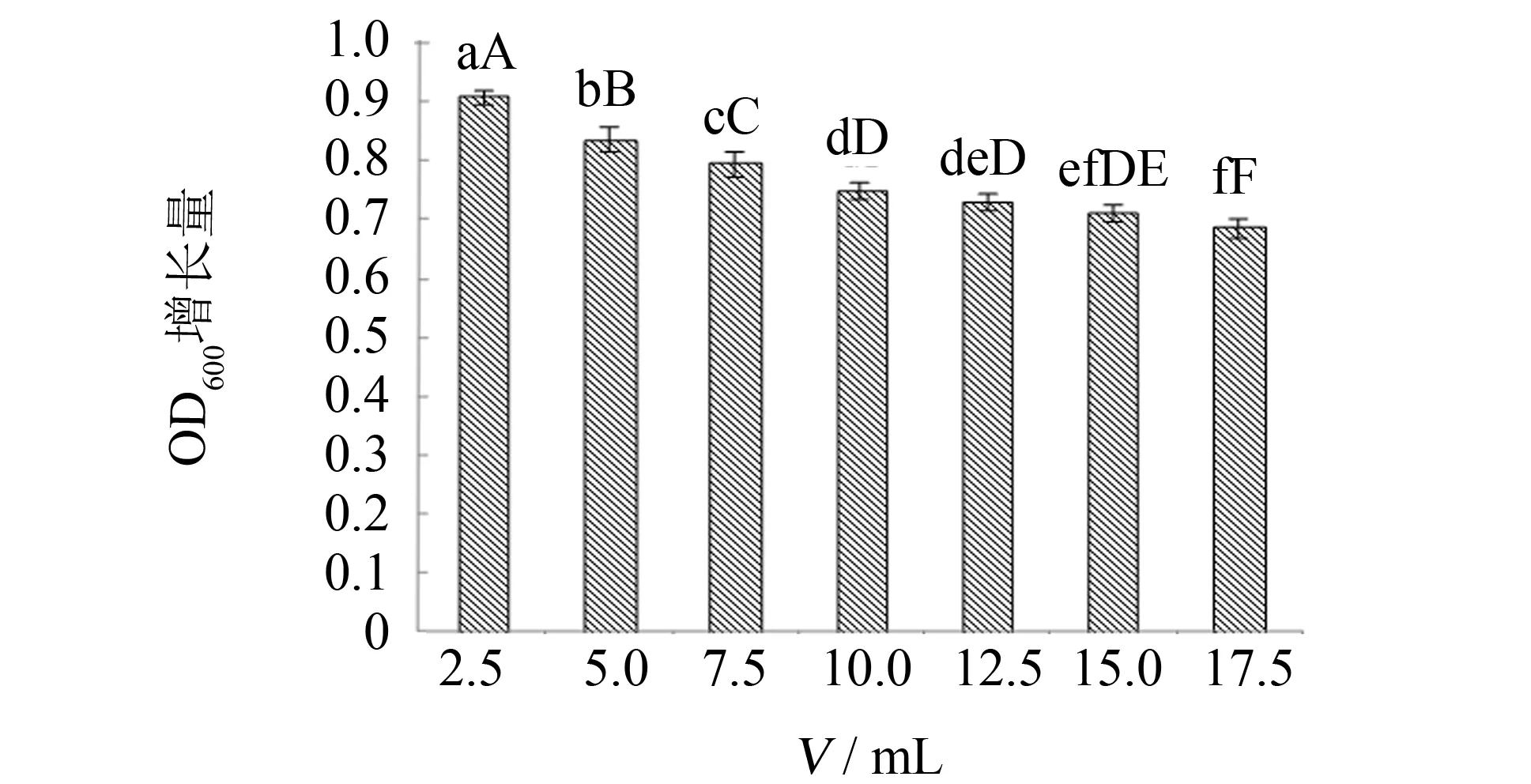
图10 培养基装液量对枯草芽孢杆菌生长的影响Fig.10 Effect of liquid volume in flask of medium on Bacillus subtilis
2.3.4 培养条件正交试验
以单因素实验结果为依据,设计正交试验L27(313)进行培养条件优化试验,同时考察转速和装液量有无交互作用. 正交试验因素水平表分别选择装液量/mL(因素A)的3水平为20、 40、 80; 转速/r·min-1(因素B)的3水平为130、 170、 200; pH值(因素C)的3水平为6.0、 7.0、 8.0; 温度/℃(因素D)的3水平为37、 45、 50. 由方差分析结果(见表2)可以看出,影响枯草芽孢杆菌生长的条件因素主次顺序为D>A>A×B>B>C. 其中,培养基装液量(A)、 培养温度(D)对于菌体生长具有显著性影响,而转速(B)和培养基初始pH值(C)对菌体生长不具有显著性影响,且转速和装液量无交互作用. 通过试验数据可以看出,最优条件组合为A1B1C2D1,即装液量20 mL/250 mL、 转速 130 r·min-1、 培养基初始pH值 7.0、 培养温度37 ℃时菌体生长最好.
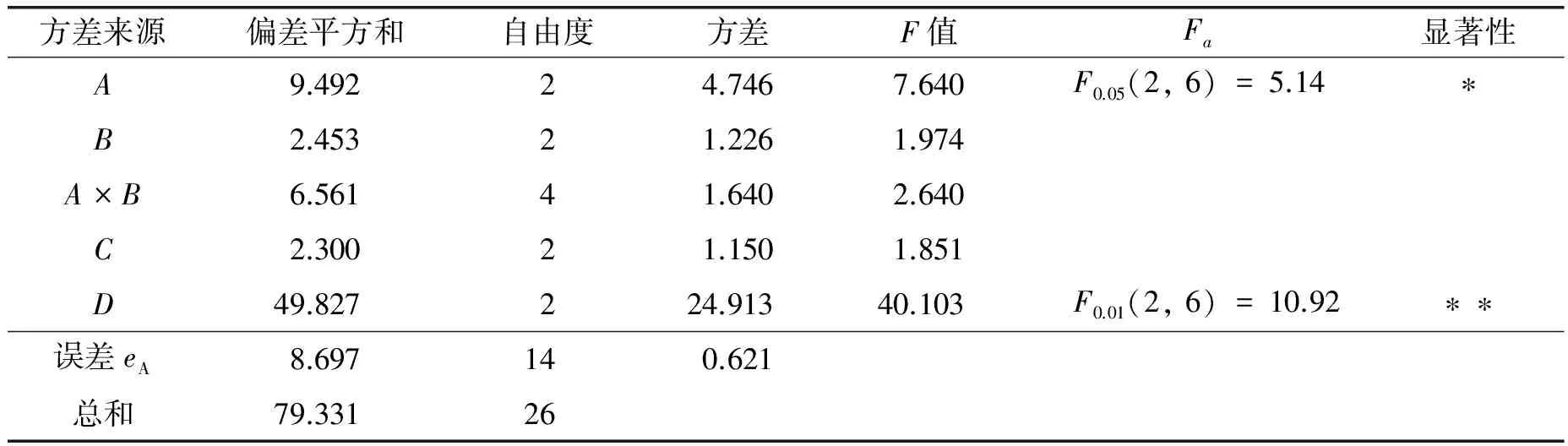
表2 培养条件正交实验综合方差分析
2.3.5 菌种接种量对细胞生物量的影响
接种量对微生物生长延滞期的长短具有影响作用. 实验考察不同接种量对菌种生长的影响,结果见图11. 由图11可见,接种量太小时(如1%和3%),菌种的生长周期变长; 接种量太大时(如15%和20%),菌种的稳定期缩短,菌种过早衰亡. 因此接种量应从5%和10%进行选择.
2.4 最佳条件实验
将枯草芽孢杆菌采用上述优化后的培养基及培养条件进行培养,并采用平板菌落计数跟踪测定5%和10%接种量下的细胞生物量,以明确采用最佳培养条件下的枯草芽孢杆菌的细胞生物量,结果见图12. 由图12可见,采用5%接种量,菌体生长的稳定期较长、 不易衰亡,菌种培养至12 h时细胞生物量最高(2.280×109cfu·mL-1),较优化前牛肉膏蛋白胨培养基的细胞生物量(2.927×107cfu·mL-1)提高了77.9倍.
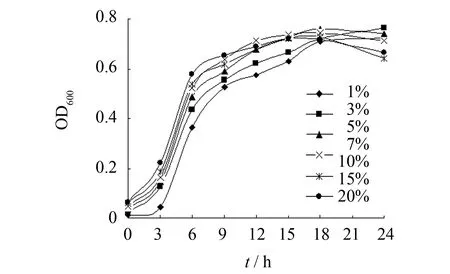
图11 接种量对枯草芽孢杆菌生长的影响Fig.11 Effect of inoculation amount on Bacillus subtilis注: 本图以菌悬液稀释10倍后的OD600为纵坐标
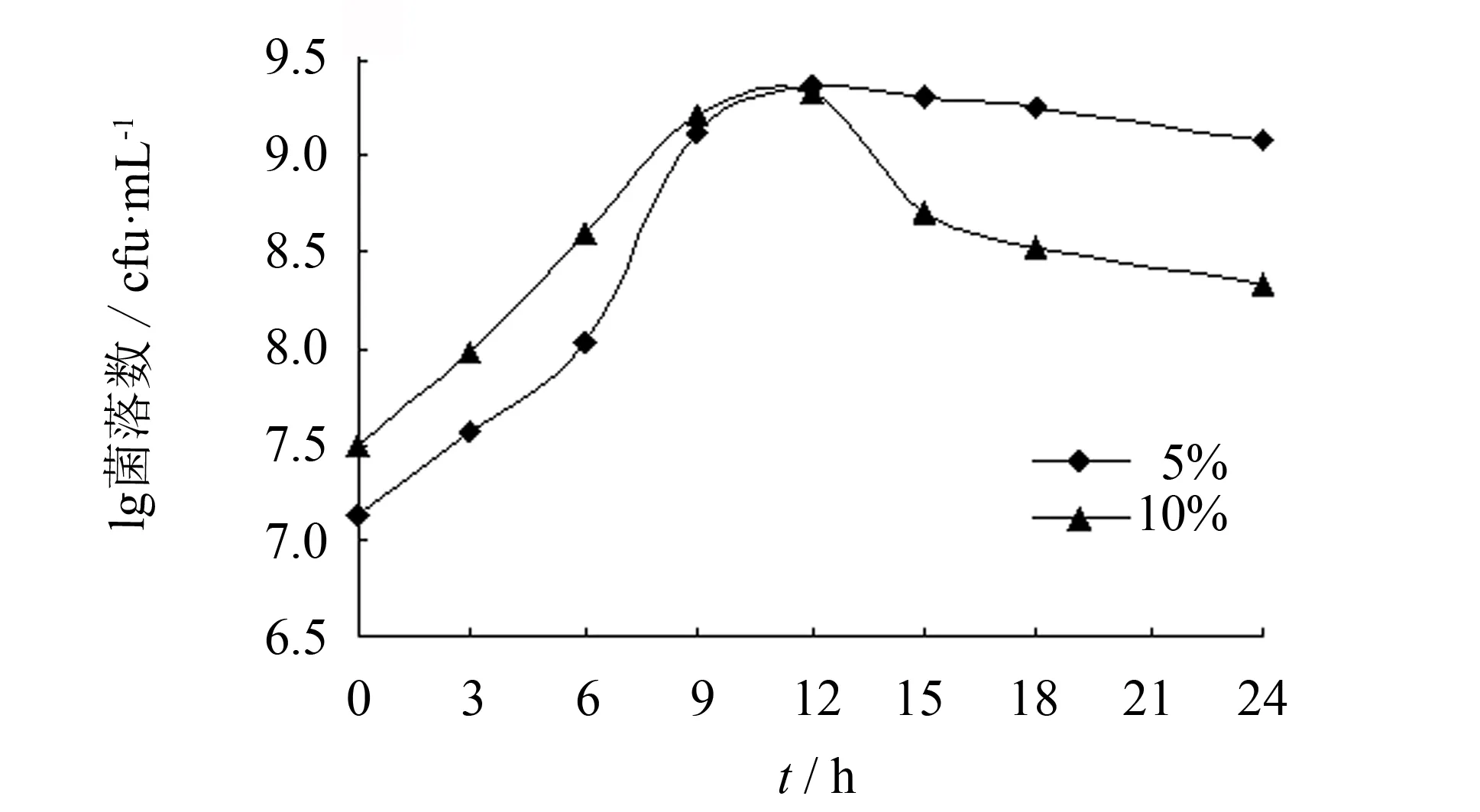
图12 最佳培养条件下枯草芽孢杆菌的细胞生物量Fig.12 Cell biomass of Bacillus subtilis under optimal culture conditions
2.5 高细胞生物量菌种应用发酵产黄腐酸实验
分别采用优化前后的培养基与培养条件进行枯草芽孢杆菌的培养,并将培养的菌种分别接种于工厂发酵培养基,以工厂原始自然发酵模式为对照,3批物料分别堆料于发酵池的上层发酵,同时测定发酵4 d 的物料中FA含量(质量分数, 以下同)和细菌细胞生物量,结果见图13、 14.
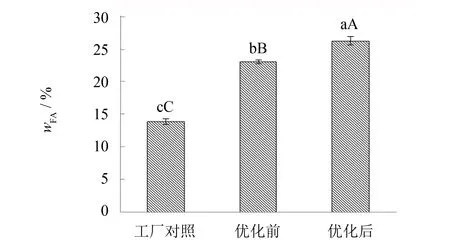
图13 枯草芽孢杆菌发酵实验产FA的比较Fig.13 Comparison of FA from bagasse fermentation by Bacillus subtilis
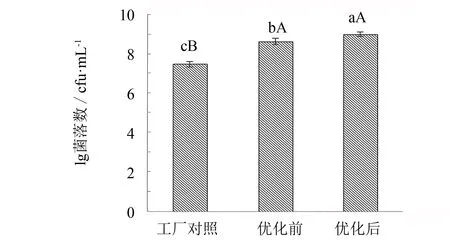
图14 枯草芽孢杆菌发酵产品中细胞生物量的比较Fig.14 Comparison of cell biomass from bagasse fermentation by Bacillus subtilis
由图13、 14知,采用优化后培养的枯草芽孢杆菌应用发酵,FA含量为26.36%,与工厂对照组(FA 13.95%)相比, FA增长率为88.96%; 与优化前培养的菌种发酵(FA含量 23.14%)相比, FA增长率为13.90% . 从细胞数量看,优化后菌种的发酵产品细胞生物量为1.09×109cfu·g-1,与工厂对照组(3.15×107cfu·g-1)相比提高了34.6倍,与优化前菌种发酵的产品相比(细胞生物量为4.71×108cfu·g-1)提高了2.3倍. 实验结果表明,采用接种枯草芽孢杆菌发酵,产品中FA含量与细胞生物量较自然发酵均有显著提高. 但从优化前后培养的菌种发酵产品比较,优化后菌种发酵的FA含量与细胞生物量较优化前培养菌种发酵的增长幅度较小. 这可能是因为物料发酵在不灭菌下,培养条件优化前的枯草芽孢杆菌接种量已满足发酵产FA的较好条件了,所以优化条件后的菌种虽大幅增加了其接种量,但发酵物料的产物增长有限.
3 结语
以实验室前期筛选出的高产黄腐酸菌株-枯草芽孢杆菌为基础,分别对其培养基与培养条件进行优化. 以获得的培养基配方为基础优化菌种,得到最适培养条件. 采用优化条件,菌种培养12 h后的细胞生物量较优化前的牛肉膏蛋白胨培养基提高了77.9倍.
将优化前后培养的枯草芽孢杆菌应用于工厂发酵蔗渣实验. 接种优化前后培养的枯草芽孢杆菌发酵产品中FA含量及有益微生物较工厂自然发酵对照组显著提高,而优化条件后培养的菌种发酵产品FA含量及有益微生物较优化前的也有一定幅度提高. 后续将以此为基础,进一步研究150 L中试发酵的应用扩大培养模式,在节约生产成本的同时,为工厂大规模化应用该菌发酵蔗渣生产黄腐酸奠定基础
[1] RILEY M A,WERTZ J E. Bacteriocins: evolution,ecology,and application[J]. Annu Rev Microbiol,2002,56(1): 117-137.
[2] BISWAJIT S,MAHESH S,TUSAR B. Water-mediated differential binding of strontium and cesium cations in fulvic acid[J]. J Physchem B,2015,119(34): 10 989-10 997.
[3] 刘景辉,贺丽萍,申逸杰,等. 黄腐酸浸种浓度对旱作燕麦出苗率的影响[J]. 东北农业大学学报,2015,46(6): 9-15.
[4] 周少丽. 黄腐酸研究进展[J]. 广州化工,2015,43(8): 41-42.
[5] 何静,毕艳艳,李宝才,等. 黄腐酸及黄腐酸钠对糖尿病小鼠的降糖作用研究[J]. 昆明理工大学学报(自然科学版),2011,36(5): 64-69.
[6] 赵莹,邱宏端,谢航,等. 发酵蔗渣产黄腐酸菌种的筛选及应用[J]. 福建农业学报,2012,27(8): 883-887.
[7] ZAK J C,WILLIG M R,MOORHEAD D L,et al.Functionaldiversityofmicrobialcommunities:aquantitativeapproach[J].SoilBiology&Biochemistry,1994,26(9): 1 101-1 108.
[8] 秦秀芝. 重温历史记录-再助腐植酸发展[J]. 腐植酸,2005(4): 45-47.
[9] 赵莹,邱宏端,谢航,等. 枯草芽孢杆菌发酵蔗渣生产黄腐酸的工艺条件优化[J]. 福州大学学报(自然科学版),2010,38(2): 290-296.
[10] 沈萍,陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社,2007: 241.
[11] 陈小煌,李自然,黄小云,等. 多粘类芽孢杆菌培养条件优化研究[J]. 福州大学学报(自然科学版),2013,41(5): 947-954.
[12] 方开泰,马长兴. 正交与均匀试验设计[M]. 北京: 科学出版社,2001: 90-102; 156-183.
[13] 刘康德. 腐植酸应用领域生产现状[J]. 精细与专用化学品,1999,7(20): 13-14.
[14]DENGLW,CAICD,CHENGM,et al.Studyandapplicationoftechnologyforpost-treatmentofanaerobicallydigestedEffluentofpiggerywastewater[J].TransactionofAgriculturalEngineering,2002,18(3): 92-94.
(责任编辑: 洪江星)
Optimization of culture conditions of strains to produce fulvic acid
XIE Hang,QIU Hongduan,LIN Juan,ZHAO Ying
(College of Biological Science and Technology,Fuzhou University,Fuzhou,Fujian 350116,China)
This study was performed to optimize the medium formula and culture conditions ofBacillussubtiliswhich produced fulvic acid (FA) from bagasse fermentation. The results showed that the optimal medium formula forBacillussubtilisconsisted of 12.50 g·L-1soluble starch, 12.50 g·L-1peptone, 0.25 g·L-1K2HPO4and 0.50 g·L-1MgSO4. And the optimal fermentation conditions were pH 7.0, 37 ℃, liquid volume of 20 mL/250 mL, rotation speed of 130 r·min-1, and inoculation amout of 5%(volume fraction). Under these conditions after growing for 12 hours, the cell biomass ofBacillussubtilisreached 2.280×109cfu·mL-1, which was increased by 77.9 times compared with those before the optimization. ApplicatedBacillussubtiliswhich culture conditions were used before and after optimization to produce FA, the results showed that FA content in the fermentation product was 26.36%(mass fraction) and the cell biomass reached 1.09×109cfu·g-1, which were increased by 13.19% and 2.3 times compared with those before the optimization.
fulvic acid;Bacillussubtilis; culture conditions optimization
10.7631/issn.1000-2243.2017.03.0438
1000-2243(2017)03-0438-08
2016-01-18
邱宏端(1955-),女,教授,主要从事应用微生物方面的研究,hongduanlq@163.com
国家农业部2013年度农业公益性行业科研专项(201303094-05)
S939.9
A
