芬太尼诱发大鼠痛觉过敏状态下中央杏仁核区突触磷酸化细胞外信号调节蛋白激酶对脊髓场电位变化研究
2017-06-09陈健贺诗静杨定中
陈健++贺诗静++杨定中
摘 要 目的:探究在芬太尼诱发大鼠痛觉过敏状态下给予突触磷酸化细胞外信号调节蛋白激酶抑制剂干预中央杏仁核区后脊髓场电位的变化。方法:SD雄性大鼠(60~90 g),CeA立体定位置管后随机分为三组(n = 6):对照组:皮下注射生理盐水,CeA给予DMSO,记录场电位; OIH组:皮下注射芬太尼建立OIH模型,待模型成功后记录场电位;U0126组:OIH组记录场电位后再在CeA给予U0126,并记录场电位;芬太尼或生理盐水注射后6.5h检测机械痛阈和热痛阈的变化。结果:大鼠在芬太尼处理6h后机械痛阈和热痛阈降低(P<0.05);OIH组诱发场电位的峰面积对照组比较明显增加(P<0.05),CeA区给予p-ERK抑制剂U0126可逆转上述变化(P<0.05);结论:CeA区突触磷酸化细胞外信号调节蛋白激酶可调制脊髓场电位的变化,在痛觉过敏的维持过程中发挥了重要作用。
关键词 场电位 痛觉过敏 杏仁核 芬太尼
杏仁核在疼痛以及疼痛相关的情绪反应中起着重要作用,有研究表明杏仁核CeLC区注射€%e受体兴奋剂内吗啡肽(作用强于吗啡的一种内源性阿片)可产生痛觉过敏,该区域主要接受从脊髓背角经臂旁核(PB)中继的伤害性信息的传入。而脊髓P-ERK在调制痛觉过敏中发挥重要作用。那么我们推测杏仁核中P-ERK在调制痛觉过敏中也发挥了作用,如何去证实这个猜想呢?Heinl等给大鼠静脉注射芬太尼,撤药后观察到C纤维突触投射的脊髓背角神经元场电位发生了长时程增强(long term potentiation,LTP )现象,而LTP是研究痛觉过敏机制的重要细胞模型。因此,本研究选取杏仁核为靶区,探究用芬太尼诱导大鼠痛觉过敏时,干预杏仁核中P-ERK后,在脊髓背角浅层记录场电位的变化情况,旨在探明痛觉过敏状态杏仁核中P-ERK是否也发挥了重要作用,也为研究疼痛上行通路调制下行通路提供新的线索和思路。
1 材料与方法
动物选择及分组。由湖北省实验动物研究中心提供的SPF级健康雄性SD大鼠18只,体重60~100 g,在室温条件下自由摄食和饮水,光照与黑暗时间为12 h:12H。实验前在老鼠中央杏仁核立体定位置管,之后采用随机数字表法分为3组(n=6):对照组1:皮下注射生理盐水,CeA给予DMSO,记录场电位;对照组2:皮下注射生理盐水,CeA给予U0126 1.5nmol,并记录场电位;OIH组:颈部皮下注射芬太尼(湖北宜昌人福药业有限责任公司),每次60 €%eg/kg,注射4次,每次间隔时间15 min,总给药剂量240 €%eg/kg,制备大鼠痛觉过敏模型,待模型成功后记录场电位;U0126组:OIH组记录场电位后再在CeA给予U0126 1.5nmol,并记录场电位;U0126购于美国Cayman chemical公司,临用前溶于含50% DMSO的生理盐水中。
杏仁核CeLC区立体定位置管给药。大鼠腹腔注射浓度为10%的水合氯醛(3 ml/kg)完全麻醉后将其固定在脑立体定位仪(Stoelting公司,美国)上,脑部皮肤消毒后暴露颅骨前囟和矢状缝并在右侧杏仁核区(参考大鼠脑立体定位图谱坐标:前囟后2.0mm,中线旁开4.2 mm,颅骨下7.5 mm)植入带管芯的套管(中国深圳市瑞沃德生命科技有限公司),迅速用牙胶骨水泥固定套管并缝合皮肤。手术后至少恢复一周,测痛确认恢复完全,以排除手术干扰。将注射内管一端用PE管连接微量注射器针头,另一端插入固定好的导管里,用微量泵缓慢给药(0.3 €%el,0.1 €%el/min),完成注射后停留5min,使药物充分弥散后拔出注射内管并装上导管帽。
疼痛行为学检测。于OIH模型建立前及芬太尼或生理盐水注射6.5h后测机械痛和热痛。行为学采用Von Frey丝(North Coast公司,美国)测定大鼠的机械痛阈。先将大鼠静置于特制的笼内30 min 使其适应环境,再用不同压力的von Frey丝垂直作用在鼠足掌面上,阳性反应(大鼠出现抬足或舐足行为),计算50%机械缩足反应阈。采用BME-410C型热痛刺激仪(CAMS公司,中国)测定大鼠热痛阈。先把大鼠放入有机玻璃箱内适应30 min,透过玻璃板底部用热辐射源照射大鼠左足掌正中间区域。热痛阈为自动记录缩足反应的潜伏期,为了免造成辐射损伤截止时间设为15s。每次照射间隔至少5 min,重复至少3次,最后取平均值。
场电位记录。采用10%水合氯醛(3ml/kg)腹腔注射麻醉大鼠,固定于定向仪(江湾Ⅰ型C 第二军医大学 中国)上。暴露脊髓腰膨大(T13-L1做椎板切除手术),用玻璃电极游离左侧坐骨神经,记录时用双极氯化银电极刺激坐骨神经。暴露的多余的神经组织用浸润0.9%生理盐水的纱布覆盖。用玻璃电极进行细胞外记录,电极深度在脊髓表面下0.1-0.5mm。采用ME-100微电极放大器和BL-420E+生物机能实验系统(成都泰盟科技有限公司 中国)处理和存储数据。以C-纤维诱发场电位的幅值和面积作为参数。给予单方波(25V,0.5ms,5min-1)刺激坐骨神经诱发脊髓背角场电位。实验结束后处死大鼠(过量水合氯醛)。
统计学处理。采用Graphpad prism6软件进行数据分析,计量资料用均数€北曜疾睿?€?)表示,多组比较采用单因素方差分析,组间比较采用t检验,同组不同时间比较采用配對t 检验,P<0.05为差异有统计学意义。
2 结果
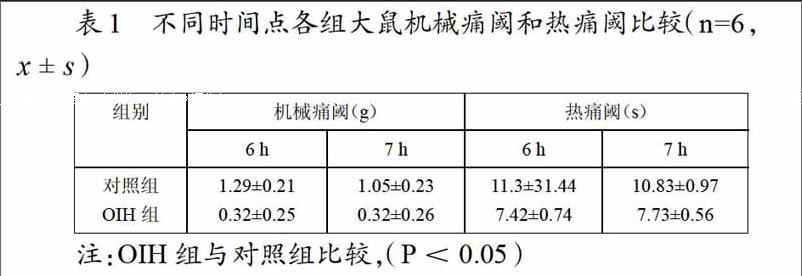
对照组与OIH组比较,OIH组6h、7h时机械痛阈和热痛阈均降低(P<0.05)。见表1。
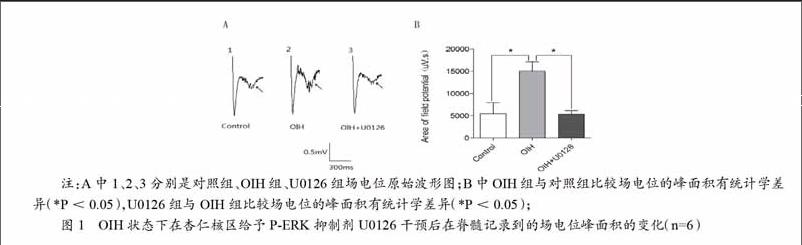
与对照组相比,OIH组场电位的峰面积增加(P<0.05);从杏仁核置管装置给予U0126干预后记录到的场电位峰面积与OIH状态时相比较显著降低(P<0.05)。见图1。
3 讨论
临床镇痛和麻醉常用阿片类药物,芬太尼是临床麻醉常用且镇痛效果也很显著的阿片类药物之一。有研究表明,芬太尼在用于镇痛和麻醉时会引起痛觉敏感性增强,即芬太尼诱导的痛觉过敏(OIH)。
Chu等的實验结果表明外周及脊髓机制不足以来解释OIH现象,我们推测OIH与疼痛上行通路有关,杏仁核作为疼痛上行通路的重要节点之一,有研究表明杏仁核中P-ERK与痛觉过敏有关,而OIH状态下C纤维突触投射的脊髓背角神经元的场电位发生了长时程增强(long term potentiation,LTP)现象。本研究采用皮下注射芬太尼(60ug/kg),每隔15min一次,共4次,累积药量240ug/kg,建立OIH模型。结果显示,与对照组比较,OIH组机械痛阈和热痛阈均降低,说明OIH模型是成功的。在OIH模型上,通过特制的导管装置靶向给予P-ERK抑制剂U0126至杏仁核区干预后,记录C纤维突触投射的脊髓背角神经元场电位。结果显示,与对照组比较OIH组场电位峰面积增加(P < 0.05);OIH组给予U0126后场电位峰面积显著降低(P < 0.05)。
综上所述, OIH状态下杏仁核中P-ERK参与调制脊髓场电位的变化,即参与调制OIH,对OIH的维持有一定的作用。但我们相信OIH的发生绝不是单个因子的作用,在杏仁核以及其它疼痛传导的节点如PAG、RVM、PB等还有很多参与疼痛调节的因子如NMDA受体系统、Ⅰ型代谢型谷氨酸受体5、PKA等,它们对OIH的作用尚不明确,需要进一步的试验去探究。
*通讯作者:杨定中
参考文献
[1] Ji G, Neugebauer V. Reactive oxygen species are involved in group ⅠmGluR-mediated facilitation of nociceptive processing in amygdala neurons. J Neurophysiol. Jul 2010;104(1):218-229.
[2] Terashvili M,Wu HE, Schwasinger E, Tseng LF. Paradoxical hyperalgesia induced by mu-opioid receptor agonist endomorphin-2,but not endomorphin-1,microinjected into the centromedial amygdala of the rat.Eur J Pharmacol.Jan 12 2007;554(2-3):137-144.
[3] Missig G, Roman C W, Vizzard M A, et al. Parabrachial nucleus (PBn) pituitary adenylate cyclase activating polypeptide (PACAP) signaling in the amygdala: implication for the sensory and behavioral effects of pain [J]. Neuropharmacology, 2014, 86:38-48. DOI:10.1016/j.neuropharm.2014.06.022.
[4] Li MM, Yu YQ, Fu H, et al. Extracellular signal-regulated kinases mediate melittin-induced hypersensitivity of spinal neurons to chemical and thermal but not mechanical stimuli. Brain research bulletin 2008; 77(5): 227-32.
[5] Heinl C, R D-S, DN X,J S. Distinct mechanisms underlying pronociceptive effects of opioids. Journal of Neuroscience 2011; 31(46): 16748-56.
[6] C€閘€鑢ier E, Rivat C, Jun Y, et al. Long-lasting hyperalgesia induced by fentanyl in rats preventive effect of ketamine [J]. The Journal of the American Society of Anesthesiologists, 2000, 92(2): 465-465.
[7] Luo F, Yang C, Chen Y, et al. Reversal of chronic inflammatory pain by acute inhibition of Ca2+/calmodulin-dependent protein kinase II [J]. J Pharmacol Exp Ther, 2008, 325(1): 267-275. DOI:10.1124/jpet.107.132167.
[8] Wen-Tao Liu, Yuan Han, Hao-Chuan Li, et al. An in vivo mouse model of long-term potentiation at synapses between primary afferent C-fibers and spinal dorsal horn neurons:essential role of EphB1 receptor. Molecular Pain,2009, doi:10.1186/1744-8069-5-29.
[9] Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review.Anesthesiology.Mar 2006;104(3):570-587.
[10] Chu LF,Dairmont J,Zamora AK,Young CA,Angst MS.The endogenous opioid system is not involved in modulation of opioid-induced hyperalgesia.J Pain. Jan 2011;12(1):108-115.
[11] Zhu JJ,Qin Y,Zhao M, et al.Ras and Rap control AMPA receptor trafficking during synaptic plasticity[J].Cell.2002;110(4):443-455.
