异槲皮苷在大鼠血浆中的药代动力学研究
2017-06-09李翠玉张文洁
王 瑛 李翠玉 张文洁*
1 .辽宁省清原满族自治县妇幼保健计划生育服务中心,辽宁 清原 113300;2 . 辽宁中医药大学,辽宁 大连 116600
实验研究
异槲皮苷在大鼠血浆中的药代动力学研究
王 瑛1李翠玉2张文洁2*
1 .辽宁省清原满族自治县妇幼保健计划生育服务中心,辽宁 清原 113300;2 . 辽宁中医药大学,辽宁 大连 116600
目的:对异槲皮苷的多剂量给药进行研究,初步确定其体内药动学参数。方法:建立HPLC-UV法测定异槲皮苷在大鼠血浆中浓度的分析方法,以牡荆素作为内标物,考察异槲皮苷在大鼠体内的药代动力学特征。色谱柱:Diamonsil C18(150 mm × 4 .6 mm,5 μm),以甲醇-乙腈-0 .1%甲酸水(35∶5∶60,V/V/V)为流动相,检测波长为360 nm,柱温:30℃,流速:1 mL/min。大鼠分别给以5 mg/kg,10 mg/kg和20 mg/kg尾静脉注射异槲皮苷溶液,并于静脉注射2、5、10、15、20、30、45、60、90、120、180min后采血,分别置于预先肝素化的EP管中,样品经处理后,注入液相色谱仪进行分析。对所得结果利用3p97药代动力学软件进行拟合处理,计算其药代动力学参数。结果:三个剂量静脉给药后,异槲皮苷在0 .2~80 μg范围内呈良好的线性关系,r2> 0 .99。血浆检测限(LOD,S/N = 3)及定量限(LOQ,S/N = 10)分别为0 .062和0 .203 μg/mL。日内和日间精密度(RSD)分别在2 .3%~7 .2%和2 .8%~7 .7%之间,准确度(RE)在-6 .3%~7 .0%和4 .0%~6 .2%之间。其提取回收率在91 .24%~94 .50%之间。三个剂量的药代动力学行为均最符合三室开放模型。在给药剂量5~10mg/kg范围内,AUC的值成比例增加。此外,药代动力学参数α half-life,β half-life,aCL,MRT0→t和MRT0→∞在20 mg/kg与其他剂量的比较中均表现出统计学差异。结论:研究建立测定大鼠血浆中异槲皮苷含量的高效液相色谱法,该法灵敏度和专属性较高,经方法学验证,精密度和准确度好、重复性高、专属性强,符合生物样品分析的要求,并将其成功的应用于多剂量静注异槲皮苷后大鼠体内的血浆药动学研究。
山楂叶;异槲皮苷;大鼠;药代动力学
异槲皮苷(isoquercitrin,ISOQ),别名槲皮素-3-O-葡萄糖苷、罗布麻甲素,是一种黄酮类化合物,是山楂叶中的主要活性成分之一。具有丰富的生物学及药理活性如抗炎[1],体内外抗氧化活性[2],对暴露于过氧化氢引起的RGC-5细胞凋亡有明显的衰减作用,以及对青光眼有治疗作用[3],越来越受到国内外学者的关注。此外,异槲皮苷在多种中草药中的许多研究方法诸如HPLC-UV[4],LC-DAD和LC-MS[5],CZE-UV[6],SPE-HPLC[7]等均在文献中有相关报道。异槲皮苷的体内外分析已见报道[8],然而异槲皮苷的多剂量静脉给药分析并未见相关研究。笔者采用内标法的HPLC分析对异槲皮苷的多剂量给药药物动力学过程进行分析,为相关的临床研究提供理论依据。
1 仪器与材料
1.1 实验动物 雄性Wistar大鼠,20只,体重(240±20)g,辽宁中医药大学实验动物中心提供,试验动物生产许可证号:SCXK(辽)2003-008。实验中所使用动物严格按照实验室动物保护指导原则进行,所使用动物征得辽宁中医药大学动物实验伦理委员会同意。试验期间自由饮水,大鼠给药前禁食12~16h。
1.2 药品 异槲皮苷,内标物牡荆素均为实验室自制(纯度>98%,HPLC)。
1.3 试剂 甲醇(色谱纯,天津市科密欧化学试剂有限公司);乙腈(色谱纯,天津市大茂化学试剂厂);甲酸(分析纯,沈阳市试剂三厂);冰醋酸(分析纯,华北地区特种化学试剂开发中心);磷酸(分析纯,沈阳市试剂三厂);纯净水(娃哈哈有限公司)。1.4 仪器 Agilent l100高效液相色谱仪(美国安捷伦公司);HH-S水浴锅(上海永光明仪器设备厂);十万分之一天平(瑞士METTLER);XW-80A微型旋涡混合器(上海沪西分析仪器厂有限公司);XYJ80-2型离心机(金坛市金南仪器厂);TGL-16C高速台式离心机(江西医疗器械厂);ZDHW电子调温电热套(北京中兴伟业仪器有限公司);微量取样器(上海荣泰生化工程有限公司);柱温箱(大连日普利科技仪器有限公司);TY10HSC-24A氮吹仪(南京科捷分析仪器有限公司)。
2 方法
2.1 大鼠血浆样品中异槲皮苷分析方法的建立
2.1.1 色谱条件 色谱柱:Diamonsil C18(150 mm × 4 .6 mm, 5μm)(迪马公司,中国北京);预柱:KR C18(35 mm × 8.0mm, i.d., 5μm)(大连科技发展公司);流动相:甲醇-乙腈-0.1%甲酸水(35∶5∶60,V/V/V);检测波长:360 nm;流速:1 mL/min;内标物:牡荆素;柱温:30℃;进样量:20μL。
2.1.2 溶液制备2.1.2.1 标准溶液的制备 精密称取异槲皮苷(图1)对照品约1.60mg,置10mL量瓶中,加适量甲醇超声溶解,并定容至刻度,摇匀,即得浓度160μg/mL对照品储备液。采用倍数稀释法分别配制成7个浓度的对照品溶液,即160.0、40.0、10.0、4.0、1.6、0.8和0.4μg/mL的系列标准溶液,于4℃冰箱保存,备用。
2.1.2.2 内标溶液的制备 取精密称定的牡荆素(图2)2.26 mg,置10mL量瓶中,加适量甲醇超声使其溶解,并稀释至刻度,摇匀,即得浓度为226μg/mL的内标储备液。再精密吸取1.0mL内标储备液置10mL量瓶中,加甲醇稀释至刻度,摇匀,制成浓度为22 .6μg/mL的溶液,作为内标,于4℃冰箱保存,备用。
2.1.2.3 空白血浆样品的制备 取6只空白大鼠(大鼠于取样前一晚禁食,自由饮水)血浆,充分混合,于-20℃冰箱保存,备用。2.1.2.4 质控(QC)样品的制备 精密吸取100μL空白血浆,分别各加入50μL工作溶液(1.2、12、120μg/mL)和10μL内标溶液照“血浆样品的处理”项下方法处理,制备成低、中、高三种浓度的质控样品。异槲皮苷血浆浓度分别为0.6、6、60μg/mL,于4℃冰箱保存,备用。

2.1.3 血浆样品预处理条件的优化2.1.3.1 提取溶剂种类的选择 取大鼠空白血浆样品100μL共三组,每组3个,分别置2mL离心管中,依次加入QC标准溶液50μL、内标溶液10μL、乙酸10μL。各组分别加入甲醇、乙腈、甲醇-乙腈(50:50)各500μL,涡旋1min,离心15min (3500r/min),取上清液,40℃氮气流下吹干,100μL流动相溶解,涡旋1min,离心5min (10,000r/min),取20μL进样。分别记录峰面积,计算提取回收率,结果见表1。综合考虑各待测组分和内标物回收率,选择甲醇作为提取溶剂。

表1 不同溶剂对大鼠血浆中异槲皮苷、内标提取回收率的影响 (n=3)
R%: extraction recovery
取大鼠空白血浆样品100μL共三组,每组3个,分别置2mL离心管中,依次加入QC标准溶液50μL,内标溶液10μL,乙酸10μL。各组分别加入甲醇400μL,500μL和1000μL,涡旋1min,离心15min (3500r/min),取上清液,40℃氮气流下吹干,100μL流动相溶解,涡旋1min,离心5min (10,000r/min),取20μL进样。分别记录峰面积,计算提取回收率,结果见表2。综合考虑各待测组分和内标物回收率,选择500μL甲醇为提取溶剂。
2.1.3.2 酸种类及用量的选择 取空白血浆样品,同“提取溶剂种类的选择”项下操作,分别考察甲酸、乙酸和磷酸对各待测组分的提取回收率的影响,结果见表3。

表2 不同甲醇用量对大鼠血浆中异槲皮苷、内标提取回收率的影响 (n= 3)
R%: extraction recovery
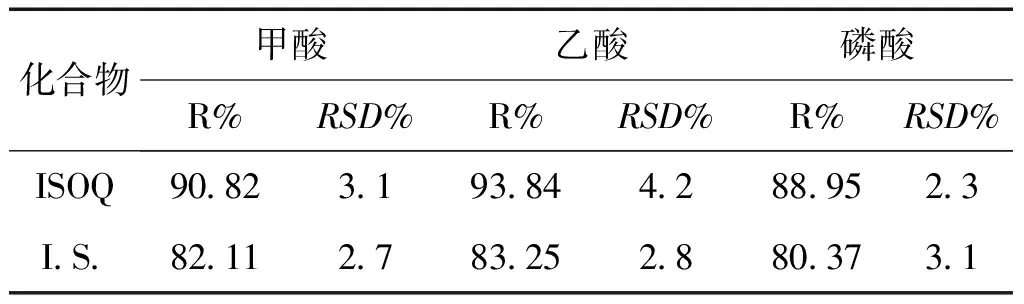
表3 不同种酸对大鼠血浆中异槲皮苷、内标的提取回收率的影响 (n=3)
R%: extraction recovery
综合考虑样品提取回收率及峰型,结果表明乙酸组效果最好。故继续考察不同用量的乙酸对提取回收率的影响。
取空白血浆样品,同“提取溶剂种类的选择”项下操作,考察其用量分别为0、10、20μL时对血浆中各待测组分含量测定的影响情况,计算各待测组分的提取回收率。结果见表4。结果显示乙酸10μL可较好抑制大鼠的血浆样品中待测组分解离,并有利于改善色谱峰峰形,故选择乙酸用量为10μL。
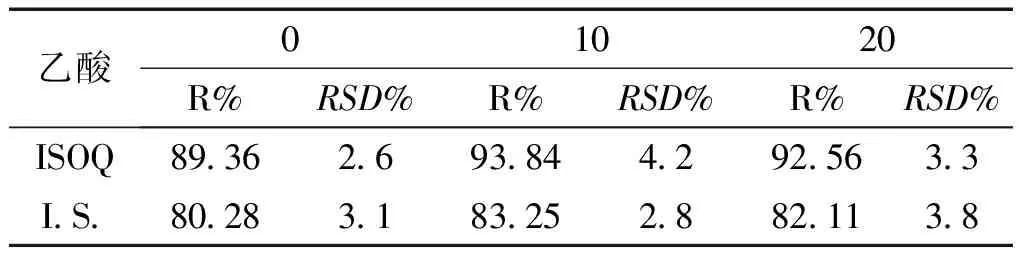
表4 不同体积乙酸对大鼠血浆中异槲皮苷、内标的提取回收率的影响 (n=3)
R%: extraction recovery
2.1.3.3 血浆样品的处理 经过对上述因素的考查,确定了血浆样本的处理方法:取血浆100μL至预先肝素化的2mL离心管中,依次加入乙酸10μL,内标10μL,甲醇500μL,涡旋1min,离心15min (3500r/min),取上清液,40℃氮气流下吹干,用100μL流动相溶解,涡旋1min,离心5min (10,000r/min),取20μL进样。分别记录峰面积,记录色谱图。2.2 动物血浆样品的采集与预处理 取雄性Wistar大鼠15只,随机分成3组,每组5只。实验前禁食12h,自由饮水。取定量异槲皮苷溶解到含20%丙二醇的生理盐水溶液(v/v)中,制成异槲皮苷溶液。按5、10和20 mg/kg体重经尾静脉一次性给予异槲皮苷溶液,分别于注射后2,5,10,15,20,30,45,60,90,120和180 min采血,每个点采血0.3 mL,置于预先肝素化的离心管中,离心(3500r/min) 15min,得血浆样本置-20℃冰箱中保存,待处理。取各采血时间点血浆100μL,按照“血浆样品的处理”项下方法操作,进样分析。
3 结果
3.1 析方法的确证
3.1.1 方法的专属性 上述色谱条件下,通过将大鼠的空白血浆样品色谱图(图2)空白血浆样品中加对照品和内标物色谱图(图2b)以及异槲皮苷静脉注射后血浆样品中加内标色谱图(图2)进行比较。结果表明,异槲皮苷与内标物色谱峰分离良好,不受内源性物质的干扰。异槲皮苷和内标物的保留时间分别为6.8min和10.6min。
3.1.2 检测限(LOD)和定量限(LOQ) 将已知浓度的标准溶液稀释,精密吸取50μL,至100μL的空白血浆中,按“血浆样品的处理”项下方法进行处理,配制样品溶液,进行测定,保证S/N均为10,重复分析五次,获得该浓度的日内精密度RSD低于8.7%,准确度RE为3.8%,该结果表明HPLC测定异槲皮苷的LOQ为0.203μg/mL,LOD(S/N=3)为0.062μg/mL。
3.1.3 标准工作曲线 取空白血浆100μL,分别加入内标溶液10μL,加入异槲皮苷系列标准溶液(0.4、0.8、1.6、4.0、10.0、40.0和160.0μg/mL)各50μL,配制成相当于血浆浓度为0.2、0.4、0.8、2.0、5.0、20.0和80.0 μg/mL的待测样品,按“血浆样品的处理”项下方法操作,进样20μL,记录色谱图。以异槲皮苷与内标物的峰面积比值为纵坐标(y),异槲皮苷浓度为横坐标(x),用加权最小二乘法进行回归运算[9],权重系数为I/C2,求得直线的回归方程为:y=0.2426x-0.0242 (r= 0.9961),本方法异槲皮苷在0.2~80μg/mL范围内线性良好。

3.1.4 提取回收率 取空白血浆100μL,按上述“血浆样品处理”项下方法分别制备低、中、高三个浓度(0.6、6、60μg/mL)的样品。以提取后样品的色谱峰面积与含有相同含量未经提取溶液直接进样所获得的色谱峰面积之比,考察样品的提取回收率。每一浓度进行6样本分析,待测组分的提取回收率均不低于(91.24±6.93)%,结果见表5。

表5 大鼠QC样品中提取回收率结果
3.1.5 精密度和准确度 取空白血浆100μL,按上述“血浆样品的处理”项下方法分别制备低、中、高三个浓度(0.6、6、60μg/mL)的血浆样品。日内精密度测定在同一天对每个浓度的QC样品进行5样本分析;日间精密度的计算,是对每个浓度的5样品进行分析(每天一个分析批),连续测定3d,并与标准曲线同时进行,以当日的标准曲线计算QC样品的浓度,求得该方法的精密度RSD%(QC样品测得值的相对标准偏差)和准确度RE(QC样品测量均值对真值的相对误差),结果见表6。本方法的日内和日间精密度RSD≤7.7%,RE在-6.3~7.0%之间。结果表明该法重复性、准确性良好,均符合生物分析方法指导原则的要求[10]。

表6 异槲皮苷精密度、准确度的测定结果 (日内精密度:n=5;日间精密度: n=3d,每天重复测定五次)
3.1.6 样品稳定性 取空白血浆100μL,按上述“血浆样品的处理”项下方法分别制备低、中、高三个浓度(0.6、6、60μg/mL)的样品,各个浓度QC样品分别经短期(室温,4h)、长期(-20℃,1个月)和连续冻融3次(冻:-20℃/24h,-20℃/12h,-20℃/12h)-融(25℃/30min,3次)循环处理后带入标准曲线中测定待测组分QC样品的浓度,计算RE%,结果见表7。结果表明生物样品在室温,-20℃放置1个月及连续冻融3次均能保持稳定。
表7 异槲皮苷在大鼠血浆中的稳定性测定结果
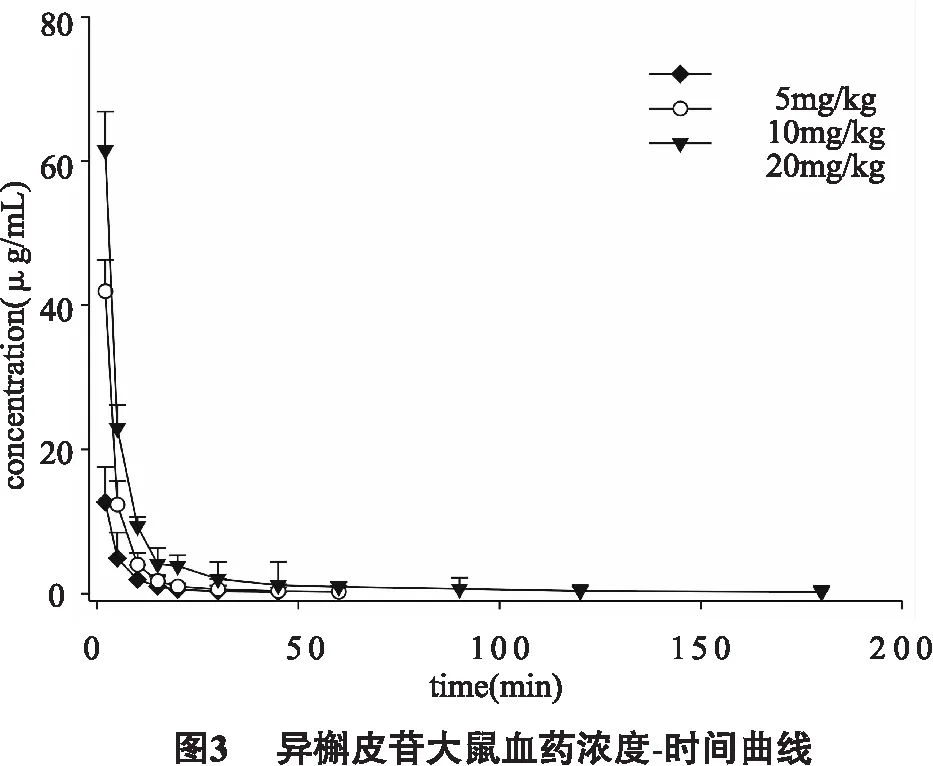
3.2 异槲皮苷药动学研究 将给药后不同时间取血测得的血药浓度和时间数据用3p97药代动力学软件拟合,通过进行一房室、二房室、三房室对各权重为1、l/C、1/C2的情况进行拟合,比较药时曲线拟合图及参数,平均药时曲线见图2-3,其主要药物动力学参数见表8。
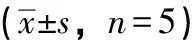
表8 异槲皮苷在大鼠体内静脉给药5、10、20mg/kg后血浆药代动力学参数
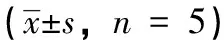
续表8 表8 异槲皮苷在大鼠体内静脉给药5、10、20mg/kg后血浆药代动力学参数
a, b The compartmental and non-compartmental approach, respectively .*P< 0.05 by one-way ANOVA compared with 5 and 10 mg/kg dose of isoquercitrin .
4 讨论
4.1 助溶剂的选择 异槲皮苷几乎不溶于冷水,微溶于沸水。鉴于其欠佳的水溶性,本实验曾尝试用DMSO作为助溶剂。有文献报道当DMSO加入量大于1%时,将会给动物造成中毒反应[11],但当在生理盐水中加入DMSO约为1%时,异槲皮苷未获得较好的溶解。后尝试使用丙二醇作为助溶剂,文献报道当丙二醇用量小于60%时,是在安全范围内[12]。分别尝试使用5%、10%、20%的丙二醇,发现当生理盐水中加入20%丙二醇时异槲皮苷能够很好地溶解,故最终确定使用含20%丙二醇的生理盐水溶液(v/v)来制备药物溶液。
4.2 流动相的选择 为了获得合适的保留时间和良好的分离度,曾分别采用甲醇-水(40:60,45:55),结果被测物分离效果不佳。后流动相中加入了乙腈,分别尝试采用甲醇-乙腈-水(30:5:65,35:5:60,25:10:65),后发现流动相为甲醇-乙腈-水(35:5:60)出峰时间比较理想,但峰形欠佳。为了改善峰形,尝试了甲醇-乙腈-甲酸水系统,分别尝试0.1%~0.5%的甲酸水,最后发现当流动相为甲醇-乙腈-0.1%甲酸水(35:5:60)时分离效果良好,故最终确定为本实验流动相。
4.3 检测波长的选择 异槲皮苷的吸收光谱显示其具有两个最大吸收波长,分别为256nm和358nm,而内标物牡荆素的两个最大吸收波长为269nm和331nm。当选择256nm作为检测波长时,血浆中的内源性物质峰会对检测造成干扰。综上最终确定检测波长为360nm。
4.4 内标物的选择 为满足测试需求,内标物应选择与被测物结构相似,保留时间较为接近的化合物。本实验对多种化合物进行了筛选,曾尝试了牡荆素-4″-O-葡萄糖苷、牡荆素-2″-O-鼠李糖苷、金丝桃苷和牡荆素等物质作为内标物。最终由于保留时间适宜,与待测物结构类似,不受内源性物质干扰,且与待测物质、血浆内源性物质之间无干扰、分离度良好,因此选择牡荆素为本试验的内标物。
4.5 药代动力学研究 结果表明给药后异槲皮苷在大鼠体内迅速消除,低剂量(5mg/kg)异槲皮苷的血药浓度只能检测到0.75h,高剂量的(20mg/kg)可以检测到3h。通过拟合度比较5,10和20mg/kg给药剂量下均选择1/C2为权重系数。依据F检验,AIC和R2的比较,三个剂量的药代动力学行为均最符合三室开放模型。在给药剂量5~10mg/kg范围内,AUC的值成比例增加。此外,药代动力学参数αhalf-life,βhalf-life,aCL, MRT0→t和MRT0→∞在20mg/kg与其他剂量的比较中均表现出统计学差异。20mg/kg剂量的αhalf-life的值比另外两个给药剂量的值大,表明异槲皮苷在大鼠体内的分布过程在20mg/kg剂量下进行的更为缓慢。而20mg/kg剂量下较大的 βhalf-life,MRT0→t和 MRT0→∞则表明异槲皮苷的消除过程相较于低剂量时也表现的更为缓慢。基于以上结果,异槲皮苷在5~10mg/kg表现出非剂量依赖性而在更高剂量(20mg/kg)时则呈现出非线性过程。这主要是由于药物的代谢酶和可透过膜的载体在高剂量给药状态下存在饱和现象,即代谢酶或载体的输送能力在体内的剂量和浓度超过某一限度时会达到饱和,从而表现出不同给药剂量下药动学过程的差异[13]。
综上所述,实验建立了HPLC法对异槲皮苷多剂量给药体内药动学的研究方法,确定了异槲皮苷在血浆样品中的含量测定方法,并进行了方法学验证。该法专属性强,分离度较好,其检测限、提取回收率、精密度、稳定性均符合生物样品分析要求。实验数据经过药动学软件处理,拟合出不同剂量异槲皮苷的大鼠体内房室模型,并计算出相关药动学参数。其在5~10mg/kg给药剂量范围内表现出非剂量依赖性,而在更高剂量20mg/kg时则呈非线性过程。本实验为异槲皮苷的进一步研究提供了理论依据。
[1]Zhang Y, Cui Y, Deng W, et al. Isoquercitrin protects against pulmonary hypertension via inhibiting PASMCs proliferation[J].Clin Exp Pharmacol Physiol.2017, 44(3):362-370.
[3]Jung S H, Kim B J, Lee E H, et al. Isoquercitrin is the most effective antioxidant in the plant Thuja orientalis and able to counteract oxidative-induced damage to a transformed cell line (RGC-5 cells)[J].Neurochemistry International, 2010, 57(7): 713-721 .
[4]Bramati L, Aquilano F, Pietta P.Unfermented rooibos tea: quantitative characterization of flavonoids by HPLC-UV and determination of the total antioxidant activity[J].Journal of Agricultural and Food Chemistry, 2003, 51(25): 7472-7474.
[5]da Silva Siqueira EM, Félix-Silva J, de Araújo LM, et al . Spondias tuberosa (Anacardiaceae) leaves: profiling phenolic compounds by HPLC-DAD and LC-MS/MS and in vivo anti-inflammatory activity[J].Biomed Chromatogr,2016, 30(10):1656-65.
[6]Jing R J, Jiang X Y, Hou S R, et al.Determination of quercetin, luteolin, kaempferol and isoquercitrin in stamen nelumbinis by capillary zone electrophoresis-ultraviolet detection[J].Chinese Journal of Analytical Chemistry, 2007, 35(8): 1187.
[7]Lai X Y, Zhao Y Y, Liang H, et al.SPE-HPLC method for the determination of four flavonols in rat plasma and urine after oral administration of Abelmoschus manihot extract[J].Journal of Chromatography B, 2007, 852(1): 108-114.
[8]Chang Q, Zuo Z, Ho W K K, et al.Comparison of the pharmacokinetics of hawthorn phenolics in extract versus individual pure compound[J].The Journal of Clinical Pharmacology, 2005, 45(1): 106-112 .
[9]钟大放.以加权最小二乘法建立生物分析标准曲线的若干问题[J].药物分析杂志,1996,16(5):343-346.
[10]US Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Veterinary Medicine (CVM).Guidance for Industry: Bioanalytical Method Validation[EB/OL].http://www.fda.gov/downloads/ Drugs/Guidance Compliance Regulatory Information/ Guidances/ UCM070107.Pdf[last accessed May 2001].
[11]马宁,刘文英,李焕德,等 . HPLC-MS法测定大鼠血浆中白藜芦醇衍生物(E)-3,5,4′-三甲氧基二苯乙烯的浓度[J].药物分析杂志,2008,28 (7):1037-1041 .
[12]王庆利,王海学.国外丙二醇的非临床安全性研究现状[J].中国新药杂志,2006, 15(18):1513-1516.
[13]Leon S, Andrew B C Y.Applied biopharmaceutics & pharmacokinetics[M].London: Prentice-Hall Co., 1993:375-379 .
Study on the Pharmacokinetics of Isoquercitrin in Rat’s Plasma
WANG Ying1LI Cuiyu2ZHANG Wenjie2*
1.Maternal and child health care center of Qingyuan Manchu Autonomous County,Qingyuan 113300,China; 2.School of Pharmacy, Liaoning University of TCM, Dalian 116600,China
Objective To investigate the pharmacokinetics of isoquercitrin in mice, and determine its preliminary pharmacokinetic parameters . Methods Established an HPLC-UV method using vitexin as internal standard for the determination of isoquercitrin in rat plasma to investigate its pharmacokinetic characters .The analyses were carried out on an analytical Diamonsil C18 column protected by a KR C18 guard column .The mobile phase was consisted of methanol-acetonitrile-0 .1% aqueous formic acid (35∶5∶60, v/v/v) .All chromatographic measurements were performed at 30℃ and a flow rate of 1 mL/min with the detection wavelength of 360 nm.The isoquercitrin solution was given to rats via tail vein injection at the dose of 5mg/kg, 10mg/kg and 20mg/kg . Blood samples (0.3 mL) were collected into heparinized tubes from the vena orbitalis at times of 2, 5, 10, 15, 20, 30, 45, 60, 90, 120 and 180 min after intravenous administration and then centrifuged.The pharmacokinetic parameters were calculated by 3p97 software .Results after three doses of intravenous administration, the linear range for plasma was within 0.2 ~ 80 μg/mL withr2> 0.99 . The limit of detection (LOD, S/N = 3) and the limit of quantification (LOQ, S/N = 10) in plasma were 0 .062 and 0.203 μg/mL, respectively.The RSDs of precision were 2.3% to 7.2% for intra-day assay and 2.8% to 7.7 % for inter-day assay, and accuracy were within -6.3 % ~ 7.0 %, and 4.0% ~ 6.2%, respectively.Its extraction recoveries in plasma were 91.24% ~ 94.50%.The three-compartment open model gave the best fit to the plasma concentration-time curves obtained in rats.The values of AUC increased proportionally within the range of 5-10 mg/kg.Additionally, the pharmacokinetic results of α half-life, β half-life,aCL, MRT0→tand MRT0→∞showed significant differences between 20 mg/kg and other doses.Conclusion Established an HPLC method for the determination of isoquercitrin in rat plasma.The analytical method after validated presented high sensitivity, specificity, good precision and accuracy with high reproducible, which conformed to the criteria for the analysis of biological sample according to guidance of USFDA, and was successfully applied to pharmacokinetic study of multi-dose intravenous administration of isoquercitrin in rats.
Hawthorn Leaves; Isoquercitrin; Rat; Pharmacokinetics
沈阳市科技项目计划(F13-194-9-00)。
王瑛(1962-),女,满族,大专,副主任检验师,研究方向为医学检验。E-mail: wyfuyou@163.com
张文洁(1966-),女,汉族,本科,教授,研究方向为药物制剂。E-mail: wenjiezhang509@hotmail.com
R284 .2
A
1007-8517(2017)09-0027-07
2017-03-02 编辑:陶希睿)
