新疆薰衣草多倍体诱导研究
2017-06-08廖晴玛尔哈巴吾斯满沙红高燕龚松旺廖志立
廖晴,玛尔哈巴·吾斯满,沙红,高燕,龚松旺,廖志立
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆霍城县农业技术推广站,新疆霍城 835200)
新疆薰衣草多倍体诱导研究
廖晴1,玛尔哈巴·吾斯满1,沙红1,高燕1,龚松旺2,廖志立1
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆霍城县农业技术推广站,新疆霍城 835200)
【目的】通过对新疆薰衣草主栽品种C-197优选优株的组培苗进行多倍体植株诱导,并对诱导成功的多倍体植株进行快繁体系的建立,探讨新疆薰衣草种质资源创新技术的有效途径,为新疆薰衣草产业提供种质资源创新技术支撑。【方法】采用新疆薰衣草C-197优选优株的组培苗为材料,接种至多倍体诱导培养基 MS+1 mg/L 6-BA+2% DMSO(二甲基亚砜)+不同浓度的秋水仙素中,进行多倍体诱导,比较在不同浓度的秋水仙素中,处理不同时间产生多倍体的差异,确定适合诱导新疆薰衣草C-197多倍体秋水仙素的浓度及处理时间。【结果】新疆薰衣草C-197优选优株的无菌苗,接种于MS+1 mg/L6-BA+2%二甲基亚砜+0.2%~0.4%秋水仙素的诱导培养基上处理48~72 h,均可使新疆薰衣草C-197的无菌苗产生多倍体。【结论】运用新疆薰衣草C-197多倍体诱导的试验方法,可快速实现对新疆薰衣草多倍体植株的新品种选育,缩短育种周期,有效提高和推进新疆薰衣草优质种苗的培育速率及种质创新。
新疆薰衣草C-197;秋水仙素;诱导;多倍体
0 引 言
【研究意义】薰衣草是新疆特色经济花卉之一。据统计,我国每年消耗薰衣草精油70 t左右,其中2/3是新疆生产的,目前我国对薰衣草精油的需求量以每年15%以上递增。我国薰衣草虽有几十年的栽培历史,栽培技术已相对完善,但栽培品种却严重退化混杂,生产量及质量在逐年下降,因而对薰衣草种质资源的创新已迫在眉睫。薰衣草是异花授粉植物,由于该群体的复杂异质性,选择优良个体进行常规繁殖,优良性状是很难稳定遗传的。为了获得性状更优异的新品种,对新疆主栽品种C-197进行多倍体育种,为薰衣草种质创新奠定坚实的基础。【前人研究进展】国外对薰衣草育种一直都很重视,除传统的常规育种外,还积极地进行基因工程和多倍体育种研究。我国对薰衣草精油的提取工艺、薰衣草的栽培管理技术等,都有较深入的研究工作。但在薰衣草的育种技术研究及优良品种的繁殖技术研究方面,开展的研究工作甚少[1-2]。尤其在新疆受经济条件的制约,育种及优质种苗生产严重滞后,极大地限制了精油生产的深层次发展。【本研究切入点】目前对新疆薰衣草C-197进行优选优株的选择并进行多倍体育种的研究未见报道。针对目前新疆薰衣草产业亟待解决的种质混杂问题,通过生物技术手段,快速对提纯的优选优株组培苗进行多倍体诱导,进而有效提高和推进新疆薰衣草优质种苗的培育速率及种质创新。【拟解决的关键问题】研究通过优选优株的组培快繁,提纯薰衣草品种的种质,在良好的种质基础上,通过诱导多倍体进行种质创新,解决目前新疆薰衣草产业中栽培品种严重退化混杂,生产量及质量在逐年下降的问题。
1 材料与方法
1.1 材 料
试验以新疆薰衣草主栽品种C-197的优选优株的组培苗为试材。
1.2 方 法
1.2.1 多倍体诱导
用新疆薰衣草C-197优选优株的组培苗,剪取粗细均匀且带两个茎节的茎段,接种至多倍体诱导培养基 MS+1 mg/L 6-BA+2% DMSO(二甲基亚砜)+不同浓度的秋水仙素(0.01%、0.05%、0.1%、0.2%、0.3%、0.4%、0.5%)中,每个处理接45个茎段, 处理不同时间(24、48、72 h)后,转接到MS+1 mg/L 6-BA+0.3 mg/LIBA继代培养基上,每天光照12 h,光照强度为1 600~2 000 lx,培养温度24~28℃。
1.2.2 多倍体纯化
培养25 d后,再转接在MS+1 mg/L 6-BA+0.3 mg/LIBA继代培养基上,如此反复培养多次,培养纯合体,去除嵌合体,得到纯化的多倍体苗。从中选择变异明显的稳定植株进行鉴定。
1.2.3 多倍体鉴定
1.2.3.1 外部形态观测
形态学变化是多倍体最直观的鉴定方法[3-4]。多倍体植物的外部形态特征与二倍体相比往往表现出生长势强,植株更加强健,叶片大而厚、叶表皱缩粗糙、颜色变深等,根据以上特征对处理后变异的植株进行初步筛选。叶片大小、厚度及茎粗可用游标卡尺测量,叶绿素含量是用SPAD-502型叶绿素测定仪,在植株上均匀地取3片叶,测定其叶绿素含量的平均值。
1.2.3.2 叶片气孔观测
摘取叶片肥大具有显著多倍体植株叶片特征的叶片下表皮进行制片,在显微镜下观察测量气孔的大小,以气孔的显著增大与否及气孔密度是否显著减小作为进一步筛选鉴定多倍体的指标[5]。
1.2.3.3 流式细胞仪鉴定
以诱导存活的薰衣草各处理的纯化多倍体组培苗为材料,切取50 mg嫩叶置培养皿中,加入萃取裂解缓冲液(15 mmol/ Tris-HCl,pH 7.5,80 mmol/L KCl,20 mmol/L NaCl,20 mmol/L EDTA-Na-2,15 mmol/L巯基乙醇0.05 (V/V )TritonX-100),快速切碎并使碎片完全浸于萃取液中,避光静置萃取2~5 min,200目尼龙网过滤,离心(1 000 r/min)漂洗3次,制备的细胞核悬浮液离心后弃上清液,获得单细胞悬浮液[6-7]。用流式细胞仪测试该样品倍性的 DNA含量峰值图,以正常植株作对照,将对照出现峰值的地方作为基准,检测变异株,观察其出现峰值的地方偏移程度。
2 结果与分析
2.1 秋水仙素对材料的诱导
采用不同浓度秋水仙素及不同时间处理的薰衣草茎段,研究表明,变异率随着处理时间和浓度的变化而变化,处理时间越短,秋水仙素浓度越低,加倍率越低;处理时间延长,秋水仙素浓度增加,加倍率随之增加,但材料的死亡率也更高。0.2%~0.3%的秋水仙素处理48~72 h产生变异的效果较好,而0.2%的秋水仙素处理48 h诱变频率高达60%,0.5%秋水仙素处理死亡率过高,药害明显,低于0.05%诱变频率几乎为零。用0.2%的秋水仙素处理48 h的薰衣草茎段的变异率最高。因此,该条件下的诱导效果最好。表1
2.2 多倍体的稳定
用秋水仙素诱导的多倍体中有纯合体和嵌合体。由于嵌合体产生的变异细胞生活力较弱、分裂速度慢,而正常二倍体细胞生活力强、分裂快,嵌合体如果不经过分离稳定则会产生回复突变,最后变成正常的二倍体。试验选取变异明显的植株,切段后转接在MS+1 mg/L 6-BA+0.3 mg/LIBA继代培养基上,如此反复培养多次,培养纯合体,可得到纯化的多倍体苗。从中选择变异明显的稳定植株进行鉴定,经检测多倍体植株表现出高度的稳定性。
表1 秋水仙碱的不同浓度和不同处理时间诱导四倍体植株变化
Table 1 Effect of colchicine at different concentration and different long time on tetraploid induction
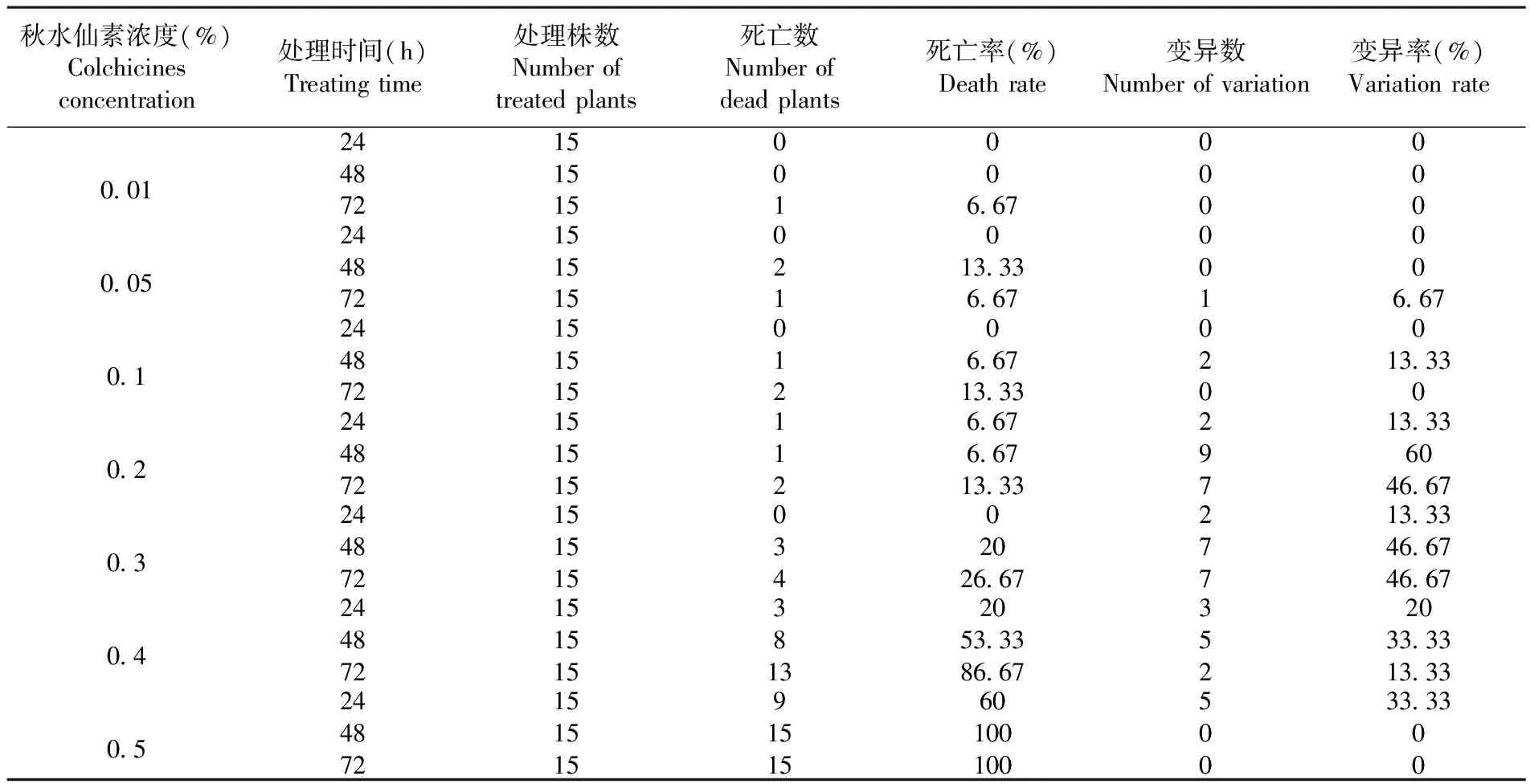
秋水仙素浓度(%)Colchicinesconcentration处理时间(h)Treatingtime处理株数Numberoftreatedplants死亡数Numberofdeadplants死亡率(%)Deathrate变异数Numberofvariation变异率(%)Variationrate0 01244872151515001006 670000000 05244872151515021013 336 67001006 670 124487215151501206 6713 33020013 3300 22448721515151126 676 6713 3329713 336046 670 324487215151503402026 6727713 3346 6746 670 424487215151538132053 3386 673522033 3313 330 5244872151515915156010010050033 3300
2.3 多倍体的鉴定
以新疆薰衣草C-197的优选优株的组培苗的叶片、茎尖、植株为对照,进行检测。
2.3.1 外部形态观测
在相同的培养条件下,对薰衣草C-197诱导的多倍体植株与对照植株进行外部形态观察比较,差异表现为:经秋水仙素处理获得的薰衣草多倍体出现叶片增大、肥厚,颜色深绿,植株粗壮,植株的生长速度明显增快;研究表明,变异植株叶片及植株明显大于对照植株。薰衣草多倍体叶片厚度、宽度、长度分别是二倍体的157.14%、173.93%、131.38%,茎粗、叶绿素含量分别是二倍体的213.21%、182.01%;方差分析结果表明,四倍体与二倍体叶片厚度、长度和宽度、茎粗及叶绿素含量均达到极显著差异,因此,用叶片的大小、茎粗及叶绿素含量可作为鉴别多倍体与二倍体的重要指标。表2,图1,图2
2.3.2 气孔鉴定
取植株形态有变化的植株与对照植株的叶表皮,用光学显微镜观察气孔,研究表明,形态有变化的植株与对照植株相比,表皮气孔直径明显增大且单位面积内的气孔数明显减少 ,可确定变异植株为多倍体。图3,图4

图1 A为对照植株叶片,B 为变异植株叶片
Fig.1 A:control plant leaves,B: variation plant leaves

图2 A为对照植株,B为变异植株
Fig.2 A:control plant,B:variation plant
表2 变异植株与对照植株外部形态及叶绿素含量比较
Table 2 External form of polyploid compared with diploid plant

样品Sample叶Leaf(mm)厚 Thickness宽 Bladewidth长 Engthofleaf茎粗(mm)Stemdiameter叶绿素含量SPADChlorophyllcontent对照植株 Controlplant0 21Bb2 57Bb5 13Bb0 53Bb15 01Bb变异植株 Variationplant0 33Aa4 74Aa6 74Aa1 13Aa27 32Aa
注:表中数据后的大、小写字母表示显著水平为0.01和0.05
Note:The Large and owercase letters after the data mean that the significant level is 0.01 and 0.05

图3 对照植株
Fig.3 Control plant
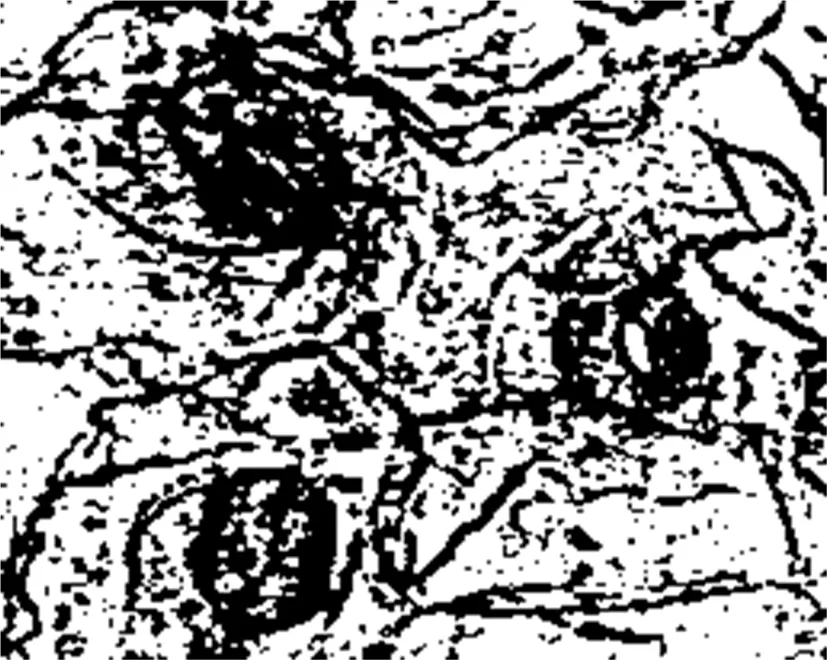
图4 变异植株
Fig.4 Variation plant
2.3.3 流式细胞仪鉴定
以新疆薰衣草C-197的组培苗植株的叶片为对照,对变异株的新鲜幼嫩叶片进行细胞DNA含量测定,研究表明,对照植株叶片的DNA含量的主峰荧光强度为64(图5);变异植株(图6)所示:植株的叶片DNA含量的主峰荧光强度为96,是对照植株的非整数倍,可确定为嵌合体,在用秋水仙素诱导多倍体时,这种非整数倍占大多数;而变异植株(图7)所示:植株的叶片DNA含量的主峰荧光强度为128,为对照的两倍,即可确定为纯合的多倍体植株。图5~7
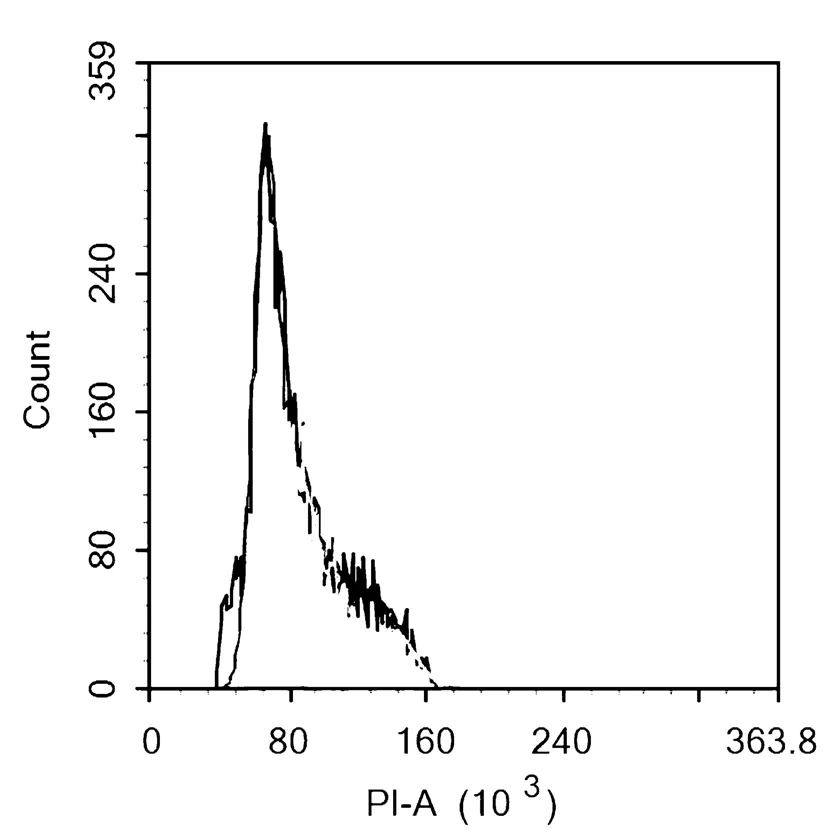
图5 对照植株DNA含量分布
Fig.5 The DNA content distribution of Control plants

图6 变异植株DNA含量分布
Fig.6 The DNA content distribution of variation plants
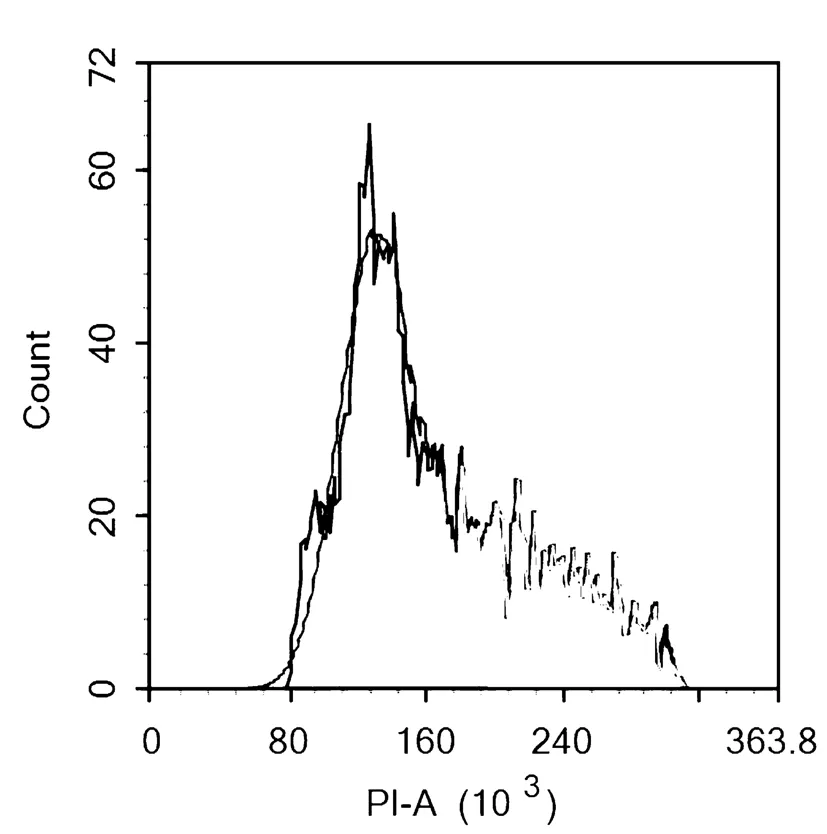
图7 变异植株DNA含量分布
Fig.7 The DNA content distribution of variation plants
3 讨 论
薰衣草的良种繁育及种质创新要通过良种筛选才得以实现,而良种筛选需要建立科学的筛选规程。在我国尚未建立薰衣草品种筛选体系和标准的情况下,研究通过对薰衣草主栽品种C-197的株型、花期、产花量等性状进行调查,选择出优选优株,并对优选优株进行组培快繁。在优质种苗快繁过程中,对C-197的优选优株进行了多倍体的诱导试验。试验结果表明:诱导薰衣草的秋水仙素浓度要适宜,不宜过低或过高,过低不能达到使植株产生变异的效果;过高会使植株产生生理性病害,同一浓度下处理的时间太短,对植株影响比较小,变异率也比较低;处理时间过长,也会对植株产生药害,表现为植株干尖、植株褐化、死亡等症状,由此可见,影响诱导薰衣草多倍体的关键条件是秋水仙素浓度及处理时间。
用秋水仙素诱导的多倍体中嵌合体占的比例比较大。由于嵌合体产生的变异细胞生活力较弱、分裂速度慢,而正常二倍体细胞生活力强、分裂快,嵌合体如果不经过分离稳定则会产生回复突变,最后变成正常的二倍体。在分离的过程中,要不断的去除那些变异小的及不能分化出正常植株的变异体,把变异大的,且能够分化出正常植株的变异体进行继代培养,一般培养5~6代以上,才能得到纯化的多倍体植株。有关嵌合体(非整数倍体)在诱导中所占比例、什么样的嵌合体更易于变为多倍体(整数倍体)等问题还有待于今后继续进行探究。
多倍体的鉴定可从植株的外部形态、叶片表皮气孔的大小、密度及叶绿素含量来判定[3-12],经秋水仙素处理获得的薰衣草多倍体出现叶片增大、肥厚,颜色深绿,植株粗壮,植株生长速度明显增快的特征。因此,叶片的大小、茎粗及叶绿素含量等可作为鉴别多倍体与二倍体的重要指标。在诱导薰衣草多倍体的过程中,尤其是在多倍体组培植株的纯化操作中,运用外部形态、叶片表皮气孔的大小、密度及叶绿素含量来判断多倍体或采用流式细胞仪对多倍体植株进行快速鉴定更为简单、方便和快捷。在实际工作中,无需先去进行染色体鉴定该植株是几倍体,只要知道是已加倍的植株,就可以先进行新品种的筛选,待该植株已被选择为新品种,再进行染色体鉴定的倍性确认。这样既能减少工作量,又能节省工作过程中大量的人力、物力及时间投入,更高效地选育出新的品种,再利用组培快繁技术提高变异植株的繁殖速率,不仅可缩短多倍体育种年限,而且可使新品种在短时期内迅速的运用于生产。
4 结 论
用0.2%~0.4%的秋水仙素对新疆薰衣草C-197的组培苗进行诱导处理48~72 h,均可使新疆薰衣草C-197的组培苗产生多倍体,0.2%的秋水仙素处理48 h诱变频率高达60%,但许多诱导出的多倍体并非都是正常的多倍体植株,而有相当部分是嵌合体(非整数倍体),所以要进行多次反复的继代,使诱导出的多倍体植株纯化后,再通过观测组培苗外部形态及气孔大小、气孔密度、或用流式细胞仪等方法进行初期的倍性鉴定,待选育的多倍体植株已被选择为新品种时,再进行染色体鉴定的倍性确认。该试验方法可更高效地选育出新的品种,并且利用组培快繁技术提高变异植株的繁殖速率,不仅可缩短多倍体育种年限,而且可使新品种在短时期内迅速的应用于生产,进而可有效提高和推进新疆薰衣草优质种苗的培育速率及种质创新。
References)
[1] 江明,夏凯国,易清元.薰衣草的育种研究进展[J].香料香精化妆品,2009,8(4):30-32.
JIANG Ming, XJA Kai-guo, YI Qing-yuan.(2009).The Study on Development of Breeding of Lavender [J].FlavorFragranceCosmetics,(4):30-32. (in Chinese)
[2] 邓平平,罗乐,张启翔. 植物组培与多倍体育种相结合的研究进展[J]. 北方园艺,2009,(5):111-113.
DENG Ping-ping, LUO Le, ZHANG Qi-xiang.(2009).The Research of the Domestic Plant Tissue Culture in Connection with the Polyploid Breeding [J].NorthernHorticulture, (5):111-113. (in Chinese)
[3]杨辉,缑辉,周涤,等.彩色马蹄莲不同品种多倍体诱导研究初探[J].云南农业大学学报,2014,29(2):229-234.
YANG Hui, GOU Hui, ZHUO Di, et al.(2014). Studies on Polyploid Induction of Different Varieties of the Colored Zantedeschia Hybrid[J].JournalofYunnanAgriculturalUniversity,29(2):229-234 .(in Chinese)
[4] 陈柏君, 高山林, 卞云云. 黄芩组织培养同源四倍体的诱导[J]. 植物资源与环境学报,2000, 9(1):9-11.
CHEN Bai-jun, GAO Shan-lin, BIAN Yun-yun. (2000).The induction of autotetraploid of Scutellaria baicalensis Georgi by tissue culture[J].JournalofPlantResourcesandEnvironment, , 9(1):9-11. (in Chinese).
[5] 杨莉,韦美丽,黄天卫,等. 用气孔保卫细胞叶绿体鉴定三七多倍体方法初探[J]. 现代中药研究与实践,2015, 29 (3):15-17.
YANG Li, WEI Mei-li, HUANG Tian-wei, et al . (2015). Study on the Method of Field Induced Polyploid of Notoginseng with Colchicines [J] .ResearchandPracticeonChineseMedicines, 29(3):15-17. (in Chinese)
[6]康喜亮,郝秀英,刘敏,等.秋水仙素诱导天山雪莲四倍体的研究[J]. 西北植物学报,2011,1(1):180-185.
KANG Xi-liang, HAO Xiu-ying, LIU Min, et al.(2011). Tetraploid Induction of Saussurea involucrata Kar .et Kir .by Colchicine [J].ActaBotanicaBoreali-OccidentaliaSinica, 1(1):180 -185. (in Chinese)
[7] 于红梅,王静,赵密珍,等. 利用流式细胞仪检测草莓倍性方法的优化[J]. 南方农业学报,2012,43(10):1 530-1 533.
YU Hong mei, WANG Jin, ZHAO Mi-zhen, et al.(2012). Optimization of strawberry ploidy identification method using flow cytometry[J].JournalofSouthernAgriculture, 43(10):1,530-1,533. (in Chinese).
[8] Weber, S., Unker, F., & Friedt, W. (2005). Improved doubled haploid production protocol for brassica napus using microspore colchicine treatment in vitro and ploidy determination by flow cytometry.PlantBreeding, 124(5):511-513.
[9] Georgiev, V., Weber, J., Bley, T., & Pavlov, A. (2009). Improved procedure for nucleus extraction for dna measurements by flow cytometry of red beet (BetavulgarisL.) hairy roots.JournalofBioscience&Bioengineering, 107(4):439-441.
[10]郑思乡,章海龙,董志渊,等. 东方百合多倍体诱导及种球繁育的研究[J].西南农业大学学报(自然科学版), 2004, 26(3):260-263.
ZHENG Si-xiang, ZHANG Hai-liong, DONG Zhi-yuan, et al. (2004). Polyploidy induction and in vitro bulb propagation of Oriental hybrids[J].JournalofSouthwestAgriculturalUniversity(NaturalScience), 26(3):260-263. ( in Chinese)
[11] 王小华,熊丽,屈云慧,等.中国桔梗多倍体诱导与鉴定[J].云南植物研究,2006,28 (6):593-598.
WANG Xiao-hua, XIONG Li, QU Yun-hui, et al . (2006). The ployploid induction and identif ication of platycodon grandiflorus(Campanulaceae) in China [J].ActaBotanicaYunnanica, 28 (6):593-598. ( in Chinese)
[12] 李涵, 鄢波,张婷,等. 切花非洲菊多倍体诱变初报[J]. 园艺学报,2009, 36(4):605-610.
LI Han, YAN Bo, ZHANG Ting, et al .(2009). Preliminary Studies on Polyploidy Mutation of Cut Flower Gerbera jamesonii Bolus[J].ActaHorticulturaeSinica, 36(4):605-610.( in Chinese)
Preliminary Study on Polyploid Induction of Xinjiang Lavender
LIAO Qing1, Marhaba Wsman1, SHA Hong1, GAO Yan1, GONG Song-wang2, LIAO Zhi-li1
(1.ResearchInstituteofHorticulturalCrops,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China; 2.HuochengCountyAgriculturalTechnologyExtendingStationsofXinjiang,HuochengXinjiang835200,China)
【Objective】 The polyploid plants will be induced by tissue culture seedlings of C-197, which is the main cultivar of Xinjiang lavender, and the rapid propagation system of polyploid plants will be established, the research aims to explore the effective ways of Xinjiang lavender germplasm resources innovation technology and provide the technical support for the Xinjiang lavender industry. 【Method】The optimal strains of C - 197 tissue-cultured plantlets were taken as the testing material, polyploid plants were induced on polyploid induction medium MS+1 mg/L 6-BA+2% DMSO + different concentrations of colchicine. Different time treatments causing polyploidy in different concentrations of colchicines were compared, thus determining the suitable concentration and time for C-197 polyploid colchicine concentration and treatment time. 【Result】Xinjiang lavender C-197 optimum strains of aseptic seedlings can make its seedlings to produce polyploid after 48-72 h explanted on induction medium MS+1 mg/L6-BA+2% DMSO +0.2%-0.4% colchicines. 【Conclusion】Using the test method of inducing polyploid plants from tissue-cultured plantlets of optimal strains of C-197 can quickly realize the lavender polyploid plant new variety breeding, shorten the breeding period, improve and promote the Xinjiang lavender quality seedlings breeding rate and germplasm innovation work.
Xinjiang lavender C-197; colchicine; induction; polyploid
LIAO Qing(1962-), Associate Professor, Bachelor of Agricalture, ornamental horticultare
10.6048/j.issn.1001-4330.2017.04.008
2017-02-07
新疆维吾尔自治区公益性科研院所基本科研业务费专项项目“新疆特色经济花卉薰衣草资源的种质优化”(KY2014033)
廖晴(1962-),女,四川安岳人,副研究员,研究方向为园艺观赏学,(E-mail)lq08270029@sina.com
S573+9
A
1001-4330(2017)04-0645-07
Supported by: Special Funded Projects of public welfare scientific institution in Xinjiang Uygur Autonomous Region "Xinjiang characteristic economy flowers lavender germplasm optimization of resources" (KY2014033)
