抗氧化剂与脑小血管病关系的研究进展
2017-06-07王裕鹏孙石磊
王裕鹏 孙石磊
郑州大学第一附属医院 郑州 450052
·综述与讲座·
抗氧化剂与脑小血管病关系的研究进展
王裕鹏 孙石磊△
郑州大学第一附属医院 郑州 450052
脑小血管病(CSVD)指影像学表现不同,但有相似临床特征、病理过程,影响脑小穿支动脉、小动脉(直径40~200 μm)、毛细血管和小静脉一组病变,导致患者认知功能下降和身体残疾。除高血压、年龄外,其与传统血管病危险因素的关系不明确,其发病机制尚不明确,近年来成为国内外研究的热点。氧化应激由体内促氧化剂与抗氧化剂水平之间的不平衡造成,可破坏脂质、蛋白质及DNA,与许多疾病的病理过程相关,本文简要论述近年国内外有关抗氧化剂与脑小血管病之间关系的研究进展。
脑小血管病;氧化应激;抗氧化剂
1 脑小血管病(CSVD)
1.1 脑小血管病(CSVD) CSVD代表影响脑小穿支动脉、小动脉(直径40~200 μm)、毛细血管和小静脉的一组病变,其有相似的病理过程。脑小血管病包括皮质下梗死、腔隙、白质高信号、扩大的血管周围间隙、微出血、微小梗死和脑萎缩[1],疾病负担占全球脑血管病的1/5。脑小血管病十分常见并导致认知功能下降,精神障碍和身体残疾,与45%的痴呆有关[2]。因其病因多样,且不明确,所以,预防和治疗效果不满意,甚至可能是有害的。
1.2 脑小血管病发病机制的研究进展 脑小血管病的发病机制尚不明确,虽认为脑小血管病的病理过程与常见血管病危险因素有关,但对于其如何导致脑小血管病的发生发展还是知之甚少,常见动脉粥样硬化危险因素中,只有年龄和高血压较明确。脑小血管病最早被认为是由于小动脉粥样硬化改变、脂质沉积,后来被认为是由于高血压、小动脉痉挛,然而,最近更多的研究倾向于由小血管内皮细胞与血脑屏障的破坏及功能紊乱造成。Meta分析显示,只有10%~15%的皮质下梗死及脑白质高信号来源于栓塞事件,而动脉粥样硬化对脑小血管病作用并不大。
现有观点认为,脑小血管病的病理变化包括微小血管壁内皮细胞功能紊乱及血脑屏障的破坏,通透性增加,血浆成分和炎症细胞进入血管壁及血管周围组织,导致小动脉管壁平滑肌细胞破坏及纤维蛋白沉积,血管壁增厚,形成脂质透明变性和纤维素样坏死[3]。导致血管腔的扩张或狭窄,僵硬的血管腔逐渐失去自我调节能力[4]。病变早期,血管周围组织水肿,水肿造成脑组织的损伤,逐渐引起细胞减少及髓鞘脱失,表现为脑白质高信号[5]。上述变化还可导致扩大的血管周围间隙、脑微出血及皮质下梗死。此外,一些研究还发现,脑血流量的下降与脑小血管病有关[6]。氧化应激和炎症反应破坏血-脑屏障,是一个突出且被发现已久的病理生理过程,其促进了脑小血管病的发生[3]。
2 氧化应激与抗氧化剂
氧化应激是促氧化剂与抗氧化剂之间失衡、促氧化剂水平超过抗氧化剂造成的[7],氧化应激可破坏脂质、蛋白质及DNA。脑需要大量的氧供,这使得脑易受到氧化应激的损伤。氧化应激产生的自由基是导致脑损伤的重要机制[8]。脑有强的抗氧化应激损伤能力,主要通过抗氧化剂及内源性抗氧化酶如超氧化物歧化酶(SOD)的作用,氧化应激同样促进脑小血管病(CSVD)的发生发展。一些研究发现,抗氧化剂与脑小血管病的病理生理过程相关,在此我们探讨抗氧化剂与CSVD的关系。
3 抗氧化剂与脑小血管病之间的关系
3.1 氧化应激与脑小血管病 大量证据表明,氧化应激影响大脑功能及其循环。超氧化物主要由NADPH氧化酶催化产生,NADPH氧化酶的激活可能是脑小动脉结构变化的关键环节。主要通过以下几点:(1)氧化应激减弱NO的生理作用:影响内皮依赖型NO信号通路,超氧化物与NO反应且抑制内皮型一氧化氮合酶(eNOS)的生物活性,从而减少NO含量,减弱NO显著的血管扩张、抗炎、抗内皮增值功能[9]。此外,NO与超氧化物反应产生活性氮ONOO,ONOO是一种强氧化剂,可通过对蛋白质和DNA的损伤而加重血管功能紊乱,并减弱血管对NO的反应[10]。活性氧(ROS)及减少的NO可直接增加Rho激酶通路,从而增加血管紧张性。(2)改变脑小血管的结构:氧化应激影响内皮功能,破坏血管内皮细胞间的紧密连接[11]。同时使血管结构重构(肥大或向内重构)[12]。(3)氧化应激破坏血脑屏障:动物实验证实,NADPH氧化酶2在缺血诱导血脑屏障破坏的过程中发挥重要作用,而NADPH氧化酶抑制剂罗布麻宁能减轻血脑屏障的破坏[13]。随后有大量实验对其进行了验证。
3.2 抗氧化剂与脑小血管病的关系 体内常见的抗氧化剂包括尿酸(UA)、胆红素、维生素C、维生素E、维生素A、胡萝卜素等。
尿酸:尿酸是嘌呤核苷酸的代谢终产物。是大脑中最重要的清除自由基的内源性抗氧化剂之一,清除血清中一半以上的自由基。研究表明,其具有神经保护作用,如低UA与老年人阿尔茨海默病(AD)和轻度认知[14]以及帕金森病相关[15]。然而,有文献指出,尿酸含量越高,卒中的发生风险越高[16]。Hayden等[17]研究发现,当血清UA>68.4 μm/L时,其抗氧化剂作用可能变成一种促氧化剂。尿酸这把双刃剑是作为抗氧化剂起神经保护作用还是作为一种促氧化剂起神经毒害作用仍需探讨。
Schretlen等[18]于2007年的一项研究发现,年龄分布在20~92岁的社区人群中,在调整性别、年龄及血管病危险因素后,尿酸正常高值人群与正常中等及低值人群相比,WMH总体积增加的风险升高2.81倍(95%CI=1.10~7.01,P=0.02),深部WMH病变体积增加的风险增高3.59倍(95%CI=1.46~8.85,P=0.006);在60岁以上老年人群中作用更显著。最近有研究发现,血清尿酸(UA)水平增加与脑白质高信号(WMH)体积呈正相关,即使是轻度升高的血清尿酸水平也与WMH体积的增大有关,尤其在老年人群中[19]。Han等[20]研究表明,在皮质下梗死患者中,脑白质高信号体积与年龄及血清尿酸水平呈正相关(r=0.275,P=0.003)。鹿特丹研究发现,较高的血清尿酸与认知功能减退及脑白质萎缩呈正相关[21]。Ryu等[22]研究发现,在高血压患者中,尿酸水平高组脑微出血的发病风险是水平低组的2.74倍(OR=2.74,95%CI=1.43~5.24,P<0.05),并且与深部及幕下的微出血相关,而在血压正常者中差异无统计学意义。Zhou等[23]研究发现,高尿酸是皮质下梗死及脑白质高信号的危险因素(OR=2.135,95%CI=1.521~2.996,P<0.001)。
胆红素:胆红素是主要的内源性脂溶性抗氧化剂,在多种组织和器官中发挥细胞保护作用。胆红素是血红素分解代谢的终产物。Zhou等[23]研究发现,胆红素是皮质下梗死及脑白质高信号的保护性因素(低剂量组与高剂量组相比,OR=2.702,95%CI=1.936~3.770,P<0.001)。研究指出,在韩国女性患者中,多因素分析在调整传统脑血管病危险因素后,血清总胆红素三分(总胆红素≤10 μmol/L与>15~26 μmol/L相比,OR=5.5,95%CI=1.24~24.4,P=0.025),结果显示,胆红素是脑白质高信号的保护性因素,而在男性中差异无统计学意义[24]。Li等[25]研究胆红素与静默脑梗死(大部分为皮质下梗死)关系时发现,胆红素为其保护性因素(OR=0.925,95%CI=0.897~0.954,P<0.001)。
其他抗氧化剂与脑小血管病的关系:Polidori等[26]研究发现,血管性痴呆患者血清中的维生素C、尿酸等水溶性抗氧化剂及包括维生素E、维生素A、胡萝卜素在内的脂溶性抗氧化剂比正常对照组血清中的含量低。类胡萝卜素已经被证实是有效的单线态氧猝灭剂和氧化自由基清除剂,Rotterdam Scan Study发现,血清中类胡萝卜素的升高是侧脑室旁脑白质高信号的保护因素[27]。Ortega等[28]研究发现血清中维生素E水平与老年人群的认知功能下降负相关。Gopalan等[29]2014年发表在Stroke上的一项随机、双盲、安慰剂对照试验发现,随访2 a,口服维生素E组脑白质高信号体积较前无明显变化,而安慰机组较前增大,2组脑白质高信号体积差异有统计学意义(P=0.019),而2组人群基线资料并无显著差异。
4 抗氧化剂影响脑小血管病发生发展的病理生理机制
尿酸影响脑小血管病可能的病理生理机制:(1)引起血管内皮细胞功能紊乱[30]且影响血小板的正常功能。虽尿酸是一种抗氧化剂,但在一些情况下可起到促氧化作用。(2)导致血脑屏障的破坏:尿酸可减少NO的生成,使血管紧张性升高及血管内皮细胞功能紊乱,刺激血管平滑肌细胞增殖[31],从而使血脑屏障破坏。(3)与高血压及慢性炎症反应相关:尿酸水平升高与血管病的危险因素,如高血压、糖尿病、全身炎症反应及血脂异常有关[19]。此外,尿酸的生成需要黄嘌呤氧化酶的催化,黄嘌呤氧化酶发挥作用的过程中可生成超氧阴离子自由基,导致脑的氧化应激损伤,这可能意味着黄嘌呤氧化酶活性是主要危险因素,血尿酸作为抗氧化剂是黄嘌呤氧化酶的附加产物,是黄嘌呤氧化酶活性程度的标志物[32]。
胆红素影响脑小血管病可能的病理生理机制:(1)强效抗氧化剂:胆红素是一种强效的抗氧化剂[33],胆红素是NADPH氧化酶的抑制剂,抑制氧化应激过程[34],且发挥细胞保护作用[35]。(2)抑制炎症反应:胆红素清除脑组织中的氧自由基并抑制低密度脂蛋白及其他脂质的氧化,从而抑制动脉粥样硬化的发展[36]。血清胆红素浓度与体重指数、甘油三酯及胰岛素抵抗呈负相关[37],而这些都属于慢性炎症过程。(3)与血压呈负相关:研究表明,血清胆红素浓度与血压水平呈负相关,Hunt等[38]研究发现,与血压正常人相比,血清胆红素浓度在未经治疗的高血压患者中明显降低。(4)胆红素水平低与内皮细胞功能紊乱及颈内动脉内膜增厚相关,高水平胆红素具有保护作用。
此外,维生素E除具有抗氧化性外,还能抑制谷氨酸介导的神经损伤。类胡萝卜素可清除自由基,抑制低密度脂蛋白的氧化,从而抑制脑小血管病的病理生理过程。
5 总结与展望
抗氧化剂与脑小血管病(CSVD)的关系有待于进一步研究,目前的研究倾向于尿酸促进脑小血管病的发生发展,而胆红素及其他血清抗氧化剂对脑小血管具有保护作用,需进一步的研究验证。
脑小血管病的疾病负担重,病理机制不清,影像学的发展及大量研究的开展都将进一步阐明其病理生理过程,目前还缺乏饮食习惯等生活方式改变或药物治疗预防和减慢其发生发展的强有力证据。
综上所述,氧化应激在脑小血管病病理生理过程中发挥重要的作用,仍需大规模的前瞻性、随机对照试验来验证不同剂量的外源性抗氧化剂与脑小血管病之间的关系,如得到添加维生素类抗氧化剂有益的阳性结果,我们可用维生素类抗氧化剂对脑小血管病进行有效防治。
[1] Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:insights from neuroimaging[J].Lancet Neurol,2013,12(5):483-497.
[2] Gorelick PB,Scuteri A,Black SE,et al.Vascular contributions to cognitive impairment and dementia a statement for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2011,42(9):2 672-2 713.
[3] Ihara M,Yamamoto Y.Emerging evidence for pathogenesis of sporadic cerebral small vessel disease[J].Stroke,2016,47(2):554-560.
[4] Stevenson SF,Doubal FN,Shuler K,et al.A systematic review of dynamic cerebral and peripheral endothelial function in lacunar stroke versus controls[J].Stroke,2010,41(6):e434-e442.
[5] Fazekas F,Kleinert R,Offenbacher H,et al.Pathologic correlates of incidental MRI white matter signal hyperintensities[J].Neurology,1993,43(9):1 683-1 683.
[6] Appelman APA,Van der Graaf Y,Vincken KL,et al.Total cerebral blood flow,white matter lesions and brain atrophy:the SMART-MR study[J].J Cereb Blood Flow Metab,2008,28(3):633-639.
[7] Sies H.Oxidative stress:oxidants and antioxidants[J].Exp Physiol,1997,82(2):291-295.
[8] Traystman RJ,Kirsch JR,Koehler RC.Oxygen radical mechanisms of brain injury following ischemia and reperfusion[J].J Appl Physiol,1991,71(4):1 185-1 195.
[9] Miller AA,De Silva TM,Judkins CP,et al.Augmented superoxide production by Nox2-containing NADPH oxidase causes cerebral artery dysfunction during hypercholesterolemia[J].Stroke,2010,41(4):784-789.
[10] Xie H,Ray PE,Short BL.NF-κB activation plays a role in superoxide-mediated cerebral endothelial dysfunction after hypoxia/reoxygenation[J].Stroke,2005,36(5): 1 047-1 052.
[11] Xu Y,Gong B,Yang Y,et al.Glutathione-S-transferase protects against oxidative injury of endothelial cell tight junctions[J].Endothelium,2007,14(6):333-343.
[12] Baumbach GL.Nox2 deficiency prevents hypertension-induced vascular dysfunction and hypertrophy in cerebral arterioles[J].Int J Hypertens,2013:793 630.
[13] Kahles T,Luedike P,Endres M,et al.NADPH oxidase plays a central role in blood-brain barrier damage in experimental stroke[J].Stroke,2007,38(11):3 000-3 006.
[14] Rinaldi P,Polidori MC,Metastasio A,et al.Plasma antioxidants are similarly depleted in mild cognitive impairment and in Alzheimer’s disease[J].Neurobiol Aging,2003,24(7):915-919.
[15] de Lau LML,Koudstaal PJ,Hofman A,et al.Serum uric acid levels and the risk of Parkinson disease[J].Ann Neurol,2005,58(5):797-800.
[16] Chien KL,Hsu HC,Sung FC,et al.Hyperuricemia as a risk factor on cardiovascular events in Taiwan:the Chin-Shan Community Cardiovascular Cohort Study[J].Atherosclerosis,2005,183(1):147-155.
[17] Hayden MR,Tyagi SC.Uric acid:A new look at an old risk marker for cardiovascular disease,metabolic syndrome,and type 2 diabetes mellitus:The urate redox shuttle[J].Nutr Metab,2004,1(1):10.
[18] Schretlen DJ,Inscore AB,Vannorsdall TD,et al.Serum uric acid and brain ischemia in normal elderly adults[J].Neurology,2007,69(14):1 418-1 423.
[19] Shih CY,Chen CY,Wen CJ,et al.Relationship between serum uric acid and cerebral white matter lesions in the elderly[J].Nutr Metab Cardiovasc Dis,2012,22(2):154-159.
[20] Han SW,Song TJ,Bushnell CD,et al.Serum Uric Acid Is Associated with Cerebral White Matter Hyperintensities in Patients with Acute Lacunar Infarction[J].J Neuroimaging,2016,26(3):351-354.
[21] Verhaaren BFJ,Vernooij MW,Dehghan A,et al.The relation of uric acid to brain atrophy and cognition:the Rotterdam Scan Study[J].Neuroepidemiology,2013,41(1):29-34.
[22] Ryu WS,Kim CK,Kim BJ,et al.Serum uric acid levels and cerebral microbleeds in patients with acute ischemic stroke[J].PloS One,2013,8(1):e55210.[23] Zhou X,Wang L,Liu H,et al.Serum antioxidant levels associated with subcortical ischemic vascular disease[J].Can J Neurol Sci,2014,41(3):375-381.
[24] Park BJ,Shim JY,Lee HR,et al.Association between serum total bilirubin level and leukoaraiosis in Korean adults[J].Clin Biochem,2012,45(4):289-292.
[25] Li RY,Cao ZG,Zhang JR,et al.Decreased serum bilirubin is associated with silent cerebral infarction[J].Arterioscler Thromb Vasc Biol,2014,34(4):946-951.
[26] Polidori MC,Mattioli P,Aldred S,et al.Plasma antioxidant status,immunoglobulin g oxidation and lipid peroxidation in demented patients:relevance to Alzheimer disease and vascular dementia[J].Dement Geriatr Cogn Disord,2004,18(3/4):265-270.
[27] Den Heijer T,Launer LJ,De Groot JC,et al.Serum carotenoids and cerebral white matter lesions:the Rotterdam scan study[J].J Am Geriatr Soc,2001,49(5):642-646.
[28] Ortega RM,Requejo AM,López-Sobaler AM,et al.Cognitive function in elderly people is influenced by vitamin E status[J].J Nutr,2002,132(7):2 065-2 068.
[29] Gopalan Y,Shuaib IL,Magosso E,et al.Clinical investigation of the protective effects of palm vitamin E tocotrienols on brain white matter[J].Stroke,2014, 45(5):1 422-1 428.
[30] Kang DH,Park SK,Lee IK,et al.Uric acid-induced C-reactive protein expression:implication on cell proliferation and nitric oxide production of human vascular cells[J].J Am Soc Nephrol,2005,16(12):3 553-3 562.
[31] Vannorsdall TD,Jinnah HA,Gordon B,et al.Cerebral ischemia mediates the effect of serum uric acid on cognitive function[J].Stroke,2008,39(12):3 418-3 420.
[32] Berry C,Hamilton CA,Brosnan MJ,et al.Investigation into the sources of superoxide in human blood vessels angiotensin Ⅱ increases superoxide production in human internal mammary arteries[J].Circulation,2000,101(18):2 206-2 212.
[33] Stocker R,Yamamoto Y,McDonagh AF,et al.Bilirubin is an antioxidant of possible physiological importance[J].Science,1987,235(4 792):1 043-1 046.
[34] Jiang F,Roberts SJ,Datla Sr,et al.NO modulates NADPH oxidase function via heme oxygenase-1 in human endothelial cells[J].Hypertension,2006,48(5):950-957.
[36] Neuzil J,Stocker R.Free and albumin-bound bilirubin are efficient co-antioxidants for alpha-tocopherol,inhibiting plasma and low density lipoprotein lipid peroxidation[J].J Biol Chem,1994,269(24):16 712-16 719.
[37] Bhuiyan AR,Srinivasan SR,Chen W,et al.Association of serum bilirubin with pulsatile arterial function in asymptomatic young adults:the Bogalusa Heart Study[J].Metabolism,2008,57(5):612-616.
[38] Hunt SC,Wu LL,Hopkins PN,et al.Evidence for a major gene elevating serum bilirubin concentration in Utah pedigrees[J].Arterioscler Thromb Vasc Biol,1996,16(8):912-917.
(收稿2016-12-16)
义(P>0.05);干预后,2组NIHSS评分、SF-36评分差异有统计学意义(P<0.05)。见表2。
表2 2组干预前后NIHSS评分、SF-36评分对比,分)
2.3 2组护理满意度对比 2组护理满意度比较差异有统计学意义(χ2=11.89,P<0.01)。见表3。

表3 2组护理满意度对比 [n(%)]
2.4 2组并发症发生情况对比 2对照组并发症发生率比较差异有统计学意义(χ2=5.96,P<0.05)。见表4。
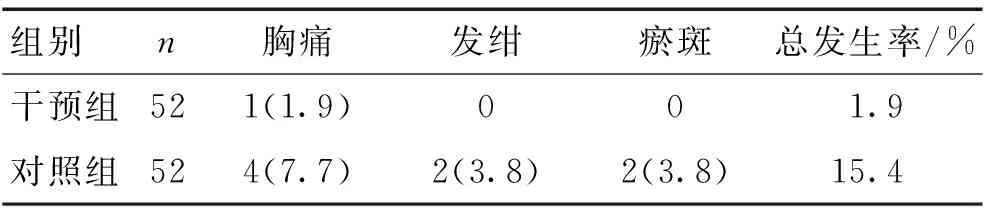
表4 2组并发症发生情况对比 [n(%)]
3 讨论
脑卒中患者进行溶栓治疗的最佳时机是发病6 h内,积极实施对症治疗能有效降低患者出现再灌注损伤的概率。一旦患者发病时间>6 h,会释放大量的氧自由基,致使其出现酸中毒、脂质过氧化反应等。在溶栓治疗的过程中,极易导致患者出现缺血再灌注损伤,给其治疗效果和预后带来严重影响[5]。临床采取积极措施,提升脑卒中合并脑栓塞诊断效果,尽早进行对症治疗,把握最佳溶栓治疗时机,从而对脑组织损伤进行控制至关重要。
通常情况下,多数脑卒中合并脑栓塞患者为中老年人,其对疾病相关知识、溶栓治疗知识的掌握程度不够,加上对疾病及医疗费用的担心,导致其出现较大的心理负担,引发焦虑、抑郁等负性情绪,影响治疗及康复效果[6]。所以,需加强脑卒中合并脑栓塞患者的护理干预,切实消除患者不良心理,提升依从性,改善治疗效果。综合护理强调在全面了解和掌握患者具体情况的基础上,通过一系列针对性护理服务,提升护理效果[7]。
本研究对干预组患者实施综合护理,内容包括基本护理、血压监测、血糖及体温监测、心理护理、健康教育等。其中,基本护理强调对患者不良生活习惯进行纠正,并做好口腔、皮肤、尿道等护理工作;确保患者气道处于通畅状态,并指导其进行适量早期患肢功能锻炼。脑卒中患者极易受多种因素的影响,导致其血压水平出现变化,需进行密切监测,避免出现意外。同样需加强患者的体温及血糖监测,防止患者出现较大血糖波动,加重脑损伤。健康教育和心理护理能提升患者对健康知识的掌握,帮助患者调整心理状态,促使其树立战胜疾病的信心。
本研究显示,干预组临床治疗总有效率明显高于对照组(P<0.05),干预后2组NIHSS评分、SF-36评分差异有统计学意义(P<0.05),护理满意度高于对照组,并发症发生率低于对照组(P<0.05),显示了综合护理在脑卒中合并脑栓塞患者中应用的优势,与文献[8-10]相符。
4 参考文献
[1] 凌云,黄晶晶.心脏瓣膜置换术后脑卒中的观察和护理[J].岭南心血管病杂志,2014,20(4):555-556.
[2] 于大林,明利,唐贤勇,等.血浆标志物与不同类型急性脑梗死的相关性研究[J].中国全科医学,2015,18(5):516-520.
[3] 刘喜平,窦志飞,胡树华.高龄非瓣膜性心房颤动脑栓塞患者不同抗栓药物二级预防临床观察[J].心脑血管病防治,2013,13(6):487-489.
[4] 柯来顺,董闽田,卢武生,等.56例心源性脑栓塞患者静脉溶栓治疗的疗效观察[J].卒中与神经疾病,2014, 21(2):81-83.
[5] 许海雁.1例风湿性心瓣膜病突发脑栓塞患者的护理[J].中国实用护理杂志,2013,29(34):35-37.
[6] 艾艳,王芸,余茜,等.以患者需求为导向的脑卒中延续护理模式效果的问卷调查[J].中国康复医学杂志,2015,30(12):1 278-1 280.
[7] 戴萍,陆克亮,李卫飞.房颤并发脑栓塞66例临床分析[J].中华全科医学,2014,12(10):1 565-1 567.
[8] 孙爱国,刘婷婷,刘晓丹,等.脑卒中患者连续性护理的应用及效果评价[J].中国医院管理,2014,34(9):71-73.
[9] 徐玫.康复护理干预对脑卒中合并肩关节脱位的效果[J].广东医学,2014,35(22):3 604-3 606.
[10] 梅嵘,李良,左选琴,等.重症脑卒中患者合并肺部感染的原因调查与护理对策[J].中华现代护理杂志,2014,49(21):2 657-2 659.
(收稿2016-12-07)
R743
A
1673-5110(2017)11-0081-04
△通讯作者:孙石磊,郑州大学第一附属医院,E-mail:sunshilei18@hotmail.com
