舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤的疗效和安全性
2017-06-07陈小兵
张 斌 陈小兵
1)河南夏邑县人民医院肿瘤科 夏邑 476400 2)河南省肿瘤医院消化内科 郑州 450008
舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤的疗效和安全性
张 斌1)陈小兵2)
1)河南夏邑县人民医院肿瘤科 夏邑 476400 2)河南省肿瘤医院消化内科 郑州 450008
目的 观察舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤的疗效和安全性。方法 选择122例晚期进展胃肠道神经内分泌肿瘤患者为研究对象,采用随机数字表法分为观察组和对照组各61例,对照组采用长效奥曲肽治疗,观察组采用舒尼替尼治疗。随访6个月,比较2组肿瘤直径、临床疗效、不良反应等。结果 治疗6个月后,观察组肿瘤直径<1 cm者占83.61%,明显高于对照组的50.82%(χ2=14.878,P<0.01);疾病控制率93.44%,明显高于对照组的80.33%(χ2=4.604,P<0.05);肾功能损害、肝功能损害明显低于对照组(14.75% vs 29.51%,19.67% vs 39.34%,χ2=3.853、5.674,P<0.05)。结论 舒尼替尼治疗有助于控制晚期进展胃肠道神经内分泌肿瘤进展,减轻肝、肾功能损害程度,改善生活质量。
进展胃肠道神经内分泌肿瘤;晚期;舒尼替尼;疾病控制;不良反应
神经内分泌肿瘤(neuroendocrine tumor,NET)是一组极其罕见的、异质性较高的肿瘤,具有低度恶性、生长缓慢的特点[1]。胃肠道神经内分泌肿瘤起源于胃肠道脱羧酶细胞和氨前体,是神经内分泌肿瘤中最常见的一类[2]。患者临床症状不典型,诊断和治疗较为困难,非手术疗法以长效奥曲肽使用较多,但药物用量较大、疗效欠佳,且对肝、肾功能的损害大[3]。舒尼替尼可抑制NET血管内皮生长因子和肝细胞因子受体等,从而抑制肿瘤血管的生成[4]。本文采取随机对照研究的方法,分析舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤的疗效和安全性。
1 对象与方法
1.1 一般资料 选择122例晚期进展胃肠道神经内分泌肿瘤患者为研究对象,经医院伦理委员会批准,告知研究事项后所有患者或家属均签署知情同意书,采用随机数字表法分为观察组和对照组各61。观察组男35例,女26例;年龄22~76岁,平均51.35岁;TNM分期:Ⅲ期32例,Ⅳ期29例。对照组男34例,女27例;年龄22~77岁,平均51.73岁;TNM分期:Ⅲ期31例,Ⅳ期30例。2组性别、年龄、肿瘤分期等一般资料比较差异无统计学意义(P>0.05),具有可比性。1.2 纳入和排除标准 纳入标准:(1)组织病理学检查确诊为胃肠道神经内分泌肿瘤;(2)影像学检查确诊为晚期进展肿瘤,失去手术机会;(3)TNM分期Ⅲ~Ⅳ期;(4)年龄22~77岁。排除标准:(1)治疗前合并心、肝、肾等脏器功能不全;(2)组织学分化差的神经内分泌癌;(3)可手术根治的早期胃肠道神经内分泌肿瘤;(4)体质过敏者。
1.3 方法 对照组使用长效奥曲肽(Novartis Pharma Stein AG生产,批准文号:注册证号H20090948,规格1 mL:0.1 mg)治疗,起始剂量20 mg,逐渐加量,到第4周时注射剂量30 mg,4周一疗程。长效奥曲肽的成分主要是微球蛋白,由于颗粒大,容易造成针管阻塞,注射过程中应尤为注意。
观察组给予舒尼替尼(意大利辉瑞公司,批准文号:注册证号H20100777,规格12.5 mg/粒)治疗,标准用药剂量37.5 mg/d,如果患者出现严重的不良反应,可逐渐减量至12.5 mg。2组均连续治疗6个月。
1.4 观察指标
1.4.1 肿瘤直径:治疗6个月后,采用MRI、CT等影像学方法测量肿瘤直径,比较2组肿瘤直径<1 cm、<2 cm和≥3 cm的患者情况。
1.4.2 临床疗效:采用实体肿瘤疗效评价标准(RECIST 1.1)[5]评价临床疗效。完全缓解(CR):病灶完全消失且维持时间≥4周;部分缓解(PR):肿瘤病灶最大径与最大垂直径乘积减少>50%,维持时间≥4周;稳定(SD):肿瘤病灶两径乘积减少<25%或增大<25%;病变进展(PD):肿瘤病灶两径乘积增大>25%或出现新病灶。有效率为CR、PR所占总例数百分比,疾病控制率为CR、PR、SD所占总例数的百分比。
1.4.3 不良反应:统计治疗期间骨髓抑制、腹泻、高血压、肾功能损害、肝功能损害等不良反应。
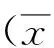
2 结果
2.1 肿瘤直径 治疗6个月后,观察组肿瘤直径<1 cm者51例,肿瘤直径<2 cm者8例,肿瘤直径≥3 cm者2例;对照组肿瘤直径<1 cm者31例,肿瘤直径<2 cm者13例,肿瘤直径≥3 cm者17例。观察组肿瘤直径<1 cm者占83.61%,明显高于对照组的50.82%(χ2=14.878,P<0.01)。
2.2 2组疗效比较 2组有效率比较差异无统计学意义(P>0.05),观察组疾病控制率明显高于对照组(P<0.05)。见表1。
2.3 2组不良反应比较 2组骨髓抑制、腹泻、高血压等不良反应比较差异无统计学意义(P>0.05),观察组肾功能损害、肝功能损害明显低于对照组(P<0.05)。见表2。

表1 2组疗效及疾病控制率比较 [n(%)]
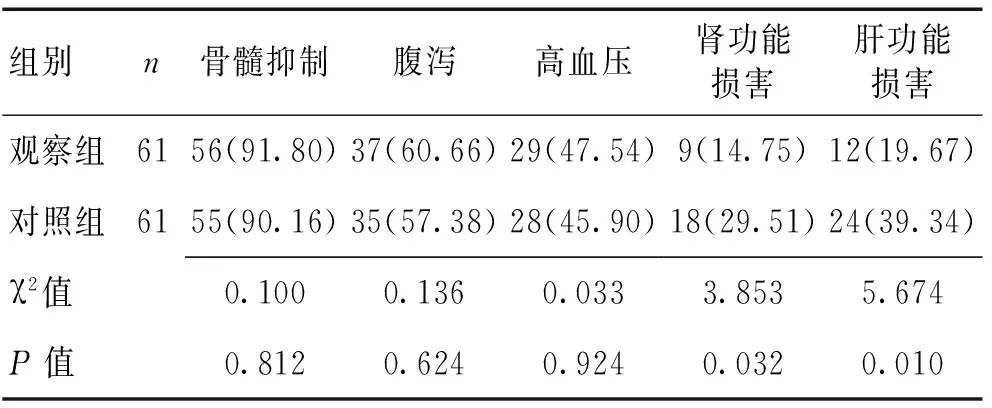
表2 2组不良反应比较 [n(%)]
3 讨论
胃肠道神经内分泌肿瘤是所有神经内分泌肿瘤中最常见的一种,临床表现与某些激素和肽类物质的过度分泌相关,大部分患者症状不明显[6]。早期诊断较为困难,而晚期进展的胃肠道神经内分泌肿瘤较多见[7]。奥曲肽是第一个用于临床的生长抑素类似物,长效奥曲肽在分化好的中肠NET中,中位生存期为14.3个月,但患者的肝、肾功能受到严重影响[8]。
舒尼替尼是一种新型靶向药物,对血小板衍生生长因子受体(platelet-derived growth factor receptors,PDGFRs)、干细胞因子受体(stem cell factor recep-tor,SCFR)、VEGF受体(VEGF receptor,VEGFR)等血管生成相关因子均具有显著的抑制作用,对胃肠道神经内分泌肿瘤具有较好的抗肿瘤活性[9]。Ito等[10]通过对12例进展型胰腺神经内分泌肿瘤(pNET)临床资料分析报道,有效率与疾病控制率分别为50%、75%,1 a无疾病进展时间为71%。随着舒尼替尼引进中国市场,对于中国患者的临床研究也逐渐展开。舒尼替尼对中国患者的敏感程度高于欧洲患者,中位生存期和无疾病进展时间高于欧洲患者[11]。本研究中,随访6个月时,观察组肿瘤直径<1 cm者比例、疾病控制率均明显高于对照组,提示舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤疗效值得肯定。
舒尼替尼是一种生物靶向制剂,针对胃肠道神经内分泌肿瘤的血管生成靶点,尤其对血管内皮生长因子有很好的抑制作用[12]。由于舒尼替尼的作用靶点准确,对正常细胞的杀伤小,不良反应低于生长抑素类似物奥曲肽[13]。国外学者研究表明,舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤主要不良不为骨髓抑制、胃肠道反应、高血压、蛋白尿、皮疹等,且均为3/4级不良反应,对患者生活质量影响较少[14-15]。本研究中,2组骨髓抑制、腹泻、高血压等不良反应差异无统计学意义,但观察组肝、肾功能损害发生率显著低于对照组,说明舒尼替尼治疗晚期进展胃肠道神经分泌肿瘤安全性值得肯定。
总之,舒尼替尼治疗有助于控制晚期进展胃肠道神经内分泌肿瘤进展,延长患者生存期,改善生活质量,且安全可靠。本研究局限性在于未对不同TNM分期晚期胃肠道进展神经分泌肿瘤患者进行比较,且缺乏舒尼替尼可能作用机制的深入分析,因此,舒尼替尼治疗晚期进展胃肠道神经内分泌肿瘤的疗效和安全性仍待进一步研究。
[1] 孟曼,夏云红,黄震琪,等.晚期胃肠道神经内分泌瘤患者治疗和生存的相关预测及预后因素分析[J].中国现代医学杂志,2015,25(23):40-45.
[2] Ding J,Sun P,Cai XY,et al.Synchronous poorly-differentiated neuroendocrine carcinoma and gastrointestinal stromal tumor of the stomach:a case report with immunohistochemical and molecular genetic analyses of KIT and PDGFRA[J].Int J Clin Exp Pathol,2014,7(12): 9 076-9 080.
[3] 吴林林,胡艳萍,刘凤阁,等.胃肠道神经内分泌肿瘤44例内镜及临床病理分析[J].疑难病杂志,2016,15(1):77-79;83.
[4] Blumenthal GM,Cortazar P,Zhang S,et al.FDA approval summary:sunitinib for the treatment of progressive well-differentiated locally advanced or metastatic pancreatic neuroendocrine tumors[J].Onclolgist,2012,17(8):1 108-1 113.
[5] Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:Revised RECIST guideline(version1.1)[J].Eur J Cancer,2009, 45(2):228-247.
[6] 郭花,王昕,王晓伟,等.胃肠道神经内分泌肿瘤的内镜下表现及治疗[J].中华消化内镜杂志,2015,32(9):608-612.
[7] 顾健,焦宇飞.胃肠胰神经内分泌肿瘤病理学特征与分级[J].现代肿瘤医学,2016,24(16):2 648-2 651.
[8] 郁明明,张如富,陈海玲,等.长效奥曲肽联合健脑补肾药治疗胃肠道神经内分泌肿瘤的疗效分析[J].中国中医药科技,2014,21(6):676-677.
[9] 高鹤丽,应红艳,程月鹃,等.舒尼替尼治疗晚期进展胰腺神经内分泌瘤临床疗效[J].中国医学科学院学报,2016,38(3):300-304.
[10] Ito T,Okusaka T,Nishida T,et al.Phase Ⅱ study of sunitinib in Japanese patients with unresectable or metastatic,well-differentiated pancreatic neuroendocrine tumor[J].Invest New Drugs,2013,31(5):1 265-1 274.
[11] 赵育凌,宋华.舒尼替尼联合醋酸奥曲肽治疗晚期胰腺神经内分泌癌患者的护理[J].中华护理杂志,2011, 46(11):1 125-1 126.
[12] 周尘飞,张俊,朱正纲.胰腺神经内分泌肿瘤的诊断及靶向治疗机制[J].诊断学理论与实践,2011,10(4):357-361.
[13] 蔡林,张崔建,李学松,等.舒尼替尼治疗转移性肾细胞癌的疗效和不良反应及其相关性分析[J].中华泌尿外科杂志,2014,35(6):425-428.
[14] Lee JL,Kim MK,Park I,et al.Randomized phase Ⅱ trial of sunitinib four weeks on and two weeks off versus two weeks on and one week off in metastatic clear-cell type renal cell carcinoma:RESTORE trial[J].Ann Oncol,2015,26(11):2 300-2 305.
[15] Jann H,Denecke T,Koch M,et al.Impact of octreotide long-acting release on tumour growth control as a first-line treatment in neuroendocrine tumours of pancreatic origin[J].Neuroendocrinology,2013,98(2):137-143.
(收稿2016-12-15)
R735
B
1673-5110(2017)11-0090-03
