人脑挫裂伤早期HMGB1的表达变化特征
2017-06-07贾利云姚安会李经纶王本瀚
贾利云 姚安会 李经纶 刘 伟 王本瀚△
1)新乡医学院 新乡 453000 2)解放军第153中心医院神经外科 郑州 450042 3)郑州大学基础医学院 郑州 450001
人脑挫裂伤早期HMGB1的表达变化特征
1,2)贾利云3)姚安会2)李经纶2)刘 伟2)王本瀚2)△
1)新乡医学院 新乡 453000 2)解放军第153中心医院神经外科 郑州 450042 3)郑州大学基础医学院 郑州 450001
目的 探讨人脑挫裂伤早期HMGB1表达的变化特征。方法 收集人脑挫裂伤后不同时间点挫裂伤组织的标本(正常组、6 h、12 h、24 h、72 h),4%多聚甲醛固定,冰冻切片,然后进行免疫荧光染色,统计分析各时间点HMGB1的表达情况;同时将HMGB1与神经元标志物NeuN进行共标,观察人脑挫裂伤后早期神经元损伤过程中从核内向胞浆内转移的情况。结果 正常人脑组织的HMGB1表达主要集中在细胞核内,与正常组相比较,人脑挫裂伤组在伤后HMGB1阳性细胞数于12 h开始下降(P<0.05),并持续至72 h;而HMGB1从核内转移至胞浆内的数目从6 h即开始增加(P<0.05),随时间增加HMGB1也随之大量转移到胞浆中,在人脑挫裂伤后24 h 达到高峰(P<0.05)。人脑挫裂伤后早期,HMGB1主要表达在神经元中(P>0.05),脑挫裂伤后神经元的数目逐渐减少(P<0.05),而HMGB1从神经元核内转移至胞浆的比例在6 h明显增加(P<0.05),于24~72 h达到高峰(P<0.05)。结论 人脑挫裂伤后早期神经元死亡或凋亡数目明显增加,HMGB1阳性细胞数也在损伤后减少;而HMGB1神经元从核内转移至胞浆的比例升高;HMGB1可能参与了脑挫裂伤后神经元的死亡或凋亡。
颅脑损伤;HMGB1;神经元
随着现代化的进程,交通及建筑业的发展,颅脑损伤的发生率越来越高,创伤性颅脑损伤(traumatic brain injury,TBI)是世界各地卫生保健系统亟待解决的重大难题,已成为威胁人们健康的主要原因之一[1-2]。高迁移率组蛋白1(high-mobility group box 1,HMGB1)为19世纪70年代发现的一种在细胞核内广泛存在、序列高度保守的非组蛋白[3]。HMGB1最初只作为一种核内蛋白研究其在细胞核内的功能,包括参与核小体的构建与功能、DNA的重组修复和复制、基因转录的调控等[4]。Wang等[5]首先发现巨噬细胞受到内毒素等刺激后可以释放HMGB1到细胞外,并作为一种炎症介质参与炎症反应的发生发展过程。释放到胞外的HMGB1不仅可以参与各种炎症性疾病,而且在肿瘤、病毒性疾病、创伤、再灌注损伤等的病理过程中也起着重要作用。HMGB1可以由坏死细胞的被动释放或炎症细胞(如巨噬细胞、单核细胞)的主动释放[6]。研究发现,TBI 后HMGB1 由坏死和损伤的神经细胞释放。释放的HMGB1与细胞膜表面受体,如RAGE、Toll样受体等模式识别受体结合,进而激活免疫细胞释放多种炎症介质,一方面介导神经细胞凋亡;另一方面,通过多种复杂的病理生理机制,对脑组织造成二次损伤,形成恶性循环[7-8]。以往关于HMGB1在脑挫裂伤后的研究多基于动物实验,而且多集中在脑挫裂伤后炎症反应的形成机制方面。对人脑挫裂伤后早期HMGB1的表达变化,尤其是损伤后早期神经元内表达特点的研究甚少。为此,我们通过收集人脑挫裂伤后不同时间点手术标本,分析人脑挫裂伤早期HMGB1的表达情况。
1 资料和方法
1.1 一般资料 纳入标准:经颅脑CT 证实为脑挫裂伤,年龄30~60 岁且需手术治疗的患者40 例。排除年龄较大或较小、存在其他器官复合伤患者8 例,32例患者纳入实验样本,其中男25例,女7例,年龄30~40 岁,平均31.34岁,标本均为挫裂伤脑组织中心约3 cm 范围内的脑组织;正常脑组织5例(脑肿瘤手术暴露过程中行额极或颞极切除的脑组织),脑挫裂伤6 h组6例,脑挫裂伤12 h组8例,脑挫裂伤24 h组8例,脑挫裂伤72 h组5例。实验经解放军153医院伦理委员会认证通过,且均征得患者家属同意,并签署知情同意书。
1.2 组织制备 将标本取出后,用4%多聚甲醛(pH=7.4,4 ℃)固定。然后置于含25%蔗糖的0.1 mol/L PB溶液中,4 ℃保存,直至标本沉底。用恒冷箱切片机(Leica,CM1900)行连续矢状切片,片厚16 μm,-20 ℃保存备用。
1.3 主要试剂与仪器 一抗:兔抗人HMGB1单克隆抗体(Abcam,美国);小鼠抗人NeuN单克隆抗体(Millipore,美国);小鼠抗人GFAP单克隆抗体(Millipore,美国);山羊抗人Iba-1单克隆抗体(Abcam,美国);二抗:山羊抗兔FITC(中杉金桥,中国);山羊抗鼠TRITC(中杉金桥,中国);驴抗山羊CY3(Beyotime,中国);驴抗兔Alexa Fluor 488(Molecular Probes,美国);DAPI(Solarbio,中国);荧光显微镜:Olympus BX51。
1.4 免疫荧光染色 HMGB1与DAPI共标:取一套切片入无triton含1%胎牛血清的封闭液室温封闭30 min,然后用0.01%的PBS(pH 7.4)浸洗3次,每次5 min。加入兔抗人HMGB1(1:200,Abcam)孵育,室温过夜(16~24 h),0.01%的PBS清洗3次,每次5 min,然后加入相应含有FITC标记的山羊抗兔IgG(1:200)的二抗及DAPI(1:1 000)。37 ℃室温避光2 h。之后用0.01%的PBS清洗后以50%甘油溶液封片;显微镜观察并照片。HMGB1与神经元标记物NeuN或星形胶质细胞标记物GFAP或小胶质细胞标记物Iba-1进行双标:取一套切片分A、B、C3组,入无triton含1%胎牛血清的封闭液室温封闭30 min,然后用0.01%的PBS(pH 7.4)浸洗3次,5 min/次。A组加入兔抗人HMGB1(1:200,Abcam)和小鼠抗人NeuN(1:50,Millipore)孵育;B组加入兔抗人HMGB1(1:200,Abcam)和小鼠抗人GFAP(1:200,Millipore)孵育;C组加入兔抗人HMGB1(1:200,Abcam)和山羊抗人Iba-1(1:200,Abcam)孵育。室温过夜(16~24 h),0.01%的PBS清洗3次,5 min/次,然后A组加入相应含有FITC标记的山羊抗兔IgG(1:200)及含有TRITC标记的山羊抗小鼠IgG(1:200)的二抗及DAPI(1: 1 000);B组加入相应含有FITC标记的山羊抗兔IgG(1:200)及含有TRITC标记的山羊抗小鼠IgG (1:200)的二抗及DAPI(1:1 000);C组加入相应含有Alexa Fluor 488标记的驴抗兔IgG(1:200)及含有CY3标记的驴抗山羊IgG(1:200)的二抗及DAPI(1:1 000)。37 ℃室温避光2 h。用0.01%的PBS清洗后以50%甘油溶液封片,并用荧光显微镜BX-51观察,随即选取4个视野进行照相。
1.5 结果判定标准 表达HMGB1的细胞:HMGB1与细胞标记物NeuN、GFAP或Iba-1及细胞核标记物DAPI三者共标的细胞;从细胞核转移至细胞浆的阳性细胞数:HMGB1同时存在于核内及胞浆内的细胞数。选择每张切片免疫反应较强的区域,视野(×200)下观察4个不重复视野,计数HMGB1染色细胞。计算表达在胞核中的HMGB1的细胞数、胞浆中的HMGB1细胞数、胞核胞浆共同表达HMGB1的细胞数。

2 结果
2.1 人脑挫裂伤后早期HMGB1的表达 通过对不同时间点脑挫裂伤组织进行HMGB1与DAPI共标染色,结果发现,与正常组比较,HMGB1阳性的细胞数于人脑挫裂伤后12 h开始下降(P<0.05),并持续下降至72 h(P<0.05);而HMGB1从细胞核内向胞浆转移的比例在人脑挫裂伤后6 h 明显增加(P<0.05),并逐渐升高,于人脑挫裂伤后24 h达到高峰(P<0.05),于72 h表达有所下降(P<0.05)。见图1。
2.2 人脑挫裂伤后早期HMGB1的表达主要在神经元 于各时间点,进行HMGB1与神经元标记物NeuN或星形胶质细胞标记物GFAP或小胶质细胞标记物Iba-1免疫荧光染色;对表达HMGB1的神经元数目与总HMGB1阳性细胞数进行比较,结果发现,人脑挫裂伤早期HMGB1主要表达在神经元,各组间无明显差异(P>0.05)。见图2。
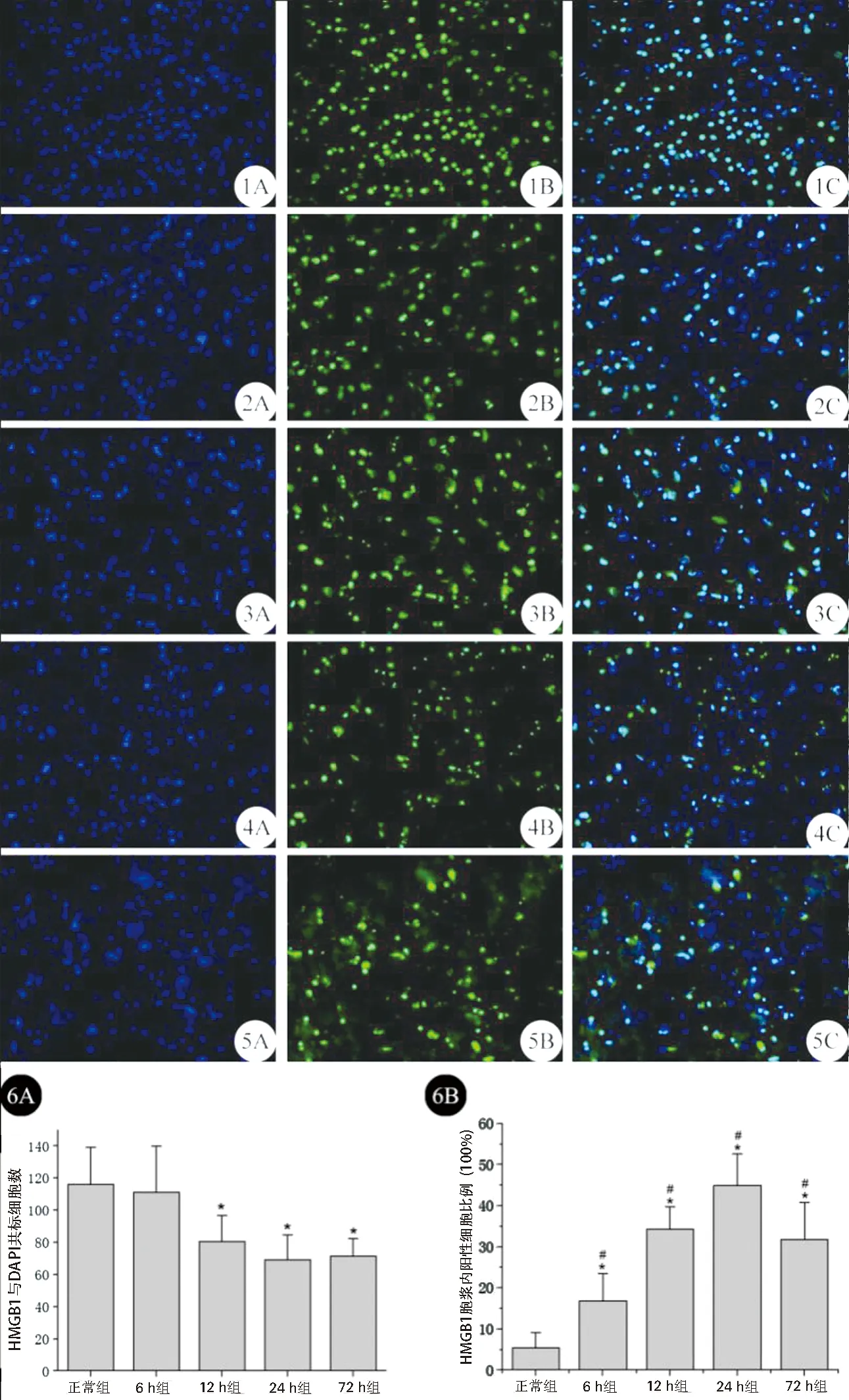
图1 人脑挫裂伤后HMGB1阳性细胞数及转移至胞浆内比例(免疫荧光染色,×200) 1A、1B、1C:正常组;2A、2B、2C:脑挫裂伤6 h;3A、3B、3C:脑挫裂伤12 h;4A、4B、4C:脑挫裂伤24 h;5A、5B、5C:脑挫裂伤72 h(A、B、C分别为DAPI、HMGB1、Merge;注:HMGB1染为绿色,DAPI染为蓝色);6A:HMGB1阳性细胞数统计图,与正常组比较,*P<0.05;6B:HMGB1转移至胞浆阳性细胞比例统计图,与正常组比较,*P<0.05,与前一组比较,#P<0.05
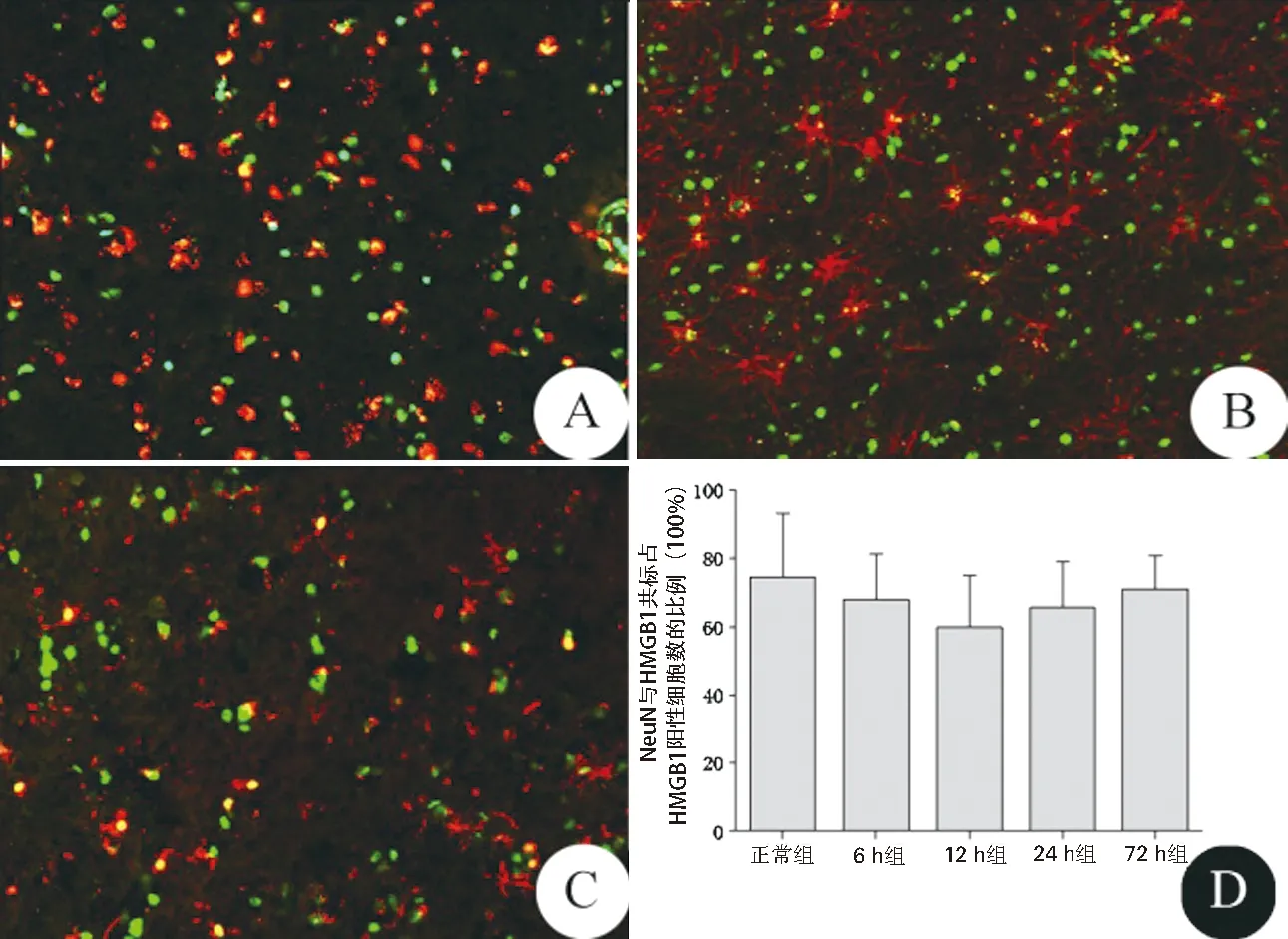
图2 人脑挫裂伤后HMGB1表达的细胞分布(免疫荧光染色,×200) A为人脑挫裂伤后24 h NeuN与HMGB1共标(HMGB1染为绿色,NeuN染为红色);B为人脑挫裂伤后24 h GFAP与HMGB1共标(HMGB1染为绿色,GFAP染为红色);C为人脑挫裂伤后24 h Iba-1与HMGB1共标(HMGB1染为绿色,Iba-1染为红色);D人脑挫裂伤后不同时间点神经元表达HMGB1的比例
2.3 HMGB1在神经元表达的特点 将人脑挫裂伤后早期不同时间点的组织切片进行HMGB1、NeuN及DAPI的免疫荧光染色,结果发现,人脑挫裂伤后神经元的数目逐渐减少(P<0.05);而HMGB1从神经元核内向胞浆转移的比例在伤后6 h明显增加(P<0.05),并逐渐升高,于人脑挫裂伤后24~72 h达到高峰(P<0.05)。见图3。
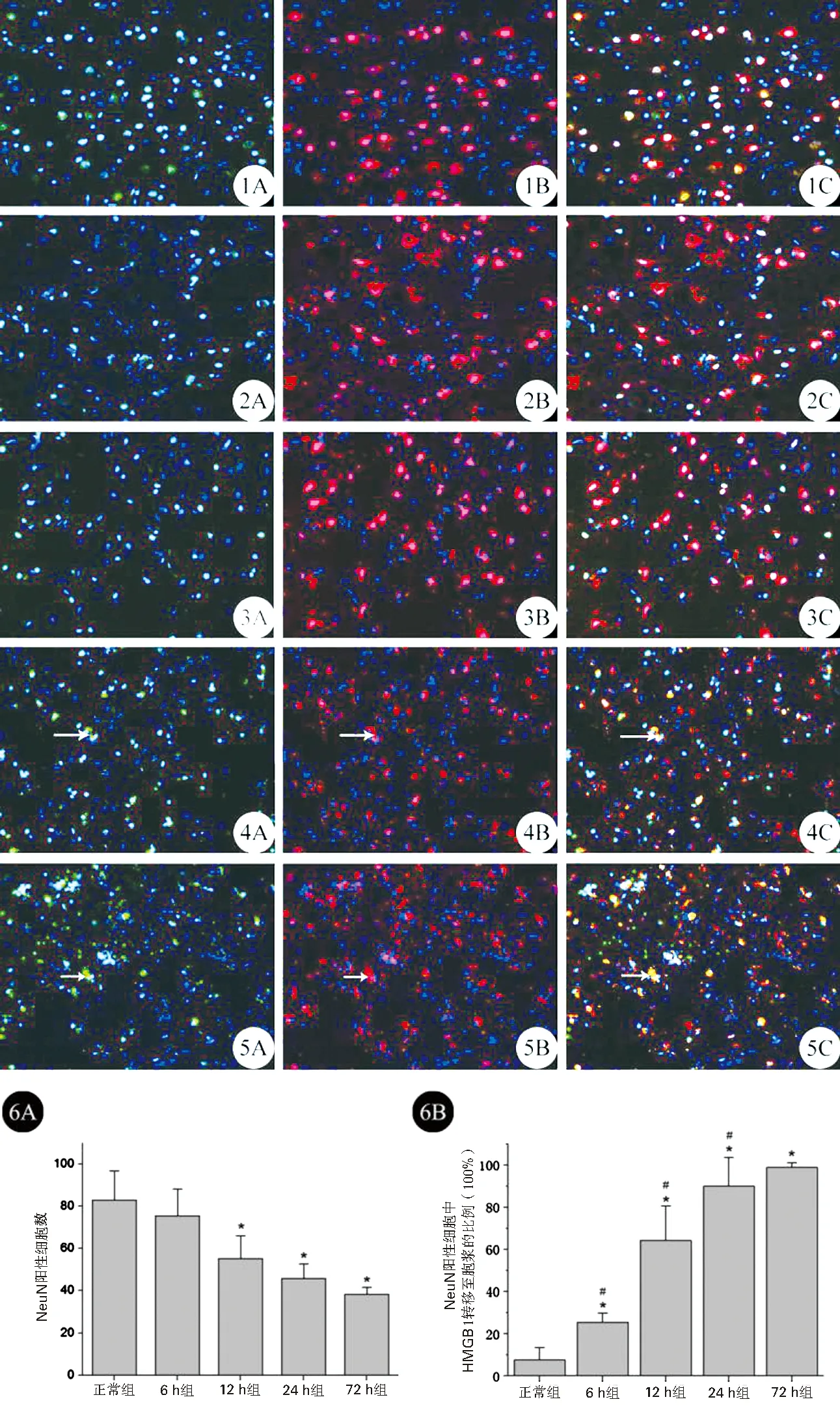
图3 人脑挫裂伤后不同时间点HMGB1神经元表达情况(免疫荧光染色,×200) 1A、1B、1C:正常组;2A、2B、2C:脑挫裂伤后6 h;3A、3B、3C:脑挫裂伤12 h;4A、4B、4C:脑挫裂伤24 h;5A、5B、5C:脑挫裂伤72 h(A为HMGB1与DAPI共标,B为NeuN与DAPI共标,C为三者Merge共标;注:HMGB1染为绿色;NeuN染为红色;DAPI染为蓝色);箭头所示:HMGB1转移至胞浆外,神经元与其共标。6A:神经元HMGB1阳性统计图,与正常组比较,*P<0.05;6B:神经元阳性细胞中HMGB1转移至胞浆比例统计图,与正常组比较,*P<0.05,与前一组比较,#P<0.05
3 讨论
HMGB1是一个普遍存在且高度保守的蛋白,在细胞内,HMGB1能与DNA结合,通过调节染色质架构发挥调控翻译,修复和重组的作用[9-10]。最近研究表明、HMGB1可以被氧化而发挥多种作用,包括亚细胞定位、调控DNA、细胞因子、调控免疫等多种作用[4]。虽然HMGB1主要存在细胞内,但在细胞受到刺激、细胞死亡、凋亡,组织缺氧及缺血/再灌注时,HMGB1可以被释放到胞浆及细胞外[9]。早期大量研究表明,TBI可引起细胞坏死、凋亡、炎症反应等多种病理生理变化[11]。Wang等通过小鼠实验研究发现,HMGB1参与了蛛网膜下腔出血导致的神经元死亡。邓必高等[12]研究发现,异丙酚可以影响大鼠内毒素脑损伤后的HMGB1表达。黄海英等[13]研究表明,通过脐带血检测HMGB1可以对在妊娠高血压产妇的新生儿脑损伤程度进行判断。我们的研究发现,HMGB1在人脑挫裂伤后早期从核内转移至胞浆的比例逐渐增高,于伤后24 h达到高峰。Gao等[14]研究发现,HMGB1在小鼠脑挫裂伤后6 h表达明显下降,而在2 d后其表达恢复至正常水平。而我们的研究同样发现,HMGB1在人脑挫裂伤后6 h表达开始下降,然而其下降一直维持至72 h。同时,我们发现,人脑挫裂伤后早期HMGB1主要表达在神经元,且随着损伤时间的延长,神经元的数目在明显下降,而HMGB1从细胞核转移至胞浆的比例却明显增高。HMGB1作为致炎因子在颅脑损伤后的病理变化中起重要作用,颅脑损伤后,细胞水肿、缺氧、炎症反应、坏死、凋亡等多种病理变化均可促使HMGB1的转移及释放,而释放的HMGB1又可以参与到颅脑损伤的继发性损伤中[14-15]。我们推测HMGB1参与了人脑挫裂伤后早期神经元的凋亡或死亡,其具体机制仍需进一步深入研究。
[1] Helmick KM,Spells CA,Malik SZ,et al.Traumatic brain injury in the US military:epidemiology and key clinical and research programs[J].Brain Imaging Behav,2015,9(3):358-366.
[2] Voss JD,Connolly J,Schwab KA,et al.Upda-te on the Epidemiology of Concussion/Mild Traumatic Brain Injury[J].Curr Pain Heada-che Rep,2015,19(7):32.
[3] Read CM,Cary PD,Crane-Robinson C,et al.Solution structure of a DNA-binding domain from HMG1[J].Nucleic Acids Res,1993,21(15):3 427-3 436.
[4] Gougeon ML,Melki MT,Saidi H.HMGB1,an alarmin promoting HIV dissemination and latency in dendritic cells[J].Cell Death Differ,2012,19(1):96-106.
[5] Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5 425):248-251.
[6] Scaffidi P,Misteli T,Bianchi ME.Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J].Nature,2002,418(6 894):191-195.
[7] Okuma Y,Liu K,Wake H,et al.Glycyrrhizin inhibits traumatic brain injury by reducing HMGB1-RAGE interaction[J].Neuropharmacology,2014,85:18-26.
[8] Stahel PF.Expression of HMGB1 and RAGE in rat and human brains after traumatic brain injury[J].J Trauma Acute Care Surg,2012,73(3):782-783.
[9] Harris HE,Andersson U,Pisetsky DS.HMGB1:a multifunctional alarmin driving autoimmune and inflammatory disease[J].Nat Rev Rheumatol,2012, 8(4):195-202.
[10] Ueda T,Yoshida M.HMGB proteins and transcriptionalregulation[J].Biochim Biophys Acta,2010,1 799(1/2): 114-118.
[11] Park E,Bell JD,Baker AJ.Traumatic brain injury:can the consequences be stopped?[J].CMAJ,2008,178(9): 1 163-1 170.
[12] 邓必高,但伶,李炜,等.异丙酚对大鼠内毒素脑损伤蛋白质络氨酸激酶和高迁移率族蛋白B-1表达的影响[J].中国现代医学杂志,2014,24(29):29-33.
[13] 黄海英,陈尚明,刘永华,等.NSE和HMGB1在妊娠高血压病产妇的新生儿脑损伤中的诊断价值[J].江苏医药,2016,42(1):44-46.
[14] Gao TL,Yuan XT,Yang D,et al.Expression of HMGB1 and RAGE in rat and human brains after traumatic brain injury[J].J Trauma Acute Care Surg,2012,72(3):643-649.
[15] Zou JY,Crews FT.Release of neuronal HMGB1 by ethanol through decreased HDAC activity activates brain neuroimmune signaling[J].PLoS One,2014,9(2):e87 915.
(收稿2016-12-27)
The features of HMGB1 expression in early traumatic brain injury
LiuLeizhen*,JiaLiyun,YaoAnhui,LiJinglun,LiuWei,WangBenhan
*XinxiangMedicalCollege,Xinxiang453000,China
Objective To explore the features of high-mobility group box 1(HMGB1)expression in early traumatic brain injury(TBI).Methods We collected traumatic brain tissues induced by traumatic brain injury at different time point(6 h,6 h,12 h,24 h and 72 h)and normal brain tissues which were fixed by 4% paraformaldehyde.After performing frozen section and using immunofluorescent staining,we statistically analyzed the expression of HMGB1.At the same time,we observed the transferring situation from cell nucleus to cytoplasm in the process of early traumatic brain injury by marking HMGB1 and neuronal specific marker(NeuN).Results HMGB1 expression of normal brain tissues was concentrated in nucleus.The number of HMGB1 positive cells in traumatic brain tissues was decreased at 12 h(P<0.05),which lasted to 72 h.The number of HMGB1 transferring from cell nucleus to cytoplasm was increased at 6 h(P<0.05)and reach the peak at 24 h after traumatic brain injury(P<0.05),which showed that with the prolonged time,the more number of HMGB1 transferred to cytoplasm.In early traumatic brain injury,HMGB1 mainly expressed in neurons(P>0.05)which were decreased gradually(P<0.05).We also found the number of HMGB1 transferring from nucleus to cytoplasm was significantly increased at 6 h(P<0.05),and peaked at 24~72 h(P<0.05).Conclusion The number of neurons’ death or apoptosis was decreased after TBI in human,and number of HMGB1 positive cells was also decreased.The ratio of HMGB1 transferring from nucleus into cytoplasm was significantly increased.HMGB1 may participate in the neurons’ death or apoptosis.
Traumatic brain injury;High mobility group box 1;Neuron
全军青年基金项目(14QNP029)
R-332
A
1673-5110(2017)09-0017-05
△通讯作者:王本瀚,E-mail:wangbenhan@sina.com
