西维来司钠联合脐带间充质干细胞移植对大鼠重型颅脑损伤的影响
2017-06-06苑国富于兵李顺宝
苑国富,于兵,李顺宝
·基础研究·
西维来司钠联合脐带间充质干细胞移植对大鼠重型颅脑损伤的影响
苑国富1a,于兵1b,李顺宝2
目的:探讨西维来司钠联合脐带间充质干细胞(UCMSCs)移植对 SD 大鼠重型颅脑损伤的影响。方法:建立SD大鼠重型颅脑损伤模型,应用改良神经功能评分(mNSS)评价神经功能,纳入评分为12~16分(重度)的 SD大鼠60只。将其随机分为模型组(颅脑损伤组)、西维来司钠组、UCMSCs组、联合组(西维来司钠+UCMSCs),分别给予相应治疗。应用 Western-Blotting 和定量荧光 PCR 法检测各组大鼠损伤部位脑组织中脑源性神经营养因子(BDNF)的蛋白及mRNA表达变化;取各组大鼠损伤部位脑组织行HE 染色观察脑组织受损情况;免疫组化检测 BDNF的阳性表达。结果:治疗后各时间点,与模型组比较,西维来司钠组、UCMSCs组、联合组的评分下降,联合组的评分低于西维来司钠组及 UCMSCs组(P<0.05);联合组大鼠损伤部位脑组织中BDNF表达高于其他各组(P<0.05);联合组受损脑组织炎症浸润细胞明显减少,水肿程度明显减轻;联合组的 BDNF 阳性表达细胞多于西维来司钠组及 UCMSCs组(P<0.05)。结论:西维来司钠联合UCMSCs移植可提高SD大鼠重型颅脑损伤后神经功能的恢复,能促进BDNF的表达。
西维来司钠;颅脑损伤;脐带间充质干细胞;BDNF;干细胞;移植;大鼠
重型颅脑损伤后会造成神经功能缺失和行为能力障碍,常留有后遗症[1-3]。目前临床上现有的治疗方法均不能达到满意的效果。因此,探讨重型颅脑损伤的有效疗法至关重要[4-6]。干细胞移植治疗脑损伤是近些年来的研究热点,脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)具有来源广泛、取材方便、无伦理争议等优点,其能通过促进各种营养因子的分泌保护受损的神经系统,在干细胞研究中备受关注[7,8]。研究发现,脑损伤过程中有炎症反应介导,中性粒细胞活化后可释放中性粒细胞弹 性 蛋 白 酶(neutrophil elastase,NE),NE等炎性细胞因子可触发血管炎性反应,参与颅脑损伤过程。西维来司钠是一种特异性NE抑制剂,可有效抑制NE的炎性反应,从而减轻重型颅脑损伤中的炎症反应,进而保护神经功能[9-12]。本研究探讨西维来司钠联合UCMSCs细胞移植对SD大鼠重型颅脑损伤的影响,报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康清洁级 1 月龄 SD 大鼠 65 只由河北医科大学动物实验中心提供[合格证号SCXK(冀)DK0390-0120],体质量为 210~230 g,雌雄不限。保持良好的饲养环境,室温20 ℃~22 ℃,湿度50%左右,通风良好。喂养普通大鼠饲料及自来水,自由进食及饮水。实验操作过程中对动物处置方法符合动物伦理学要求。
1.1.2 主要试剂及设备 DMEM/F12 培养基(购于美国 Hyclone公司),胰蛋白酶(购于北京赛百盛基因技术有限公司),胎牛血清(购于美国 Gibco 公司),Western blot试剂盒、RT-PCR 试剂盒(购于美国Coulter公司),M-MLV 逆转录酶(购于美国 Biorad公司),10%水合氯醛(购于美国 Abcam 公司),抗BDNF抗体、兔抗鼠多克隆抗体(购于康为世纪生物科技有限公司),CY3 标记山羊抗兔 Ig G 抗体(购于武汉博士德生物技术有限公司),凝胶成像分析系统(购于美国 Alpha Innotech 公司),脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)(购于武汉博士德公司),石蜡切片机(购于上海徕卡仪器有限公司),荧光倒置显微镜(购于德国Heraeus公司),DAB显色试剂盒(购于北京中山生物技术有限公司),超净工作台(购于苏州安泰空气技术有限公司),CO2培养箱(购于长沙市长锦科技有限公司)。
1.2 方法
1.2.1 UCMSCs 的 培 养 采 用 密 度 梯 度 离 心 法(1 500 r/min 离心 15 min)于无菌条件下,将所获足月胎儿脐带血进行体外分离 UCMSCs,用 1∶1PBS稀释采集的脐血,叠加于淋巴细胞分离液上,以2 000 r/min 密度梯度离心 20 min,收集白膜界面单个核细胞,以 1 000 r/min 离心 5 min,PBS 缓冲液冲洗 2 遍,弃去上清液。加入含体积分数为 15%的DMEM/F12 培养基,以 2×109/L 接种于 5 cm×5 cm 的培养瓶。37 ℃(含5%的CO2,饱和湿度)培养箱中培养,每天半量换液,72 h 更换培养基,去除未贴壁细胞,以后每隔 3 d 换液 1 次。观察细胞生长状况,待贴壁细胞融合 50%~80%后,细胞集落出现,2.5 g/L胰蛋白酶消化传代,传代时按1∶3比例进行,倒置相差显微镜下每日观察细胞生长情况。使用 CD29(1∶300)、CD44(1∶200)、CD34(1∶200)抗体,对培养细胞进行组织化学染色鉴定,检测合格细胞用于实验移植。
1.2.2 大鼠重型颅脑损伤模型的建立及实验分组 采用液压冲击法建立大鼠重型颅脑损伤模型。以10%水合氯醛经腹腔麻醉后,按国际通用标准,对各组给予(364.77±16.21)kPa 峰值的冲击压力,建立重度颅脑损伤模型。造模成功建立后大鼠表现为去大脑强直和呼吸暂停,部分动物发生抽搐,短暂血压上升,伴心率减慢。对出现自主呼吸暂停的大鼠,即刻采用小动物呼吸机给予面罩吸氧。建模过程中死亡2只,改良神经功能评分(modified neurological severity score,mNSS)评 分 为 8~12 分 的3只大鼠被弃选,剩余评分为12~18分(重度)的60只纳入实验,随机分为模型组、西维来司钠组、UCMSCs组、联合组,每组各15只。模型组尾静脉注射细胞培养液;西维来司钠组尾静脉注射西维来司钠 30 mg/(g ·d),UCMSCs组尾静脉注射 1.0×l09/L 的UCMSCs悬液 1 mL,联合组尾静脉联合注射西维来司钠 30 mg/ (g·d)+UCMSCs细胞悬液 1.0×l09/L。连续治疗 5 d。
1.2.3 神经功能评价 分别对各组大鼠在治疗前及治疗后 3、7、14、21 d 采用 mNSS 评价大鼠神经功能:总分为 18 分,正常为 0分,评分内容分为运动、感觉、平衡和反射4个部分,评分越低神经行为学功能越好,评分越高神经功能障碍越严重。
1.2.4 定 量 荧 光 PCR 法 检 测 各 组 大 鼠 损 伤 部 位 脑 组 织 中BDNF、NGF mRNA 的表达变化 建模后 2周,每组取 2只大鼠损伤部位脑组织,经 4 ℃离心 20 min,弃去上清,PBS 冲洗 3 次,通过 TRIzol法提取总 RNA,根据 PCR 试剂盒说明书将 RNA 逆转 录 为 cDRA。 扩 增 BDNF 和 内 参 GAPDH。 BDNF 上 游5’-CTCGAATTCCACCATGACCATCCTTTTCCTTA-3’,下游5’-CGCTCGAGAACATAAATCCACTAT CTTCCCCTF-3’,扩增产 物 为 124 bp。 GAPDH 上 游 :5 ' -CACCTTTGATGCTGGGGCT',下游:5'-GGTCCAGGGTTTCTTACTC-3',扩增产 物 为 130 bp。 PCR 反 应 条 件 :95 ℃ 变 性 3 min,94 ℃ 变 性10 s,55 ℃ 退 火 30 s,72 ℃ 延 伸 30 s,40 个 循 环 ,72 ℃ 延 伸7 min。产物于 4 ℃保存。用 DNA 纯化试剂盒回收纯化凝胶内的BDNF基因产物。PCR产物采用2%的琼脂糖凝胶电泳鉴定,使用凝胶图像分析系统计算 GAP-43/NGF 产物与 GAPDH 产物的光密度积分的比值,作为 GAP-43/NGF-m RNA 的表达。
1.2.5 Western-Blotting 检测各组大鼠损伤部位 BDNF、NGF 蛋白的表达变化 将 RT-PCR 提取物进行离心,于 4 ℃下以1 200 rpm 速度离心 5 min,-20℃保存。取上清为粗提蛋白质,稀释终浓度为 0.5 mg/mL,采用 Bradford 法检测 BDNF 蛋白的浓度,以 5%浓缩胶 40 V 衡压 1 h,以 10%分离胶 60 V 恒压 3.5 h,湿转 14 V 恒 压 14 h,37 ℃ 下 摇 床 封 闭 2 h,洗 膜 3 次(每 次10 min)。加适当体积样品到 96 孔板的样品孔中,37 ℃封闭30 min。分别滴加 BDNF 一抗(1∶500),兔抗鼠多克隆抗体稀释溶于 TBST 中,4 ℃过夜,PBS 冲洗 3 次,每次 5 min,滴加 CY3 标记二抗(1∶100,1%BSA-PBS 稀释)37 ℃孵育 30 min。PBS 冲洗3 次,每次 5 min,二甲基联苯胺(3,3-diaminobenzidine,DAB)显色。实验重复 3 次。采用 Quantity one软件分析 BDNF、NGF 条带与GAPDH条带吸光面积比值观察植入细胞BDNF表达情况。
1.2.6 HE 染色观察各组大鼠脑组织受损情况 建模后 2 周,每组取 2 只大鼠受损脑组织,经 40 g/L 多聚甲醛固定切片后,二甲苯对石蜡切片脱蜡,随后依次浸入梯度酒精(70%、80%、95%、无水酒精)中脱水。蒸馏水清洗切片 2 min,置于苏木素染液中10 min,再用蒸馏水清洗切片后,浸入梯度酒精,伊红酒精溶液染色后,用二甲苯透明。树胶封片,恒温箱中干燥后于显微镜下观察,并摄像。显微镜下每张切片于受损脑组织区取5个不重复视野,观察各组脑组织病理学形态变化。
1.2.7 免疫组化检测 BDNF 的表达情况 于建模后 2 周随机各组各取2只大鼠,10%水合氯醛经腹腔麻醉后处死大鼠,取受损脑组织,40 g/L 多聚甲醛灌注,固定 10 min,二甲苯对石蜡切片脱蜡,用无水乙醇对石蜡切片进行梯度水化,蒸馏水清洗,PBS冲洗 3 min,3%过氧化氢室温孵育 10 min,以消除内源性过氧化物酶的活性,PBS 冲洗 3 次,每次 5 min,加热抗原修复 20 min,室温 冷 却 后 PBS 冲 洗 3 次 ,每 次 5 min。 免 疫 组 化 染 色 严 格 按BDNF 试剂盒说明操作,滴加 BDNF 一抗(1∶500)及兔抗鼠多克隆抗体稀释液内孵育,4 ℃过夜,PBS 冲洗 3 次,每次 5 min,滴加CY3 标记二抗(1∶100,1%BSA-PBS 稀释)37 ℃孵育 60 min,弃掉 PBS液,每张切片加入 100 μL新鲜配制的DAB溶液,置于显微镜下观察 10 min,DAB 显色阳性为细胞核呈棕黄色。蒸馏水彻底清洗 3 次,每次 2 min,放入梯度酒精和二甲苯中脱水透明,切片风干,中性树脂封片。在高倍镜(×200)下每张切片上任取5个视野,荧光显微镜观察并计算BDNF阳性细胞数。
1.3 统计学处理
应用 SPSS 11.5 统计软件包分析数据,计量资料以(均数±标准差)(±s)表示,单因素方差分析、t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 UCMSCs的形态观察
原代培养的 UCMSCs细胞小而圆,悬浮状生长,培养5 d时UCMSCs散在分布培养瓶底,细胞呈纺锤形或椭圆形;首次更换培养液后,可见少量贴壁细胞,呈单个或几个细胞的克隆,有突起伸出;5~7 d出现大量贴壁细胞,集落数目明显增多,细胞体透亮;培养 10~14 d 时集落间渐融合成单层,集落细胞不断扩增。经多次传代,贴壁细胞均匀分布,UCMSCs呈放射状向周围扩展,漩涡状排列,均一性好,纯度≥97%,见图1。
2.2 各组大鼠的mNSS评分比较
图1 UCMSCs形态学观察(×200)
治疗前,各组大鼠的mNSS 评分差异无统计学意义(P>0.05);治疗后各时间点,与模型组比较,西维来司钠组、UCMSCs组、联合组的评分下降,差异有统计学意义(P<0.05);联合组的评分低于西维来司钠组及UCMSCs组,差异有统计学意义(P<0.05),见表1。
2.3 各组大鼠损伤部位脑组织中 BDNF mRNA 的表达变化
定量荧光PCR结果显示,联合组的BDNF mRNA表达高于其他 3 组,西维来司钠组及 UCMSCs组的 BDNF mRNA表达高于模型组,差异有统计学意义(P<0.05),见图 2。
2.4 Western-Blot检测各组大鼠损伤部位 BDNF 蛋白的表达变化
各组大鼠损伤部位脑组织中的BDNF蛋白表达变化比较,联合组的损伤部位脑组织中的BDNF蛋白表达高于其他各组,西维来司钠组及UCMSCs组,西维来司钠组及UCMSCs组损伤部位脑组织中的BDNF蛋白表达高于模型组,差异有统计学意义(P<0.05),见图 3。
2.5 HE 染色观察各组大鼠脑组织受损情况
治疗14 d后,HE染色显示,模型组可见大量炎症细胞浸润、细胞呈明显水肿反应、间隙增大,有坏死、裂解细胞出现;西维来司钠组及UCMSCs组可见炎症细胞浸润有所减少,仍有部分水肿;联合组可见炎症浸润细胞明显减少,水肿基本消退,有瘢痕组织形成。各组间比较,联合组受损脑组织恢复程度明显优于西维来司钠组及UCMSCs组;西维来司钠组及UCMSCs组又较模型组明显好转。
2.6 免疫组化检测 BDNF 的阳性表达情况
免疫组化检测结果显示,在模型建立后 7 d 时 BDNF 阳性细胞达高峰后开始下降,而联合组 21 d 时仍有部分 BDNF 阳性细胞表达,联合组的BDNF阳性细胞表达多于其他各组,西维来司钠组及UCMSCs组BDNF阳性细胞表达多于模型组,差异有统计学意义(P<0.05),见表2、图 5。
表1 各组大鼠不同时间点的 mNSS 评分(分,±s)
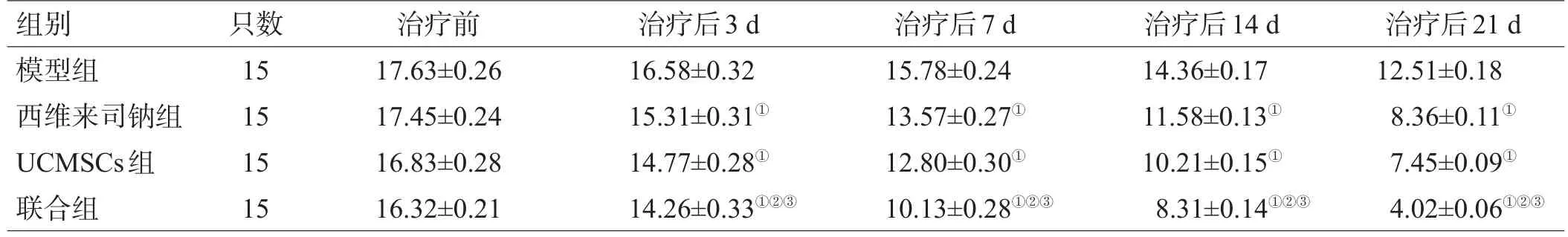
表1 各组大鼠不同时间点的 mNSS 评分(分,±s)
注:与模型组比较,①P<0.05;与西维来司钠组比较,②P<0.05;与 UCMSCs组比较,③P<0.05
组别模型组西维来司钠组UCMSCs组联合组只数15 15 15 15治疗前17.63±0.26 17.45±0.24 16.83±0.28 16.32±0.21治疗后3 d 16.58±0.32 15.31±0.31①14.77±0.28①14.26±0.33①②③治疗后7 d 15.78±0.24 13.57±0.27①12.80±0.30①10.13±0.28①②③治疗后14 d 14.36±0.17 11.58±0.13①10.21±0.15①8.31±0.14①②③治疗后21 d 12.51±0.18 8.36±0.11①7.45±0.09①4.02±0.06①②③
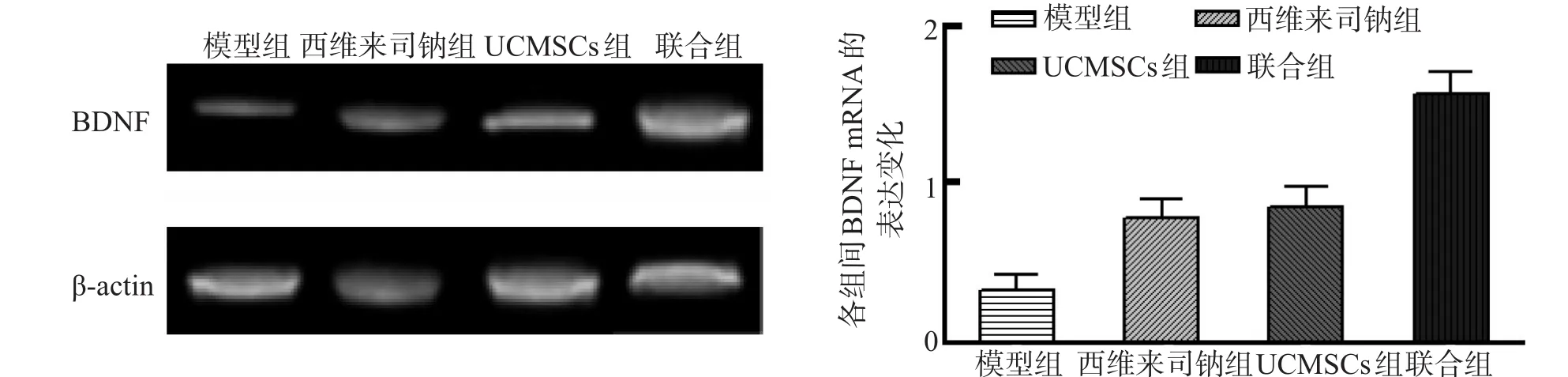
图2 RT-PCR 检测各组间 BDNF mRNA 的表达变化
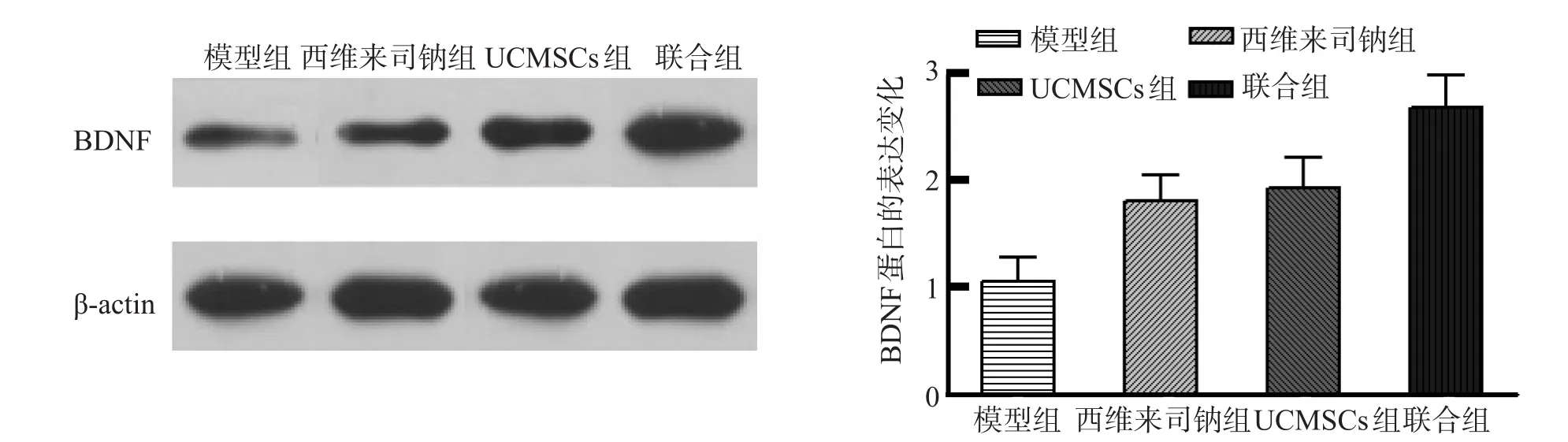
图3 Western blotting 检测各组间 BDNF 蛋白的表达变化
3 讨论
目前临床上尚未研究出重型颅脑损伤有效的治疗方法[13,14]。大量研究表明干细胞移植可对脑损伤发挥较好的疗效,这为脑损伤后的治疗及修复提供了新思路[15,16]。随着对干细胞的深入研究发现,UCMSCs不仅具有神经元表面抗原,而且还能表达各种神经递质受体。其具有较骨髓源干细胞更多的优势,如分化能力更强、资源更丰富、排斥反应较轻、病毒感染风险低、无肿瘤细胞污染、对供者没有任何不良影响等,目前已成为备受关注的种子干细胞[17-19]。研究表明,UCMSCs单独移植的效果不是很理想,需结合生物工程材料及药物等手段进行综合治疗。
研究发现,西维来司钠可对脊髓、肝、心肌等再灌注损伤后的中性粒细胞炎性浸润发挥作用[20-22]。重症颅脑损伤后,炎性介质的级联反应可导致脑细胞结构功能广泛损伤,使血管内皮细胞、血管上皮细胞通透性增加,血管膜遭到破坏,进而加重颅脑损伤程度[23,24]。西维来司钠可有效抑制中性粒细胞激活后释放的NE,从而抑制NE介导的炎症反应,进而减轻炎症级联反应对颅脑的损伤[25-27]。目前尚未见有关西维来司钠联合 UCMSCs移植对重症颅脑损伤的研究,故本研究拟进行此实验,以期发现二者联合应用对重症颅脑损伤救治的价值[28-30]。
表2 各组BDNF阳性细胞表达比较(±s)

表2 各组BDNF阳性细胞表达比较(±s)
注:与模型组比较,①P<0.05;与西维来司钠组比较,②P<0.05;与 UCMSCs组比较,③P<0.05
组别模型组西维来司钠组UCMSCs组联合组治疗后7 d 32.81±1.58 41.76±1.42①41.57±1.55①52.41±1.39①②③治疗后 14 d 30.42±1.28 35.74±1.86①36.65±1.79①45.36±1.83①②③治疗后21 d 12.21±2.08 19.13±2.32①19.34±2.27①34.75±2.18①②③
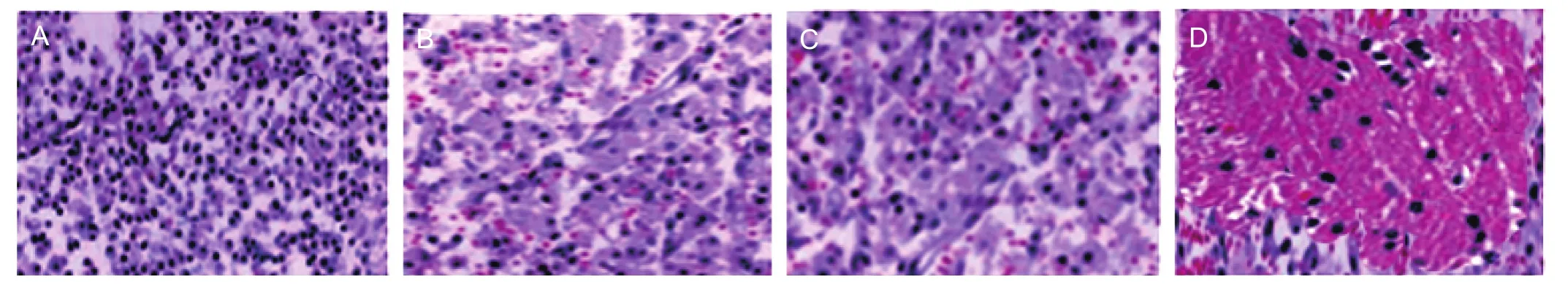
图4 HE染色观察各组大鼠脑组织受损情况(×200)
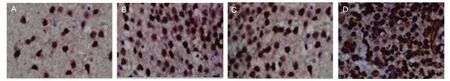
图5 各组 7 d 时免疫组化检测 BDNF 的阳性表达(×400)
本研究显示,在不同时间点联合组的mNSS评分低于西维来司钠组及UCMSCs组,表明UCMSCs联合应用西维来司钠后可更好地改善局部微环境,促进神经元功能的修复;联合组损伤部位脑组织中BDNF的表达优于西维来司钠组及UCMSCs组,表明UCMSCs在联合西维来司钠后更好地促进BDNF表达;HE染色观察到与模型组、西维来司钠组及UCMSCs组比较,联合组受损脑组织炎症浸润细胞明显减少,水肿程度明显减轻;免疫组化检测到BDNF的阳性表达在联合组显著多于西维来司钠组及UCMSCs组,二者联合应用的效果要明显优于单独应用。但因本研究资料及时间的局限性,对西维来司钠联合UCMSCs移植治疗的具体机制尚未明确,仍需进一步深入探讨。
[1] 冯士军,韩建国.RhoA 基因沉默联合脐带间充质干细胞移植脑损伤大鼠功能的恢复[J].中国组织工程研究,2013,17:23-30.
[2]Pang KM,Sung MA,Alrash-dan MS,et al.Trans-plantation of mesenchymal stem cells from human umbilical cord versus human umbilical cord blood for peripheral nerve regeneration[J].Neural Regen Res,2010, 5:838-845.
[3] 吕加希,尹宏.脐带间充质干细胞联合C5a受体拮抗剂移植治疗脑损伤大鼠的功能恢复[J].中国组织工程研究与临床康复,2011,15:9182-9185.
[4] 朱占胜,吴明灿,张家均,等.创伤性颅脑损伤后炎症细胞因子白介素 6/18/27变化及临床意义[J].广东医学,2011,32:762-763.
[5] 王东,张建军,马景鑑,等.神经干细胞NgR基因沉默立体定向移植治疗大鼠脑损伤[J].中国组织工程研究与临床康复,2010,14:2539-2544.
[6]Han SR,Yee GT,Choi CY,et al.Cortical laminar necrosis in an infant with severe traumatic brain injury[J].J Korean Neurosurg Soc,2011,50: 472-474.
[7] 丁丽君,董志,乐乐乐,等 .西维来司钠对大鼠脑缺血/再灌注损伤的保护作用及机制[J].中国药理学通报,2011,27:54-58.
[8]Liliang PC,Liang CL,Weng HC,et al.Proteins in Serum Predict Outcome After Severe Traumatic Brain Injury[J].J Surg Res,2010,160:3072-3078.
[9]Kumagai K,Saikawa Y,Takeuchi H,et al.The neutrophil elastase inhibitor sivelestat suppresses accelerated gastrointestinal tumor growth via peritonitis after cecal ligation and puncture[J].Anticancer Res,2013,33: 3653-3659.
[10]张红,苟大明,李健权,等.西维来司钠对体外循环中血浆弹性蛋白酶、补体 G3、G4 及尿 NAG 的影响[J].第三军医大学学报,2006,28:331-333.
[11]Park JS,Park KH,Kim H,et al.Effects of sivelestat treatment on acute lung injury in paraquat-intoxicated rats[J].Drug Chem Toxicol, 2014,37:114-120.
[12]Yuan Q,Jiang YW,Fang QH,et al.Improving effect of Sivelestat on lipopolysaccharide-induced lung injury in rats[J].APMIS,2014,122:810-817.
[13]李楠.急性颅脑损伤患者血清 hs-CRP、TNF-α、IL-10 水平变化及意义[J].山东医药,2010,50:80-81.
[14]苏海,苏祖禄,贺学农,等.中性粒细胞弹性蛋白酶抑制剂对颅脑创伤大鼠血脑屏障通透性和脑水肿的影响[J].重庆医学,2014,43:3458-3460.
[15]Sekhon MS,Dhingra VK,Sekhon IS,et al.The safety of synthetic colloid in critically ill patients with severe traumatic brain injuries[J].J Crit Care,2011,26:357-362.
[16]Hang RH,Xu YJ,Xie HF,et al.Evaluating on recognition impairment after traumatic brain injury with WCST[J].Fa Yi Xue Za Zhi,2011,27: 346-349.
[17]苑国富,李红星.大鼠颅脑损伤后亚低温治疗对RhoA及 Nogo-A表达的影响[J].中国现代医学杂志,2011,21:1435-1438.
[18]姚远,朱占胜,陈世洁,等.创伤性颅脑损伤中炎性细胞因子表达的研究进展[J].医学综述,2011,17:3060-3062.
[19]Ikegame Y,Yamashita K,Hayashi S,et al.Neutrophil elastase inhibitor prevents ischemic brain damage via reduction of vasogenic edema[J]. Hypertens Res,2010,33:703-707.
[20]凌海平,杭春华,李伟,等.西维来司钠对小鼠颅脑创伤后神经保护作用的研究[J].中华神经外科疾病研究杂志,2011,11:231-235.
[21]Wang H,Wang S,TangA,et al.Combined effects of sivelestat and resveratrol on severe acute pancreatitis-associated lung injury in rats[J].Exp Lung Res,2014,40:288-297.
[22]韦俐,周鹏,袁志诚,等.急性颅脑损伤后血清 TNF-α 和 IL-18 的含量变化及临床意义[J].实用临床医药杂志,2009,13:51-54.
[23]贾杰,胡永善,吴毅,等.神经生长因子对大鼠缺血性脑损伤急性期的疗效研究[J].神经损伤与功能重建,2011,1:1-5.
[24] 江基尧.我国颅脑创伤救治现状与展望[J].中华创伤杂志,2008, 24:81-83.
[25]Yang QW,Lu FL,Zhou Y,et al.HMBG1 mediates ischemia-reperfusion injury by TRIF-adaptor independent Toll-like receptor 4 signaling[J]. J Cereb Blood Flow Metab,2011,31:593-605.
[26]Yang YF.Interleukin-1 receptor associated kinases-1/4 inhibition protects against acute hypoxia/ischemia-induced neuronal injury in vivo and in vitro[J].Neurosci,2011,19:25-34.
[27]Sakai S,Tajima H,Miyashita T,et al.Sivelestat sodium hydrate inhibits neutrophil migration to the vessel wall and suppresses hepatic ischemiareperfusion injury[J].Dig Dis Sci,2014,59:787-794.
[28]Hoh NZ,Wagner AK,Alexander SA,et al.BCL2 genotypes:functional and neurobehavioral outcomes after severe traumatic brain injury[J].J Neurotrauma,2010,27:1413-1427.
[29]Nomura N,Asano M,Saito T,et al.Sivelestat attenuates lung injury in surgery for congenital heart disease with pulmonary hypertension[J].Ann Thorac Surg,2013,96:2184-2191.
[30] 方明,张琳,章车明,等.急性颅脑损伤患者血清细胞因子的变化[J].神经损伤与功能重建,2015,10:26-30.
(本文编辑:王晶)
R741;R742
ADOI10.16780/j.cnki.sjssgncj.2017.03.019
1.保定市徐水区人民医院 a.神经外科 b.急诊科河北 保定 072550 2.保定市第一中心医院心内科河北 保定 071000
2016-03-25
苑国富medicalthesis821@ 163.com
