小檗碱对三转基因阿尔茨海默病小鼠海马组织Aβ和Bcl-2、Bax表达的影响
2017-06-06梁宇彬黄敏常鑫郭毅
梁宇彬,黄敏,常鑫,郭毅
小檗碱对三转基因阿尔茨海默病小鼠海马组织Aβ和Bcl-2、Bax表达的影响
梁宇彬,黄敏,常鑫,郭毅
目的:观察旋小檗碱对 APP/PS1/Tau 三转基因阿尔茨海默病(AD)小鼠海马组织 β-淀粉样蛋白(Aβ)和Bcl-2、Bax表达的影响。方法:20只三转基因 AD 小鼠随机分为对照组和给药组,各 10 只。加药组给予小檗碱 50 mg ·kg-1·d-1灌胃,对照组给予等容量生理盐水灌胃,共 3 个月。Western Blot检测小鼠海马组织蛋白Aβ、Bcl-2和 Bax 表达,免疫组化测定小鼠海马 Aβ 表达,ELISA 检测小鼠海马 Bcl-2、Bax 表达。结果:给药组海马组织 Aβ 表达较对照组降低(P<0.05);与对照组比较,给药组海马组织 Bcl-2 表达增加而 Bax 表达减少(P<0.05)。结论:小檗碱能降低三转基因 AD 小鼠的 Aβ 表达,其机制可能与 Bcl-2 和 Bax 表达改变有关。
阿尔茨海默病;小檗碱;三转基因小鼠;β-淀粉样蛋白;凋亡
阿 尔 茨 海 默 病(Alzheimer’s disease,AD)是一种以认知功能障碍和学习记忆减退为主的进行性中枢神经系统退行性变性病,大脑病理组织是以 β-淀粉样蛋白(amyloid-β,Aβ)沉积而形成的老年斑和 tau 蛋白神 经 原 纤 维 缠 结(neurofibrillary tangles,NFTs)为主[1];其中,Aβ 病理沉积是目前 AD发 病 主 流学说[1,2]。目 前 许 多研究认为 神 经元凋亡是AD等退行性疾病发展过程中重要机 制 之 一[3,4]。 小 檗 碱(Berberine)是 从 黄 连素中提取的天然异喹啉类生物碱,具有抗炎、抗癌、抗病毒、抑菌及降糖、调脂等多种药理作用[5],被认为是治疗 AD 的药物靶点之一[6,7]。本实验观察小檗碱对三转基因 AD 小鼠的Aβ和海马组织相关凋亡基因表达的影响。
1 材料与方法
1.1 实验动物与材料
1.1.1 动物实验 雄性三转基因 AD 小鼠(表达人源突变基因 APPSwe、tauP301L 及鼠源PS1 突变基因)20 只,4 月龄,体质量(30.5± 3.0)g,购于美国 Jax 动物实验室。小鼠存在认知能力损伤和老年斑、神经纤维缠结、神经元缺失,且行为学实验检测显示逃避潜伏期明显上升[8]。
1.1.2 主要试剂与仪器 小檗碱购自武汉福鑫化工有限公司;组织裂解液试剂盒购自碧云天公司;即用型免疫组织化学试剂盒购自福州迈新生物技术开发有限公司;Aβ、Bcl-2、Bax 和 β-actin、兔鼠二抗体均购自 Sigama公司;Bcl-2、Bax 的 ELISA 试剂盒购自南京森贝伽生物有限公司。
1.2 方法
1.2.1 分组及处理 所有小鼠随机分为对照组和给药组,每组 10 只。给药组给予小檗碱 50 mg ·kg-1·d-1灌胃,对照组用等容剂量生理盐水灌胃,共3个月。
1.2.2 免疫组织化学染色 各组小鼠干预 3 个月后,乙醚麻醉小鼠,2组各取3只小鼠剪下头部,迅速取出大脑至 40 g/L 多聚甲醛固定 24 h,梯度乙醇脱水(30%、50%、75%、85%、95%、100%),二甲苯透明、浸蜡、包埋、切片、42 ℃水浴展片、捞片、37 ℃烘箱烤片,脱蜡至水,采用 SABC 方法进行免疫组化染色。以兔抗 Aβ(1: 200)抗体为一抗,二抗室温孵育 1 h(羊抗兔 DL488),荧光抗淬灭封片剂封片,激光扫描共聚焦显微镜观察,以镜下观察老年斑的沉积情况。
1.2.3 Western 印迹检测 干预 3 个月后,乙醚麻醉小鼠,2组各取3只小鼠断头取脑,在显微镜下快速剥离血管膜和取出完整的海马组织,装入干净的标本无菌EP 管中,称量海马质量,按质量与体积比 1:9 加入 1× TBS,并加入蛋白酶及磷酸酶抑制剂。超声破碎组织,离心,取上清即为可溶性蛋白(TBS-soluble),分装冻存至-80 ℃冰箱;采用BCA法对样品进行蛋白定量,SDSPAGE凝胶电泳分离后转印到PVDF膜上;5%脱脂奶粉封闭 2 h,加入 Aβ(1:5 000)、Bcl-2(1:1 000)、Bax(1:1000),4 ℃过夜;TBST 漂洗次 3 次,10 min/次;加入 1: 10 000 辣 根 过 氧 化 物 酶 标 记 的 二 抗 室 温 孵 育 2 h;TBST 漂洗 3 次,10 min/次;ECL 发光液显影。
1.2.4 ELISA 测定 Bcl-2、Bax 表达水平 各组小鼠干预3个月后,乙醚麻醉小鼠,2组各取4只小鼠的海马组织置于无菌管,用组织裂解液研磨组织之后放在4℃2 h,3 000 转离心 20 min 后取上清液,按照试剂盒说明书配置 Bcl-2、Bax 试剂盒标准品溶液,并按 50 μL/孔制作浓度梯度:480 ng/L,320 ng/L,160 ng/L,80 ng/L,40 ng/L,0 ng/L,按照试剂盒说明操作。各样品重复 3 次实验。
1.3 统计学处理
2 结果
2.1 小檗碱对海马组织Aβ的表达影响
对照组海马组织中Aβ表达显著增加,可见散在深褐色老年斑,神经元数目减少;给药组海马CA1区的老年斑减少、着色变浅,细胞数量增多,细胞完整性多,见图 1。Western 印迹结果显示,与对照组比较,给药组海马组织 Aβ表达明显表达下降(P<0.05),见图2。
2.2 小檗碱对海马组织 Bcl-2、Bax 蛋白表达的影响
Western 印迹显示,与对照组比较,给药组小鼠海马组织 Bcl-2 表达量增加(P<0.01),Bax 表达量减少(P<0.05),见图 3。ELISA 结果提示,与对照组比较,给药组海马组织 Bcl-2 表达量相对增加,Bax 表达相对减少(P<0.05),见图 4。

图1 各组海马组织内Aβ表达(DAB显色,×400)
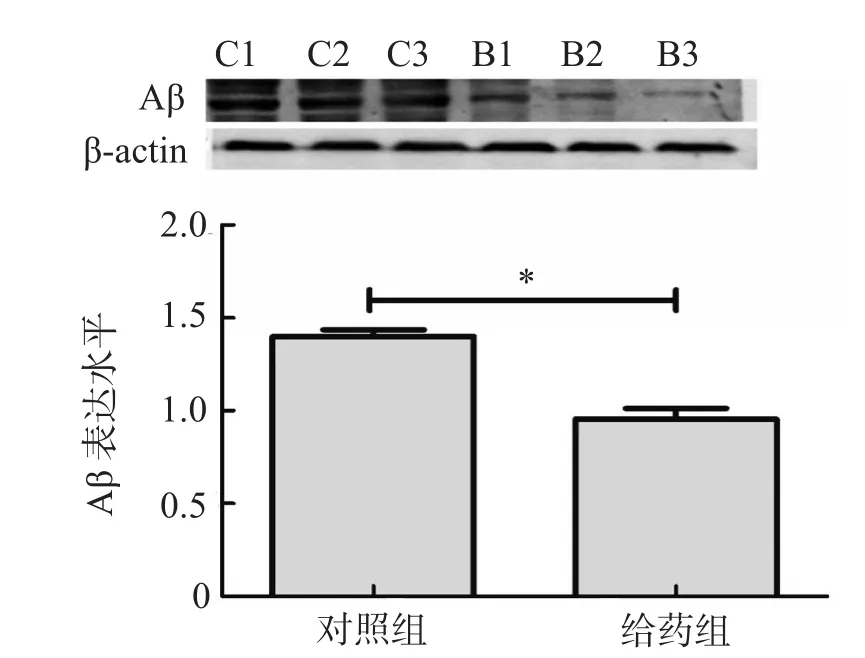
图2 Western 印迹检测各组海马组织 Aβ 蛋白表达水平
3 讨论
本实验采用了 APP/PS1/Tau 三转基因 AD 小鼠模型,能够准确地模拟AD的病理特征。该小鼠达4月龄时海马区开始出现Aβ、神经纤维缠结、神经元缺失会等 AD 特征,且随年龄增长此病理特征加重[8]。Aβ 导致的神经元损伤主要是通过异常凋亡途径实现[9],Aβ 首先引起神经元的钙离子超载和氧化应激,激活神经元内凋亡因子,损伤神经元线粒体[10],使细胞的供能系统受阻,引起神经元功能紊乱,最终造成神经元异常凋亡[11]。小檗碱具有抗炎、降血脂、控制血糖等多种药理作用[7],近年研究表明小檗碱可能用于治疗糖尿病、脑卒中、高脂血症等慢性炎症性疾病[12],在神经系统领域中备受关注,特别是在退行性疾病,如AD中。
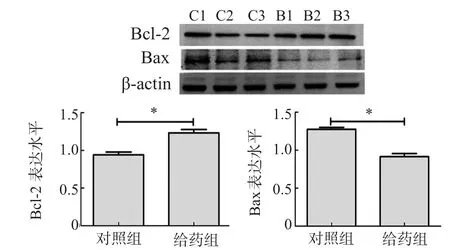
图3 Western 印迹检测各组海马组织 Bcl-2 和 Bax 蛋白表达水平

图4 ElISA 检测各组海马组织 Bcl-2、Bax 表达水平
本实验发现三转基因AD小鼠给予小檗碱后小鼠海马组织的Aβ表达减少,说明小檗碱能减少AD小鼠海马内 Aβ 沉积,减缓 AD 病理发展的进程。Bcl-2是抑制凋亡基因,Bax是促进凋亡基因,在酒精诱导沙鼠海马神经细胞凋亡模型和脑血管病中的神经细胞凋亡模型中观察到 Bcl-2 的表达减少和 Bax 表达增多[13]。其中Bcl-2 家族能抑制细胞色素 C 的释放,从线粒体中释放的细胞色素C是已知激活细胞凋亡的原因,因此降低Bax 与 Bcl-2 比值可抑制细胞色素 C 的释放,从而抑制细胞凋亡[14,15];笔者发现给予小檗碱后的 AD 小鼠海马组织中抑制凋亡基因的 Bcl-2 的表达相对增加和促进凋亡基因的 Bax 相对表达减少,说明 Bcl-2、Bax 可能参与了小檗碱对AD小鼠海马的神经细胞凋亡的调控,从而减少其海马组织Aβ沉积、减少神经元凋亡,表明小檗碱对神经元具有一定的保护作用。
致谢:感谢深圳大学生命科学与海洋学院提供三转基因小鼠和实验室设备。
[1]Hunter S,Arendt T,Brayne C.The senescence hypothesis of disease progression in Alzheimer disease:an integrated matrix of disease pathways for FAD and SAD[J].Mol Neurobiol,2013,48:556-570.
[2]Van der Flier WM,Scheltens P.Alzheimer disease:hippocampal volume loss and Alzheimer disease progression[J].Nat Rev Neurol,2009,5: 361-362.
[3]Calissano P,Matrone C,Amadoro G.Apoptosis and in vitro Alzheimer disease neuronal models[J].Commun Integr Biol,2009,2:163-169.
[4]Gao C,Liu Y,Jiang Y,et al.Geniposide ameliorates learning memory deficits,reduces tau phosphorylation and decreases apoptosis via GSK3beta pathway in streptozotocin-induced alzheimer rat model[J].Brain Pathol, 2014,24:261-269.
[5]Cui HS,Matsumoto K,Murakami Y,et al.Berberine exerts neuroprotective actions against in vitro ischemia-induced neuronal cell damage in organotypic hippocampal slice cultures:involvement of B-cell lymphoma 2 phosphorylation suppression[J].Biol Pharm Bull,2009,32:79-85.
[6]Birdsall TC,Kelly GS.Berberine:Therapeutic potential of an alkaloid found in several medicinal plants[J].Altern Med Rev:1997,2:94-103.
[7]朱飞奇,何国厚,梁志坚,等.小檗碱对阿尔茨海默病大鼠模型小胶质细胞活化的影响[J].中华神经医学杂志,2009,8:902-906.
[8]Puzzo D,Lee L,Palmeri A,et al.Behavioral assays with mouse models of Alzheimer's disease:practical considerations and guidelines[J].Biochem Pharmacol,2014,88:450-467.
[9]Durairajan SS,Liu LF,Lu JH,et al.Berberine ameliorates β-amyloid pathology,gliosis,and cognitive impairment in an Alzheimer's disease transgenic mouse model[J].NeurobiolAging,2012,33:2903-2919.
[10]刘艳萍,陆征宇,董强.阿尔茨海默病病理改变的线粒体机制[J].神经损伤与功能重建,2015,9:239-241.
[11]Kalalian-Moghaddam H,Baluchnejadmojarad T,Roghani M,et al. Hippocampal synaptic plasticity restoration and anti-apoptotic effect underlie berberine improvement of learning and memory in streptozotocin-diabetic rats[J].Eur J Pharmacol,2013,698:259-266.
[12]Chang W,Chen L,Hatch GM.Berberine as a therapy for type 2 diabetes and its complications:From mechanism of action to clinical studies[J]. Biochem Cell Biol,2015,93:479-486.
[13]Pollack M,Phaneuf S,Dirks A,et al.The role of apoptosis in the normal aging brain,skeletal muscle,and heart[J].Ann N Y Acad Sci,2002, 959:93-107.
[14]Kim M,Shin MS,Lee JM,et al.Inhibitory Effects of Isoquinoline Alkaloid Berberine on Ischemia-Induced Apoptosis via Activation of Phosphoinositide 3-Kinase/Protein Kinase B Signaling Pathway[J].Int Neurourol J,2014,18:115-125.
[15]杨吉平,费琳,张军峰,等.小檗碱对 Aβ25~35诱导的阿尔茨海默病细胞模型的保护作用[J].中国老年学杂志,2014,20:5794-5796.
(本文编辑:唐颖馨)
Effects of Berberine on the Expression of Amyloid- β and Bax,Bcl-2 in Hippocampus of Three Transgenic Mice with Alzheimer’s disease
LIANG Yu-bin,HUANG Min,CHANG Xin,GUO Yi.
2nd Clinical Medical College of Jinan University,Shenzhen 518020,China
Objective:To observe the effect of berberine on the expression of amyloid-β (Aβ),Bcl-2 and Bax in the hippocampus ofAPP/PS1/Tau three transgenic mice ofAlzheimer’s disease(AD).Methods:TwentyAPP/ PS1/Tau three transgenic AD(3XTg-AD)mice were randomly divided into control group and treatment group (n=10 respectively).Mice in treatment group were treated with berberine at the dose of 50 mg ·kg-1·d-1by gastric gavage orally for 90 days.Mice in control group were treated with the normal saline at the same dose by gasteic gavage orally for 90 days.The Aβ,Bcl-2 and Bax protein in hippocampus were detected by western blot.The expression of Aβ in the hippocampus was determined by immunohistochemistry.The Bcl-2 and Bax protein in hippocampus was detected by ELISA.Results:Compared with the control group,the expression of Aβ in the hippocampus of the berberine group was significantly decreased(P<0.05);the expression of Bcl-2 was more intensive in hippocampus tissue of berberine group than that of control group(P<0.05),but the expression of Bax was the opposite(P<0.05).Conclusion:Berberine can decrease the expression of Aβ in the hippocampus of APP/ PS1/Tau three transgenic AD mice,and up-regulating Bcl-2 expression and down-regulating Bax expression may play a role in the mechanism.
Alzheimer’s disease;berberine;three transgenic mice;amyloid-β;apoptosis
R741;R742
ADOI10.16780/j.cnki.sjssgncj.2017.03.002
暨南大学第二临床医学院深圳 518020
深圳市科技研发资金项目(No.JCYJ2015052 9112551484)
2016-08-31
郭毅xuanyi_guo@163. com
